Los protocolos de estimulación mínima basados en el citrato de clomifeno se presentan como una alternativa eficaz, más sencilla y económica respecto a las pautas convencionales. Nuestro objetivo es presentar los resultados clínicos y de laboratorio obtenidos en nuestro centro en 170 ciclos de estimulación mínima, y revisar los pros y contras de este protocolo en los tratamientos de FIV/ICSI.
Material y métodosAnálisis retrospectivo de los 170 ciclos de estimulación mínima realizados en nuestro centro entre septiembre de 2013 y noviembre de 2014.
ResultadosDe los 170 ciclos analizados un 96,8% (158) alcanzó la punción folicular y en un 72,3% (123) la transferencia. Se obtuvieron una media de 3,4 ovocitos metafase ii, con una tasa de fecundación por ICSI del 79%. La media de embriones transferidos fue de 1,6, con una tasa de implantación del 30,3% y de gestación clínica por transferencia del 39%. Analizados los ciclos por grupos de edad, las tasas de embarazo clínico por ciclo iniciado, punción y transferencia han sido del 49%, 55% y 55,5% respectivamente en las pacientes menores de 35 años; 29,8%, 30,3% y 45,9% en el grupo intermedio ente los 35 y 40 años y 12,9%, 15,1% y 19,5% en los ciclos realizados en mayores de 40 años.
DiscusiónLa estimulación mínima presenta múltiples ventajas: menor complejidad, menor gasto de medicación para los pacientes y menor agresividad, convirtiéndose en una alternativa entre los protocolos a aplicar en los tratamientos de FIV/ICSI.
Minimal stimulation protocols based on clomiphene citrate are an effective alternative, easier, and inexpensive compared to conventional stimulation for IVF. The clinical and laboratory results obtained from 170 cycles of minimal stimulation are reported.
Material and methodsA retrospective analysis of 170 cycles that were performed in this center from September 2013 to November 2014.
ResultsOf the 170 analyzed cycles, 96.8% (158) reached oocyte retrieval, and 72.3% (123) had embryo transfer. A mean of 3.4 mature oocytes (metaphase II) were obtained, reporting a fertilization rate by intra-cytoplasmic sperm injection (ICSI) of 79%. A mean of 1.6 embryos were transferred, and the implantation rate was 30.3%, with a clinical pregnancy rate of39% per transfer. On analyzing cycles by age group, clinical pregnancy rate per cycle, oocyte retrieval and transfer was 49%, 55%, and 55%, respectively in patients under 35; 29.8%, 30.3%, and 45.9%, respectively, in patients between 35 and 40; and 12.9%, 15.1%, and 19.5%, respectively, in those cycles performed on patients older than 40.
DiscussionMinimal stimulation is a real alternative for conventional protocols applied in IVF. Main advantages are less complexity, savings in medication, less invasive, and similar pregnancy rate when compared to conventional stimulation.
Louis Brown se convirtió en 1978 en el primer recién nacido del mundo concebido tras la técnica de fecundación in vitro (FIV). Este hito de la medicina fue el resultado de fecundar el único ovocito periovulatorio obtenido de la madre durante su ciclo natural. El ciclo natural fue pronto sustituido por el concepto de estimulación ovárica controlada (EOC), con el objetivo de obtener más de un ovocito y así incrementar las posibilidades de éxito.
El incremento en las dosis de gonadotrofinas durante la estimulación también ha resultado en un aumento en el coste de los tratamientos para los pacientes y en una mayor incidencia de complicaciones (Baker, 2013). A esto se añade el hecho de que los laboratorios de FIV han mejorado significativamente en las últimas 3 décadas y los nuevos medios y equipos de cultivo embrionario disponibles han evolucionado rápidamente, requiriéndose un menor número de ovocitos para mantener unas tasas de embarazo similares a las de décadas previas (Revelli et al., 2011).
En 1996 el Dr. Edwards, considerado uno de los padres de la medicina reproductiva, publica un editorial en la revista Human Reproduction titulado Time to revolutionize ovarian stimulation (Edwards et al., 1996), en el que realiza un fuerte alegato en favor de la estimulación suave y de la necesidad de buscar alternativas más sencillas para los pacientes que requieren de tratamientos de FIV.
Los protocolos de estimulación mínima, basados en el citrato de clomifeno, han surgido como una alternativa a la estimulación convencional en esta carrera hacia una FIV más natural, sencilla y económica. Las clínicas pioneras en este protocolo, fundamentalmente la Kato Ladies Clinic de Japón y la clínica New Hope Fertility Center, en EE. UU., acumulan ya una gran experiencia y varias publicaciones en las que han presentado resultados esperanzadores (Teramoto y Kato, 2007; Bodri et al., 2014; Kato et al., 2012; Zhang et al., 2010).
Actualmente no existen datos sobre la estimulación mínima aplicada en población española. En este trabajo presentamos el protocolo utilizado en nuestro centro y el análisis retrospectivo de los resultados clínicos y de laboratorio obtenidos en 170 ciclos entre 2013 y 2014, con el objetivo de valorar si este protocolo puede convertirse en una alternativa más a ofrecer a las parejas que realizan un tratamiento de FIV/ICSI.
Material y métodosSe ha incluido en el estudio los 170 primeros ciclos de estimulación mínima realizados entre septiembre de 2103 y noviembre de 2014. En nuestro centro privado se ofrece exclusivamente el protocolo de estimulación mínima basado en el CC y dosis mínimas de gonadotrofinas o ciclo natural. Las pacientes que tras explicarles las ventajas e inconvenientes de cada una de las opciones optaron por el ciclo natural no se incluyeron en el análisis.
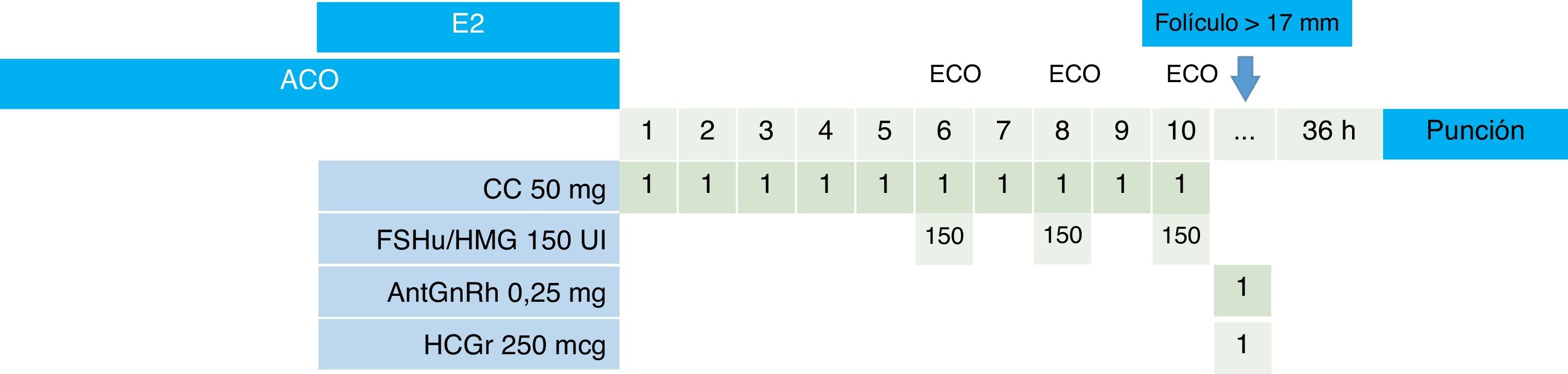
No se ha excluido de tratamiento a ninguna paciente en función de la edad, concentración basal de FSH, hormona antimulleriana o número de ciclos de FIV/ICSI realizados previamente. Solo se han ofrecido otras alternativas de estimulación (letrozol, estimulación suave a dosis bajas de gonadotrofinas desde día 5 de ciclo…) en aquellas pacientes con alguna contraindicación para el uso de CC (alteraciones visuales, etc.) o candidatas a diagnóstico preimplantacional. En estos casos los ciclos no se han incluido en el análisis. El análisis de los datos ha sido por intención de tratar, por lo que se incluyen aquellos ciclos sin respuesta ovárica a la estimulación y con ovulación prematura antes de la punción, y en los que por tanto la transferencia embrionaria fue cancelada (fig. 1).
La actividad de nuestro centro es de lunes a viernes, por lo que los ciclos deben ser programados para evitar las punciones y transferencias los fines de semana. Para ello nos basamos, salvo contraindicación médica, en el uso de anticonceptivo (entre el primer y el 3.er día de ciclo, durante 12 a 16 días) o valerianato de estradiol (desde el día 24 del ciclo previo, durante 2-6 días) junto con el adelanto (para evitar la punción en sábado) o el retraso (para evitar la punción en domingo) de un máximo de 24h en la maduración folicular con aGnRH o HCG.
Tras 5 días de lavado en el caso del anticonceptivo, o al día siguiente de suspender el valerianato de estradiol, se empieza la estimulación. El mismo día en que se inicia la estimulación se lleva a cabo una ecografía basal para confirmar que se puede empezar con la misma. En las pacientes con baja reserva y FSH basal>10 mUI/ml se prolonga el anticonceptivo o el estradiol hasta que su concentración sea inferior a esta concentración.
La estimulación se inicia con un comprimido de 50mg/d de CC durante 5 días, realizando el primer control ecográfico al 6.° día. Si en este primer control se objetiva un único folículo>8mm (algo habitual en las pacientes con baja reserva extrema) se mantiene la dosis diaria de CC y no se añaden gonadotrofinas. Si existen 2 o más folículos con posibilidades se añade ya desde el 6.° día una dosis subcutánea de 150UI de HMG o FSHu, que se repite en días alternos, además de mantener la dosis diaria de 50mg de CC por vía oral. En caso de ciclos monofoliculares se decide seguir adelante con el ciclo o cancelarlo tras valorarlo con los pacientes. Añadiendo las gonadotrofinas de forma precoz buscamos incrementar el número de folículos reclutados, con el objetivo de poder manejar finalmente una cantidad de ovocitos superior a los obtenidos con los protocolos más estrictos de las clínicas Kato y New Hope. Manteniendo el CC a diario más allá de los 5 días iniciales aprovechamos su bloqueo hipotalámico para evitar el pico prematuro de LH.
Tras este primer control se realiza una nueva ecografía cada 48-72h hasta que el folículo dominante alcanza los 17-18mm de diámetro. En el día de la maduración ovocitaria la paciente recibe una dosis única de 0,25mg de antagonista de la GnRH (antGnRH) 2h antes del triggering con 250mcg de HCGr. De esta forma, con la mayor flexibilidad a la hora de utilizar el antGnRH, se disminuyen las determinaciones hormonales necesarias y evitamos que el periodo hasta la punción folicular dependa de las concentraciones repetidas de LH.
La aspiración de los ovocitos tiene lugar a las 36h de la maduración ovocitaria. Para realizarla, salvo petición de la paciente de no recibir anestesia, utilizamos una sedación superficial con propofol para llevar a cabo el procedimiento en menos de 5min. Además de reducir las molestias para las pacientes, la sedación también nos permite utilizar agujas de aspiración de calibre habitual (19G). La paciente permanece ingresada por espacio de 1h, y tras comprobar buena tolerancia oral es dada de alta.
Realizamos por protocolo microinyección espermática (ICSI) de los ovocitos maduros a las 2-3h de la punción, pese a que diversos estudios no han demostrado una mayor tasa de fertilización en pacientes con un número bajo de ovocitos recuperados (Luna et al., 2011). La fecundación se valora a las 17-20h de la misma.
Al día siguiente de la punción, salvo en aquellos casos en los que se haya decidido realizar la transferencia diferida con embriones vitrificados, la paciente comienza el soporte de la fase lútea con 200mg cada 12h de progesterona micronizada por vía vaginal.
La transferencia se realiza en el día 2 o día 3 de desarrollo embrionario, aunque en pacientes con fallo de implantación previo o que soliciten SET llevamos a cabo cultivo secuencial para la transferencia en estadio de blastocisto de forma diferida.
En aquellas pacientes en las que el endometrio no alcanza un patrón trilaminar y un diámetro antero-posterior en el corte sagital superior a los 6mm el día de la maduración folicular, se aconseja la vitrificación de los embriones para su posterior transferencia diferida en el ciclo natural o sustituido. De las 121 transferencias realizadas 19 (15,7%) han sido diferidas. Se ha tenido en cuenta el resultado de la primera transferencia en los ciclos diferidos a la hora de analizar los resultados clínicos.
Los datos son presentados como media y rango. Dado el carácter retrospectivo del análisis, no se requirió consentimiento informado por parte de los pacientes.
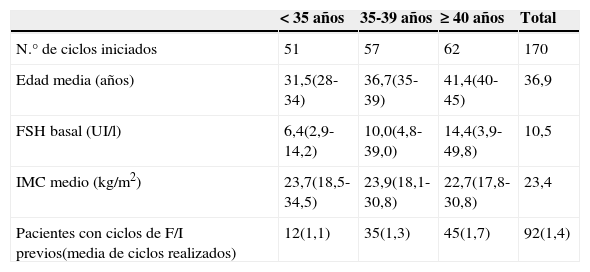
ResultadosEntre septiembre de 2103 y noviembre de 2014 se han iniciado en nuestro centro 170 ciclos de estimulación mínima. La tabla 1 resume las características basales de estas pacientes. La edad media de las pacientes ha sido de 36,9 años, realizándose un 36,4% de los ciclos en mayores de 40 años. La FSH basal ha sido de 10,5mUI/ml, habiendo realizado tratamientos de FIV/ICSI en 92 de las pacientes, con una media de 1,4 ciclos realizados.
Características basales de las pacientes en los 170 ciclos analizados en este trabajo
| <35años | 35-39años | ≥40 años | Total | |
|---|---|---|---|---|
| N.° de ciclos iniciados | 51 | 57 | 62 | 170 |
| Edad media (años) | 31,5(28-34) | 36,7(35-39) | 41,4(40-45) | 36,9 |
| FSH basal (UI/l) | 6,4(2,9-14,2) | 10,0(4,8-39,0) | 14,4(3,9-49,8) | 10,5 |
| IMC medio (kg/m2) | 23,7(18,5-34,5) | 23,9(18,1-30,8) | 22,7(17,8-30,8) | 23,4 |
| Pacientes con ciclos de F/I previos(media de ciclos realizados) | 12(1,1) | 35(1,3) | 45(1,7) | 92(1,4) |
De los 170 ciclos iniciados, en 158 (92,9%) se llegó a programar la aspiración folicular. Las cancelaciones previas a la punción (12 ciclos) fueron por no respuesta o ciclos monofoliculares en los que, de acuerdo con los pacientes, se decidió no continuar con la estimulación.
La duración media de la estimulación fue de 12,1 días, con un consumo de 630,2mg de CC y de 600,7UI de FSH/HMG por paciente. En 155 de los ciclos se añadió FSH/HMG a partir del 6.° día de estimulación, al objetivarse por ecografía más de 2 folículos>10mm, continuando solo con CC en los otros 5 ciclos. Diecisiete de los 170 ciclos fueron monofoliculares, programándose la punción folicular en 15 de ellos. Los otros 2 ciclos se cancelaron a petición de las pacientes, y se recogen como cancelaciones por «no respuesta» en el análisis de los datos.
De los 158 ciclos en los que se alcanzó la punción folicular, en 153 (96,8%) se obtuvo al menos un ovocito, con una media en estas pacientes de 3,4MII por punción. De los 5 casos sin ovocitos, en 3 (1,8% por punción) se confirmó la ovulación previa y en 2 (1,2%) no se recuperaron óvulos, pese a llevar a cabo la aspiración folicular.
Se realizó microinyección en el 100% de los casos, con una tasa de fecundación (definida por la presencia en el ovocito de 2 pronúcleos y 2 corpúsculos polares) del 79%. De las pacientes con fecundación, 123 (72,3% de los ciclos) llegaron a tener embriones para transferir, con una media de 1,6 embriones transferidos.
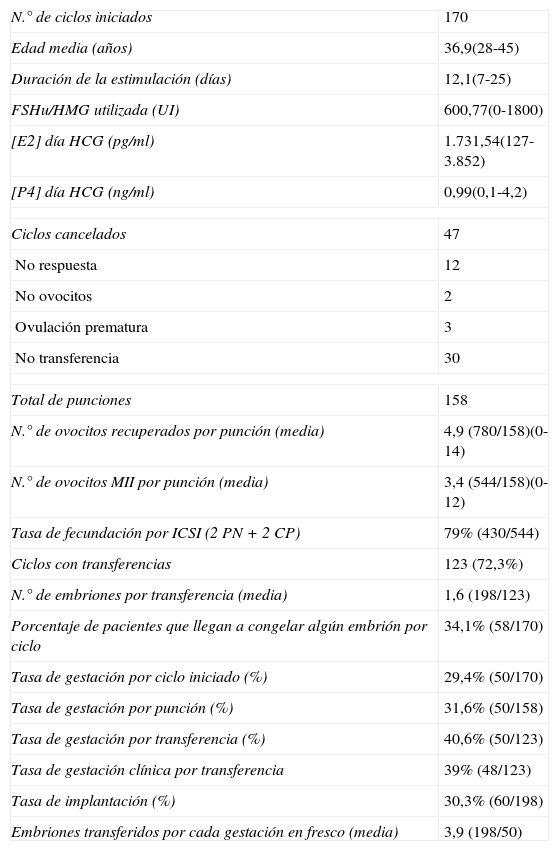
De las 121 transferencias realizadas, 19 (15,7%) han sido diferidas. Se ha tenido en cuenta el resultado de la primera transferencia en los ciclos diferidos a la hora de analizar los resultados clínicos. La tasa de embarazo bioquímico fue del 29,4% por ciclo iniciado, 31,6% por punción y 40,6% por transferencia; la tasa de implantación alcanzó el 30,3% y la tasa de gestación clínica por transferencia fue del 39%. Los datos de laboratorio se recogen en la tabla 2 y los resultados clínicos en las tablas 3 y 4.
Datos globales de los 170 ciclos analizados
| N.° de ciclos iniciados | 170 |
| Edad media (años) | 36,9(28-45) |
| Duración de la estimulación (días) | 12,1(7-25) |
| FSHu/HMG utilizada (UI) | 600,77(0-1800) |
| [E2] día HCG (pg/ml) | 1.731,54(127-3.852) |
| [P4] día HCG (ng/ml) | 0,99(0,1-4,2) |
| Ciclos cancelados | 47 |
| No respuesta | 12 |
| No ovocitos | 2 |
| Ovulación prematura | 3 |
| No transferencia | 30 |
| Total de punciones | 158 |
| N.° de ovocitos recuperados por punción (media) | 4,9 (780/158)(0-14) |
| N.° de ovocitos MII por punción (media) | 3,4 (544/158)(0-12) |
| Tasa de fecundación por ICSI (2PN+2CP) | 79% (430/544) |
| Ciclos con transferencias | 123 (72,3%) |
| N.° de embriones por transferencia (media) | 1,6 (198/123) |
| Porcentaje de pacientes que llegan a congelar algún embrión por ciclo | 34,1% (58/170) |
| Tasa de gestación por ciclo iniciado (%) | 29,4% (50/170) |
| Tasa de gestación por punción (%) | 31,6% (50/158) |
| Tasa de gestación por transferencia (%) | 40,6% (50/123) |
| Tasa de gestación clínica por transferencia | 39% (48/123) |
| Tasa de implantación (%) | 30,3% (60/198) |
| Embriones transferidos por cada gestación en fresco (media) | 3,9 (198/50) |
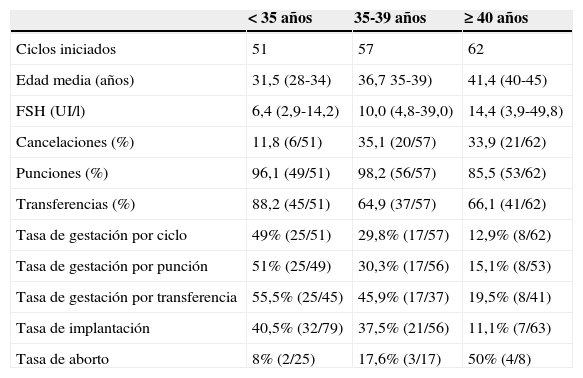
Resultados clínicos por grupos de edad en los 170 ciclos analizados
| <35 años | 35-39 años | ≥40 años | |
|---|---|---|---|
| Ciclos iniciados | 51 | 57 | 62 |
| Edad media (años) | 31,5 (28-34) | 36,7 35-39) | 41,4 (40-45) |
| FSH (UI/l) | 6,4 (2,9-14,2) | 10,0 (4,8-39,0) | 14,4 (3,9-49,8) |
| Cancelaciones (%) | 11,8 (6/51) | 35,1 (20/57) | 33,9 (21/62) |
| Punciones (%) | 96,1 (49/51) | 98,2 (56/57) | 85,5 (53/62) |
| Transferencias (%) | 88,2 (45/51) | 64,9 (37/57) | 66,1 (41/62) |
| Tasa de gestación por ciclo | 49% (25/51) | 29,8% (17/57) | 12,9% (8/62) |
| Tasa de gestación por punción | 51% (25/49) | 30,3% (17/56) | 15,1% (8/53) |
| Tasa de gestación por transferencia | 55,5% (25/45) | 45,9% (17/37) | 19,5% (8/41) |
| Tasa de implantación | 40,5% (32/79) | 37,5% (21/56) | 11,1% (7/63) |
| Tasa de aborto | 8% (2/25) | 17,6% (3/17) | 50% (4/8) |
Resultados clínicos según el rango de FSH basal en los 170 ciclos analizados
| FSH<10 | FSH≥10 | |
|---|---|---|
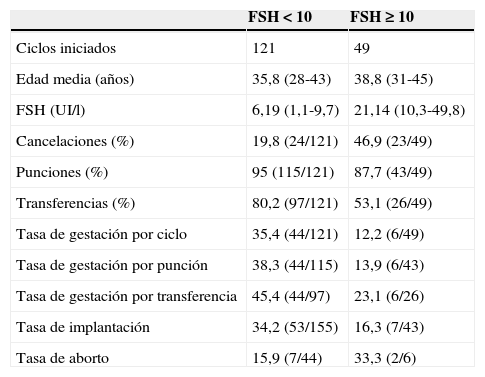
| Ciclos iniciados | 121 | 49 |
| Edad media (años) | 35,8 (28-43) | 38,8 (31-45) |
| FSH (UI/l) | 6,19 (1,1-9,7) | 21,14 (10,3-49,8) |
| Cancelaciones (%) | 19,8 (24/121) | 46,9 (23/49) |
| Punciones (%) | 95 (115/121) | 87,7 (43/49) |
| Transferencias (%) | 80,2 (97/121) | 53,1 (26/49) |
| Tasa de gestación por ciclo | 35,4 (44/121) | 12,2 (6/49) |
| Tasa de gestación por punción | 38,3 (44/115) | 13,9 (6/43) |
| Tasa de gestación por transferencia | 45,4 (44/97) | 23,1 (6/26) |
| Tasa de implantación | 34,2 (53/155) | 16,3 (7/43) |
| Tasa de aborto | 15,9 (7/44) | 33,3 (2/6) |
Hemos analizado los resultados clínicos por grupos de edad según las divisiones utilizadas para el Registro anual de la Sociedad Española de Fertilidad (SEF). En el grupo de menor edad, por debajo de los 35 años, la tasa de cancelación por ciclo iniciado es del 11,8% y las tasas de gestación por ciclo iniciado, punción y transferencia han sido del 49%, 55% y 55,5% respectivamente. En el grupo de edad intermedia, entre los 35 y los 39 años, las cancelaciones han subido hasta el 35,1% de los ciclos iniciados, con tasas de gestación por ciclo del 29,8%, del 30,3% por punción y del 45,9% por transferencia. Para los 62 ciclos realizados en el grupo de mayor edad, por encima de los 40 años, la cancelación por ciclo iniciado fue del 33,9%, con tasas de gestación por ciclo, punción y transferencia del 12.9%, 15,1% y 19,5% respectivamente.
Las tasas de implantación fueron del 40,5% para las pacientes más jóvenes, del 37,5% para el grupo intermedio y del 11,1% en las mujeres por encima de los 40 años.
DiscusiónLos protocolos de estimulación suave pueden representar un paso importante hacia el objetivo de una FIV más sencilla, mejor tolerada y sin complicaciones para los pacientes, así como más económica tanto para ellos como para la sociedad (sobre todo asociada a la transferencia selectiva de un embrión, evitando así el embarazo múltiple) (Polinder et al., 2008).
Las ventajas del uso prolongado del CC se sustentan fundamentalmente en la reducción del consumo de gonadotrofinas (FSH o HMG) para la estimulación. Además, bloqueando el pico de LH mediante su uso continuado más allá de los 5 días habituales, evitamos el uso de agonistas o antagonistas de la GnRH con este fin. Esto supone un indudable alivio económico para los pacientes, reduciendo además el desgaste emocional (De Klerk et al., 2006; Sills et al., 2012). Además, la estimulación mínima reduce los riesgos para la salud, como el SHO, y evita en parte el dolor y el estrés causado por las inyecciones para las pacientes. Estos beneficios pueden justificar indirectamente por qué las tasas de abandono tras un tratamiento que termina sin embarazo son menores cuando se utiliza una estimulación suave si las comparamos con las de la FIV convencional (Verberg et al., 2009).
La discusión se ha centrado habitualmente en la eficacia de la estimulación mínima aplicada a la FIV. Hasta la fecha, son pocos los estudios publicados sobre esta estrategia, la mayoría retrospectivos y de los mismos grupos de trabajo, lo que dificulta alcanzar conclusiones con suficiente evidencia científica (Teramoto y Kato, 2007; Bodri et al., 2014; Kato et al., 2012; Zhang et al., 2010). Pese a la ausencia de datos con una alta consistencia, los trabajos publicados por las clínicas Kato y New Hope recogen un número impresionante de ciclos, con tasas de implantación y embarazo realmente llamativas, más aún si tenemos en cuenta las características especiales de sus pacientes (un porcentaje importante de mujeres con baja reserva, con FSH basales extremas y edad materna por encima de los 42 años) y del propio protocolo (>90% de los ciclos con SET y uso mínimo de gonadotrofinas durante la estimulación).
La mayor crítica a la estimulación mínima son las altas tasas de cancelación por ciclo iniciado, que en las series publicadas por la KLC y New Hope están por encima del 30%, aun en los grupos de mejor pronóstico (Kato et al., 2012; Zhang et al., 2010). Este dato es evidentemente superior al de la estimulación convencional, pero también lo es el hecho de que la tasa de abandono en los tratamientos de estimulación suave o mínima (mild or minimal stimulation) es mucho menor (Verberg et al., 2009).
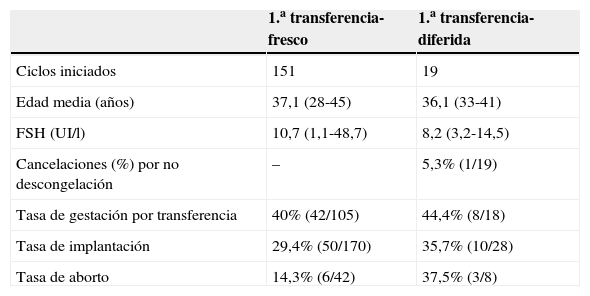
Otra de las dudas que genera el protocolo de las clínicas pioneras es que quedan algunos puntos sin definir claramente en su estrategia: 1) el posible efecto negativo del triggering con agonista de la GnRH para la fase lútea (Youseff et al., 2014); o 2) los criterios para continuar con la transferencia en fresco o decidir hacerlo en diferido (tabla 5), más aún si tenemos en cuenta el posible efecto perjudicial del CC a nivel endometrial (Wallace et al., 2011).
Comparación de los resultados clínicos entre los ciclos con primera transferencia en fresco o diferida
| 1.a transferencia-fresco | 1.a transferencia-diferida | |
|---|---|---|
| Ciclos iniciados | 151 | 19 |
| Edad media (años) | 37,1 (28-45) | 36,1 (33-41) |
| FSH (UI/l) | 10,7 (1,1-48,7) | 8,2 (3,2-14,5) |
| Cancelaciones (%) por no descongelación | – | 5,3% (1/19) |
| Tasa de gestación por transferencia | 40% (42/105) | 44,4% (8/18) |
| Tasa de implantación | 29,4% (50/170) | 35,7% (10/28) |
| Tasa de aborto | 14,3% (6/42) | 37,5% (3/8) |
Nosotros hemos llevado este concepto por primera vez a población española, adaptando la base establecida por las clínicas Kato y New Hope a las características específicas de nuestras pacientes. El protocolo de estimulación mínima aplicado por las clínicas pioneras (Teramoto y Kato, 2007; Zhang et al., 2010) ha ido ganado poco a poco en complejidad, perdiendo parte de la sencillez inherente al concepto inicial. Por ejemplo, el número de controles ecográficos y hormonales es alto, muchas veces diarios en los últimos días del ciclo. Por otro lado, la estimulación mínima es llevada al extremo reduciendo al máximo el uso de gonadotrofinas, lo que disminuye el número de ovocitos por ciclo y eleva las tasas de cancelación por encima del 30% en los datos publicados por estos dos centros.
Por estos motivos nuestro centro ha desarrollado un protocolo propio tratando de aunar ambos principios: la sencillez y menor agresividad de la estimulación mínima, junto a pequeñas modificaciones que tienen como objetivo reducir las tasas de cancelación y aumentar la comodidad para los pacientes. De esta forma, con la mayor flexibilidad a la hora de administrar gonadotrofinas tras los primeros 5 días de estimulación con citrato de clomifeno, y el uso final de una o 2 dosis de antGnRH para minimizar las cancelaciones, conseguimos aumentar la rentabilidad de los ciclos sin incrementar en exceso el coste ni la complejidad del protocolo. Los resultados hasta la fecha, especialmente por debajo de los 40 años, nos animan a continuar en esta línea de estimulación mínima.
La programación de los ciclos tiene 2 beneficios: 1) permite repartir de forma equitativa las punciones a lo largo de la semana, evitando la sobrecarga del laboratorio; 2) evita parte del trabajo realizado los fines de semana, lo que permite ahorrar costes que repercuten directamente en los pacientes. En nuestro centro los ciclos se han programado utilizando un anticonceptivo oral combinado o estradiol y siendo flexibles a la hora de adelantar o retrasar la recuperación de ovocitos 24h. Ninguna de estas estrategias tiene un impacto negativo en los resultados clínicos en los últimos trabajos publicados al respecto (Tremellen y Lane, 2010; García-Velasco et al., 2011).
En el protocolo aplicado en nuestra clínica hemos sustituido el aGnRH por un bolo de HCG recombinante, eliminando así las dudas que puede generar el impacto del aGnRH sobre la fase lútea y las tasas de embarazo en caso de continuar con la transferencia en fresco (Youseff et al., 2014). En cuanto al tipo de transferencia embrionaria, la decisión de transferir en fresco o realizarla en diferido se basa en el patrón y grosor endometrial el día de su administración. A día de hoy carecemos de un número suficiente de casos para comparar ambas estrategias, aunque la tendencia de los ciclos realizados hasta la fecha sea hacia unas tasas de implantación superiores en la transferencia en diferido.
Las tasas de embarazo obtenidas por nuestro grupo son similares a las publicadas en el último registro de la SEF al comparar los 3 estratos de edad en los que se dividen los ciclos. Esto se consigue además con un gasto de medicación bajo (con la media de CC, FSH/HMG, HCG y antGnRH consumidas el coste aproximado de medicación es de 300,56€ por paciente) y una media de 3,3 visitas y de 6,2 inyecciones subcutáneas por ciclo de estimulación. Además, como muestra la tabla 3, la FSH basal de los grupos de edad intermedia y alta es realmente elevado. Si analizamos los resultados clínicos de nuestras pacientes en función de esta FSH basal (<o> 10UI/l) en lugar de por grupos de edad, queda patente aún más la influencia de este marcador de reserva ovárica sobre los resultados del ciclo (tabla 4) y confirma los resultados obtenidos por Verberg et al. al definir que el número óptimo de ovocitos depende del régimen de estimulación utilizado (Verberg et al., 2008): un número reducido de óvulos puede ser suficiente para alcanzar el embarazo si se realiza una estimulación suave, no siendo su significado patológico ni empeorando el pronóstico reproductivo de la paciente al tratarse realmente del objetivo al usar estas dosis bajas.
Respecto al menor número de ovocitos obtenidos, y por tanto una menor posibilidad de tener embriones sobrantes para congelar y utilizar en un futuro, es evidente que la estimulación mínima no puede competir con la estimulación convencional en cuanto a tasa acumulada de embarazo por ciclo iniciado (Bodri et al., 2014). Esto, aun siendo cierto, si compararamos series grandes de ciclos no debe hacernos olvidar que no todas las pacientes llegan a congelar embriones en sus ciclos de estimulación convencional (un 63,6% de las parejas no llega a tener embriones para congelar según el registro de la SEF de 2011), y que en ocasiones estas transferencias de embriones vitrificados tienen costes para los pacientes similares o incluso superiores a los de un ciclo de estimulación mínima completo. En nuestra casuística se llega a congelar al menos un embrión en el 34,5% de los ciclos (tabla 2).
Pese a las dudas que pueda generar la estimulación mínima, considerarla como un procedimiento experimental, como han intentado algunos autores (Gleicher et al., 2011; Gleicher et al., 2012), no tiene justificación. Por tanto, quizá la discusión no debería centrarse en qué tipo de estimulación es mejor, convencional o a dosis bajas, sino en si existen alternativas más seguras, sencillas y económicas a la estimulación que hemos venido realizando en los últimos años. Explicando las diferentes alternativas a los pacientes, con las ventajas e inconvenientes de cada protocolo, la pareja con problemas de fertilidad podrá decidir qué se aproxima más a sus expectativas.
Creemos en una elección personalizada del tipo de estimulación ovárica para cada paciente que comience un ciclo de FIV/ICSI, y que dentro de esta individualización la estimulación mínima tiene su hueco, no como aspirante a ser la mejor alternativa, sino como una opción más, eficaz y sencilla, a proponer a la pareja que debe elegir conociendo los pros y los contras de cada una de ellas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.