Los indicadores de calidad son una herramienta clave para asegurar que el servicio prestado por el laboratorio de reproducción permite la práctica de una medicina centrada en los pacientes. El objetivo de este trabajo es establecer especificaciones para los indicadores de calidad del laboratorio de reproducción.
Material y métodosPara establecer las especificaciones se utilizaron el método basado en el estado del arte o el método de consenso de expertos. Para el primer método los datos fueron extraídos del Registro de Técnicas de Reproducción Asistida de Inseminación Artificial y FIV/ICSI, de la Sociedad Española de Fertilidad de los años 2009-2012. Se definieron 3 niveles de especificaciones: mínimo (aquella que es capaz de conseguir el 95% de los mejores laboratorios), deseable (aquella que es capaz de conseguir el 75% de los mejores laboratorios) y óptimo (aquella que es capaz de conseguir el 25% de los mejores laboratorios). Se utilizó el método de consenso de expertos en aquellos indicadores donde no había suficientes datos para calcularlos por el método del estado del arte.
ResultadosSe utilizó el método de consenso en 6 de ellos (33%) y método del estado del arte en 12 (67%). No se observaron solapamientos en casi ninguna especificación entre los distintos niveles de calidad establecidos de un indicador, a excepción de los indicadores relacionados con la crioconservación ovocitaria. De igual modo, la mayoría de las especificaciones de calidad permanecieron estables durante los 4 años del estudio, a excepción de la crioconservación embrionaria.
DiscusiónNuestro trabajo ha permitido por primera vez establecer especificaciones para indicadores de calidad del laboratorio de reproducción. La mayoría de los procedimientos empleados en el laboratorio de reproducción están estabilizados en su rendimiento. Los cambios en las especificaciones de calidad en la crioconservación embrionaria muestran que los recientes avances en este campo han influido significativamente en sus resultados
Quality indicators are of crucial importance in ensuring that the service provided by an assisted reproduction laboratory facilitates the practice of patient-centered medicine. The aim of this paper is to determine specifications for such quality indicators.
Material and methodsThe methods used were based on the state of the art or on expert consensus. For the first method, data were obtained from the Registry of Techniques for Assisted Reproduction, Artificial Insemination and IVF/ICSI, published by the Spanish Fertility Society in 2009-2012. Three levels of specifications were defined: minimal (achievable by 95% of the best laboratories), desirable (achievable by 75% of the best laboratories), and optimal (achievable by 25% of the best laboratories). The expert consensus method was used in the case of indicators for which insufficient data were available for the state of the art method to be used.
ResultsThe consensus method was used in six cases (33%) and the state of art method in twelve (67%). No overlap was observed between the different quality standards for indicators for almost any specification, except for those related to oocyte cryopreservation. Similarly, most of the quality specifications remained unchanged during the four years analysed, except for those relating to embryo cryopreservation.
DiscussionThis study, for the first time, establishes specifications for quality indicators for assisted reproduction laboratories. Most of the procedures used in this context have stable levels of performance. Nevertheless, changes in the quality specifications for embryo cryopreservation suggest that recent advances in this field have significantly influenced the results obtained
Entre los objetivos de la reciente norma UNE 179007 «Sistemas de gestión de la calidad para laboratorios de reproducción asistida» se encuentra la unificación de los indicadores y los criterios mínimos (especificaciones o estándares) para el aseguramiento de la calidad en los laboratorios de reproducción asistida. En este sentido, ASEBIR, publicó en 2008 un documento de consenso sobre «Estandarización de indicadores en el laboratorio de reproducción asistida» elaborado por su Comisión de Calidad (De los Santos et al., 2007), y en 2009 estableció por primera vez estándares para algunos de estos indicadores. En esta misma dirección van trabajos de distintas sociedades científicas internacionales de reproducción humana como «Alpha Scientists in Reproductive Medicine» en el caso de marcadores para la crioconservación (Alpha Scientists in Reproductive Medicine, 2012) y el trabajo realizado por la Association of Medical Andrologist sobre los laboratorios de andrología (Tomlinson et al., 2012). También Mortimer y Mortimer (2005) en su trabajo pionero sobre calidad en el laboratorio de reproducción asistida resaltaron la importancia de la utilización de indicadores de calidad y de establecer especificaciones para ellos.
Existen varias estrategias para establecer las especificaciones de calidad de los indicadores de laboratorio clínico (Kenny et al., 1999) entre ellos se encuentran el consenso de expertos y el método basado en el estado del arte. Estas estrategias son utilizadas por diversas sociedades científicas de laboratorio clínico nacionales e internacionales (Westgard, 2014; Morancho et al., 2014; Sciacovelli et al., 2004).
En el caso concreto del laboratorio de reproducción, existen trabajos previos sobre las especificaciones de calidad de indicadores de procedimiento (fase técnica) de parámetros seminales, las cuales han sido calculadas basadas en la variación biológica (Álvarez et al., 2003), en el estado del arte (Castilla et al., 2005) y en la opinión de los clínicos (Aguilar et al., 2008).
El estado del arte hace referencia al nivel más alto de desarrollo conseguido en un momento dado sobre cualquier aparato, técnica o campo científico. Por ejemplo, si uno de cada 5 laboratorios puede conseguir un nivel de calidad determinado, entonces la tecnología y metodología es suficiente para que todos los laboratorios puedan conseguir el mismo nivel de prestación. El conocimiento del «estado del arte» en reproducción asistida en nuestro entorno está basado en el trabajo de organizaciones sin ánimo de lucro nacionales (Registro de la Sociedad Española de Fertilidad [SEF]; Prados et al., 2012) o internacionales (EIM; Kupka et al., 2014 o ICMART; Mansour et al., 2014).
En este estudio nos proponemos calcular las especificaciones para los indicadores de calidad propuestos por ASEBIR utilizando el método basado en el estado del arte o el método de consenso de expertos.
Materiales y métodosPara establecer las especificaciones de calidad basadas en el estado del arte se utilizaron los datos anuales del Registro de Técnicas de Reproducción Asistida (TRA) de Inseminación Artificial y FIV/ICSI, de la SEF de los años 2009-2012. Por tanto, se realizó un análisis retrospectivo de los datos del registro sobre los resultados de las clínicas de reproducción asistida de España. El Registro SEF recibió los datos de las clínicas de reproducción asistida de toda España, siempre de forma voluntaria.
Solo se utilizaron los datos de aquellos laboratorios que realizaron más de 30 ciclos en la técnica correspondiente. El número medio anual de centros participantes en el Registro de la SEF es de 135. Las técnicas estudiadas fueron los ciclos de FIV con ovocitos propios y donados, los ciclos de crioconservación de embriones y ciclos de DGP con embriones en fresco, y la inseminación artificial. En todas las técnicas se registraron datos de al menos 30 laboratorios, excepto en aquellas con ovocitos crioconservados, que solo utilizaron los datos reportados por 14 centros.
Los criterios para establecer las especificaciones fueron los límites utilizados por AEFA (Calafell et al., 2002) para el cálculo de las especificaciones de calidad analíticas en los que se definen 3 niveles de especificaciones:
- •
Mínima: aquella que es capaz de conseguir el 95% de los mejores laboratorios
- •
Deseable: aquella que es capaz de conseguir el 75% de los mejores laboratorios
- •
Óptima: aquella que es capaz de conseguir el 25% de los mejores laboratorio.
Hay una excepción en el caso de tasa de gestación múltiple donde solo se indicó el estándar a nivel óptimo dada la relevancia clínica de este indicador que exige la excelencia de los centros de reproducción.
El método de cálculo utilizado se basó en el descrito por Calafell et al. (2010):
- •
Selección del indicador.
- •
Recuento del número de resultados por indicador (N).
- •
Exclusión del 5% de los resultados discrepantes. Se ordenan de menor a mayor los resultados y se excluye del p1 al p5 o del p95 al p100, según indicador.
- •
Recuento de resultados para ese indicador que no han sido excluidos (Q).
- •
Cálculo del percentil correspondiente (p95, p75, p25) de la distribución resultante. Para ello se ordenan los resultados de los laboratorios de menor a mayor (o de mayor a menor, según indicador).
- •
El valor de cada percentil se considera la especificación de cada nivel de calidad (mínima, deseable y óptima).
- •
Se calcula el intervalo de confianza al 95% para el percentil obtenido.
Las especificaciones que no pudieron ser calculadas mediante el método basado en el estado del arte, se obtuvieron por el método de consenso de expertos. A partir de una revisión sistemática de la literatura un grupo de 9 expertos, todos ellos miembros del Grupo de Interés de Calidad de ASEBIR, tras analizar las referencias encontradas, consensuó unas especificaciones de calidad para dicho indicador. Hubo varias reuniones de consenso, celebrándose la última en mayo de 2014, en el transcurso del XXX Congreso Nacional de la SEF en Barcelona.
ResultadosPara establecer las especificaciones de indicadores de calidad de ASEBIR se utilizó el método de consenso en 6 de ellos (33%) y el método del estado del arte en 12 (67%).
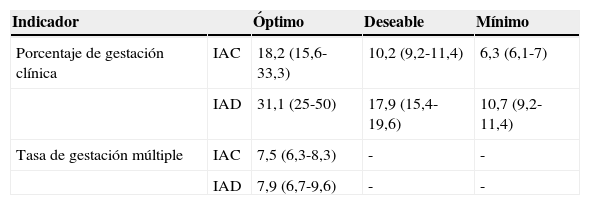
En la tabla 1 se muestran los niveles óptimo, deseable y mínimo de las especificaciones de calidad de los indicadores en los que se utilizó el método del estado del arte tanto para inseminación artificial conyugal (IAC) como para inseminación artificial de donante (IAD), exceptuando la tasa de gestación múltiple donde solo se indica el nivel óptimo.
Especificaciones basadas en el estado del arte para indicadores de calidad del laboratorio de andrología y resultados clínicos para las técnicas de IA
| Indicador | Óptimo | Deseable | Mínimo | |
|---|---|---|---|---|
| Porcentaje de gestación clínica | IAC | 18,2 (15,6-33,3) | 10,2 (9,2-11,4) | 6,3 (6,1-7) |
| IAD | 31,1 (25-50) | 17,9 (15,4-19,6) | 10,7 (9,2-11,4) | |
| Tasa de gestación múltiple | IAC | 7,5 (6,3-8,3) | - | - |
| IAD | 7,9 (6,7-9,6) | - | - |
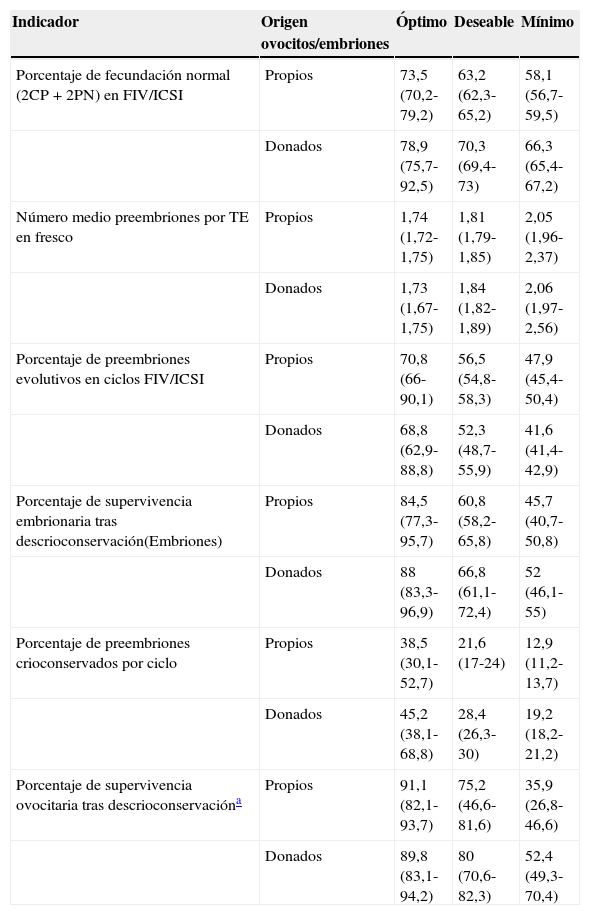
Los niveles óptimo, deseable y mínimo de las especificaciones de calidad del resto de los indicadores calculados por el método basado en el estado del arte se representan en las tablas 2 y 3 y. Como se aprecia, no se solapan los indicadores de calidad de casi ninguna especificación entre los distintos niveles de calidad establecidos de un indicador, a excepción de los indicadores relacionados con la crioconservación ovocitaria.
Especificaciones basadas en el estado del arte para los indicadores de calidad del laboratorio de embriología
| Indicador | Origen ovocitos/embriones | Óptimo | Deseable | Mínimo |
|---|---|---|---|---|
| Porcentaje de fecundación normal (2CP+2PN) en FIV/ICSI | Propios | 73,5 (70,2-79,2) | 63,2 (62,3-65,2) | 58,1 (56,7-59,5) |
| Donados | 78,9 (75,7-92,5) | 70,3 (69,4-73) | 66,3 (65,4-67,2) | |
| Número medio preembriones por TE en fresco | Propios | 1,74 (1,72-1,75) | 1,81 (1,79-1,85) | 2,05 (1,96-2,37) |
| Donados | 1,73 (1,67-1,75) | 1,84 (1,82-1,89) | 2,06 (1,97-2,56) | |
| Porcentaje de preembriones evolutivos en ciclos FIV/ICSI | Propios | 70,8 (66-90,1) | 56,5 (54,8-58,3) | 47,9 (45,4-50,4) |
| Donados | 68,8 (62,9-88,8) | 52,3 (48,7-55,9) | 41,6 (41,4-42,9) | |
| Porcentaje de supervivencia embrionaria tras descrioconservación(Embriones) | Propios | 84,5 (77,3-95,7) | 60,8 (58,2-65,8) | 45,7 (40,7-50,8) |
| Donados | 88 (83,3-96,9) | 66,8 (61,1-72,4) | 52 (46,1-55) | |
| Porcentaje de preembriones crioconservados por ciclo | Propios | 38,5 (30,1-52,7) | 21,6 (17-24) | 12,9 (11,2-13,7) |
| Donados | 45,2 (38,1-68,8) | 28,4 (26,3-30) | 19,2 (18,2-21,2) | |
| Porcentaje de supervivencia ovocitaria tras descrioconservacióna | Propios | 91,1 (82,1-93,7) | 75,2 (46,6-81,6) | 35,9 (26,8-46,6) |
| Donados | 89,8 (83,1-94,2) | 80 (70,6-82,3) | 52,4 (49,3-70,4) |
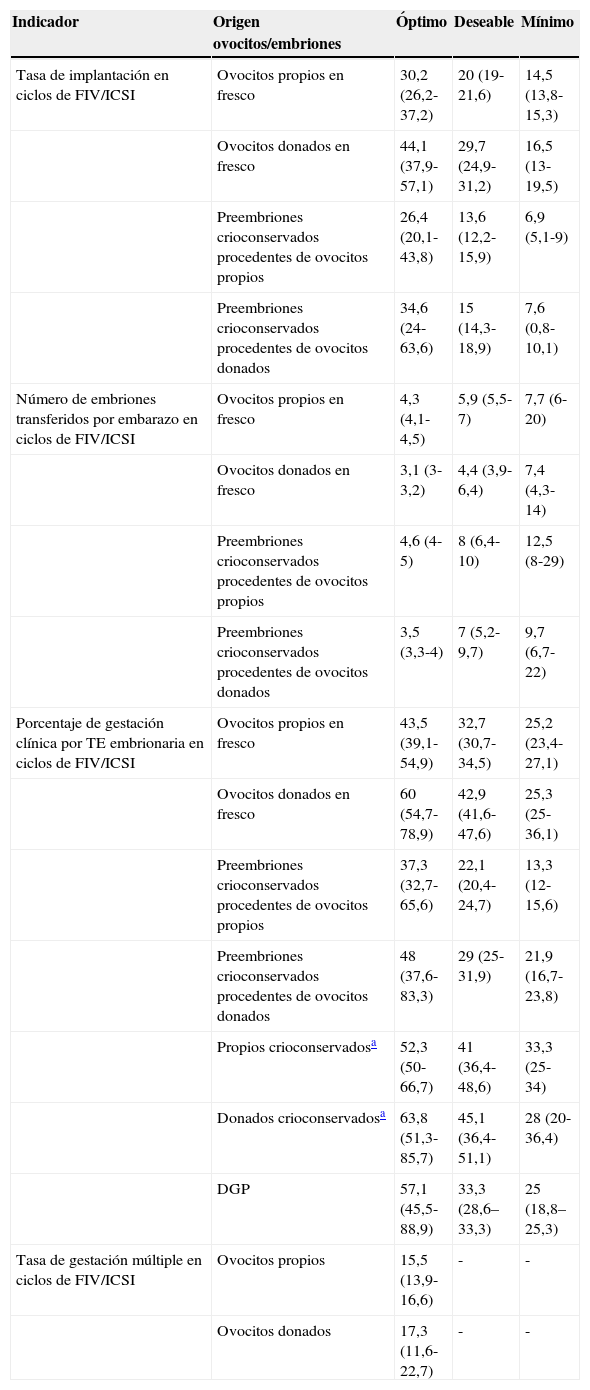
Especificaciones basadas en el estado del arte para los indicadores de calidad en gestación
| Indicador | Origen ovocitos/embriones | Óptimo | Deseable | Mínimo |
|---|---|---|---|---|
| Tasa de implantación en ciclos de FIV/ICSI | Ovocitos propios en fresco | 30,2 (26,2-37,2) | 20 (19-21,6) | 14,5 (13,8-15,3) |
| Ovocitos donados en fresco | 44,1 (37,9-57,1) | 29,7 (24,9-31,2) | 16,5 (13-19,5) | |
| Preembriones crioconservados procedentes de ovocitos propios | 26,4 (20,1-43,8) | 13,6 (12,2-15,9) | 6,9 (5,1-9) | |
| Preembriones crioconservados procedentes de ovocitos donados | 34,6 (24-63,6) | 15 (14,3-18,9) | 7,6 (0,8-10,1) | |
| Número de embriones transferidos por embarazo en ciclos de FIV/ICSI | Ovocitos propios en fresco | 4,3 (4,1-4,5) | 5,9 (5,5-7) | 7,7 (6-20) |
| Ovocitos donados en fresco | 3,1 (3-3,2) | 4,4 (3,9-6,4) | 7,4 (4,3-14) | |
| Preembriones crioconservados procedentes de ovocitos propios | 4,6 (4-5) | 8 (6,4-10) | 12,5 (8-29) | |
| Preembriones crioconservados procedentes de ovocitos donados | 3,5 (3,3-4) | 7 (5,2-9,7) | 9,7 (6,7-22) | |
| Porcentaje de gestación clínica por TE embrionaria en ciclos de FIV/ICSI | Ovocitos propios en fresco | 43,5 (39,1-54,9) | 32,7 (30,7-34,5) | 25,2 (23,4-27,1) |
| Ovocitos donados en fresco | 60 (54,7-78,9) | 42,9 (41,6-47,6) | 25,3 (25-36,1) | |
| Preembriones crioconservados procedentes de ovocitos propios | 37,3 (32,7-65,6) | 22,1 (20,4-24,7) | 13,3 (12-15,6) | |
| Preembriones crioconservados procedentes de ovocitos donados | 48 (37,6-83,3) | 29 (25-31,9) | 21,9 (16,7-23,8) | |
| Propios crioconservadosa | 52,3 (50-66,7) | 41 (36,4-48,6) | 33,3 (25-34) | |
| Donados crioconservadosa | 63,8 (51,3-85,7) | 45,1 (36,4-51,1) | 28 (20-36,4) | |
| DGP | 57,1 (45,5-88,9) | 33,3 (28,6–33,3) | 25 (18,8–25,3) | |
| Tasa de gestación múltiple en ciclos de FIV/ICSI | Ovocitos propios | 15,5 (13,9-16,6) | - | - |
| Ovocitos donados | 17,3 (11,6-22,7) | - | - |
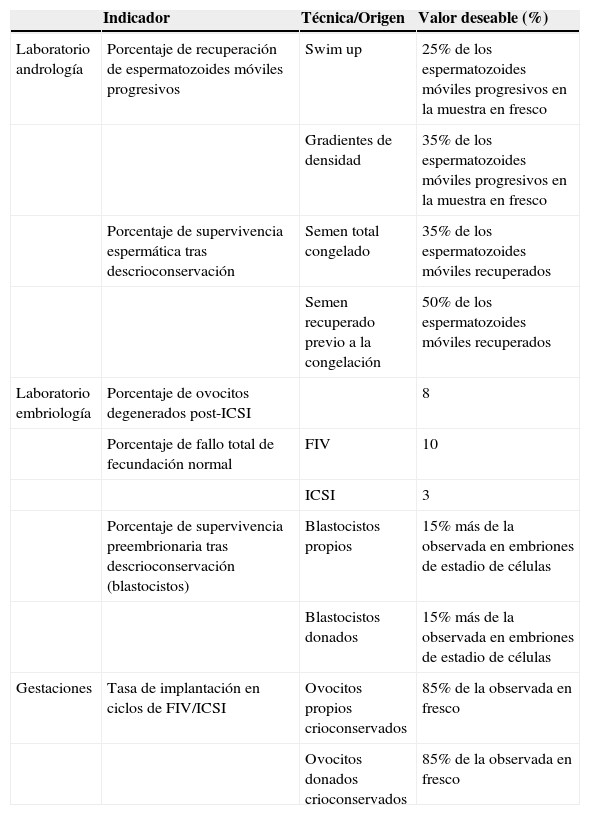
En la tabla 4 podemos observar que de los 6 indicadores en los que se utiliza el método de consenso, en 2 la especificación se refirió al valor del estado del arte obtenido para otros indicadores (tasa de supervivencia embrionaria en blastocistos y tasa de implantación en FIV/ICSI de ovocitos propios y donados descrioconservados).
Especificaciones de los indicadores de calidad de los laboratorios de reproducción asistida y resultados clínicos basados en consenso de expertos
| Indicador | Técnica/Origen | Valor deseable (%) | |
|---|---|---|---|
| Laboratorio andrología | Porcentaje de recuperación de espermatozoides móviles progresivos | Swim up | 25% de los espermatozoides móviles progresivos en la muestra en fresco |
| Gradientes de densidad | 35% de los espermatozoides móviles progresivos en la muestra en fresco | ||
| Porcentaje de supervivencia espermática tras descrioconservación | Semen total congelado | 35% de los espermatozoides móviles recuperados | |
| Semen recuperado previo a la congelación | 50% de los espermatozoides móviles recuperados | ||
| Laboratorio embriología | Porcentaje de ovocitos degenerados post-ICSI | 8 | |
| Porcentaje de fallo total de fecundación normal | FIV | 10 | |
| ICSI | 3 | ||
| Porcentaje de supervivencia preembrionaria tras descrioconservación (blastocistos) | Blastocistos propios | 15% más de la observada en embriones de estadio de células | |
| Blastocistos donados | 15% más de la observada en embriones de estadio de células | ||
| Gestaciones | Tasa de implantación en ciclos de FIV/ICSI | Ovocitos propios crioconservados | 85% de la observada en fresco |
| Ovocitos donados crioconservados | 85% de la observada en fresco |
Como se aprecia en la figura 1, la especificación de calidad para el nivel deseable del indicador del laboratorio de embriología «porcentaje de fecundación normal» no varió a lo largo de los 4 años analizados. Sin embargo, sí se observa un aumento de la especificación de calidad para el nivel deseado del indicador de «tasa de supervivencia embrionaria» a la crioconservación.
En la figura 2 se observa que el nivel deseable de los indicadores de tasa de gestación por transferencia y la tasa de implantación fue similar a lo largo de los años analizados, exceptuando el valor deseable del porcentaje de gestación con criotransferencias de ovocitos donados, que varió en los años del estudio.
DiscusiónLa estabilidad observada en las especificaciones de calidad obtenidas mediante el método del estado del arte durante el periodo de tiempo analizado nos permite afirmar que la mayoría de las técnicas y procedimientos empleados en el laboratorio de reproducción asistida están estabilizados. Sin embargo, en crioconservación embrionaria los cambios observados muestran que ha habido algún factor que ha cambiado el rendimiento de esta técnica. Estos cambios podrían deberse a que la crioconservación embrionaria ha mejorado notablemente sus resultados, debido a que la vitrificación proporciona mejores tasas de supervivencia embrionaria y gestación que la congelación lenta tradicional (Loutradi et al., 2008). Dos aspectos importantes de esta técnica son los elevados niveles de toxicidad del crioprotector a temperatura ambiente (Shaw et al., 1992) y que el procedimiento de vitrificación y desvitrificación es tan rápido que evita la formación de cristales(Vajta et al., 1998). No obstante, los datos que se desprenden de diferentes estudios básicos muestran que la vitrificación es un método menos perjudicial para ovocitos y embriones que la congelación lenta (Larman et al., 2007; Cobo et al., 2008; Martínez-Burgos et al., 2011).
El aumento de criotransferencias observado en los últimos años (Kupka et al., 2014; Prados et al., 2012) debido a la generalización de la vitrificación y como consecuencia de la alta tasa de supervivencia embrionaria comparada con la congelación lenta, ha permitido establecer que la tasa de implantación es similar o superior con embriones vitrificados que con frescos (Roque et al., 2013). Las criotransferencias alcanzan el 22% de la actividad en los centros de reproducción asistida en Europa. En España, casi el 20% de los embarazos de FIV se logra mediante criotransferencia (Prados et al., 2012). No solo existen evidencias de una mejor tasa de implantanción y de embarazo con la técnica de vitrificación, sino que además, se han comunicado estudios de seguimiento de niños nacidos de embriones vitrificados por diversos métodos (Li et al., 2007), demostrando así la seguridad de esta técnica.
Los comentados avances en criotransferencias embrionarias han llevado a diversos autores a proponer la vitrificación de todos los embriones obtenidos en ciclos en fresco y transferirlos en ciclos posteriores con endometrios mejor preparados (Devroey et al., 2011; Roque et al., 2013). Evitando la transferencia en fresco y vitrificando todos los embriones destinados a futuras criotransferencias se podría mejorar la seguridad y eficacia de las técnicas de IVF e ICSI (Maheshwari y Bhattacharya, 2013). La generalización de esta práctica tendría consecuencias a nivel de las especificaciones de calidad, por lo que es necesaria una actualización de estas anualmente.
Nuestras especificaciones de calidad para criotransferencias embrionarias son menos exigentes que las publicadas por Alpha (Alpha Scientists in Reproductive Medicine, 2012). Esta Sociedad estableció mediante consenso de expertos los estándares más comunes de indicadores de calidad en crioconservación de gametos y embriones. Los valores de Alpha en comparación con nuestros datos están en su mayoría dentro de los intervalos de confianza, excepto en el caso de la tasa de supervivencia embrionaria donde su nivel «competence» está muy por encima de su equivalente en nuestro indicador (nivel deseable). Este hecho puede deberse a que en el caso de Alpha diferencian sus valores en función de la técnica usada; por un lado usan la congelación lenta y por otro la vitrificación. Otro motivo que puede causar estas diferencias es el método utilizado para calcular las especificaciones de calidad de los indicadores de crioconservación; en nuestro estudio es el método basado en el estado del arte y en la Sociedad Alpha se realiza mediante consenso de expertos. Diferencias en las especificaciones de calidad según el método usado para su cálculo se han descrito en otras áreas de laboratorio clínico (Álvarez et al., 2003; Castilla et al., 2005; Aguilar et al., 2008).
Las especificaciones de calidad de gestación múltiple en ciclos FIV/ICSI con ovocitos propios establecidas son claramente inferiores a la media de gestación múltiple observada en Europa (20,6%; Kupka et al., 2014) y en España (22,4%; Prados et al., 2012). Lo mismo ocurre en el caso de gestaciones múltiples en IAC e IAD, donde las tasas europeas están en el 8,1% y el 9,8% respectivamente, mientras que nuestros niveles óptimos tienen unos valores del 7,5% en IAC y del 7,9% en IAD. Aunque la situación ideal es 0% de embarazo múltiple, nuestra especificación de calidad puede considerarse como un objetivo «alcanzable» de excelencia.
La importancia de los aspectos técnicos en determinados indicadores ha obligado a desglosar las especificaciones de calidad basadas en consensos de expertos por técnica. Así, se tienen que considerar 2 especificaciones de calidad para el porcentaje de recuperación de espermatozoides móviles: una para «swim up» y otras para «gradientes de densidad». Diversos autores han observado diferencias en los resultados de ambas técnicas (Claassens et al., 1998; Morshedi et al., 2003). Igual ocurre con los indicadores de supervivencia espermática a la crioconservación, donde se diferencia entre el semen que se congela directamente y aquel que se recupera antes de ser congelado, ya que son varios los trabajos que reportan diferencias entre estos procedimientos (Amesse et al., 2003; Punyatanasakchai et al., 2008). En el futuro, probablemente sea necesario establecer especificaciones en función de las nuevas técnicas de crioconservación o de la calidad de las muestras de semen crioconservadas.
Una de las limitaciones de las especificaciones de calidad calculadas se debe a que los datos se obtuvieron del Registro de la SEF, donde la recogida y envío de datos es voluntaria, lo que podría sesgar los resultados. Además, los solapamientos comentados de los intervalos de confianza de algunas de las especificaciones de calidad de los indicadores nos hace pensar en que sería necesario un mayor número de centros participantes en estas técnicas. Las especificaciones de indicadores relacionados con ovocitos crioconservados no deben considerarse completamente válidas pues fueron obtenidas con los datos reportados por menos de 15 centros. Todas las demás especificaciones fueron calculadas a partir de los datos reportados por más de 30 centros.
Las especificaciones de los indicadores de calidad descritas en este trabajo deben interpretarse como una indicación del «nivel de calidad» del procedimiento, con la finalidad de establecer que la prestación es adecuada para su uso clínico. En el trabajo establecemos 3 niveles de calidad utilizando 3 percentiles, pero estos percentiles son parámetros estadísticos obtenidos a partir de una muestra por lo que tienen una incertidumbre en su cálculo. Por esto optamos por una estimación puntual (percentil) y una estimación por intervalo (intervalo de confianza). Fuera del ámbito estadístico, consideramos que para un fácil manejo de estas especificaciones es recomendable usar solo la estimación puntual (percentiles). Así, para cualquier laboratorio cuyo valor de un indicador de calidad sea inferior (en caso de indicadores directos, cuanto más alto es, mayor es la calidad) a un nivel determinado de calidad deberá considerarse que su prestación no alcanza ese nivel. Los niveles de calidad lo marcan los valores entre cada percentil establecido. Los intervalos de confianza son solo estimaciones de esos percentiles, que nos permiten, principalmente, comprobar si hay variación significativa a lo largo de los años
En resumen, los métodos utilizados (estado del arte y consenso) demuestran que son válidos para establecer las especificaciones de calidad de los indicadores del laboratorio de reproducción, a excepción del método del arte para los indicadores de la crioconservación de embriones que precisa de un seguimiento en los próximos años debido a los grandes avances producidos en este campo. Este trabajo viene a cubrir una laguna en el ámbito de la gestión de calidad en laboratorio de reproducción, y ayudará a los centros de reproducción a utilizar los indicadores de calidad como herramienta central para asegurar que el servicio prestado permite la práctica de una medicina reproductiva centrada en el paciente. Facilitando los procedimientos para garantizar la calidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Anexo:Grupo de Interés de Calidad de ASEBIR:Vicente Badajoz, Carmen Bou, Sonia Delgado, Arantza Farreras, María José Gómez, Marta Luna, Clara Mangrané, Alba Mauri, Yolanda Minguez, Irene Molina, Nicolás Prados, Anna Rabanal, Juan Pablo Ramírez, Lourdes Sánchez, Nagore Uriarte y Montserrat Boada.
Comité de Registro de la Sociedad Española de Fertilidad:Agustín Ballesteros, Rosario Buxaderas, Yolanda Cabello, Irene Cuevas, Montserrat de Andrés, Maria José de los Santos, Juana Hernandez, Julio Herrero, Javier Marqueta, Ana Segura y Ester Vidal.