El uso de medios de contraste dentro del arsenal diagnóstico y terapéutico médico puede ocasionar efectos adversos como toxicidad renal e injuria renal aguda, conocida como nefropatía inducida por contraste. Se estima que en la población con función renal normal la incidencia es del 0-5%; sin embargo, en personas con alteración de la función renal basal puede llegar a un 12-27%. La nefropatía inducida por contraste se define como un aumento absoluto (≥ 0,5mg/dl) o relativo (≥ 25%) de la creatinina sérica en 24-72 h postexposición al medio de contraste. Es la tercera causa de injuria renal aguda intrahospitalaria y conlleva un aumento en la morbimortalidad de la población. No se dispone de un tratamiento específico para esta entidad. Por tanto, el énfasis se realiza en la prevención. Se han probado distintos agentes farmacológicos, sin embargo, hoy en día los únicos métodos que han logrado asegurar adecuada nefroprotección son el uso de agentes de contraste isoosmolares o de baja osmolaridad junto con hidratación continua del paciente antes, durante y después de la intervención.
The use of contrast media in the diagnostic and therapeutic medical arsenal can cause adverse effects, such as renal toxicity and acute kidney injury, known as contrast-induced nephropathy. It is estimated that the incidence is about 0-5% among the population with normal renal function; however it can reach 12-27% among people with altered baseline renal function. Contrast-induced nephropathy is defined as an absolute (≥ 0.5mg/dL) or relative increase (≥ 25%) of the serum creatinine within 24-72hours post-exposure to the contrast media. It is the third leading cause of in-hospital acute kidney injuries, and it leads to an increase in morbidity and mortality of the population. As there is no specific treatment available for this condition, emphasis should be placed on prevention. Different pharmacological agents have been tested, but the use of iso-osmolar or hypo-osmolar contrast agents along with continuous hydration before, during, and after the intervention are the only methods that have currently achieved adequate nephroprotection.
Es común en la práctica clínica la realización de estudios diagnósticos por medio de imágenes. Con el avance de la ciencia, los servicios de imágenes diagnósticas y los recursos terapéuticos, han amentado los eventos adversos asociados a ciertos procedimientos, como arteriografías, resonancias contrastadas, coronariografías, etc. Entre estos efectos adversos se encuentran eventos cardiovasculares, requerimiento de terapia sustitutiva renal, mortalidad, nefropatía inducida por contraste (NIC), entre otros1. En estudios observacionales no controlados se ha evidenciado un incremento de la ocurrencia de injuria renal aguda (IRA) como consecuencia a la administración intravenosa o intraarterial de medios de contraste yodados los cuales son fármacos nefrotóxicos, lo que explica el surgimiento de la NIC1-3. Tras la aparición de estudios posteriores se observó que su incidencia tal vez no era tan alta luego de tener un grupo control para comparar, por lo que se comenzó a cambiar el paradigma y el temor que se tenía4,5.
Sin embargo, se establece en la literatura que la NIC es uno de los factores etiológicos más importantes de IRA en ámbitos intrahospitalarios, se constituye una causa de altos costos, estancias más prolongadas en hospitales y aumento de la morbimortalidad6,7. En los últimos años se han logrado avances en el conocimiento de la fisiopatología, los factores de riesgo asociados, la prevención y el tratamiento adecuados6.
A continuación, se pretende realizar una descripción acerca de las definiciones propuestas, la epidemiología, la fisiopatología, la forma de presentación clínica y el enfoque de la prevención, siendo este el pilar más importante a tratar, evaluando las estrategias disponibles en la actualidad. Además, se busca describir los últimos hallazgos relacionados con el impacto de las estrategias de prevención.
DefiniciónEl término NIC hace referencia a un deterioro abrupto de la función renal secundaria a la administración de un medio de contraste (MC), en ausencia de otra etiología que lo explique8. Esta patología se encuentra con frecuencia en procedimientos asociados a servicios de diagnóstico por imágenes, especialmente aquellos de cardiología intervencionista (PCI)9. Se ha establecido que es la tercera causa de IRA en pacientes hospitalizados, alcanzando el 12% de los casos, seguida de hipoperfusión (42%) y postoperatorio (POP) renal (18%)7.
La definición clásica propuesta por Barret y Parfrey, la cual ha sido utilizada en muchos estudios, se entiende como aumento de la creatinina sérica (Crs) absoluto (≥ 0,5mg/dl) o relativo (≥ 25%) en comparación con la creatinina basal en las 24-48h o incluso hasta 72h luego de administración de un MC en ausencia de otra causa alternativa6,8,10. Sin embargo, hay numerosas definiciones propuestas en la literatura mundial. Cabe destacar que según las guías Kidney Disease Improving Global Outcomes (KDIGO), la definición propuesta recientemente es un aumento≥50% de Crs o≥0,3mg/dl que usualmente se presenta a las 48h9-11. Similarmente las guías americanas, The Acute Kidney Injury Network (AKIN) propone la definición como un aumento de≥0,3mg/dl en Crs con oliguria9-12.
Dada la gran cantidad de definiciones, resulta difícil establecer una sola definición aceptada por todos; sin embargo, la definición de elevación>0,5mg/dl es la que más se acepta13. Aunque no se llegue a un acuerdo mundial acerca de la definición, la más utilizada según la literatura es la propuesta por el grupo KDIGO, siendo la más práctica, con solo 2 criterios, sencilla de recordar o acceder y útil para clasificación de pacientes.
Por lo general, se presenta 1-3 días postexposición, el pico de elevación de la Crs es a los 3-5 días, retornando a la normalidad a los 7-10 días7 o incluso según otros reportes hasta 10-21 días, así que se considera que es autolimitada y reversible; raramente llega a causar falla renal persistente con necesidad de diálisis9-14. Cabe destacar que la elevación de Crs se puede dar en los 7-10 días siguientes a la administración del MC, sin embargo, no es lo común. Así pues, ciertos factores determinantes de la elevación de la creatininemia, como el sexo, la edad, la masa muscular, son responsables de la variabilidad en el tiempo de elevación y el grado de la misma6. Por último, cabe añadir que por su curso autolimitado y reversible, tras un procedimiento ambulatorio que requirió administración de MC, puede presentar elevación transitoria de la creatinina sin que nunca detectada clínicamente. Se recomienda medir los niveles de Crs entre las 24 y 72h postexposición al MC15.
EpidemiologíaLa incidencia de NIC varía mucho de acuerdo con los estudios que se tomen como referencia. Varía por las distintas definiciones usadas, por los medios de contraste utilizados, por los procedimientos a los cuales los pacientes fueron sometidos y además por los factores de riesgo individuales9.
La incidencia de NIC en la población general con función renal normal es de (0-5%); sin embargo, en pacientes con función renal alterada aumenta hasta un 12-27%7. Los factores predictores más relevantes de NIC son la función renal alterada y cateterismo cardiaco.
Los procedimientos que más se asocian a la NIC son las PCI, siendo más frecuente en la PCI de urgencia que en la electiva9. Por fortuna, el porcentaje de pacientes que luego de una PCI desarrollan una nefropatía que requiera diálisis es muy bajo,<1%16. No obstante, difiere en pacientes con alto riesgo. Además, en varios estudios se ha evidenciado la incidencia de NIC luego de otros procedimientos, como tomografía axial computarizada (TAC) contrastada (6%)17 y la postangiografía periférica (9%)18. Cabe aclarar que según estudios más recientes se considera que el riesgo de NIC tras procedimientos como la TAC con contraste es casi inexistente en pacientes con función renal normal de base, pero puede haber riesgo si la función está alterada8.
FisiopatologíaEl riñón es un órgano con alto nivel metabólico y estrés osmótico, muy susceptible a la isquemia, hipoperfusión sistémica y local6. La parte más susceptible a isquemia es la región medular externa, la cual requiere más oxígeno debido al alto transporte activo de solutos por el asa gruesa ascendente de Henle; la presión parcial de oxígeno en este lugar es de aproximadamente 10-20mmHg6,19.
Ante la administración de MC, la perfusión renal muestra un comportamiento bifásico, aumentando la perfusión en los 20min siguientes, sin embargo, esta respuesta es seguida de una disminución en la perfusión medular, la cual puede durar horas hasta días6,20. Lo que ocurre a continuación es un desequilibrio de los mediadores vasoactivos locales (vasoconstrictores y vasodilatadores), como el óxido nítrico, las prostaglandinas, la adenosina, la endotelina y las especies reactivas de oxígeno (ROS), predominando la vasoconstricción renal. Estos mediadores son liberados por las células endoteliales debido a la citotoxicidad directa del MC6,19. Así mismo, el MC provoca un aumento del consumo de oxígeno medular debido al alto transporte activo que se debe realizar para disminuir los efectos de una diuresis osmótica21.
El MC en el plasma induce también distorsión, agregación de los eritrocitos y aumento de la viscosidad, estos 2 mecanismos adicionales influyen también en la disminución de la perfusión renal y en la obstrucción capilar19. Una vez es filtrado el MC, el aumento de la viscosidad tubular causa obstrucción de la luz, liberación de ROS y daño tubular agudo22. Además, al aumentar la osmolaridad, causa excreción de agua y sodio marcadas, lo que eleva la presión intratubular que por último reduce la TFG y contribuye a la patogénesis de IRA7.
El mecanismo exacto y todas las interacciones de los factores involucrados en la patogénesis de la NIC no se conocen del todo7,19. En resumen, las teorías dominantes se basan en:
- –
Efectos citotóxicos directos del MC, que favorece fenómenos de inhibición de reabsorción tubular de proteínas, vacuolización, apoptosis y necrosis. Todo esto es mediado por los efectos de los ROS anteriormente mencionados, que causan estrés oxidativo y activación de citosinas proinflamatorias por este mecanismo7,19,23.
- –
Hay una precipitación de cristales favorecida en las células tubulares23.
- –
Hipoxia medular renal como consecuencia de un desequilibrio en moléculas vasoactivas con un predominio de vasoconstricción (adenosina y endotelina) y disminución de vasodilatadores (óxido nítrico y prostaglandinas), lo cual genera una cascada oxidativa que termina en injuria hipóxica a los túbulos renales y pérdida de nefronas7,23.
Según algunos estudios se cuestiona si es en verdad el MC lo que causa la NIC; argumentan que la IRA es causada por factores de riesgo y ocurre solo de forma coincidencial con la administración de MC. Sin embargo, por la falta de estudios que clarifiquen el tema, se recomienda seguir considerando la NIC como un fenómeno real que ocurre al menos en una población limitada8. Los factores de riesgo se clasifican en factores propios del paciente y propios del procedimiento7,23.
Propios del pacienteLa incidencia de NIC post-PCI varía desde un 2% hasta un 24-30%, dependiendo si los pacientes presentaban o no factores de riesgo como enfermedad renal preexistente7-9. Entre los factores se encuentran:
Función renal basal. El principal factor de riesgo antes del procedimiento para desarrollar NIC es la enfermedad renal crónica (ERC) previa con una tasa de filtración glomerular estimada (TFGe)<60ml/min/1,73 m219,24.
Comorbilidades y otros. Falla cardiaca NYHA III o IV, anemia y diabetes mellitus, con incidencias del 20, el 6,2-26,2 y el 3,7-10%, respectivamente25-27. Además: edad > 75 años, episodios de hipotensión (presión arterial sistólicos < 80mmHg por < 1h o que requiera vasopresores), trasplantes renales, hipoalbuminemia, fármacos nefrotóxicos concomitantes y cirrosis hepática7,23.
A su vez, los ancianos, los diabéticos o los pacientes con ERC tienen disfunción endotelial, lo que los hace más propensos a la citotoxicidad y respuesta vasoconstrictora exagerada por el MC. Del mismo modo, personas con bajo volumen circulante o estenosis de arteria renal tienen más riesgo de NIC, puesto que la respuesta vasoconstrictora ante el MC agravaría más su condición de base19.
Factores propios del procedimiento (medios de contraste)Primero hay que establecer que la palabra contraste se refiere a que en la imagen radiológica hay variación en la escala de grises, teniendo transiciones desde blanco brillante a negro absoluto6. Los medios de contraste son materiales usados para mejorar la visibilidad de los vasos sanguíneos. Son excretados principalmente por el riñón, tienen una vida media de 2h, a las 4h el 75% se ha eliminado y el 100% a las 24h7. La estructura básica de una sustancia utilizada como MC es un anillo bencénico con 3 átomos de iodo, estos le confieren el poder de opacificación19.
Las principales propiedades de los MC son el poder iónico, la osmolaridad (que depende del número de partículas disueltas en la solución) y la viscosidad del agente usado28. Todos los MC utilizados son citotóxicos, unos menos que otros, y dependen de las propiedades anteriormente mencionadas28.
Los MC se clasifican en hipoosmolares (no iónicos) o de baja osmolaridad (MCBO), hiperosmolares (iónicos) o de alta osmolaridad (MCAO) e isoosmolares (MCIO)6. Según Azzalini et al.29: los MCAO definidos como una osmolaridad de (1.500-800 mOsmol/kg) incluyen el metrizoato, diatrizoato y el iothalamato; los MCBO (600-850 mOsmol/kg) incluyen el iopamidol, iopentol, ioversol, ioxaglate y el iohexol, y los MCIO (290 mOsmol/kg) incluyen el iotrolan, el iosimenol y, por último, el iodixanol. Los destacados en letra cursiva son los más usados.
Los MCAO son altamente nefrotóxicos y, por tanto, en la práctica clínica raramente se usan en la actualidad y han sido retirados del mercado en la mayoría de los países dados sus efectos adversos, mientras que los MCBO y MCIO son más seguros. Sin embargo, la osmolaridad está inversamente relacionada con la viscosidad, lo que significa que estos últimos son más viscosos19. Otro beneficio que presentan los MCBO es mejor absorbancia de rayos X y, por tanto, mejor visualización del vaso. Por lo anterior, y por la disminución de los eventos adversos y de NIC comparados con MCAO, se usan agentes hipo o isoosmolares, y esto se refleja en las guías de la Sociedad Europea de Cardiología (ESC)9. Cabe señalar que la clasificación que se les dio fue cronológica; primero se describieron los MCAO, luego los MCBO y por último los MCIO21.
El principal factor de riesgo es la osmolaridad alta, además del volumen total utilizado, su viscosidad, inyección intraarterial, múltiples inyecciones en<72h30.
Volumen. El riesgo de NIC aumenta conforme aumenta el volumen de MC utilizado en las intervenciones, determinándose que por cada 20ml de MC que se administra por encima de 4ml/kg se dobla el riesgo de NIC9. Bartholomew et al. en un estudio hallaron un riesgo relativo (RR) de 1,8 si se administra > 240ml de MC con respecto a pacientes que se les agregue menos de este valor31. Según otros estudios, el riesgo aumenta cuando el volumen de MC es > 350ml o >4ml/kg19.
Dosis máxima de contraste. Debería ser 5ml de contraste por kilogramo de peso del paciente (máximo 300ml) dividido la Crs pre exposición al MC9,32.
Como se dijo anteriormente, los MCAO tienen más nefrotoxicidad, la cual fue disminuida con el uso de MCIO y MCBO. McCullough et al.33 realizaron un metaanálisis que demostró una baja incidencia de NIC con MCIO como iodixanol comparado con MCBO, principalmente en personas con ERC o diabetes. Por esta razón, se puede asegurar que los MCBO o MCIO sí reducen la NIC, pero en pacientes de alto riesgo, mientras que en pacientes con función renal normal tienen poca o nula ventaja.
En los estudios no se registra cual es mejor: los hipoosmolares o isoosmolares. Por lo tanto, en el momento actual no existe evidencia clara que soporte el uso de uno u otro. Se hace mención de un metaanálisis publicado recientemente el cual indica un posible efecto benéfico del iodixanol (MCIO) comparado con los MCBO; sin embargo, la diferencia no fue clínicamente significativa23. Es por esto que aún no existen estudios para soportar una recomendación y tampoco existen estudios que comparen cabeza a cabeza diferentes medios de contraste.
Escalas de riesgoPara establecer un riesgo probable del desarrollo de la NIC y comparar el riesgo de exposición al MC se han desarrollado sistemas de puntuación, Mehran et al.34 diseñaron un sistema de predicción del riesgo de NIC posprocedimiento de 0-16 puntos, en donde < 5 puntos (bajo riesgo) tiene un 7,5% de posibilidad de NIC, 0,04% riesgo de diálisis, mientras que puntajes>16 (muy alto riesgo) tienen probabilidad de NIC del 57,3 con un 12,6% de necesidad de diálisis. Además, para cada categoría de puntaje se establece un porcentaje de mortalidad asociado23 (tabla 1).
Predicción del riesgo de NIC después de PCI
| Factor de riesgo | Puntuación | ||
|---|---|---|---|
| Hipertensión arterial | 5 | ||
| Presión sistólica<80mmHg más de 1 h | |||
| Soporte inotrópico | |||
| Uso de balón de contrapulsación | 5 | ||
| Insuficiencia cardiaca | 5 | ||
| Clase funcional NYHA avanzada | |||
| Historia previa de edema pulmonar agudo | |||
| Edad>75 años | 4 | ||
| Diabetes mellitus | 3 | ||
| Hematocrito<39% para hombres, < 36% para mujeres | 3 | ||
| Volumen medio de contraste utilizado | 1 por cada 100ml | ||
| Tasa de filtración glomerular (ml/min/1,73 m2) | |||
| Entre 40-60 | 2 | ||
| Entre 20-40 | 4 | ||
| <20 | 6 | ||
| Puntuación | |||
|---|---|---|---|
| Puntos totales | Riesgo de incremento de creatinina sérica mayor de 0,5mg/dl o del 25% | Riesgo de diálisis | Mortalidad al año (%) |
| Menos de 5 | 7,5 | 0,04 | 2 |
| 6-10 | 14 | 0,12 | 5,7 |
| 11-16 | 26.1 | 1,09 | 13,5 |
| Más de 16 | 57,3 | 12,6 | 33,3 |
NIC: nefropatía inducida por medios de contraste; PCI: procedimiento de cardiología intervencionista.
Tomado de Fernández-Cimadevilla et al.23.
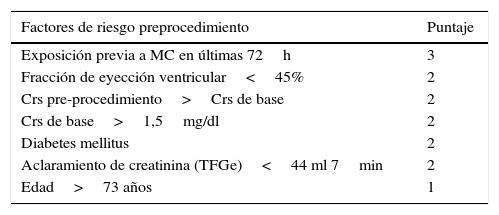
A pesar de la creación de este sistema, solo sirve para ver la posibilidad postexposición, por lo que se diseñó otro sistema para detectar posibilidad preexposición, desarrollado por Maioli et al.35 (tabla 2).
Probabilidad de NIC preexposición a MC
| Factores de riesgo preprocedimiento | Puntaje |
|---|---|
| Exposición previa a MC en últimas 72h | 3 |
| Fracción de eyección ventricular<45% | 2 |
| Crs pre-procedimiento>Crs de base | 2 |
| Crs de base>1,5mg/dl | 2 |
| Diabetes mellitus | 2 |
| Aclaramiento de creatinina (TFGe)<44 ml 7min | 2 |
| Edad>73 años | 1 |
| Puntaje | 0-3 | 4-6 | 7-8 | > 9 |
|---|---|---|---|---|
| Riesgo de NIC | Bajo 1,1% | Moderado 7.5% | Alto 22,3% | Muy alto 52,1% |
Crs creatinina sérica; MC: medio de contraste; NIC: nefropatía inducida por medios de contraste; TFGe: tasa de filtración glomerular estimada.
Adaptado de Rear et al.19.
La NIC generalmente es autolimitada y cursa con una disminución transitoria de la función renal; normalmente cursa como una IRA no oligúrica en personas con Crs normal y generalmente se presenta en procedimientos ambulatorios, sin necesidad de hospitalización; sin embargo, es oligúrica en pacientes que tienen compromiso leve/moderado de la función renal6,30. Dura de 3-5 días, con una potencial recuperación de la función renal normal al séptimo día. Solo unos pocos casos requieren diálisis, lo cual implica hospitalización por tiempo prolongado, hasta 17 días aproximadamente6.
Complicaciones y eventos adversosSi bien la mayoría de las NIC son autolimitadas y la función renal regresa a su estado habitual en 1-3 semanas, se pueden presentar complicaciones a corto y a largo plazo, como la insuficiencia renal permanente, la diálisis y la muerte8. Una de las complicaciones presentadas fue el empeoramiento progresivo de la función renal, hasta en el 20% de los casos36, con requerimiento de terapia sustitutiva renal el 0,7-7%19. Varios estudios han demostrado la asociación entre la NIC y la mortalidad intrahospitalaria y mortalidad a largo plazo9.
Sin embargo, en los estudios en que se busca establecer la relación entre NIC y mortalidad, esta no es del todo clara según varios reportes8,37. Tal postulado se debe a la presencia de otras variables, como las comorbilidades de los pacientes, que incrementan el riesgo de IRA y además por sí solas pueden ser causantes de mortalidad. En los estudios observacionales no se hicieron ajustes para estas covariables, por lo que los resultados son difíciles de comparar9.
No obstante, en un metaanálisis realizado por James et al.38, de los estudios escogidos ajustados a las covariables que podían ser confusores, se encontró que el RR de mortalidad y eventos cardiovasculares fue 2,39 y 1,98, respectivamente, pero aun así son débiles para probar esta relación entre NIC y mortalidad9,37. Otros estudios reportan que la mortalidad intrahospitalaria fue 5 veces mayor y la mortalidad a 1 y 5 años era 4 veces mayor comparada con los que no desarrollaron NIC, con porcentajes de tasa de mortalidad a un año entre el 20 y el 38%19.
Prevención de nefropatía inducida por contrasteUna vez instaurada la NIC, no hay tratamiento definitivo, por lo cual los esfuerzos se deben basar en un acercamiento dirigido a la prevención del evento, especialmente en los que tengan alto riesgo de NIC7. En contraste con otros temas de interés médico, se han elaborado pocas guías para la NIC; entre las últimas publicadas se encuentra la actualización A European Renal Best Practice (ERBP) position statement on the Kidney Disease Improving Global Outcomes (KDIGO) Clinical Practice Guidelines on Acute Kidney Injury, del 2012 39 y el 201340. También se encuentran las guías de la Sociedad Europea de Cardiología del 201441.
Según la actualización hecha por (European Renal Best Practice en las guías KDIGO) del 201239 siempre se debe sopesar el beneficio del procedimiento sobre el riesgo de NIC; si este es muy alto, la recomendación sería usar otro método de imagen que no requiera contraste, pero que tenga una exactitud diagnóstica similar.
Medidas no farmacológicas (tabla 3)Medio de contrasteLos MCBO son más caros que los MBAO, pero han logrado disminuir la incidencia de NIC. En pacientes con función renal normal no hay diferencia entre MC hipo o hiperosmolares7. En los estudios que compararon los MCBO no se encontró diferencia en el riesgo de NIC entre ellos. Como recomendación luego de un metaanálisis, se establece que no hay diferencia importante entre el MC que se escoja, sea MCBO o un MCIO42, así que se recomienda el uso de cualquiera de estos 2, enfatizando que entre menor volumen de MC mejor19.
Recomendaciones y evidencia en la prevención de NIC con medidas no farmacológicas
| Medida | Consideraciones | Nivel de evidencia |
|---|---|---|
| Usar MCBO o MCIO | Cualquiera de los 2 se puede usar Evitar uso de MCAO | IA |
| Usar el mínimo volumen posible del MC | El volumen del MC debe limitarse a < 4ml/kg o la relación volumen de MC/depuración de Crs (V/CrCl < 3,7:1 | IIA |
| Calcular el riesgo de desarrollo de NIC | Usar escalas creadas por Mehran et al. y Maioli et al. | IC |
| Suspender medicamentos nefrotóxicos | Suspender fármacos no esenciales por 24 h antes hasta 24 h después de administración de MC | No graduado |
Adaptado de Rear et al.19.
El volumen del MC debe limitarse a < 4ml/kg o la relación volumen de MC/depuración de Crs (V/CrCl < 3,7:1)19. McCulough et al. encontraron que el riesgo era muy bajo si solo se usaba<100ml de MC en personas con función renal normal, puesto que si es alterada aún representa riesgo7. En caso de ser necesario otro procedimiento, se deben esperar desde 3 días hasta 2 semanas o hasta que sea clínicamente aceptable, para dar tiempo a recuperación de lesiones eventuales y permitir la depuración del MC19. Sin embargo, ante la urgencia de realizar estudios, por ejemplo en pacientes con comorbilidades cardiovasculares, no hay que retrasar el método diagnóstico, a menos que el riesgo sea excesivo19.
Hemodiálisis y hemofiltraciónEstos 2 métodos se han propuesto como alternativas inmediatamente después del procedimiento con el MC para depurarlo de la circulación. Estudios indican que la hemodiálisis profiláctica no tuvo ningún beneficio43,44; por el contrario, la hemofiltración por 24h posprocedimiento sí redujo la incidencia de NIC45. Sin embargo, según las guías KDIGO, no son recomendados en la práctica clínica39.
Suspender fármacos nefrotóxicos no esencialesMuchos de los medicamentos utilizados de rutina tienen excreción renal y potencial de nefrotoxicidad, entre los cuales se destacan los antiinflamatorios no esteroideos/inhibidores de la ciclooxigenasa 2, aminoglucósidos, diuréticos de asa, antivirales como aciclovir, inhibidores de la enzima conversora de angiotensina y antagonistas del receptor de angiotensina II, por lo que deben ser suspendidos 24h antes hasta 24h después del MC7,19. De forma similar, un medicamento en particular, la metformina (antidiabético oral), que tiene excreción renal de un 90%, debe suspenderse 2 días antes y reiniciar 2 días después del MC. Esto se hace para reducir el riesgo de acidosis láctica que se puede producir si se disminuye la depuración de este fármaco19.
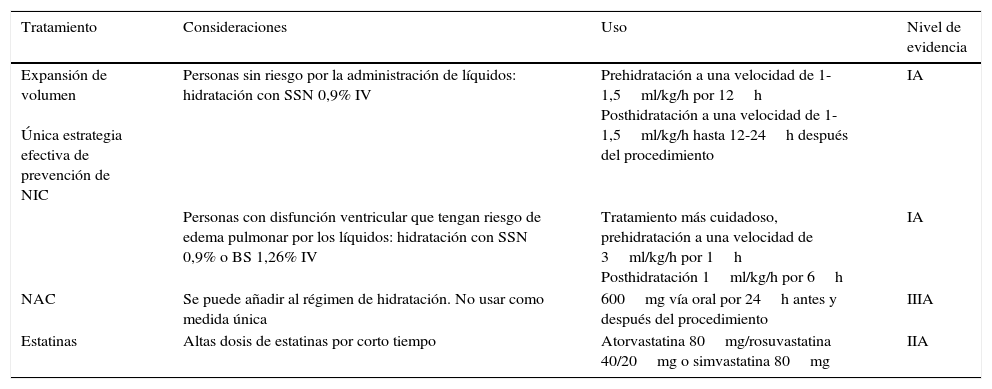
Manejo farmacológico (tabla 4)Expansión de volumenEs la única estrategia efectiva de prevención de NIC7,8,19. No se sabe muy bien el mecanismo por el cual reduce el riesgo; sin embargo, lo que se postula es que con el aporte de líquidos se diluye el MC, lo que disminuye la nefrotoxicidad, además que con la expansión de volumen se inhibe el sistema renina angiotensina aldosterona y se mantiene el flujo sanguíneo renal por lo que se disminuyen los efectos vasoconstrictores y la hipoxia46,47.
Recomendaciones y evidencia en la prevención de NIC con manejo farmacológico
| Tratamiento | Consideraciones | Uso | Nivel de evidencia |
|---|---|---|---|
| Expansión de volumen Única estrategia efectiva de prevención de NIC | Personas sin riesgo por la administración de líquidos: hidratación con SSN 0,9% IV | Prehidratación a una velocidad de 1-1,5ml/kg/h por 12h Posthidratación a una velocidad de 1-1,5ml/kg/h hasta 12-24h después del procedimiento | IA |
| Personas con disfunción ventricular que tengan riesgo de edema pulmonar por los líquidos: hidratación con SSN 0,9% o BS 1,26% IV | Tratamiento más cuidadoso, prehidratación a una velocidad de 3ml/kg/h por 1h Posthidratación 1ml/kg/h por 6h | IA | |
| NAC | Se puede añadir al régimen de hidratación. No usar como medida única | 600mg vía oral por 24h antes y después del procedimiento | IIIA |
| Estatinas | Altas dosis de estatinas por corto tiempo | Atorvastatina 80mg/rosuvastatina 40/20mg o simvastatina 80mg | IIA |
Adaptado de Rear et al.19.
Usar la vía oral o IV son similares para la administración de los líquidos expansores de volumen en pacientes de bajo riesgo de NIC19. Sin embargo, en pacientes de moderado o alto riesgo, se ha comprobado que la vía IV es superior48. En contraste con lo descrito por Trivedi et al.48, se han hecho estudios posteriores que no demuestran que la vía IV es mejor49. Un metaanálisis reciente demostró que la hidratación por vía oral (administrando agua) era al menos igual de efectiva que la hidratación IV en pacientes con o sin enfermedad renal de base; sin embargo, esta afirmación no aplica para personas con ERC estadios 4 o 5 ni con disfunción ventricular sistólica puesto que no fueron incluidas en los estudios50.
Por lo general, se usan cristaloides IV como la solución salina (SSN) isotónica, puesto que se encontró que reducía riesgo de NIC comparada con SSN hipotónica (0,45%)51. Sin embargo, se postuló el bicarbonato de sodio (BS) como alternativa, pensando en el beneficio teórico por la alcalinización de la luz tubular que disminuye los ROS52. Por lo tanto, se han realizado varios estudios comparando el BS vs. SSN en los que los resultados son muy variados y su uso es controvertido53-56.
Según un estudio realizado en pacientes en unidad de cuidados intensivos sobre el uso de BS, no disminuyó la incidencia de NIC57. Según otros 2 metaanálisis recientemente publicados, el uso de BS no fue superior a la SSN isotónica56-58. El último estudio mencionado fue realizado en Colombia y además añadieron que no es superior en la reducción de requerimiento de reemplazo renal ni en la reducción de mortalidad58.
Dada la falta de evidencia y recomendaciones a favor, las guías de la Sociedad Europea de Cardiología recomiendan hidratación antes, durante y después del procedimiento19.
Otros agentes profilácticos propuestos para la prevención de NIC han sido N-acetilcisteína (NAC), ácido ascórbico, teofilina y estatinas, entre otros7,19. La NAC y el ácido ascórbico son fármacos antioxidantes y con propiedades vasodilatadoras que neutralizan los ROS y pudieran reducir la NIC.
N-acetilcisteínaTiene propiedades antioxidantes al neutralizar los radicales libres3 y vasodilatadoras por vías tanto dependientes del óxido nítrico56 como dependientes de una mejoría en la función vasodilatadora endotelial3. La dosis usada por lo general son 1.200mg por vía oral por 24h antes y después del procedimiento23,59. Según varios estudios se ha encontrado un beneficio. Haciendo mención de uno de ellos, fue un estudio prospectivo, el cual concluyó que la adición de NAC a SSN era superior a NAC junto con ácido ascórbico en la prevención de NIC59. Sin embargo, se encuentran otros estudios y metaanálisis que no demuestran un beneficio al añadir NAC a la SSN56. A pesar de las controversias, según las guías de la ESC y la actualización hecha por (European Renal Best Practice en las guías KDIGO), se recomienda no usarlo como único método de prevención, pero se puede usar como adición al régimen de hidratación11.
Ácido ascórbicoNecesita más estudios, sin embargo, hasta el momento no se recomienda debido a que no han comprobado su beneficio y hasta se registró aumento de la incidencia de NIC7,60.
TeofilinaEs una xantina no selectiva antagonista de receptores de adenosina; se ha postulado como candidata a reducir NIC por disminución de la vasoconstricción arteriolar mediada por adenosina7. A pesar que hay estudios que avalan su uso y afirman ser superior a NAC en la prevención NIC61, su uso no se recomienda por resultados contrarios encontrados en metaanálisis realizados62.
DopaminaGracias a su efecto vasodilatador en la vasculatura renal fue promisoria pero no se recomienda su uso por resultados negativos cuando se estudió7. Así mismo el fenoldopam que es un agonista selectivo de receptores dopamina 1, no es recomendado según la actualización hecha por European Renal Best Practice en las guías KDIGO39.
Por último, las estatinas se han estudiado por varios efectos nefroprotectores incluso en pacientes con ERC. Entre sus efectos pleiotrópicos se encuentran la limpieza de ROS, efectos antiinflamatorios y antitrombóticos. Estimulan la producción de óxido nítrico y han demostrado efectos antiapoptóticos de células tubulares renales63. Además de lo anterior, las estatinas también inducen disminución en el número de receptores de angiotensina y disminuyen la síntesis de endotelina 1, modulando así la hipoperfusión renal64. Recientemente se hizo un metaanálisis que demostró una disminución significativa del 51% de riesgo para NIC en el grupo de pacientes tratados con rosuvastatina vs. grupos control65. Otro metaanálisis que comparó estatinas con SSN y NAC vs. SSN o BS y NAC demostró una disminución significativa con un RR 0,52 a favor del grupo de estatinas en reducción de NIC56. Consistentemente, las guías ESC recomiendan el uso de altas dosis de estatinas (atorvastatina 80mg/rosuvastatina 40/20mg o simvastatina 80mg) como terapia preventiva de NIC19.
Resumen y conclusiónLos procedimientos diagnósticos y terapéuticos que usan medios de contraste, principalmente la PCI, están asociados a NIC, que conlleva riesgos de morbimortalidad, tanto intrahospitalarios como a largo plazo, y posible deterioro de la función renal. No hay una definición unánime usada universalmente para NIC, por lo que los estudios muchas veces no son comparables y hay confusión o dificultad en el diagnóstico de la entidad. Como sugerencia para la realización de nuevos estudios, luego de los procedimientos realizados, se deberían anotar datos como el tipo de contraste utilizado, el volumen, el tiempo de duración del examen, el intervalo transcurrido entre aplicación de nuevo MC, además de ser rigurosos estableciendo las comorbilidades de los pacientes y sus factores de riesgo bien definidos para futuras comparaciones.
Por los estudios recientes, se puede plantear que en personas sin factores de riesgo su presentación es poco frecuente. De ahí la importancia de identificar los que sí los tenga.
Hasta el momento, la estrategia de expansión continua de volumen con líquidos IV o por vía oral, el uso de MC hipo o isoosmolares con el mínimo volumen de posible y el retiro de fármacos nefrotóxicos son las medidas preventivas que se han demostrado consistentemente efectivas. Gracias a los avances, hay alternativas que pueden reducir más el riesgo de NIC, como la adición de estatinas al tratamiento. La NAC aún sigue siendo motivo de controversia, aunque se acepta su uso. Por la carga de enfermedad, resulta de gran importancia conocer los factores de riesgo para desarrollar NIC, hacer uso de las escalas propuestas para determinar la posibilidad del riesgo y ofrecer el tratamiento rápido y oportuno para los pacientes, con el fin de asegurar un curso benigno si se desarrolla la enfermedad, o prevenirla por completo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesSe declara no presentar conflictos de interés actuales o potenciales.
Agradezco al Dr. Jhon Mauricio Lopera Vargas, nefrólogo de la institución Hospital San Vicente de Paul, por la asesoría brindada y apoyo en la elaboración del presente artículo.
Agradezco a la Dra. Maria Isabel Perez Palacio por su apoyo en la revisión y correcciones necesarias.