El cerebelo es una estructura que se ha vinculado con múltiples funciones, tales como control motor, cognición, memoria y procesamiento emocional. En cuanto a su relación con los sistemas sensoriales no está claro el papel que desempeña en relación con el sentido del olfato. Suponemos que las ratas macho sexualmente inexpertas presentarán un incremento en la actividad neuronal del vermis cerebelar tras ser estimuladas con olor de hembra receptiva y almendra.
MétodosComparamos la actividad de la capa granular del vermis cerebelar mediante la inmunorreactividad a Fos tras estimulación olfativa. Esta estimulación se realizó durante 60min en cámaras cúbicas de acrílico con un doble fondo. Los estímulos fueron aserrín limpio, con esencia de almendra y proveniente de la cama de hembras receptivas. Finalmente los machos fueron anestesiados con pentobarbital sódico intraperitoneal. El tejido cerebelar fue fijado con paraformaldehído para su posterior análisis inmunohistoquímico.
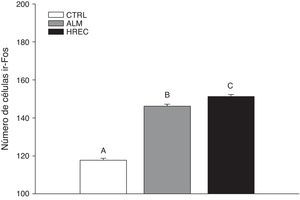
ResultadosEl número de células inmunorreactivas a Fos en todos los lóbulos del vermis cerebelar de los grupos estimulados con almendra y hembra receptiva fue similar, pero mayor comparado con el grupo de aserrín limpio.
ConclusionesLa estimulación olfativa del sistema olfatorio principal (almendra) y accesorio (hembra receptiva) incrementa la producción de proteína Fos en la capa granular de la corteza cerebelar del vermis de ratas macho sexualmente inexpertas.
The cerebellum has been linked to multiple functions, such as motor control, cognition, memory, and emotional processing. As for its involvement in the sensory systems, the role of the cerebellum in the sense of smell remains unclear. We suggest that sexually naive male rats will present increased neuronal activity in the cerebellar vermis after being stimulated with almond odour or oestrous odour from receptive females.
MethodsWe compared activity in the cerebellar vermis using Fos immunoreactivity after olfactory stimulation. Stimulation took place during 60min in a cube-shaped acrylic chamber with a double bottom. Stimuli were clean woodchip bedding, bedding with almond extract, and bedding taken from a cage of receptive females. Male rats were subsequently anaesthetised with intraperitoneal sodium pentobarbital. Cerebellar tissue was fixed with paraformaldehyde for later immunohistochemical analysis.
ResultsThe number of Fos immunoreactive cells in all lobes of the cerebellar vermis was similar between groups stimulated with almond extract and with oestrous odour, and higher than in the clean woodchip group.
ConclusionsStimulation of the main olfactory system (almond) and the accessory system (oestrous odour) increases Fos protein production in the granular layer of the cortex of the cerebellar vermis in naive male rats.
El cerebelo es una estructura que ha sido ampliamente estudiada, y se le adjudican múltiples funciones como son el control motor, el procesamiento cognitivo1,2 y el sensorial3–5. Se conoce ampliamente la relación que tiene el cerebelo con los sentidos de la visión, el oído y el tacto6–10. Estudios de neuroimagen en humanos y en primates no humanos han demostrado que el cerebelo tiene gran actividad durante la estimulación olfativa con olores relacionados con la alimentación3,11 y con la conducta sexual12, mientras que en ratas mediante inmunohistoquímica se observó que dicha actividad se ve incrementada ante estímulos relacionados con la conducta reproductiva13,14. Hemos mostrado previamente que la ejecución de la conducta sexual de ratas macho resulta en un incremento en el número de neuronas inmunoreactivas a Fos (ir-Fos) en el cerebelo. En machos que alcanzan una eyaculación el número de neuronas activadas es similar al de machos con estimulación sin contacto13. En estas pruebas los machos pudieron ver, escuchar y oler el incentivo animal. Dicha estimulación sensorial produce la activación de un gran número de células granulares, indicando que las señales sexuales disparan la actividad de esas neuronas. Aunque estos estudios vinculan el cerebelo con la estimulación sensorial, poco se sabe de la influencia que el olfato tiene sobre este. El objetivo de este trabajo es determinar y comparar la expresión de la proteína Fos del vermis cerebelar de ratas macho sexualmente inexpertas, después de ser estimuladas olfativamente con aserrín limpio, aserrín con olor a almendra y aserrín proveniente de la cama de hembras receptivas. Suponemos que los estímulos de almendra y hembra receptiva incrementarán el número de células ir-Fos.
Materiales y métodoSujetos y alojamientoSe usaron 18 ratas macho sexualmente inexpertas (250 a 350g) y 6 hembras ovariectomizadas (200 a 250g) de la cepa Wistar. Los animales se alojaron (por sexo) en cajas de acrílico transparente (44×34×20cm; 6 por caja), con una capa de aserrín de aproximadamente 3-4cm de espesor en su base. Se mantuvieron en un cuarto con temperatura aproximada de 22±2°C y ciclos de luz oscuridad invertidos (12×12h). El acceso al agua purificada y alimento (Rismart®) fue ad libitum hasta el día de la prueba. Todos los procedimientos quirúrgicos y de manipulación se llevaron acabo bajo la política de la Sociedad de Neurociencias en el uso de animales en investigación neurocientífica.
Estimulación olfativaLa estimulación olfativa de las ratas macho fue llevada a cabo de acuerdo a lo descrito por Portillo y Paredes15, utilizando aserrín estéril (Rismart®, México) como vehículo en una cámara de acrílico cúbica (30×30×30cm). La cámara contó con un fondo doble y los animales se introdujeron en la parte superior, teniendo como base una capa de acrílico horadado de 4mm de grosor, elevándolos 5cm de la base inferior. Entre las 2 bases se colocó un recipiente con el estímulo olfativo (80g): aserrín limpio en el caso del grupo control (CTRL, n=6), aserrín con esencia de almendra (ALM, n=6) o aserrín proveniente de la cama de hembras receptivas (ovarectomizadas con estro inducido) (HREC, n=6). Una vez que fueron introducidos los machos se les dio un periodo de habituación de 10min, posterior al cual se empezó la estimulación introduciendo el recipiente con el aserrín. Los machos permanecieron 60min más dentro de la cámara con el estímulo.
InmunohistoquímicaAl final de la estimulación olfativa los animales se anestesiaron con pentobarbital sódico (60mg/kg, i.p.), posteriormente se procedió a la perfusión transcardiaca con solución salina (0,9%; 300ml), seguida de paraformaldehído al 4% (pH 7,4; 400ml) en un buffer de fosfato (PB por sus siglas en inglés). Se extrajo el cráneo y se obtuvo el cerebelo completo para mantenerse las siguientes 12h en fijación en el paraformaldehído. El vermis fue aislado y crioprotejido sucesivamente con 10, 20 y 30% de sacarosa (PB 0,1M, 10ml). Se realizaron cortes sagitales de 40μm en un criostato (Leica CM1850). Se analizaron 3 cortes de la parte central del vermis.
Los cortes fueron sometidos a una prueba de inmunorreactividad a Fos de acuerdo a lo descrito por Manzo et al.13; se incubaron en el primer anticuerpo (Ac) policlonal Fos a una dilución de 1:2.000, en solución PBT 0,3% y 3% de suero normal de cabra (NGS). Se incubó durante 48h a 4°C. Se agregó el segundo Ac contra conejo (Ac puente o secundario) en PBT 0,3% a una dilución de 1:250, incubándose durante 90min en agitación constante a temperatura ambiente. Posteriormente se aplicó el complejo avidina-biotina (Kit AB) en PB 0,1M a una dilución de 1:200 durante 90min en agitación constante a temperatura ambiente. Finalmente se reveló en 20ml de PB 0,1M con 5 gotas de di-amino-benzidina (0,1mg/100ml), 4 gotas de níquel (0,05mg/5ml) y 3 gotas de peróxido de hidrógeno al 30%. Finalmente los cortes fueron montados en portaobjetos gelatinizados y dejados secar 2 días para después ser deshidratados y limpiados con xileno (Fisher). Terminado el proceso se aplicó Permount (Fisher scientific) y el cubreobjeto para su análisis posterior.
Análisis histológico y estadísticoImágenes digitalizadas de los cortes histológicos del cerebelo se obtuvieron y analizaron a través de un microscopio (AX70 Olympus Optical Co., LTD, Japón) conectado a un ordenador con el programa Image Pro Plus 6.7 (Media Cybernetics). Bajo un objetivo de 40×, delimitando un área de 20.000μm2, se contabilizaron las células granulares de regiones (proximal, medial y distal) de cada lóbulo cerebelar obteniendo un promedio de 3 cortes por animal. Los datos fueron analizados estadísticamente con el programa Statistica (Stat soft™) y JMP 6 (SAS 2005). Fueron sometidos a una prueba de normalidad, la cual fallaron, por lo que se clasificaron por ranqueo (Rank test) con la finalidad de poder analizarlos con pruebas estadísticas paramétricas16. Se empleó un modelo de ANOVA anidado siguiendo un modelo lineal generalizado (GLM), ya que los datos fueron ordenados de forma jerarquizada. El modelo queda representado con la siguiente fórmula: y= Grupo + Animal [Lóbulo] + Lóbulo [Región] + G x L + G x R + L x R + G x L x R + el Error. Donde y es la variable respuesta y G, L y R son el Grupo, el Lóbulo y la Región respectivamente. Las Regiones (proximal, medial y distal) fueron anidadas dentro de Lóbulo, y éste a su vez anidado en Animal, como se sugiere en el análisis con psudorepeticiones17. Se realizó un análisis post hoc de Tukey para conocer las diferencias entre los lóbulos de los grupos.
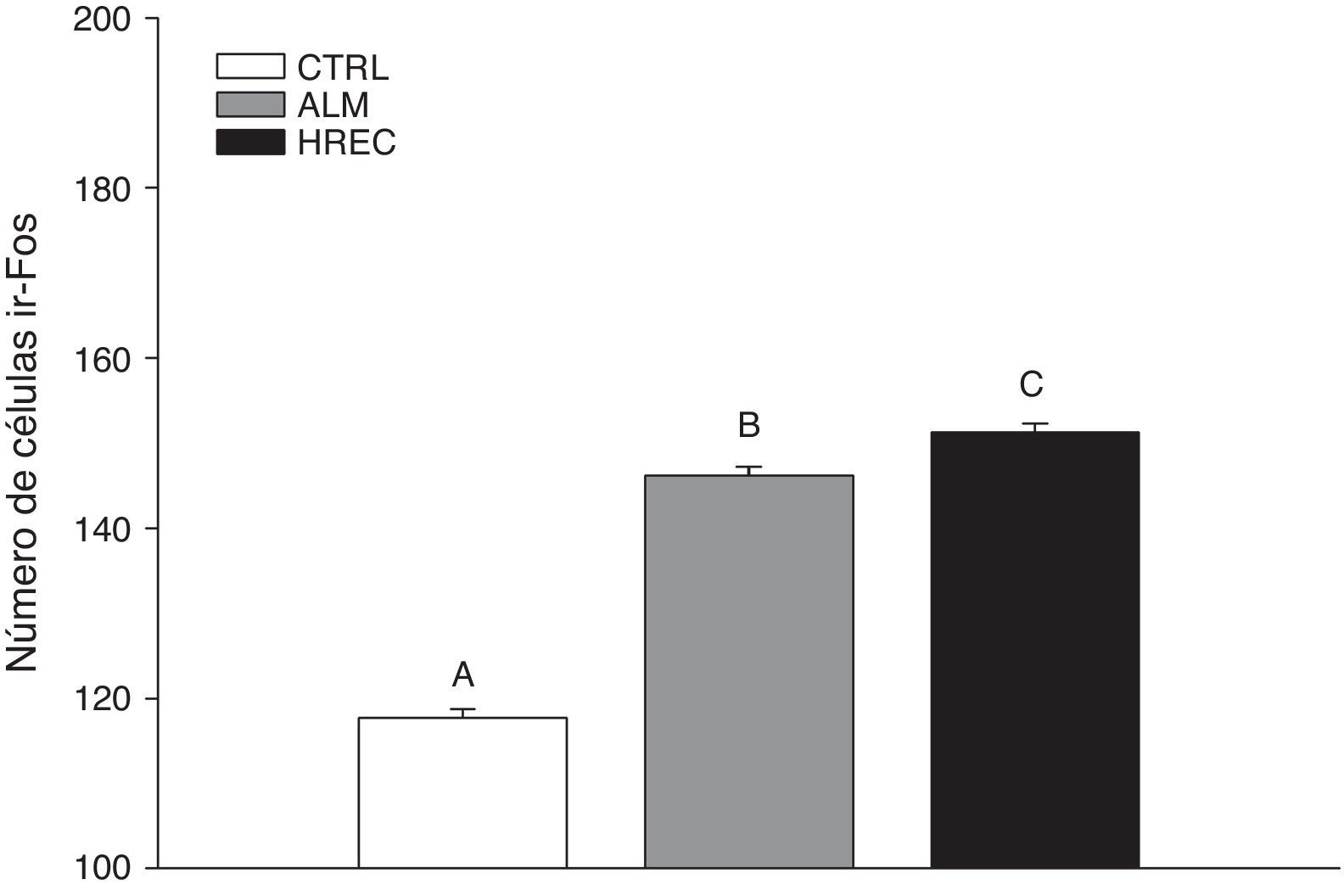
ResultadosSe encontraron diferencias significativas entre los grupos (F2,1349=146,6, p<0,0001). El análisis post hoc (Tuckey) reveló que el CTRL (media=124,02±1,39) posee el menor número de células ir-Fos, con respecto a los grupos ALM (media=150,03±1,39) y HREC (media=155,13±1,39). El grupo HREC presentó la cantidad mayor de células ir-Fos (fig. 1).
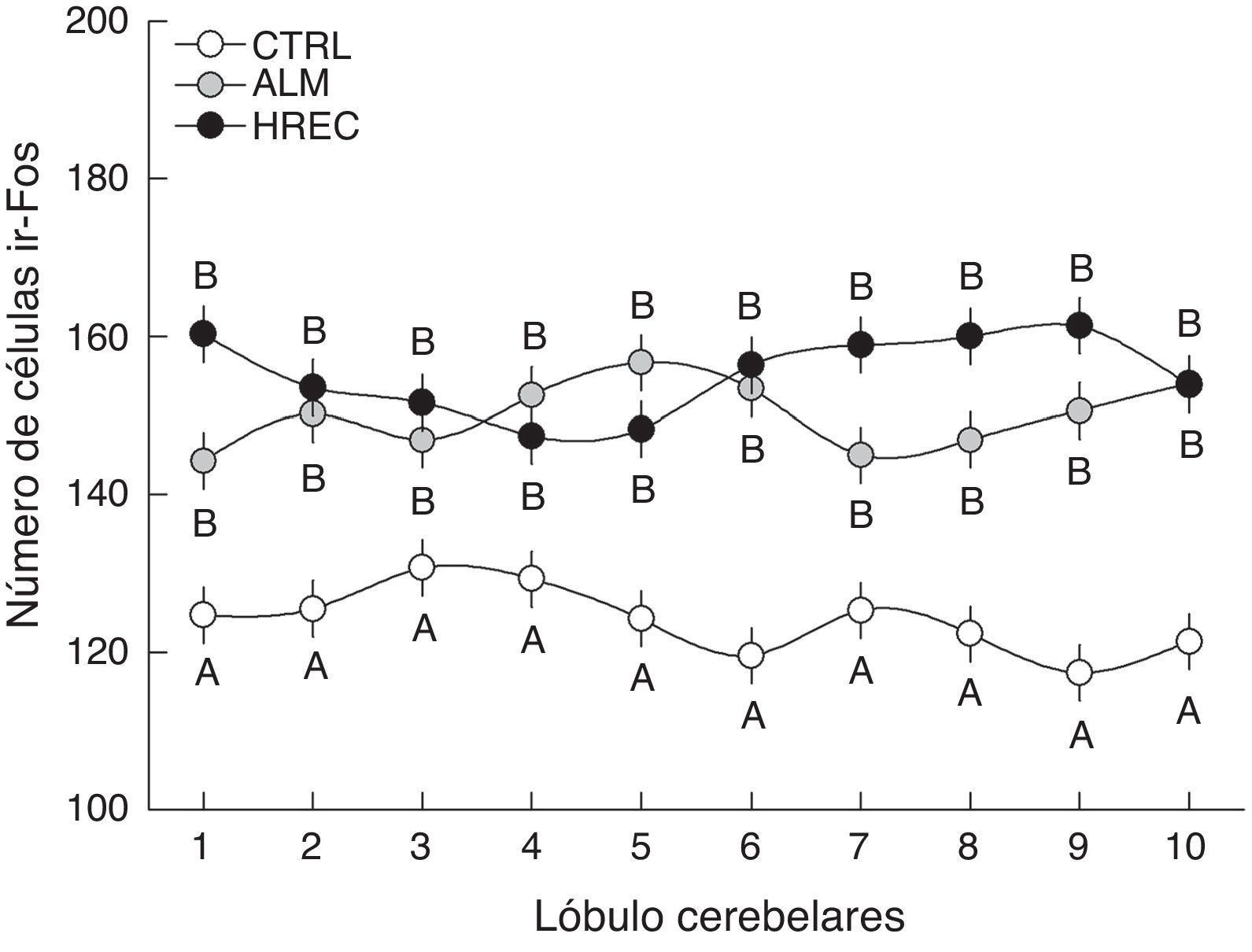
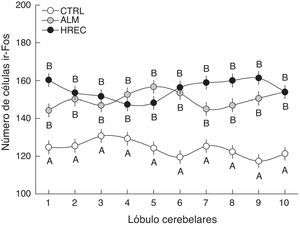
El análisis de la interacción grupo-lóbulo señaló una diferencia significativa (F18,1349=1,6555, p=0,0458). La prueba post hoc reveló que todos los lóbulos del grupo CTRL fueron significativamente diferentes de aquellos correspondientes a los grupos ALM y HREC. Sin embargo, entre estos últimos no existió diferencia significativa, solo una tendencia en los lóbulos 1, 7, 8 y 9 (fig. 2).
Número de células (media±ee) ir-Fos en la capa granular de cada lóbulo, después de la estimulación olfativa. Los lóbulos de los grupos ALM y HREC son significativamente mayores que aquellos del grupo CTRL (p=0,04). Aunque se observa un patrón de activación diferente entre los lóbulos de los grupos ALM y HREC, no llegan a presentar diferencias estadísticas.
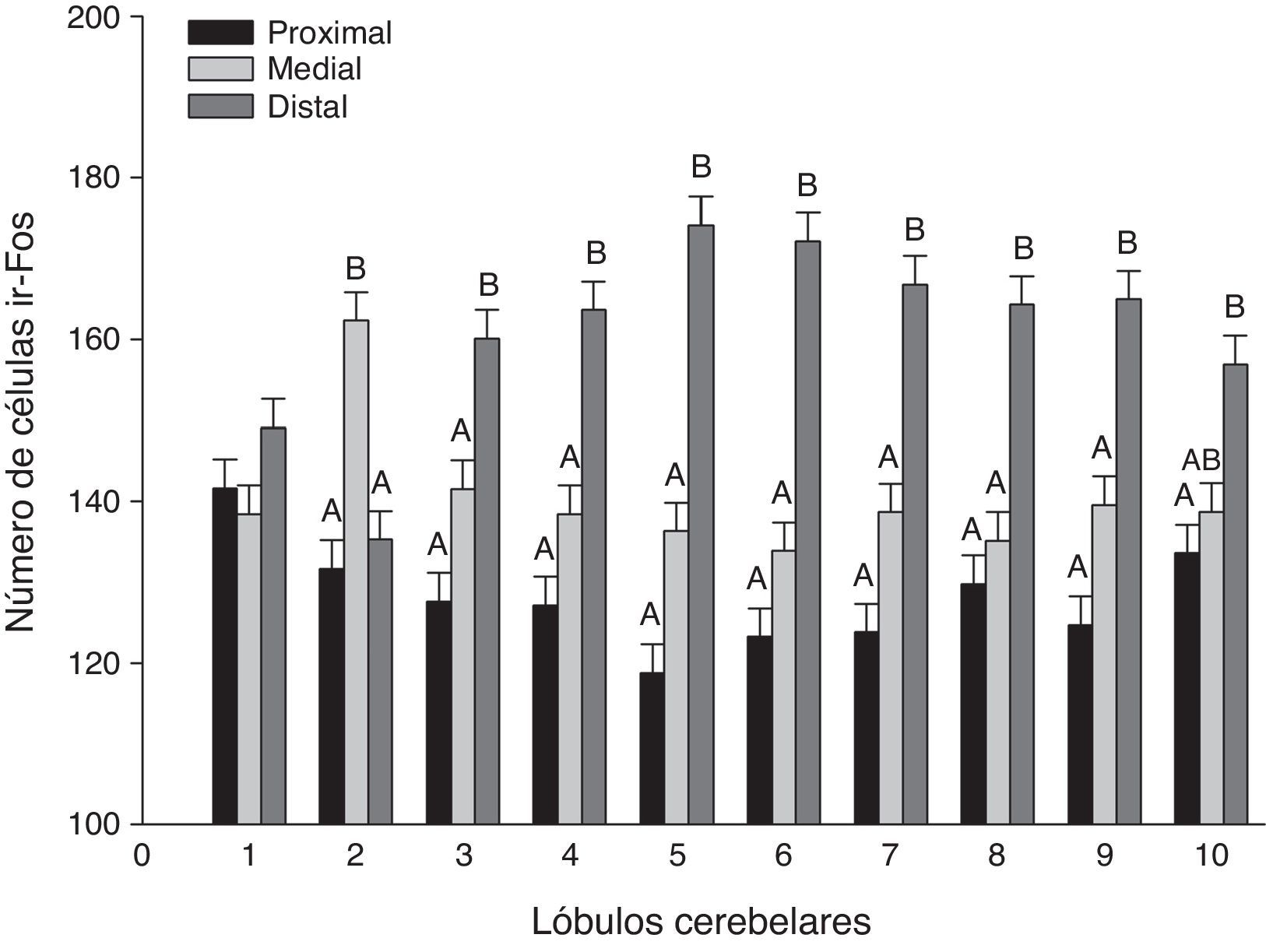
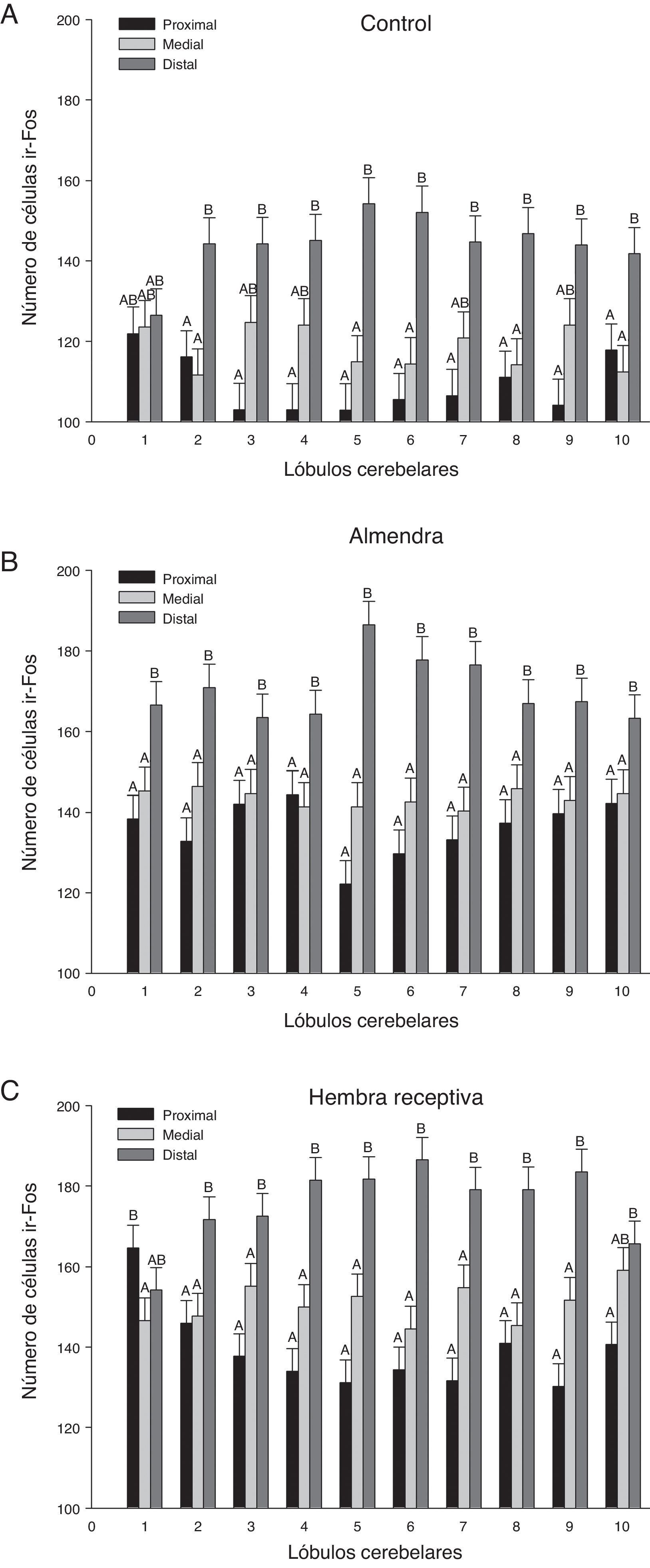
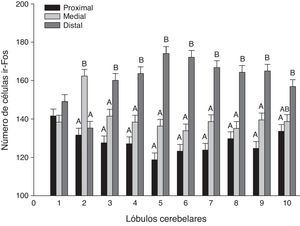
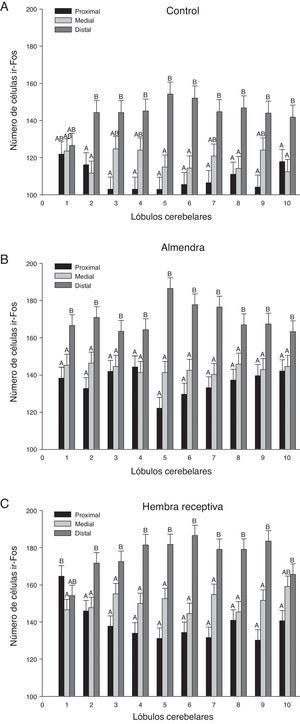
En un análisis global de los 3 grupos estimulados se encontraron diferencias significativas entre las regiones de los lóbulos (F20,1349=21,02, p<0,0001), donde la región distal mostró el mayor número de células ir-Fos, con respecto a la medial y proximal en casi todos los lóbulos (fig. 3). En el análisis de la interacción región-lóbulo de cada uno de los grupos se encontró la misma tendencia de actividad, con valores significativamente diferentes entre las regiones (p<0,0001) (fig. 4).
Representación gráfica de las neuronas ir-Fos encontradas en las 3 regiones (proximal, medial y distal) analizadas para cada grupo. A. Control. B. Almendra. C. Hembra receptiva. Las diferencias significativas (p<0,0001) entre las regiones de los lóbulos se representan con letras. Las regiones que no comparten letras iguales presentan diferencias entre sí.
Nuestros resultados muestran un incremento en la actividad de la corteza cerebelar durante la estimulación olfativa en ratas macho sexualmente inexpertas. De acuerdo a lo descrito por Portillo y Paredes15 y Lledo et al.18 usamos como estímulos el olor a almendra (ALM) y a hembra receptiva (HREC) que activan los sistemas olfativos principal y accesorio (vomeronasal) respectivamente. Observamos que sin importar la naturaleza del estímulo, o el sistema olfatorio activado, se produjo un incremento en la actividad de la capa granular de la corteza del vermis cerebelar con respecto al grupo control (aserrín limpio), idea apoyada por otros estudios3,11,19.
A pesar de que los 2 estímulos (almendra y hembra receptiva) tuvieron efecto aumentando significativamente en la actividad de la corteza cerebelar con respecto al grupo control, existe un patrón, sin presentar diferencias significativas, en la magnitud con que se da la activación neuronal en cada grupo. Esta diferencia puede ser explicada debido a un incremento del interés por parte de las ratas macho en el olor de hembra receptiva, lo cual a su vez aumenta el movimiento exploratorio y la actividad olfatomotora, la cual ha sido explorada con anterioridad, mostrando que es capaz de activar el cerebelo sin la necesidad de un odorante presente3,11.
Por otro lado, Manzo et al.13 demostraron que el cerebelo de ratas macho podía ser activado por la estimulación multisensorial (vista, olfato y audición) provista por ratas hembras receptivas, y que dicha actividad cerebelar no se veía alterada por el desempeño motor llevado a cabo por los sujetos durante la cópula. Otra posible explicación es que el cerebelo esté desempeñando un papel en la expectativa de la recompensa sexual instintiva creada por la percepción de la información sensorial provista por la secreción de hembras receptivas. La función cerebelar en las emociones y la expectativa de la recompensa sexual ya ha sido confirmada anteriormente13,14. Sin embargo, se desconoce la actividad del cerebelo de ratas sexualmente expertas estimuladas con olores relacionados con la conducta sexual.
Por otro lado, los cortes sagitales de la región medial del vermis cerebelar muestran a nivel lobular patrones de activación neuronal distintos en cada uno de los grupos experimentales. Sin embargo, la falta de significación en los resultados del efecto «interacción grupo-lóbulo» nos impide señalar qué lóbulos son más sensibles a un tipo de estímulo. Pese a esto, existen tendencias que sugieren una regionalización en la parte medial del vermis cerebelar de acuerdo a la clase del estímulo percibido. Los lóbulos 1, 7, 8 y 9 de los sujetos correspondientes al grupo HREC poseen claramente una mayor cantidad de células ir-Fos comparados con los mismos lóbulos de los sujetos pertenecientes al grupo ALM. Esto podría significar que dichos lóbulos son más susceptibles a ser activados por proyecciones provenientes del sistema olfatorio accesorio que por el principal.
A su vez los lóbulos 2, 3, 4 y 10, que mostraron una cantidad similar de células inmunorreactivas entre ambos grupos, podrían estar desempeñando el papel de controlar el aspecto olfatomotor.
El bulbo olfatorio principal, junto con el núcleo olfatorio anterior, como ha sido descrito por Lledo et al.18, envían eferencias a la corteza piriforme, tubérculo olfatorio, amígdala cortical y corteza entorrinal. Por su lado, el ATV posee neuronas que proyectan sus axones a la corteza piriforme, a la corteza cerebelar y a los núcleos cerebelares laterales20,21. En el caso del bulbo olfatorio accesorio envía fibras originadas en su capa mitral hacia la amígdala posterolateral y medial; en esta se origina la ruta amigdalofugal, que conecta con los núcleos ventromediales hipotalámicos y el área preóptica; la amígdala posterolateral proyecta, vía la estría terminalis, hacia la cama del núcleo de la estría terminalis y el área preóptica media15. La posible interacción entre el sistema vomeronasal y el cerebelo puede estar dado por 2 rutas: 1) a través de las fibras hipotalamocerebelosas; 2) o a través del ATV, que recibe aferencias desde la amígdala medial.
El enlace entre ambos sistemas olfatorios y el cerebelo, a través del ATV, figura como una posibilidad prometedora, ya que concuerda con la información provista en este experimento. La ruta corteza piriforme-ATV-cerebelo, correspondiente al sistema olfatorio principal, apoya la idea propuesta por Sobel et al.3 de que los lóbulos cerebelares anteriores regulan el aspecto olfatomotor de la olfacción. Además, Ikai et al.20 describieron aferencias cerebelares provenientes del ATV que inervaban en la corteza cerebelosa de rata, lo que corresponde a lo observado por Sobel et al.3 en varios lóbulos cerebelares en humanos. Esto también es coherente con lo observado en nuestro experimento, donde los lóbulos 2 y 3 del vermis cerebelar muestran un aumento significativo ante los 2 estímulos. Por otro lado, el sistema vomeronasal estaría conectado vía amígdala medial-ATV-cerebelo14, ruta apoyada por los resultados de Manzo et al.13, quienes demostraron que el lóbulo 7 del vermis cerebelar en ratas macho es más sensible a la estimulación multisensorial que puede proveer una rata hembra receptiva. Este resultado sustenta nuestros hallazgos, donde el lóbulo 7 de la región medial del vermis cerebelar mostró una mayor activación en los sujetos pertenecientes al grupo HREC, en comparación con el grupo ALM. El circuito núcleo fastigial-amígdala medial-ATV-cerebelo3,14,20 nos sugiere la existencia de un mecanismo de retroalimentación14, que pudiese estar regulando la sensibilidad del cerebelo como consecuencia de la estimulación del sistema vomeronasal. Esto a su vez proveería una explicación de la disminución en los niveles de células ir-Fos en el vermis del cerebelo de las ratas macho tras copular sucesivamente, considerando que la estimulación sensorial es persistente13. Es por lo anterior que sugerimos investigar el lóbulo 7 del vermis cerebelar como una posible región sensible a la información proveniente del sistema vomeronasal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.