Aunque quetiapina y ziprasidona producen menos síntomas extrapiramidales (SEP) que otros antipsicóticos, su uso en pacientes mayores de 75 años con demencia se ve condicionado por la obligatoriedad de prescribirlos “por uso compasivo”. Realizamos un análisis descriptivo del uso de antipsicóticos atípicos de uso compasivo (AAUC) en el área sanitaria de Ferrol.
Pacientes y métodosIncluimos a todos los pacientes que recibieran un AAUC desde marzo de 2004 (fecha en que entró en vigor la dispensación de AAUC) hasta el 30-11-2008.
ResultadosSe incluyó a 133 de un total de 164 pacientes (el 63,6%, mujeres; media±desviación estándar de edad, 81,9±4,95 años). El 94,1% presentaba demencia (el 42,9%, enfermedad de Alzheimer; el 30,8%, demencia-enfermedad de Parkinson, y el 15,8%, demencia vascular/mixta). El 68,4% había recibido algún otro antipsicótico previo y el 32,3% presentaba SEP secundarios. Los AAUC prescritos fueron: quetiapina (76,7%), ziprasidona (18,8%) y olanzapina (4,5%). La media de tiempo de seguimiento fue 20,25±20,38 meses. El cumplimiento terapéutico fue del 95,5%. El 19,7% presentó efectos secundarios. La media de mejora en la escala NPI (Neuropsychiatric Inventory) fue 33,3±24,75 puntos. La agitación/agresividad (5,6±4,55), las ideas delirantes (4,94±5,07), la irritabilidad (4,38±4,94) y la ansiedad (4,32±4,83) fueron los síntomas que más mejoraron. Aunque no hubo diferencias entre los 3 AAUC, quetiapina conllevó un mayor mantenimiento en monoterapia (el 94,1 frente al 72% de ziprasidona y el 83,3% de olanzapina; p<0,0001).
ConclusionesLos AAUC son fármacos efectivos y bien tolerados. Quetiapina es el AAUC más utilizado. Un porcentaje excesivo de pacientes reciben antes otros antipsicóticos y presentan SEP.
Although atypical antipsychotics (AA) provoke fewer extra-pyramidal symptoms (ES) than classic antipsychotics, their use in patients greater than or equal to 75 years old with dementia must be under compassionate-use. This is an important limitation. We performed a descriptive analysis of the use of atypical antipsychotics under compassionate-use (AACU) in the Ferrol health area.
Patients and methodsWe retrospectively assessed all the patients who were receiving an AACU from March, 2004 (that is the date when prescription under compassionate-use of AA came into force in Spain) to November 30, 2008.
ResultsOne hundred and thirty-three of 164 patients (63.6% women; median ages, 81.9±4.95 years) were included. Diagnostic aetiologies were: 42.9% Alzheimer's disease, 30.8% Parkinson-dementia/Lewy body disease, and 15.8% vascular/mixed dementia. A total of 68.4% of patients had received other anti-psychotic drugs previously and 32.3% had ES due to antipsychotics. The AACU received were: quetiapine (76.7%), ziprasidone (18.8%), and olanzapine (4.5%). Median follow-up time was 20.25±20.38 months. Side effects were observed in 19.7% of patients. Improvement of NPI (Neuropsychiatric Inventory) was 33.3±24.75 points. Agitation/aggressiveness (5.6±4.55), delirious ideas (4.94±5.07), irritability (4.38±4.94), and anxiety (4.32±4.83) were the symptoms that most improved. Although there were no differences between AACU, quetiapine was associated with significant maintenance in monotherapy (94.1% vs 72% for ziprasidone and 83.3% for olanzapine; p<0.0001).
ConclusionsAACU are effective and well tolerated drugs. Quetiapine was the most frequently used AACU. An excessive percentage of patients previously received other antipsychotics and present with ES.
Los neurolépticos son fármacos frecuentemente utilizados en neurología para el control de los síntomas conductuales en pacientes con demencia; especialmente, los antipsicóticos atípicos (AA) debido a su menor capacidad de inducir o agravar síntomas extrapiramidales (SEP). En este sentido, risperidona presenta un perfil farmacológico más parecido al de los neurolépticos clásicos1, y es habitual encontrarnos en la consulta con cuadros de parkinsonismo secundarios a ésta. Sin embargo, ziprasidona, olanzapina y, especialmente, quetiapina y clozapina son AA que causan menos SEP2. Por contra, su prescripción en todo paciente sin diagnóstico de esquizofrenia/episodio maníaco (en la práctica, en pacientes de 75 años o mayores) se ve condicionada por la obligatoriedad de su tramitación como uso compasivo (ahora catalogada como medicamentos en condiciones diferentes de las autorizadas dentro de la regulación sobre la disponibilidad de medicamentos en situaciones especiales, RD 1015/2009 del 19 de junio, capítulo III). Esto supone un inconveniente evidente, si tenemos en cuenta que muchos de los pacientes, fundamentalmente con demencia y trastornos conductuales, que precisan su uso son pacientes de edad avanzada. En este sentido, la experiencia clínica acumulada al tratar a pacientes con deterioro cognitivo y trastorno conductual apunta probablemente hacia un uso inicial predominantemente de neurolépticos clásicos o risperidona entre los AA.
En el presente trabajo realizamos un análisis descriptivo detallado del uso de AA prescritos por especialistas y administrados a los pacientes del área sanitaria de Ferrol por el Servicio de Farmacia del Hospital A. Marcide mediante uso compasivo.
Pacientes y métodosRealizamos un estudio epidemiológico, observacional, no intervencionista, poblacional, descriptivo, retrospectivo, en el que se incluye a todos los pacientes que estén recibiendo o hayan recibido uno o más AA por uso compasivo (AAUC), administrados por el Servicio de Farmacia del Hospital A. Marcide de Ferrol desde marzo de 2004 (fecha en que entró en vigor la dispensación de AAUC) hasta el 30-11-2008. Se consideró como criterios de exclusión los siguientes: pacientes menores de 75 años, pacientes de los que no se disponía de los datos (en la historia clínica y/o registro de datos de farmacia) requeridos en el estudio para su posterior análisis y pacientes o familiares que se negasen a dar su consentimiento informado para participar en el estudio.
Consideramos como hipótesis, según nuestra experiencia, que probablemente los AAUC se prescriben en un mayor porcentaje de casos como segunda opción tras otros que ya han producido SEP, otros efectos secundarios o bien no han resultado eficaces.
El objetivo principal del estudio es, por lo tanto, realizar un análisis descriptivo del uso de AAUC prescritos en el área sanitaria de Ferrol y conocer, entre otros datos, los siguientes: fármaco más prescrito, servicio prescriptor, síntomas más frecuentes, diagnóstico más frecuente, porcentaje de pacientes que habían recibido otro neuroléptico previamente y de aquellos que presentasen SEP y datos de efectividad, tolerancia y seguridad de los AAUC. Como objetivo secundario, se consideró realizar un análisis comparativo entre los diferentes AAUC administrados, y siempre teniendo en cuenta las limitaciones metodológicas correspondientes al tipo de estudio y que, además, éste no fue diseñado con este propósito.
Los datos de cada paciente se obtuvieron de la información disponible en la historia clínica, de un registro de datos del servicio de farmacia (programa informático de dispensación a pacientes externos Dipex®) y de las entrevistas realizadas a los familiares de los pacientes. Las puntuaciones en las escalas MMSE (Mini-Mental State Examination), FAST (Functional Assessment Staging) y GDS (Global Deterioration Scale) son las correspondientes al momento en que se decidió prescribir el AAUC. Un facultativo del servicio de farmacia con experiencia clínica en el manejo de pacientes con demencia y trastornos de conducta pasó la escala NPI (Neuropsychiatric Inventory, 0-144 puntos) antes de comenzar con el AAUC y entre al menos 4 y 6 meses después de iniciar dicho tratamiento. Cuantificamos el porcentaje de mejora para cada ítem de la escala NPI aplicando la fórmula: [(mejoría en el NPI / NPI basal)×100]. La mejora, tanto general como conductual, experimentada por el paciente con el AAUC se valoró mediante la opinión del familiar cuidador directo, y se consideraron las siguientes categorías: mejora muy importante, importante, moderada, leve y ninguna mejora. Los diagnósticos en cuanto a los diferentes tipos de demencia se establecieron siguiendo los criterios diagnósticos emitidos por el Grupo de Estudio de Neurología de la Conducta y Demencias de la SEN3.
El Comité de Ética del Hospital A. Marcide de Ferrol aprobó la realización de este trabajo. Fue necesario, igualmente, obtener el consentimiento informado del paciente o, en su defecto, de uno de sus familiares.
Análisis estadísticoLos datos se analizaron con el programa estadístico SPSS 15.0. Las variables cuantitativas se expresan como media±desviación estándar. Las variables cualitativas se expresan como porcentaje. Para realizar el análisis comparativo se utilizó el test de la t de Student o ANOVA de un factor para las variables cuantitativas, y el test de la χ2 para las cualitativas. Se consideraron significativos los valores para una p<0,05.
ResultadosSe incluyó a 133 de un total de 164 pacientes (el 63,2%, mujeres; con media±desviación estándar de edad de 81,92±4,85 años). Se excluyó a 29 pacientes por falta de información, mientras que de 2 no se obtuvo el consentimiento informado para su participación por parte de la familia. La figura 1 representa la selección de los pacientes y los datos del seguimiento.
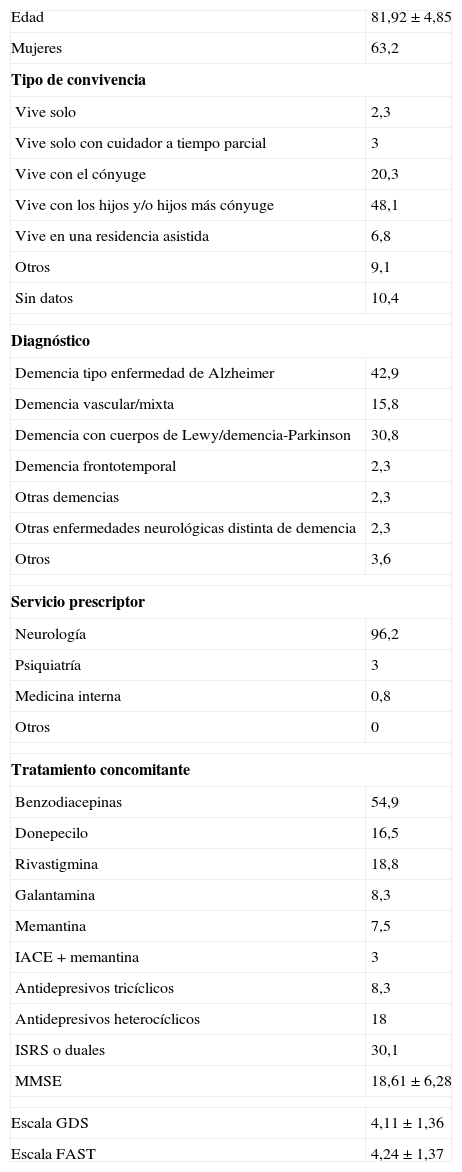
La tabla 1 recoge las características basales de la muestra. El 96,2% de los AAUC fueron prescritos por un neurólogo. En cuanto al diagnóstico, el 94,1% de los pacientes a quienes se prescribió un AAUC tenían algún tipo de demencia; las más frecuentes, la enfermedad de Alzheimer (EA) (42,9%), la demencia asociada a la enfermedad de Parkinson (D-EP) o demencia con cuerpos de Lewy (DCL) (30,8%), y la demencia vascular o mixta (DV-M) (15,8%). En relación con otros tratamientos concomitantes, el 54,9% recibía benzodiacepinas; el 54,1%, inhibidor de la acetilcolinesterasa y/o memantina, y el 56,4%, algún antidepresivo.
Características basales de la muestra (n=133).
| Edad | 81,92±4,85 |
| Mujeres | 63,2 |
| Tipo de convivencia | |
| Vive solo | 2,3 |
| Vive solo con cuidador a tiempo parcial | 3 |
| Vive con el cónyuge | 20,3 |
| Vive con los hijos y/o hijos más cónyuge | 48,1 |
| Vive en una residencia asistida | 6,8 |
| Otros | 9,1 |
| Sin datos | 10,4 |
| Diagnóstico | |
| Demencia tipo enfermedad de Alzheimer | 42,9 |
| Demencia vascular/mixta | 15,8 |
| Demencia con cuerpos de Lewy/demencia-Parkinson | 30,8 |
| Demencia frontotemporal | 2,3 |
| Otras demencias | 2,3 |
| Otras enfermedades neurológicas distinta de demencia | 2,3 |
| Otros | 3,6 |
| Servicio prescriptor | |
| Neurología | 96,2 |
| Psiquiatría | 3 |
| Medicina interna | 0,8 |
| Otros | 0 |
| Tratamiento concomitante | |
| Benzodiacepinas | 54,9 |
| Donepecilo | 16,5 |
| Rivastigmina | 18,8 |
| Galantamina | 8,3 |
| Memantina | 7,5 |
| IACE+memantina | 3 |
| Antidepresivos tricíclicos | 8,3 |
| Antidepresivos heterocíclicos | 18 |
| ISRS o duales | 30,1 |
| MMSE | 18,61±6,28 |
| Escala GDS | 4,11±1,36 |
| Escala FAST | 4,24±1,37 |
FAST: Functional Assessment Staging; GDS: Global Deterioration Scale; IACE: inhibidores de la acetilcolinesterasa; ISRS: inhibidores selectivos de la recaptación de serotonina; MMSE: Mini-Mental State Examination.
Los datos expresan porcentaje o media±desviación estándar.
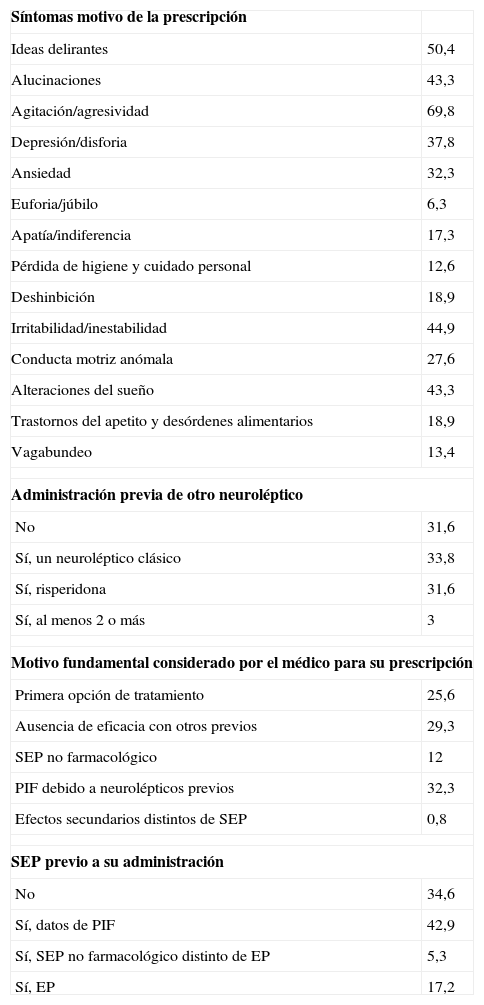
La tabla 2 muestra datos relacionados con la indicación del AAUC. Los síntomas más frecuentes de los pacientes en el momento de prescribirles AAUC eran agitación y/o agresividad (69,8%), ideas delirantes (50,4%), irritabilidad (44,9%), alucinaciones (43,3%) y alteraciones del sueño (43,3%). El 68,4% de los pacientes había recibido previamente al menos otro antipsicótico; risperidona era el más frecuente (31,6%). Un 42,9% presentaba parkinsonismo inducido por fármacos (PIF); en el 75,3% de ellos era un PIF secundario a neurolépticos.
Características relacionadas con la indicación de antipsicóticos atípicos de uso compasivo.
| Síntomas motivo de la prescripción | |
| Ideas delirantes | 50,4 |
| Alucinaciones | 43,3 |
| Agitación/agresividad | 69,8 |
| Depresión/disforia | 37,8 |
| Ansiedad | 32,3 |
| Euforia/júbilo | 6,3 |
| Apatía/indiferencia | 17,3 |
| Pérdida de higiene y cuidado personal | 12,6 |
| Deshinbición | 18,9 |
| Irritabilidad/inestabilidad | 44,9 |
| Conducta motriz anómala | 27,6 |
| Alteraciones del sueño | 43,3 |
| Trastornos del apetito y desórdenes alimentarios | 18,9 |
| Vagabundeo | 13,4 |
| Administración previa de otro neuroléptico | |
| No | 31,6 |
| Sí, un neuroléptico clásico | 33,8 |
| Sí, risperidona | 31,6 |
| Sí, al menos 2 o más | 3 |
| Motivo fundamental considerado por el médico para su prescripción | |
| Primera opción de tratamiento | 25,6 |
| Ausencia de eficacia con otros previos | 29,3 |
| SEP no farmacológico | 12 |
| PIF debido a neurolépticos previos | 32,3 |
| Efectos secundarios distintos de SEP | 0,8 |
| SEP previo a su administración | |
| No | 34,6 |
| Sí, datos de PIF | 42,9 |
| Sí, SEP no farmacológico distinto de EP | 5,3 |
| Sí, EP | 17,2 |
EP: enfermedad de Parkinson; PIF: parkinsonismo inducido por fármacos; SEP: síntomas extrapiramidales.
Los datos se expresan como porcentaje.
En cuanto al tipo de AAUC administrado, el más frecuente fue quetiapina (76,7%), seguido de ziprasidona (18,8%) y olanzapina (4,5%). La media de tiempo de seguimiento evolutivo con AAUC fue 20,25±20,38 meses. La media de dosis de mantenimiento fue 183,11±136,83 (intervalo, 25-600) mg/día para quetiapina, 71,32±65,37 (intervalo, 20-120) mg/día para ziprasidona y 6±2,24 (intervalo, 5-10) mg/día para olanzapina. El 89,5% de los pacientes mantuvieron el AAUC pautado inicialmente en monoterapia sin recibir otros antipsicóticos. El 19,7% de los pacientes presentaron efectos secundarios; la somnolencia (7,6%) y la agitación/efecto paradójico (3,8%) fueron los más frecuentes. El 23,3% de los pacientes fallecieron.
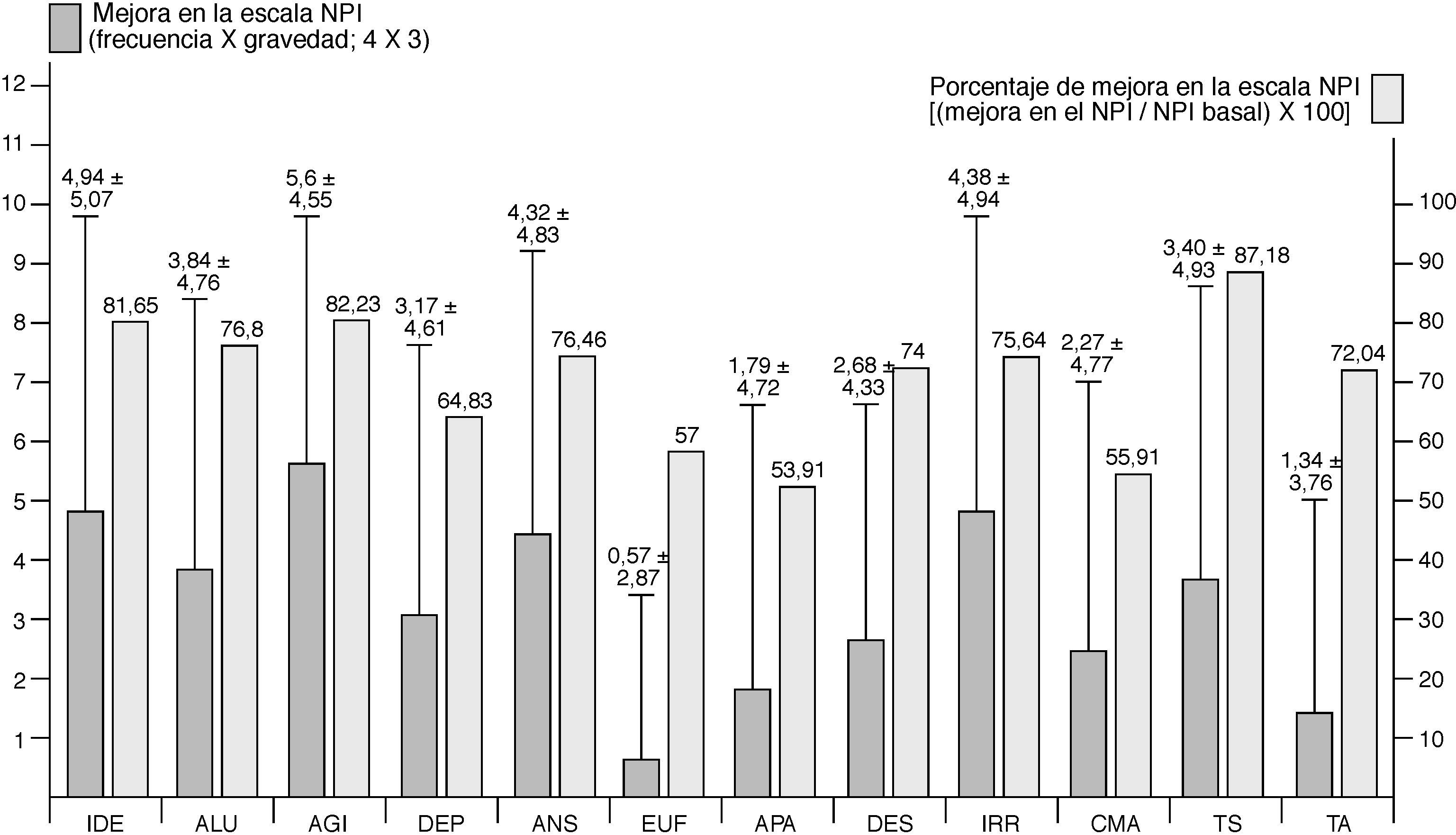
Con respecto a la mejora experimentada por los pacientes, un 84,3% presentó algún grado de mejora conductual (un 49,7%, mejora importante a muy importante) y el 75,3% mejora general (el 25,6%, mejora importante a muy importante). La media de mejora en la escala NPI fue 33,3±24,75 puntos. La agitación/agresividad (5,6±4,55), las ideas delirantes (4,94±5,07), la irritabilidad (4,38±4,94), la ansiedad (4,32±4,83), las alucinaciones (3,84±4,76) y los trastornos del sueño (3,4±4,93) fueron los síntomas que más mejoraron (tabla 3 y fig. 2).
Características relacionadas con la administración del antipsicótico atípico (AA) de uso compasivo.
| AA administrado como primera opción | |
| Quetiapina | 76,7 |
| Ziprasidona | 18,8 |
| Olanzapina | 4,5 |
| Mantenimiento del tratamiento | |
| Se mantiene el AA en monoterapia | 89,5 |
| Cambio por otro o se asocio un segundo AA | 10,5 |
| Tiempo de evolución con el AA (meses) | 20,25±20,38 |
| Dosis media de mantenimiento (mg/día) | |
| Quetiapina | 183,11±136,83 |
| Ziprasidona | 71,32±65,37 |
| Olanzapina | 6±2,24 |
| Cumplimiento terapéutico | 95,5 |
| Mejora conductual (cuidador) | |
| Mejora muy importante | 21,1 |
| Mejora importante | 28,6 |
| Mejora moderada | 18,8 |
| Mejora leve | 15,8 |
| Ninguna mejora | 15,7 |
| Mejora general (cuidador) | |
| Mejora muy importante | 4,5 |
| Mejora importante | 21,1 |
| Mejora moderada | 27,1 |
| Mejora leve | 22,6 |
| Ninguna mejora | 24,7 |
| Escala NPI (antes de AA) | 50,17±24,25 |
| Escala NPI (después de AA) | 16,86±16,64 |
| Mejora en NPI (total) | 33,3±24,75 |
| Ideas delirantes | 4,94±5,07 |
| Alucinaciones | 3,84±4,76 |
| Agitación/agresividad | 5,6±4,55 |
| Depresión/disforia | 3,17±4,61 |
| Ansiedad | 4,32±4,83 |
| Euforia/júbilo | 0,57±2,87 |
| Apatía/indiferencia | 1,79±4,72 |
| Desinhibición | 2,68±4,33 |
| Irritabilidad/inestabilidad | 4,38±4,94 |
| Conducta motriz anómala | 2,27±4,77 |
| Sueño | 3,40±4,93 |
| Desorden alimentario | 1,51±3,76 |
| Acontecimientos adversos graves | 3,7 |
| Fallecimientos | 23,3 |
| Efectos secundarios | 19,7 |
| Somnolencia | 7,6 |
| Discinesias | 1,5 |
| Agitación/efecto paradójico | 3,8 |
| Otros | 6,8 |
NPI: Neuropsychiatric Inventory.
Los datos expresan porcentaje o media±desviación estándar.
Mejora de los diferentes síntomas conductuales recogidos en el NPI expresado en términos absolutos (frecuencia×gravedad=4×3 [0–12]) y en porcentaje de mejora con respecto a la gravedad basal de cada síntoma [(mejora en la NPI / NPI basal)×100]. AGI: agitación; ALU: alucinaciones; ANS: ansiedad; APA: apatía; CMA: conducta motriz anómala; DEP: depresión; DES: desinhibición; EUF: euforia; IDE: ideas delirantes; IRR: irritabilidad; TA: trastornos alimenticios; TS: trastornos del sueño.
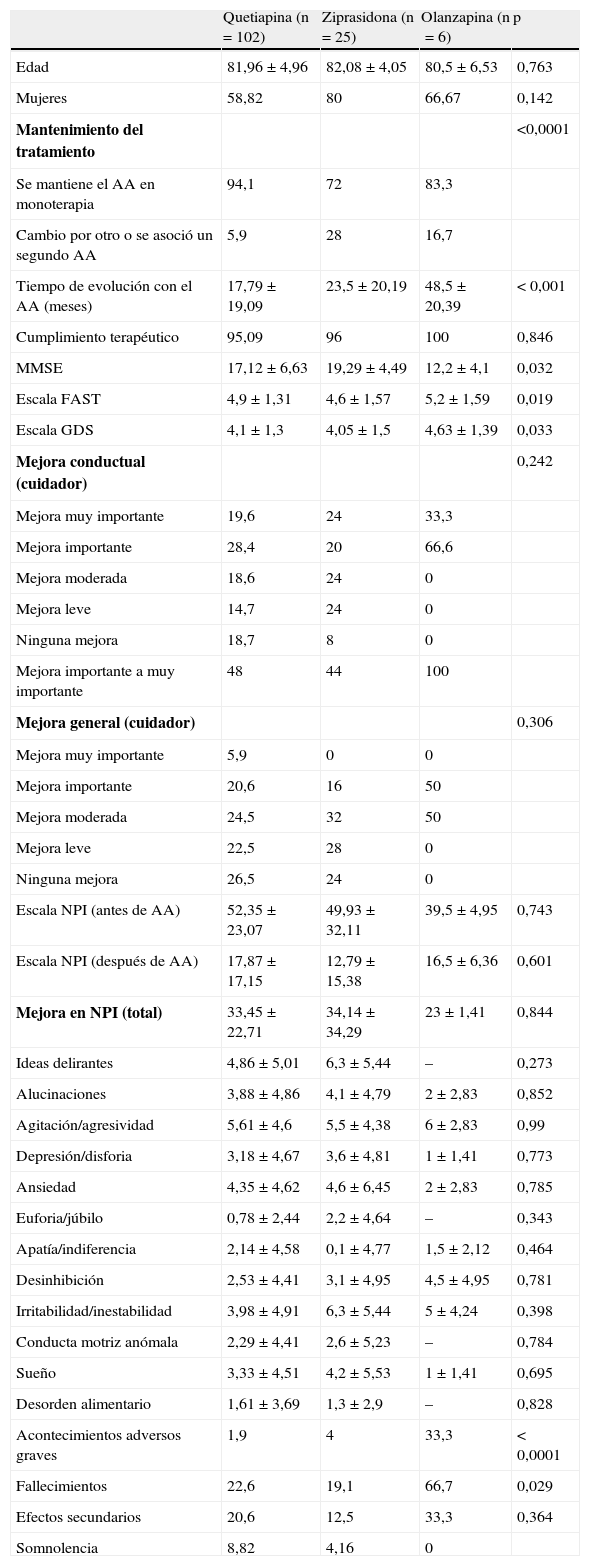
En el análisis comparativo entre los tres AAUC administrados, no hay diferencias en cuanto a la mejora conductual y general experimentadas, ni tampoco en el NPI (tabla 4). Quetiapina sí se asoció a un mayor porcentaje de casos mantenidos en monoterapia (94,1%) frente a ziprasidona (72%) y olanzapina (83,3%) (p<0,0001). La media de tiempo de seguimiento (en meses) de los pacientes que recibían olanzapina fue mayor (48,5±20,39) en comparación con ziprasidona (23,5±20,19) y quetiapina (17,79±19,09) (p<0,001). El 19,7% de los pacientes presentaron efectos secundarios. Dos pacientes (1,9%) que recibían quetiapina (uno, ictus isquémico, y el otro, infarto agudo de miocardio) y uno (4%) que recibía ziprasidona (insuficiencia renal aguda) presentaron acontecimientos adversos graves frente a 2 pacientes (33,3%) con olanzapina (uno, ictus isquémico, y el otro, trombosis arterial periférica) (p=0,007).
Análisis comparativo entre los antipsicóticos atípicos (AA) empleados (n=133).
| Quetiapina (n=102) | Ziprasidona (n=25) | Olanzapina (n=6) | p | |
| Edad | 81,96±4,96 | 82,08±4,05 | 80,5±6,53 | 0,763 |
| Mujeres | 58,82 | 80 | 66,67 | 0,142 |
| Mantenimiento del tratamiento | <0,0001 | |||
| Se mantiene el AA en monoterapia | 94,1 | 72 | 83,3 | |
| Cambio por otro o se asoció un segundo AA | 5,9 | 28 | 16,7 | |
| Tiempo de evolución con el AA (meses) | 17,79±19,09 | 23,5±20,19 | 48,5±20,39 | < 0,001 |
| Cumplimiento terapéutico | 95,09 | 96 | 100 | 0,846 |
| MMSE | 17,12±6,63 | 19,29±4,49 | 12,2±4,1 | 0,032 |
| Escala FAST | 4,9±1,31 | 4,6±1,57 | 5,2±1,59 | 0,019 |
| Escala GDS | 4,1±1,3 | 4,05±1,5 | 4,63±1,39 | 0,033 |
| Mejora conductual (cuidador) | 0,242 | |||
| Mejora muy importante | 19,6 | 24 | 33,3 | |
| Mejora importante | 28,4 | 20 | 66,6 | |
| Mejora moderada | 18,6 | 24 | 0 | |
| Mejora leve | 14,7 | 24 | 0 | |
| Ninguna mejora | 18,7 | 8 | 0 | |
| Mejora importante a muy importante | 48 | 44 | 100 | |
| Mejora general (cuidador) | 0,306 | |||
| Mejora muy importante | 5,9 | 0 | 0 | |
| Mejora importante | 20,6 | 16 | 50 | |
| Mejora moderada | 24,5 | 32 | 50 | |
| Mejora leve | 22,5 | 28 | 0 | |
| Ninguna mejora | 26,5 | 24 | 0 | |
| Escala NPI (antes de AA) | 52,35±23,07 | 49,93±32,11 | 39,5±4,95 | 0,743 |
| Escala NPI (después de AA) | 17,87±17,15 | 12,79±15,38 | 16,5±6,36 | 0,601 |
| Mejora en NPI (total) | 33,45±22,71 | 34,14±34,29 | 23±1,41 | 0,844 |
| Ideas delirantes | 4,86±5,01 | 6,3±5,44 | – | 0,273 |
| Alucinaciones | 3,88±4,86 | 4,1±4,79 | 2±2,83 | 0,852 |
| Agitación/agresividad | 5,61±4,6 | 5,5±4,38 | 6±2,83 | 0,99 |
| Depresión/disforia | 3,18±4,67 | 3,6±4,81 | 1±1,41 | 0,773 |
| Ansiedad | 4,35±4,62 | 4,6±6,45 | 2±2,83 | 0,785 |
| Euforia/júbilo | 0,78±2,44 | 2,2±4,64 | – | 0,343 |
| Apatía/indiferencia | 2,14±4,58 | 0,1±4,77 | 1,5±2,12 | 0,464 |
| Desinhibición | 2,53±4,41 | 3,1±4,95 | 4,5±4,95 | 0,781 |
| Irritabilidad/inestabilidad | 3,98±4,91 | 6,3±5,44 | 5±4,24 | 0,398 |
| Conducta motriz anómala | 2,29±4,41 | 2,6±5,23 | – | 0,784 |
| Sueño | 3,33±4,51 | 4,2±5,53 | 1±1,41 | 0,695 |
| Desorden alimentario | 1,61±3,69 | 1,3±2,9 | – | 0,828 |
| Acontecimientos adversos graves | 1,9 | 4 | 33,3 | < 0,0001 |
| Fallecimientos | 22,6 | 19,1 | 66,7 | 0,029 |
| Efectos secundarios | 20,6 | 12,5 | 33,3 | 0,364 |
| Somnolencia | 8,82 | 4,16 | 0 |
Los datos expresan porcentaje o media±desviación estándar.
El presente trabajo constituye un análisis retrospectivo sobre el uso de AAUC administrados en nuestra área sanitaria hasta noviembre de 2008. Dicho análisis muestra que los AAUC son fármacos probablemente efectivos y bien tolerados en pacientes con trastornos psicóticos y/o de conducta asociados a demencia.
Una de las características de la nueva generación de AA es su menor capacidad de inducir o agravar los SEP. Esta propiedad se relaciona con su menor actividad sobre los receptores dopaminérgicos D2 en el estriado y su capacidad para actuar como antagonistas de los receptores serotoninérgicos 5HT2A, lo que se traduce en menos parkinsonismos, con un buen control de los síntomas psicóticos. Especialmente poco parkinsonizantes resultan quetiapina4 y clozapina (poco utilizada, ya que produce agranulocitosis en el 2% de los casos y obliga a controles hemáticos periódicos5), y algo más ziprasidona6 y olanzapina7. En cambio, risperidona tiene un perfil farmacológico similar al de los neurolépticos clásicos y produce frecuentemente parkinsonismo1. Recientemente comercializada, la paliperidona es un metabolito de la risperidona, potencialmente menos parkinsonizante, que ha demostrado ser eficaz en el control de síntomas psicóticos en diferentes estudios en esquizofrenia8, y cuyos resultados como antipsicótico en la práctica diaria están por ver. Otros AA, como amisulprida, aripiprazol, sertindol o zotepina, no se utilizan habitualmente en pacientes con demencia y trastorno de conducta.
El inconveniente es que en nuestro país, a excepción de risperidona, que es el único AA aprobado para el tratamiento de los síntomas conductuales y psicológicos de las demencias por la Agencia Española del Medicamento, la prescripción de quetiapina, olanzapina y ziprasidona en pacientes mayores de 75 años con demencia y trastorno conductual debe ser por uso compasivo, asumiendo el médico prescriptor, bajo su exclusiva responsabilidad, su utilización para una indicación distinta de las autorizadas (Ley del Medicamento, artículo 23 del Real Decreto). La utilización de un medicamento por uso compasivo requiere el consentimiento informado por escrito del paciente o de su representante legal, un informe clínico en el que el médico justifique la necesidad de dicho tratamiento, la conformidad del director del centro donde se vaya a aplicar el tratamiento y la autorización de la Dirección General de Farmacia y Productos Sanitarios para cada caso concreto. Todo ello condiciona en muchos casos la prescripción de antipsicóticos a los pacientes mayores de 75 años con trastorno conductual asociado a demencia, con el riesgo correspondiente de administrar antipsicóticos que no precisan de uso compasivo, pero con más efectos secundarios (especialmente, SEP). En nuestra serie, de 133 pacientes (el 94,1% con algún tipo de demencia), 91 (68,4%) habían recibido previamente al menos otro antipsicótico (risperidona en el 31,6% de los casos) y hasta un 32,3% presentaba SEP secundarios. Esto pudiera deberse a que muchos pacientes llegan derivados al neurólogo desde atención primaria u otros especialistas con menos conocimientos en el manejo de antipsicóticos y/o imposibilidad para prescribir AAUC, e incluso a una prescripción frecuente por parte del neurólogo como primer AA de risperidona (los datos sobre qué médico prescribió el/los antipsicótico/s que recibía previamente el paciente no fueron recogidos). Sin embargo, en el análisis por grupos diagnósticos, hasta el 51,2% de los pacientes con D-EP/DCL no habían recibido previamente ningún antipsicótico (el AAUC fue la primera opción de tratamiento antipsicótico para el control de los síntomas conductuales), frente al 21,1% de aquellos con EA o el 19% con DV-M (p=0,049; datos no mostrados). Esto indica el rechazo a tratar con antipsicóticos potencialmente parkinsonizantes (sin necesidad de ser prescritos por uso compasivo) a pacientes con EP y, por el contrario, la administración más frecuente de éstos como primera opción a pacientes con demencia y trastorno conductual pero sin SEP. El problema es que a largo plazo estos pacientes empeoran su situación funcional debido a los efectos secundarios producidos por estos fármacos Y muchos de ellos presentan SEP cuando prescribimos un AAUC.
En relación con las características de la muestra, el 94,1% de los pacientes que recibieron un AAUC presentaban demencia. De los 8 pacientes sin demencia, 5 presentaban alteraciones conductuales sin criterios de demencia; 2, alteraciones conductuales asociadas a enfermedad vascular cerebral, y 1, cefalea refractaria. En cuanto al tipo de demencia, llama la atención el elevado porcentaje de pacientes con D-EP/DCL (30,8%) en comparación con la distribución habitual (EA, 50-70%; DV, 15-27%; DCL, 10-15%, y D-EP, 5-8%9–11). Esto se explica muy probablemente por el hecho de que los pacientes con D-EP/DCL presentan frecuentemente trastornos psicóticos, alucinaciones, depresión, ansiedad y otros síntomas, en relación tanto con el tratamiento como con su EP, que condicionan la necesidad del uso de antipsicóticos en muchos casos. Aunque la DFT cursa muchas veces con trastornos de conducta que obligan al uso de neurolépticos, sólo 3 pacientes en nuestra serie presentaban DFT. La baja prevalencia de DFT y el comienzo de la enfermedad entre los 45 y 64 años12 podrían explicarlo. Una mayor puntuación en la escala FAST se asoció a una puntuación también mayor en la escala NPI (correlación positiva, potencia de 0,197; p=0,044; en el caso de la escala GDS y MMSE se evidenciaron tendencias hacia una correlación positiva y negativa respectivamente con el NPI, pero sin resultar significativas; datos no mostrados). Curiosamente, esto no sucede en el grupo tratado con olanzapina (sólo 6 pacientes) que, aunque presentan una mayor puntuación en las escalas FAST y GDS y una menor puntuación en el MMSE, tienen una puntuación menor en el NPI. Esto señala algo evidente, que a mayor grado de deterioro cognitivo, mayor probabilidad de alteración conductual en los diferentes tipos de demencia, algo ya conocido, sobre todo en la EA, en la que típicamente los trastornos de conducta acontecen en fases más avanzadas de la enfermedad13.
En cuanto al tipo de convivencia, destaca que sólo el 6,8% del total de la muestra vivía en una residencia asistida, y que hasta un 68,4% lo hacía en compañía de otra persona. Con respecto al tratamiento concomitante, el 57,6% del grupo de pacientes con demencia (53 de 125 pacientes) recibían un inhibidor de la acetilcolinesterasa y/o memantina. Éste es tal vez un porcentaje bajo, si tenemos en cuenta que donepecilo14,15, rivastigmina16, galantamina17 y memantina18,19 han demostrado ser eficaces en el control de diferentes síntomas conductuales en pacientes con demencia en diferentes estudios, lo cual, sumado a su buena tolerabilidad, nos puede permitir retrasar el uso de neurolépticos (fármacos siempre peor tolerados y con más efectos secundarios). El porcentaje de pacientes tratados con benzodiacepinas (55,2%) y antidepresivos (56,8%) en el grupo con demencia es congruente con otras series20.
Quetiapina fue, sin duda, el AAUC más utilizado en nuestra serie (102 pacientes), seguido de ziprasidona (25 pacientes) y olanzapina (6 pacientes). Hubo una mejora tanto de los síntomas conductuales como general considerable, según las opiniones de los familiares cuidadores de los pacientes. La escala NPI se utilizó para evaluar los síntomas conductuales en relación con las recomendaciones vigentes21. Dicha escala evidenció que los síntomas psicóticos/conductuales que más mejoraron fueron especialmente los síntomas positivos (ideas delirantes, alucinaciones, agresividad, irritabilidad y ansiedad), mientras que algunos negativos como la apatía apenas mejoraron. No obstante, como la mejora en los diferentes ítems del NPI en términos absolutos está condicionada por la puntuación basal para cada ítem, también analizamos el porcentaje de mejora como (mejoría en el NPI / NPI basal)×100 para cada síntoma. En términos de porcentaje el síntoma conductual que más mejoró fueron los trastornos del sueño. Estos resultados están en concordancia con otras series22–24. En este sentido, olanzapina ha demostrado ser eficaz en la mejoría de la ansiedad y las alucinaciones con dosis de 5mg/día25,26. Quetiapina ha demostrado ser segura y eficaz en el tratamiento a largo plazo de psicosis debida a varias causas en poblaciones de ancianos (dosis media de 137,5mg/día)27, en pacientes con psicosis asociada a EP (dosis de entre 25 y 75mg/día)28–30 y en pacientes con DCL31. Aunque hay menos experiencia con ziprasidona, diferentes trabajos han demostrado que ésta mejora la agitación, la depresión y la psicosis en pacientes ancianos con demencia32,33.
Por supuesto, y teniendo en cuenta que se trata de un análisis retrospectivo y el estudio no fue diseñado con tal intención, los datos referentes a la comparación entre quetiapina, ziprasidona y olanzapina de nuestra serie deben considerarse con las limitaciones correspondientes (102 pacientes recibieron quetiapina y sólo 6, olanzapina). Aunque no hubo diferencias en cuanto a su efectividad, quetiapina sí se asoció a un mayor porcentaje de casos en monoterapia (p<0,0001). En general, hubo buena tolerancia y cumplimiento terapéutico; la somnolencia fue el efecto secundario más frecuente (10 casos). Otros efectos secundarios recogidos fueron agitación/efecto paradójico (5 casos), discinesias (2 casos), temblor (1 caso), acatisia (1 caso), ganancia de peso excesiva (1 caso) y sequedad de boca (1 caso). Cinco pacientes (3,7%) presentaron acontecimientos adversos graves (dos de ellos, ictus isquémico) mientras recibían un AACU. Aunque su aparición se asoció significativamente a olanzapina, debe tenerse en cuenta que sólo 6 pacientes recibieron olanzapina (y un solo caso en este grupo ya supone el 16,6%). También hubo un mayor porcentaje de fallecimientos en este grupo, pero las causas de muerte no fueron analizadas. Estos datos también están condicionados probablemente por el hecho de que el tiempo de seguimiento con el AACU en el grupo de olanzapina fue mayor con respecto a quetiapina y ziprasidona y, lo que es más importante, que los pacientes que recibieron olanzapina presentaban un estado de demencia más avanzado (evaluada mediante las escalas MMSE, FAST y GDS). En un reciente metaanálisis de 15 ensayos clínicos (12 semanas de duración) sobre AA en pacientes con demencia, hubo una tasa de mortalidad del 3,5% en el grupo de los tratados con un AA frente al 2,3% de los tratados con placebo, aunque el exceso de mortalidad no se examinó de forma individual en cada caso34. Probablemente, deben realizarse estudios bien diseñados para aclarar si hay riesgo de muerte y, en tal caso, cuantificarlo (y sus causas), en pacientes de edad avanzada que reciben AA.
El presente trabajo tiene importantes limitaciones. Se trata de un análisis retrospectivo y no un trabajo prospectivo, a doble ciego, diseñado para evaluar la eficacia de los AAUC. Por ello, los datos sobre su efectividad y seguridad deben considerarse en dicho contexto. Los grupos en cuanto al AAUC recibido son muy dispares respecto al número de pacientes tratados para establecer comparaciones. No se analizó la causa del fallecimiento, como tampoco la evolución de los síntomas parkinsonianos en el grupo de pacientes que tenían SEP antes de recibir el AAUC (aunque sí la mejora general según una encuesta realizada al familiar conviviente). En la categorización del grado de mejora experimentada, tanto general como conductual, con el AA, no se tiene en cuenta la posibilidad de empeoramiento como una de las opciones y queda incluida en el grupo de “ninguna mejoría”. No se han tenido en cuenta otras posibles modificaciones del tratamiento que pudieran influir en los cambios experimentados en el NPI después de recibir el AAUC. Tampoco se valoró la carga de estrés del cuidador. Por el contrario, y como aspectos favorables, debe tenerse en cuenta que se trata de una muestra con un elevado número de pacientes, que nos permite obtener datos interesantes acerca del manejo de los AAUC en pacientes de 75 años o más que los precisen. Éstos pueden considerarse una buena opción de tratamiento en pacientes con demencia y síntomas como trastornos del sueño, agitación, ideas delirantes, alucinaciones, ansiedad o irritabilidad.
En conclusión, los datos del presente trabajo demuestran que los AAUC son fármacos efectivos y bien tolerados en pacientes de 75 años o más con demencia y trastorno conductual concomitante. Un porcentaje excesivo de pacientes reciben otros antipsicóticos previamente y muchos presentan SEP secundarios. Proponemos que tal vez deberían utilizarse los AAUC como fármacos de primera línea para el control de la sintomatología conductual y/o psicótica en estos pacientes, por delante de otros antipsicóticos con más efectos secundarios.
Presentaciones y financiaciónEl presente trabajo no ha recibido financiación de ningún tipo para su realización.
Se ha presentado como comunicación tipo póster en la pasada reunión de la Sociedad Española de Neurología, Barcelona, 17-21 de noviembre de 2009.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.








![Mejora de los diferentes síntomas conductuales recogidos en el NPI expresado en términos absolutos (frecuencia×gravedad=4×3 [0–12]) y en porcentaje de mejora con respecto a la gravedad basal de cada síntoma [(mejora en la NPI / NPI basal)×100]. AGI: agitación; ALU: alucinaciones; ANS: ansiedad; APA: apatía; CMA: conducta motriz anómala; DEP: depresión; DES: desinhibición; EUF: euforia; IDE: ideas delirantes; IRR: irritabilidad; TA: trastornos alimenticios; TS: trastornos del sueño. Mejora de los diferentes síntomas conductuales recogidos en el NPI expresado en términos absolutos (frecuencia×gravedad=4×3 [0–12]) y en porcentaje de mejora con respecto a la gravedad basal de cada síntoma [(mejora en la NPI / NPI basal)×100]. AGI: agitación; ALU: alucinaciones; ANS: ansiedad; APA: apatía; CMA: conducta motriz anómala; DEP: depresión; DES: desinhibición; EUF: euforia; IDE: ideas delirantes; IRR: irritabilidad; TA: trastornos alimenticios; TS: trastornos del sueño.](https://static.elsevier.es/multimedia/02134853/0000002500000005/v1_201305151029/S0213485310000204/v1_201305151029/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

