La anosognosia es frecuente en la enfermedad de Alzheimer (EA). El objetivo fue describir su prevalencia en el momento del diagnóstico y analizar los factores predisponentes y su influencia en la evolución posterior de la EA.
MétodosEstudio observacional, multicéntrico, prospectivo, analítico, realizado en consultas de neurología general. Se incluyó a pacientes recién diagnosticados de EA (criterios NINCDS-ADRDA). Se realizaron 2 evaluaciones —cognitivas, funcionales y neuropsiquiátricas—, con un intervalo de 18 meses. Se empleó la Clinical Insight Rating scale como medida de anosognosia (CIR, rango 0-8). El criterio de progresión fue un incremento en la Clinical Dementia Rating-sum of boxes mayor a 2,5 puntos. Las variables predictoras se analizaron mediante regresión logística.
ResultadosSe incluyó a 127 pacientes, 94 completaron las 2 evaluaciones. El 31,5% mostraba anosognosia grave (CIR 7-8), el 39,4% conciencia alterada (CIR 3-6) y el 29,1% conciencia normal (CIR 0-2). La mediana del CIR basal en la cohorte fue 4 (Q1-Q3: 1-7) y a los 18 meses 6 (Q1-Q3: 3-8); p<0,001. La edad avanzada (odds ratio [OR] 2,43; IC del 95%, 1,14-5,19), menor escolaridad (OR 2,15; IC del 95%, 1,01-4,58) y mayor afectación neuropsiquiátrica (OR 2,66; IC del 95%, 1,23-5,74) fueron variables predictoras de anosognosia. El CIR basal fue similar en los grupos con y sin progresión clínica significativa.
ConclusionesLa gran mayoría de los pacientes con EA en el momento del diagnóstico muestran un grado significativo de anosognosia que se asocia a mayor edad, menor escolaridad y mayor afectación conductual. No se demostró influencia de la anosognosia sobre la evolución inicial de la EA tras el diagnóstico.
Anosognosia is a frequent symptom in Alzheimer disease (AD). The objective of this article is to describe prevalence of this condition at time of diagnosis and analyse any predisposing factors and their influence on disease progression.
MethodsObservational, prospective, and analytical multi-centre study in an outpatient setting. Patients recently diagnosed with AD (NINCDS-ADRDA criteria) were included. Each patient underwent two cognitive, functional, and neuropsychiatric assessments separated by an interval of 18 months. The Clinical Insight Rating Scale was employed as a measure of anosognosia (CIR, scored 0-8). Progression was defined as an increase in the Clinical Dementia Rating Scale-sum of boxes of more than 2.5 points. The predictor variables were analysed using binary logistic regression.
ResultsThe study included 127 patients, and 94 completed both assessments. Of the total, 31.5% displayed severe anosognosia (CIR 7-8); 39.4%, altered level of consciousness (CIR 3-6); and 29.1%, normal awareness (CIR 0-2). The median baseline CIR in this cohort was 4 (Q1-Q3: 1-7), and at 18 months, 6 (Q1-Q3: 3-8), P<.001. Advanced age (odds ratio (OR) 2.43; CI 95%:1.14-5.19), lower educational level (OR 2.15; CI 95%:1.01-4.58), and more marked neuropsychiatric symptoms (OR 2.66; CI 95%:1.23-5.74) were predictor variables of anosognosia. Baseline CIR was similar in the groups with and without significant clinical progression.
ConclusionsThe large majority of patients with AD at the time of diagnosis showed significant anosognosia, and this condition was associated with advanced age, lower educational level, and more marked behavioural symptoms. Our results did not show that anosognosia had an effect on the initial clinical progression of AD after diagnosis.
La anosognosia se define como la incapacidad para reconocer no solo la presencia de déficits característicos de una enfermedad –cognitivos, motores, sensoriales o afectivos- sino también su magnitud, su progresión y las limitaciones que producen en la vida diaria1. Es común en el curso de infartos hemisféricos derechos, donde fue descrita en 1914 por Babinski. Constituye un síntoma muy habitual en la enfermedad de Alzheimer (EA), incluso en fases precoces, aunque también es frecuente en otros procesos, como la demencia frontotemporal o la esquizofrenia2. La anosognosia no tiene un correlato anatómico o bioquímico específico por tratarse de un fenómeno complejo, multidimensional, no unitario en su naturaleza ni en su intensidad. Estudios recientes con SPECT de perfusión y RM funcional sugieren que se asocia a afectación del córtex prefrontal dorsolateral derecho3, el gyrus frontal inferior derecho4, el córtex cingulado anterior y regiones parietotemporales del hemisferio derecho5. Las puntuaciones de los test neuropsicológicos que evalúan algunas de estas áreas, como los que exploran las funciones ejecutivas y las habilidades visuoespaciales, se ven afectadas en mayor medida en pacientes que presentan este síntoma6.
La relevancia de la anosognosia en la EA procede de su elevada frecuencia y de sus consecuencias personales, familiares y sociosanitarias. La falta de conciencia de enfermedad se asocia a conductas de riesgo de los pacientes7 y con un aumento de la carga del cuidador8,9. En la práctica, puede suponer un problema muy importante en la falta de adherencia a los tratamientos y para la realización de tareas esenciales, como la conducción de vehículos, el control de las finanzas o para otorgar un testamento.
Las investigaciones previas sobre la prevalencia de anosognosia en la EA proceden de estudios transversales de series clínicas o consultas de demencias. Diferencias conceptuales y la existencia de distintos instrumentos de medición son la causa de cifras dispares, entre el 5 y el 70%1,10,11 En España, un estudio reciente de Turro-Garriga et al. mostró una prevalencia del 46,7%, que se incrementa hasta el 91% en demencia moderada-avanzada12.
El estudio prospectivo DEMDIAG (Evaluación de la demencia tipo Alzheimer en el momento del diagnóstico) fue diseñado para evaluar distintas características clínicas, sociodemográficas y nutricionales de la EA cuando se realiza el diagnóstico, así como para analizar su influencia en la evolución de la enfermedad a los 18 meses. Los objetivos del trabajo que presentamos fueron evaluar la prevalencia de anosognosia, sus factores predisponentes y su influencia en la evolución posterior de la EA.
Pacientes y métodosDiseño del estudioEstudio observacional, multicéntrico, prospectivo, analítico. Se realizó en las consultas externas de Neurología General del Hospital Universitario Río Hortega de Valladolid y el Complejo Hospitalario de Segovia. Se realizaron 2 evaluaciones a los pacientes. Para la evaluación basal se efectuó un reclutamiento prospectivo entre octubre del 2009 y marzo del 2011. La segunda evaluación se realizó a los 18 ± 1 meses de la basal, entre abril del 2011 y octubre del 2012.
Criterios de inclusión de los pacientesLos criterios de inclusión en el estudio fueron: 1) sujetos de cualquier edad y sexo; 2) residentes en la comunidad; 3) consultaban por primera vez, en el ámbito de atención especializada, por síntomas de deterioro cognitivo en cualquier grado; 4) el estudio diagnóstico posterior confirmó una demencia por EA, y 5) existencia de un cuidador o informador fiable. No se incluyó a pacientes institucionalizados. Para el diagnóstico de demencia por EA se emplearon los criterios NINCDS-ADRDA de EA probable13.
Protocolo del estudioLos pacientes fueron sometidos a una evaluación neurológica y neuropsicológica en 2 ocasiones (basal y a los 18 meses). Entre estas se realizó el seguimiento habitual a criterio de los neurólogos responsables, expertos en evaluación y tratamiento de la demencia. En la evaluación basal se realizó una entrevista estructurada que recogió distintas variables sociodemográficas y los años de escolaridad. El nivel de estudios se estratificó en «sin estudios» (analfabetos y estudios primarios incompletos), «estudios primarios» y «secundarios o más». Se recogieron los antecedentes médicos, de forma específica factores de riesgo vascular y hábitos, así como antecedentes familiares de demencia. Se realizó un estudio diagnóstico diferencial de demencias secundarias que incluyó un estudio analítico completo con determinación de iones, función renal, hormonas tiroideas y vitamina B12. Se determinó el genotipo ApoE. En todos los casos se realizaron pruebas de neuroimagen; de forma preferente, una RM cerebral y, cuando no fuera posible, una tomografía computarizada cerebral. Se calculó el retraso en el diagnóstico como el tiempo en meses entre el inicio de los primeros síntomas de la enfermedad y su confirmación diagnóstica.
Instrumentos de medidaPara evaluar el grado de anosognosia se empleó la Clinical Insight Rating scale (CIR)14 cuya puntuación está basada en la información proporcionada durante la entrevista clínica por el propio paciente y su cuidador. La escala CIR evalúa 4 componentes: 1) conciencia de la situación (motivos y circunstancias de la visita a la consulta); 2) conciencia del déficit de memoria u otros problemas cognitivos; 3) conciencia del deterioro en actividades de la vida diaria, y 4) conciencia de progresión del deterioro cognitivo. En cada uno de ellos se puntúa como 0, reconocimiento intacto; 1, reconocimiento alterado, y 2, reconocimiento ausente. La puntuación total de la escala (rango 0-8) es la suma de la puntuación de cada componente. El valor más alto es indicativo de una ausencia de conciencia de enfermedad.
Para la evaluación del estado cognitivo se empleó la versión española del Cambrigde Cognitive Examination-Revised (CAMCOG-R; rango 0-105)15, que incluye la puntuación del Mini-Mental State Examination (MMSE) de Folstein. Para la evaluación funcional se empleó la versión española de la Rapid Disability Rating Scale-2 (RDRS-2; rango 18-72)16. Para la evaluación conductual se empleó la versión española breve del inventario neuropsiquiátrico (Neuropsychiatric Inventory Questionaire [NPI-Q])17, que mide la presencia y la gravedad de 12 aspectos patológicos de la conducta, así como el estrés que producen en el cuidador. Se obtienen 2 puntuaciones, gravedad (rango 0-36) y estrés (rango 0-60). Para la evaluación de la carga del cuidador se empleó la escala de Zarit (rango 22-110)18. Como medida global de la gravedad de la demencia se empleó la Clinical Dementia Rating (CDR)19. Se calculó la puntuación total según el algoritmo propuesto por Morris20. Adicionalmente, se calculó la CDR «sum of boxes» (CDR-SB) como la suma de las puntaciones individuales de cada uno de los 6 dominios que evalúa la escala21. El criterio de progresión de la enfermedad entre las 2 evaluaciones del estudio fue un incremento en la CDR-SB mayor de 2,5 puntos22.
Análisis estadísticoLas características clínicas y sociodemográficas fueron analizadas mediante frecuencias absolutas y relativas en el caso de variables cualitativas y con medidas de tendencia central y dispersión para las variables cuantitativas. Se evaluó el ajuste a la curva normal de las variables mediante el test de Kolmogorov-Smirnov previo a la elección de test paramétricos o no paramétricos. La comparación entre proporciones se realizó con el test de la χ2. En las pruebas de contraste de hipótesis, para las variables normales se emplearon la prueba de la t de Student (para datos independientes o relacionados) y ANOVA de un factor. Para las variables cuantitativas ordinales o cuantitativas no normales, se emplearon la U de Mann-Whitney o la H de Kruskall-Wallis en el caso de variables independientes y la prueba de los signos de Wilcoxon para datos pareados.
En el análisis de variables predictoras de anosognosia se categorizó la puntuación del CIR según el valor basal fuera menor o, igual o superior a la mediana (variable dependiente CIR ≥ 5) y se realizó un estudio de regresión logística multivariable con el método de pasos hacia delante. Se categorizaron todas las variables cuantitativas incluidas en el modelo según el valor de su mediana en la evaluación basal. Se calcularon las odds ratio (OR) ajustadas con intervalos de confianza (IC) del 95%.
Previamente, se realizó un estudio de fiabilidad de la escala CIR en 35 pacientes con EA. La concordancia interobservador mostró un coeficiente de correlación intraclase (CCI) de 0,93; IC del 95%, 0,87-0,96, p<0,01, con un índice kappa de 0,6. La fiabilidad test-retest (concordancia intraobservador) mostró un CCI de 0,89, IC del 95%, 0,77-0,95, p<0,01, con un índice kappa de 0,43. Para todos los análisis se categorizó la puntuación del CIR en conciencia preservada (puntuación 0-2), conciencia alterada (puntuación 3-6) y anosognosia (puntuaciones 7 y 8).
El análisis estadístico se realizó con el programa SPSS v. 22.0 (IBM Corp, Armonk, Nueva York, EE. UU.). El nivel de significación empleado fue p<0,05.
Consideraciones éticasEl estudio fue aprobado por los Comités de Ética e Investigación Clínica del Hospital Universitario Río Hortega de Valladolid y el Complejo Hospitalario de Segovia. Se solicitó la firma de un documento de consentimiento informado al paciente o a su representante legal o familiar más próximo en caso de incapacidad.
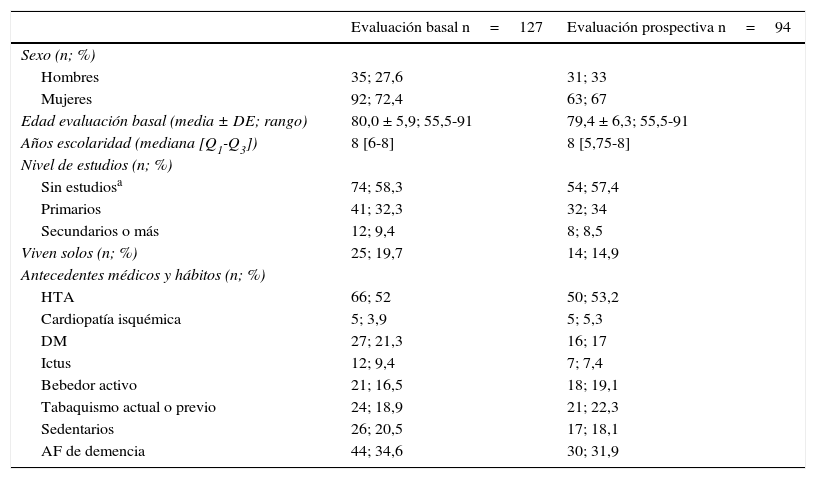
ResultadosSe incluyó en la evaluación basal a 127 pacientes con demencia por EA. Hubo 21 pérdidas de seguimiento, 3 exclusiones por enfermedad grave y 9 fallecimientos. Completaron las 2 evaluaciones 94 pacientes. En la tabla 1 se muestran algunas características sociodemográficas y los principales antecedentes de todos los sujetos incluidos y los que completaron las 2 evaluaciones. El porcentaje de mujeres fue mayor (87,9% vs. 67%; p<0,05) en el grupo de una evaluación (n=33) con respecto al de 2 evaluaciones (n=94). La edad fue también más alta (81,7 vs. 79,4; p=0,06). No hubo diferencias en el resto de las características sociodemográficas entre los 2 grupos.
Características sociodemográficas de todos los sujetos evaluados
| Evaluación basal n=127 | Evaluación prospectiva n=94 | |
|---|---|---|
| Sexo (n; %) | ||
| Hombres | 35; 27,6 | 31; 33 |
| Mujeres | 92; 72,4 | 63; 67 |
| Edad evaluación basal (media ± DE; rango) | 80,0 ± 5,9; 55,5-91 | 79,4 ± 6,3; 55,5-91 |
| Años escolaridad (mediana [Q1-Q3]) | 8 [6-8] | 8 [5,75-8] |
| Nivel de estudios (n; %) | ||
| Sin estudiosa | 74; 58,3 | 54; 57,4 |
| Primarios | 41; 32,3 | 32; 34 |
| Secundarios o más | 12; 9,4 | 8; 8,5 |
| Viven solos (n; %) | 25; 19,7 | 14; 14,9 |
| Antecedentes médicos y hábitos (n; %) | ||
| HTA | 66; 52 | 50; 53,2 |
| Cardiopatía isquémica | 5; 3,9 | 5; 5,3 |
| DM | 27; 21,3 | 16; 17 |
| Ictus | 12; 9,4 | 7; 7,4 |
| Bebedor activo | 21; 16,5 | 18; 19,1 |
| Tabaquismo actual o previo | 24; 18,9 | 21; 22,3 |
| Sedentarios | 26; 20,5 | 17; 18,1 |
| AF de demencia | 44; 34,6 | 30; 31,9 |
AF: antecedentes familiares; DM: diabetes mellitus; HTA: hipertensión arterial.
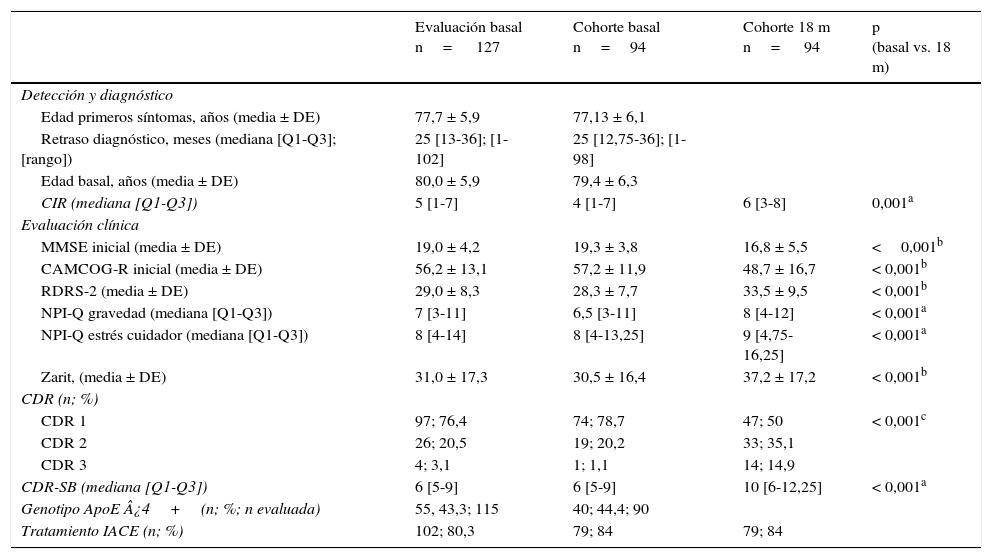
La tabla 2 muestra las características clínicas de la demencia de todos los sujetos incluidos y las de los que completaron las 2 evaluaciones, así como las diferencias entre la evaluación basal y la de los 18 meses. Se determinó el genotipo ApoE en 115 pacientes; 55 (43,3%) eran portadores del alelo ApoE ¿4. El porcentaje de pacientes con demencia grave (CDR 3) fue mayor en el grupo de una evaluación respecto al de 2 (9,1% vs. 1,1%; p<0,05). Empeoraron de forma significativa las puntuaciones de todas las escalas entre la evaluación basal y la de los 18 meses. El 84% de los pacientes estaban en tratamiento activo con inhibidores de la colinesterasa en la segunda evaluación. La mediana del CIR fue 5 (Q1-Q3: 1-7) en la evaluación basal de los 127 sujetos incluidos. La conciencia de enfermedad estaba preservada en 37 (29,1%), alterada en 50 (39,4%) y 40 mostraban anosognosia (31,5%).
Características clínicas de la demencia
| Evaluación basal n= 127 | Cohorte basal n=94 | Cohorte 18 m n= 94 | p (basal vs. 18 m) | |
|---|---|---|---|---|
| Detección y diagnóstico | ||||
| Edad primeros síntomas, años (media ± DE) | 77,7 ± 5,9 | 77,13 ± 6,1 | ||
| Retraso diagnóstico, meses (mediana [Q1-Q3]; [rango]) | 25 [13-36]; [1-102] | 25 [12,75-36]; [1-98] | ||
| Edad basal, años (media ± DE) | 80,0 ± 5,9 | 79,4 ± 6,3 | ||
| CIR (mediana [Q1-Q3]) | 5 [1-7] | 4 [1-7] | 6 [3-8] | 0,001a |
| Evaluación clínica | ||||
| MMSE inicial (media ± DE) | 19,0 ± 4,2 | 19,3 ± 3,8 | 16,8 ± 5,5 | <0,001b |
| CAMCOG-R inicial (media ± DE) | 56,2 ± 13,1 | 57,2 ± 11,9 | 48,7 ± 16,7 | < 0,001b |
| RDRS-2 (media ± DE) | 29,0 ± 8,3 | 28,3 ± 7,7 | 33,5 ± 9,5 | < 0,001b |
| NPI-Q gravedad (mediana [Q1-Q3]) | 7 [3-11] | 6,5 [3-11] | 8 [4-12] | < 0,001a |
| NPI-Q estrés cuidador (mediana [Q1-Q3]) | 8 [4-14] | 8 [4-13,25] | 9 [4,75-16,25] | < 0,001a |
| Zarit, (media ± DE) | 31,0 ± 17,3 | 30,5 ± 16,4 | 37,2 ± 17,2 | < 0,001b |
| CDR (n; %) | ||||
| CDR 1 | 97; 76,4 | 74; 78,7 | 47; 50 | < 0,001c |
| CDR 2 | 26; 20,5 | 19; 20,2 | 33; 35,1 | |
| CDR 3 | 4; 3,1 | 1; 1,1 | 14; 14,9 | |
| CDR-SB (mediana [Q1-Q3]) | 6 [5-9] | 6 [5-9] | 10 [6-12,25] | < 0,001a |
| Genotipo ApoE ¿4+(n; %; n evaluada) | 55, 43,3; 115 | 40; 44,4; 90 | ||
| Tratamiento IACE (n; %) | 102; 80,3 | 79; 84 | 79; 84 | |
CAMCOG-R: prueba cognitiva de Cambridge revisada; CDR: Clinical Dementia Rating; CDR-SB: Clinical Dementia Rating «sum of boxes»; IACE: inhibidores de la acetil-colinesterasa; MMSE: Mini-Mental State Examination; NPI-Q: Cuestionario del inventario neuropsiquiátrico; RDRS-2: Rapid Disability Rating Scale-2.
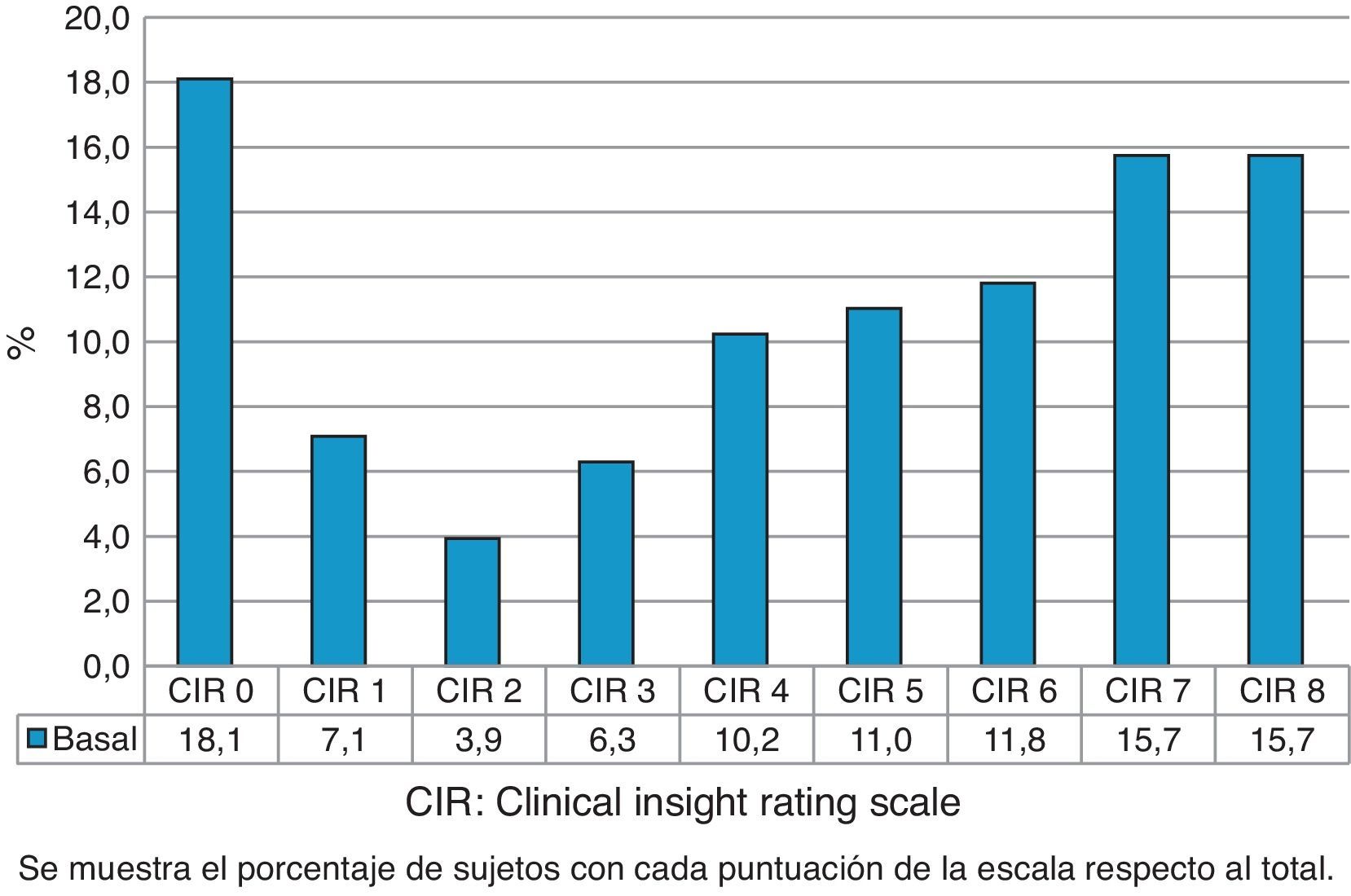
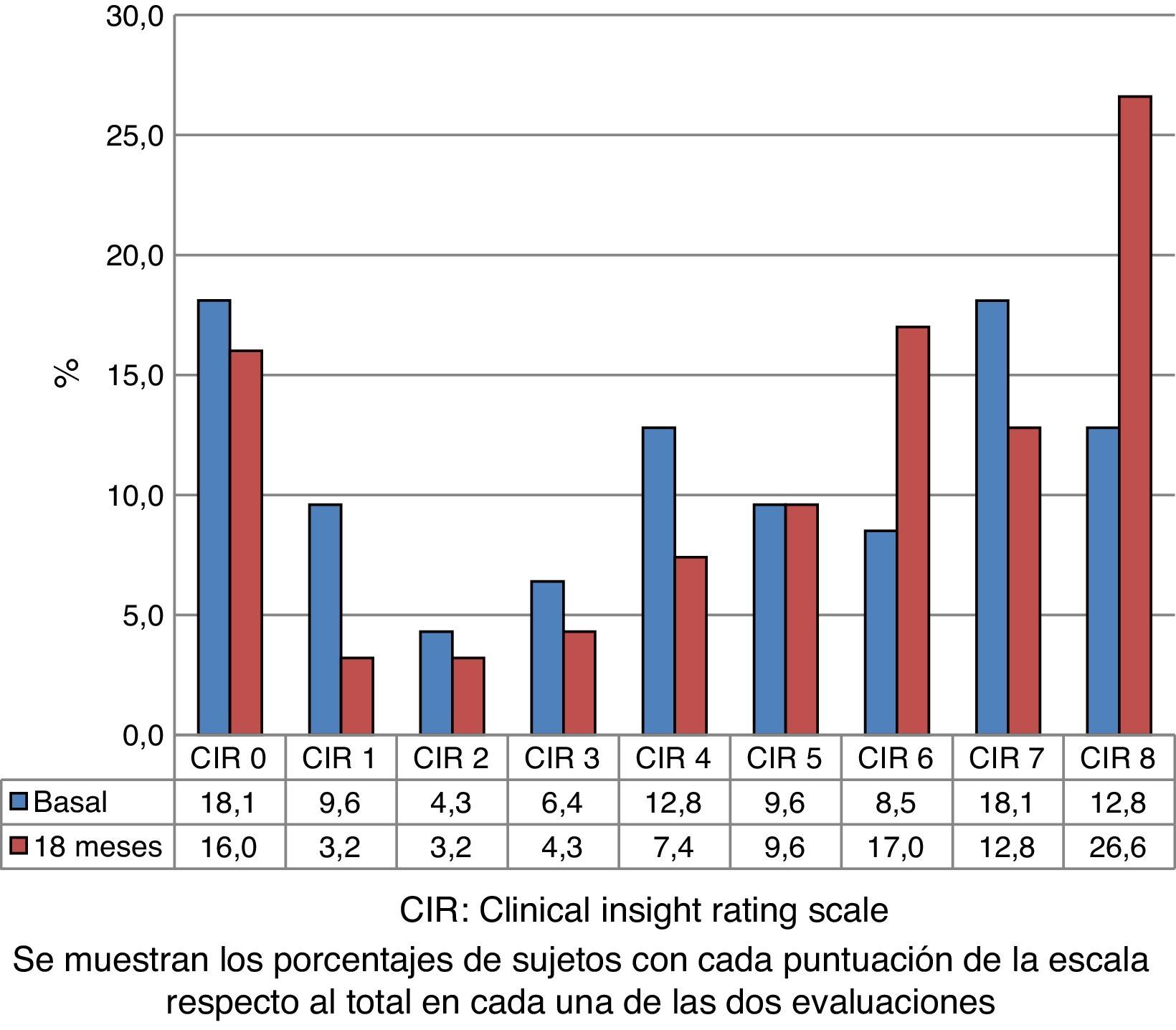
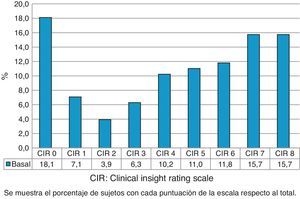
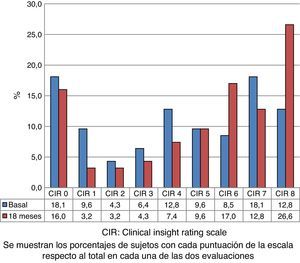
La figura 1 muestra la distribución de las puntuaciones del CIR en la evaluación basal de todos los sujetos evaluados. Esta distribución es bimodal, con mayor representación de la puntuación más baja y las más altas de la escala. La figura 2 muestra la evolución de las puntuaciones entre las 2 evaluaciones. El porcentaje de anosognosia aumentó del 30,9 al 39,4% y la conciencia alterada del 37,2 al 38,3%. La conciencia preservada disminuyó del 31,9 al 22,3%. La falta de conciencia de progresión de la enfermedad fue el dominio que más contribuyó a la puntuación global de la escala CIR, aunque sin diferencias significativas respecto a los otros 3.
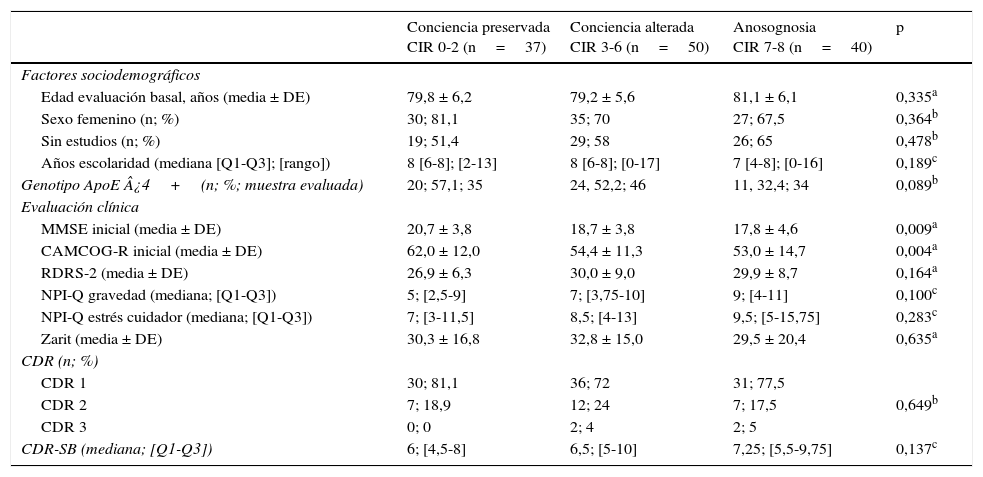
En la tabla 3 se muestran las características sociodemográficas y clínicas según el grado de anosognosia en la evaluación basal en todos los pacientes incluidos. Un mayor deterioro cognitivo en el MMSE y el CAMCOG-R se asoció a una menor conciencia de enfermedad. La frecuencia de los factores de riesgo vascular analizados (hipertensión arterial, cardiopatía isquémica, ictus previo, diabetes mellitus, tabaquismo y sedentarismo) fue similar entre los distintos grados de anosognosia, sin ninguna diferencia significativa. La mediana del CIR fue significativamente mayor en los pacientes con genotipo ApoE ¿4 negativos respecto a los positivos (5 [Q1-Q3: 2,25-7] vs. 4 [Q1-Q3: 1-6]; p<0,05). Las puntuaciones basales en las pruebas cognitivas fueron similares entre los grupos con genotipo ApoE ¿4 positivo y los negativos (MMSE 19,0 y 19,1, respectivamente; p=0,93; CAMCOG-R 57,5 y 55,2, respectivamente; p=0,35). No hubo diferencias en la mediana del CIR por sexos (hombres 5 [Q1-Q3: 3-7], mujeres 5 [Q1-Q3: 1-7]; p=0,33) o nivel de estudios (sin estudios 5 [Q1-Q3: 2-7], primarios o más 4 [Q1-Q3: 1-6]; p=0,21]. El cambio en la puntuación del CIR a los 18 meses mostro una correlación negativa con el cambio en la puntuación de MMSE (r=–0,43, p<0,001), CAMCOG-R (r=–0,34; p<0,001) y positiva con el cambio en CDR (r=0,28; p<0,01) y CDR-SB (r=0,25; p<0,05).
Características sociodemográficas y clínicas según el grado de anosognosia en la evaluación basal (n=127)
| Conciencia preservada CIR 0-2 (n=37) | Conciencia alterada CIR 3-6 (n=50) | Anosognosia CIR 7-8 (n=40) | p | |
|---|---|---|---|---|
| Factores sociodemográficos | ||||
| Edad evaluación basal, años (media ± DE) | 79,8 ± 6,2 | 79,2 ± 5,6 | 81,1 ± 6,1 | 0,335a |
| Sexo femenino (n; %) | 30; 81,1 | 35; 70 | 27; 67,5 | 0,364b |
| Sin estudios (n; %) | 19; 51,4 | 29; 58 | 26; 65 | 0,478b |
| Años escolaridad (mediana [Q1-Q3]; [rango]) | 8 [6-8]; [2-13] | 8 [6-8]; [0-17] | 7 [4-8]; [0-16] | 0,189c |
| Genotipo ApoE ¿4+(n; %; muestra evaluada) | 20; 57,1; 35 | 24, 52,2; 46 | 11, 32,4; 34 | 0,089b |
| Evaluación clínica | ||||
| MMSE inicial (media ± DE) | 20,7 ± 3,8 | 18,7 ± 3,8 | 17,8 ± 4,6 | 0,009a |
| CAMCOG-R inicial (media ± DE) | 62,0 ± 12,0 | 54,4 ± 11,3 | 53,0 ± 14,7 | 0,004a |
| RDRS-2 (media ± DE) | 26,9 ± 6,3 | 30,0 ± 9,0 | 29,9 ± 8,7 | 0,164a |
| NPI-Q gravedad (mediana; [Q1-Q3]) | 5; [2,5-9] | 7; [3,75-10] | 9; [4-11] | 0,100c |
| NPI-Q estrés cuidador (mediana; [Q1-Q3]) | 7; [3-11,5] | 8,5; [4-13] | 9,5; [5-15,75] | 0,283c |
| Zarit (media ± DE) | 30,3 ± 16,8 | 32,8 ± 15,0 | 29,5 ± 20,4 | 0,635a |
| CDR (n; %) | ||||
| CDR 1 | 30; 81,1 | 36; 72 | 31; 77,5 | |
| CDR 2 | 7; 18,9 | 12; 24 | 7; 17,5 | 0,649b |
| CDR 3 | 0; 0 | 2; 4 | 2; 5 | |
| CDR-SB (mediana; [Q1-Q3]) | 6; [4,5-8] | 6,5; [5-10] | 7,25; [5,5-9,75] | 0,137c |
CAMCOG-R: prueba cognitiva de Cambridge revisada; CDR: Clinical Dementia Rating; CDR-SB: Clinical Dementia Rating «sum of boxes»; MMSE: Mini-Mental State Examination; NPI-Q: Cuestionario del inventario neuropsiquiátrico; RDRS-2: Rapid Disability Rating Scale-2.
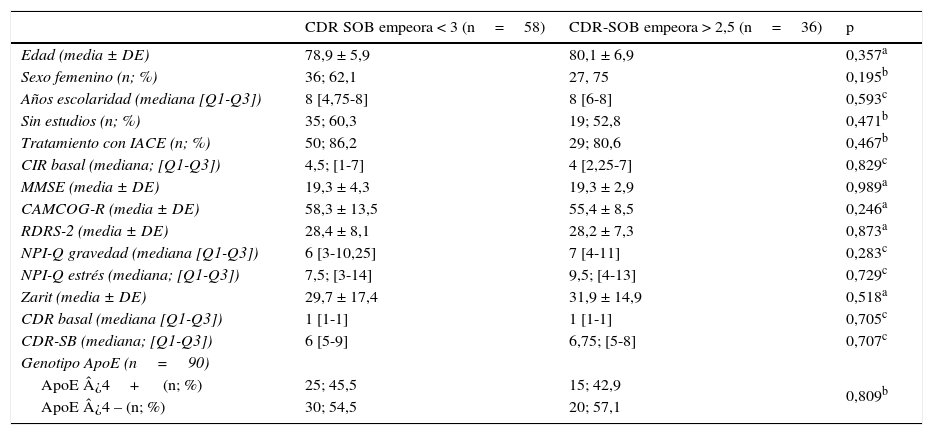
En la tabla 4 se muestran algunas características clínicas y demográficas y las puntuaciones basales en las escalas de evaluación empleadas según la evolución de la enfermedad a los 18 meses. En ese momento, 58 pacientes permanecieron estables según el criterio establecido y 36 empeoraron. La mediana del CIR fue similar en la evaluación basal de ambos grupos (4,5 [Q1-Q3: 1-7] vs. 4 [Q1-Q3: 2,25-7]; p=0,83).
Características sociodemográficas y clínicas según evolución (n=94)
| CDR SOB empeora < 3 (n=58) | CDR-SOB empeora > 2,5 (n=36) | p | |
|---|---|---|---|
| Edad (media ± DE) | 78,9 ± 5,9 | 80,1 ± 6,9 | 0,357a |
| Sexo femenino (n; %) | 36; 62,1 | 27, 75 | 0,195b |
| Años escolaridad (mediana [Q1-Q3]) | 8 [4,75-8] | 8 [6-8] | 0,593c |
| Sin estudios (n; %) | 35; 60,3 | 19; 52,8 | 0,471b |
| Tratamiento con IACE (n; %) | 50; 86,2 | 29; 80,6 | 0,467b |
| CIR basal (mediana; [Q1-Q3]) | 4,5; [1-7] | 4 [2,25-7] | 0,829c |
| MMSE (media ± DE) | 19,3 ± 4,3 | 19,3 ± 2,9 | 0,989a |
| CAMCOG-R (media ± DE) | 58,3 ± 13,5 | 55,4 ± 8,5 | 0,246a |
| RDRS-2 (media ± DE) | 28,4 ± 8,1 | 28,2 ± 7,3 | 0,873a |
| NPI-Q gravedad (mediana [Q1-Q3]) | 6 [3-10,25] | 7 [4-11] | 0,283c |
| NPI-Q estrés (mediana; [Q1-Q3]) | 7,5; [3-14] | 9,5; [4-13] | 0,729c |
| Zarit (media ± DE) | 29,7 ± 17,4 | 31,9 ± 14,9 | 0,518a |
| CDR basal (mediana [Q1-Q3]) | 1 [1-1] | 1 [1-1] | 0,705c |
| CDR-SB (mediana; [Q1-Q3]) | 6 [5-9] | 6,75; [5-8] | 0,707c |
| Genotipo ApoE (n=90) | |||
| ApoE ¿4+ (n; %) | 25; 45,5 | 15; 42,9 | 0,809b |
| ApoE ¿4 – (n; %) | 30; 54,5 | 20; 57,1 |
CAMCOG-R: prueba cognitiva de Cambridge revisada; CDR: Clinical Dementia Rating; CDR-SB: Clinical Dementia Rating «sum of boxes»; MMSE: Mini-Mental State Examination; NPI-Q: Cuestionario del inventario neuropsiquiátrico; RDRS-2: Rapid Disability Rating Scale-2.
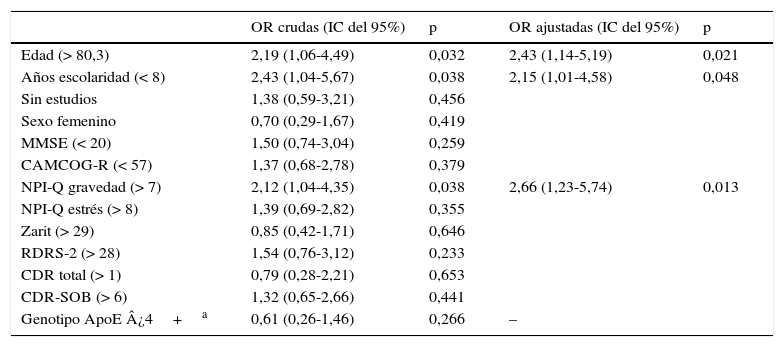
En la tabla 5 se muestra el análisis de factores asociados a anosognosia en toda la población evaluada (variable dependiente CIR ≥ 5). La edad avanzada (OR 2,43 para edad superior a 80,3 años), los años de escolaridad (OR 2,15 para menos de 8 años) y la puntuación de NPI-Q subescala de gravedad (OR 2,7 para puntuación mayor a 7) fueron incluidas en el modelo final como variables predictoras de anosognosia.
Análisis de factores de riesgo de anosognosia (variable dependiente: CIR ≥ 5 en evaluación basal), n=127
| OR crudas (IC del 95%) | p | OR ajustadas (IC del 95%) | p | |
|---|---|---|---|---|
| Edad (> 80,3) | 2,19 (1,06-4,49) | 0,032 | 2,43 (1,14-5,19) | 0,021 |
| Años escolaridad (< 8) | 2,43 (1,04-5,67) | 0,038 | 2,15 (1,01-4,58) | 0,048 |
| Sin estudios | 1,38 (0,59-3,21) | 0,456 | ||
| Sexo femenino | 0,70 (0,29-1,67) | 0,419 | ||
| MMSE (< 20) | 1,50 (0,74-3,04) | 0,259 | ||
| CAMCOG-R (< 57) | 1,37 (0,68-2,78) | 0,379 | ||
| NPI-Q gravedad (> 7) | 2,12 (1,04-4,35) | 0,038 | 2,66 (1,23-5,74) | 0,013 |
| NPI-Q estrés (> 8) | 1,39 (0,69-2,82) | 0,355 | ||
| Zarit (> 29) | 0,85 (0,42-1,71) | 0,646 | ||
| RDRS-2 (> 28) | 1,54 (0,76-3,12) | 0,233 | ||
| CDR total (> 1) | 0,79 (0,28-2,21) | 0,653 | ||
| CDR-SOB (> 6) | 1,32 (0,65-2,66) | 0,441 | ||
| Genotipo ApoE ¿4+a | 0,61 (0,26-1,46) | 0,266 | – |
Variables incluidas en el modelo de regresión logística: edad, años de escolaridad, NPI-Q gravedad y genotipo ApoE ¿4+.
Un aspecto prioritario en el análisis de la frecuencia de anosognosia en poblaciones con EA es el instrumento de evaluación empleado, dado que no existe una herramienta bien establecida o reconocida para este fin23. La evaluación de la anosognosia en personas con demencia puede realizarse con distintos métodos: basados en escalas clínicas, basados en cuestionarios, basados en la ejecución de diferentes test, métodos fenomenológicos y métodos multidimensionales24. Las técnicas más utilizadas hasta ahora han sido el juicio clínico en entrevistas estructuradas (escalas clínicas) y el análisis de la discrepancia entre el paciente y el cuidador ante un mismo cuestionario23,25. Aunque analiza pocas dimensiones y es un instrumento simple, en nuestro estudio decidimos emplear una escala clínica sencilla y rápida, con aceptables parámetros de fiabilidad. La prevalencia de conciencia alterada de enfermedad o anosognosia (CIR mayor o igual a 3) fue del 71% en nuestra población, lo que representa cifras más elevadas que las obtenidas en otros estudios con distintas herramientas de medición, que hace que sean difícilmente comparables. En trabajos previos, las cifras de prevalencia oscilan entre el 20 y el 68%1,10-12,25–27. Algunos se han centrado en la descripción de este síntoma en EA leve. Orfei et al., en un estudio realizado en deterioro cognitivo leve amnésico y EA leve, encontraron una tasas de anosognosia del 3 y el 42%, respectivamente28. Kalbe et al., en un trabajo previo en pacientes con puntuaciones en el MMSE ≥ 24, describieron una tendencia significativa a infraestimar los déficits cognitivos en los sujetos con demencia leve por EA en comparación con los pacientes con deterioro cognitivo leve29.
La principal característica diferenciadora del estudio DEMDIAG es que está ligado intrínsecamente a una situación concreta: el momento en el que se realiza el diagnóstico de la EA. Esta circunstancia puede tener importantes connotaciones prácticas dado que supone el primer contacto especializado con el paciente y su proceso, y puede contribuir a una primera aproximación pronóstica si se detectan factores asociados a una evolución más agresiva de la enfermedad. Este aspecto, sin duda, justifica la realización de estudios en el momento del diagnóstico. Lógicamente, está muy influido por las características de la asistencia sanitaria (modelo empleado, diferencias territoriales, facilidad de acceso al médico especialista), factores culturales y sociales (reconocimiento de los síntomas, repercusión global, antecedentes de EA en el entorno) y clínicos (síntomas de inicio, presencia de síntomas conductuales, comorbilidades). En nuestro estudio, casi todos los pacientes fueron diagnosticados en estadios leves a moderados (CDR 1 y 2, media de MMSE 19), con una edad media de 79 años y una mediana del retraso entre los primeros síntomas y el diagnóstico de 25 meses. Estas cifras son muy similares a las del estudio observacional EACE, extensa evaluación en consultas de neurología y geriatría realizada recientemente en España en ese mismo momento «evolutivo» de la EA30. Por este motivo, pueden acercarse a la «realidad» de la EA en el momento del diagnóstico en nuestro país.
El estudio DEMDIAG aporta además una visión prospectiva de la evolución de la enfermedad en los primeros 18 meses tras el diagnóstico. En los análisis se empleó como criterio de progresión un incremento en la CDR-SB mayor o igual a 3 puntos en ese periodo. El incremento anual en esta escala es 1,9 en pacientes con CDR basal de 1, según los resultados de un extenso estudio longitudinal reciente, siendo mayor en pacientes más ancianos y con alelo ApoE ¿422. Recientemente, teniendo en cuenta sus propiedades psicométricas, se ha propuesto la CDR-SB como medida evolutiva primaria en ensayos clínicos en EA31. En nuestra serie, aunque empeoró significativamente la puntuación de todas las escalas evaluadas entre las 2 evaluaciones, solo cumplió el criterio de progresión el 38% de los pacientes. La puntuación basal del CIR fue similar entre el grupo que permaneció estable y el que empeoró, por lo que la anosognosia no parece estar asociada a mayor riesgo de progresión clínica, al menos en los meses siguientes al diagnóstico. Apenas existen investigaciones previas con carácter prospectivo que evalúen este aspecto de la enfermedad. Starkstein et al. describen un incremento significativo en la frecuencia de anosognosia en el seguimiento de una serie de 62 pacientes con EA. Los sujetos con anosognosia grave mostraron una mayor duración de la enfermedad32.
El análisis bivariable puso de manifiesto una clara asociación entre la falta de conciencia de enfermedad y un mayor deterioro cognitivo. Además, las puntuaciones en los test cognitivos y las escalas globales empeoraron de forma paralela al grado de anosognosia. Estos hallazgos ya han sido detectados en otros estudios previos1,6,11,12,33,34. En cambio, no apreciamos diferencias en otras variables como el sexo, la edad o el nivel de estudios que sí han sido publicadas previamente7,11,12,35. Tampoco detectamos asociación con peor estado funcional o mayor carga del cuidador, aspectos que sí se han relacionado con este síntoma en otros trabajos8,9,12,36. De forma llamativa, el grado de anosognosia fue significativamente menor en los pacientes con genotipo ApoE ¿4 positivo. Cualquier intento de explicación a este fenómeno sería meramente especulativo.
El análisis multivariable identificó como variables predictoras de anosognosia una edad más avanzada, un menor grado de escolaridad y mayor afectación en la esfera de la conducta. La información de estudios previos relativos a estas variables muestra datos discrepantes. Clare et al. describieron el efecto contrario en relación con la edad, mayor anosognosia en los pacientes más jóvenes37. Por el contrario, Aalten et al. y Turro-Garriga et al. han descrito la asociación de una edad más avanzada con anosognosia más intensa12,38, de forma similar a nuestro trabajo. En relación con la escolaridad, se ha relacionado una menor reserva cognitiva, midiéndola en forma de educación, tipo de ocupación y capacidad lectora, con mayores grados de anosognosia39. Por otro lado, el efecto de los trastornos de conducta ha sido evaluado recientemente por Horning et al. en 107 pacientes con EA probable. Como cabría esperar, una buena conciencia de enfermedad se asoció a depresión y ansiedad, incluso después de controlar la variable de rendimiento cognitivo. En cambio, la anosognosia se asoció a mayores niveles de apatía40.
El estudio DEMDIAG tiene algunas limitaciones. En primer lugar, el número de pacientes reclutados y las pérdidas en el seguimiento, sobre todo de los pacientes más ancianos. El análisis previo de fiabilidad de la escala CIR no fue óptimo, especialmente en la concordancia intraobservador (test-retest). La estratificación de los pacientes según el resultado de la escala no deja de ser un método artificial. El criterio de progresión en la escala CDR-SB ha podido ser estricto, teniendo en cuenta la edad media en la evaluación basal y la frecuencia del alelo ApoE ¿4. Por último, la menor proporción de portadores de este alelo en el grupo con anosognosia no permite descartar la posible inclusión de demencias no Alzheimer en este grupo. En cualquier caso, consideramos que la principal limitación es la que impone la evaluación de un síntoma fluctuante y complejo, tanto en sus distintas dimensiones como en su magnitud, sin olvidar su estrecha relación con la percepción de una tercera persona, el cuidador.
Los resultados de nuestro estudio confirman que la anosognosia es un síntoma de elevada prevalencia en la EA, ya presente en el momento del diagnóstico en la mayoría de las ocasiones. Sin embargo, el grado de conciencia de enfermedad no parece influir en la evolución global de la enfermedad tras el diagnóstico. Una mejor atención a este síntoma tan frecuente en la EA podría contribuir a mejorar la adherencia a los tratamientos, de la demencia u otras comorbilidades y, sobre todo, a prevenir conductas de riesgo de los pacientes.
FinanciaciónEl estudio DEMDIAG recibió financiación pública por parte de la Gerencia de Salud de Castilla y León, expediente GRS 556/A/10.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de interés.
Los autores desean agradecer la colaboración en la selección de los pacientes a todos los miembros de las Secciones de Neurología del Complejo Hospitalario de Segovia y el Hospital Universitario Río Hortega de Valladolid.
Este trabajo fue presentado de forma parcial en sendas comunicaciones orales en la LXV Reunión Anual de la SEN en Barcelona en 2013 y la LXVI Reunión Anual de la SEN en Valencia en 2014.