El ictus y la fibrilación auricular (FA) son una verdadera epidemia vascular, y sus consecuencias son catastróficas. La complicación más común y devastadora de la FA es el ictus.
DesarrolloEl diagnóstico etiológico correcto del ictus es esencial para poder realizar una prevención adecuada. El porcentaje de ictus isquémicos criptogénicos es demasiado elevado, y es preciso mejorar la detección de la FA. La isquemia cerebral cardioembólica por FA es prevenible, pero la inercia médica, la falta de adherencia del paciente y los problemas de los anticoagulantes orales antagonistas de la vitamina K hacen que muchos pacientes con FA estén en riesgo de sufrir una isquemia cerebral.
ConclusionesLos relevantes avances recientes con fármacos como la dronedarona y el dabigatrán abren una esperanza real para mejorar su prevención y pronto se reflejarán en las guías terapéuticas de prevención y, por lo tanto, los neurólogos debemos conocerlos.
Stroke and atrial fibrillation (AF) are a real vascular epidemic, and the consequences are disastrous. The most common complication of AF is stroke.
BackgroundThe correct aetiological diagnosis of stroke is essential for adequate prevention. The percentage of cryptogenic ischaemic strokes is far too high and the detection of AF needs to be improved. Cardio-embolic cerebral ischaemia due to AF is preventable, however due to medical inertia, the lack of compliance by the patient, and the problems with oral vitamin K antagonist anticoagulants, means that many patients with AF are at risk of suffering from a stroke.
ConclusionsThe significant recent advances with drugs such as dronedarone and dabigatran, provide real hope for an improvement in its prevention, and for this reason neurologists must know about them.
Las enfermedades vasculares son una verdadera epidemia. De ellas, el ictus y la fibrilación auricular (FA) son de gran relevancia por sus consecuencias humanas y sociales. Ambas son prevenibles y tratables, y estamos de enhorabuena debido a los importantes avances del último año relacionados con la prevención del ictus cardioembólico debido a la FA.
El ictus continúa siendo la segunda causa de muerte en España, tras la cardiopatía isquémica, y la primera causa en la mujer, según datos del año 2007, con un total de 33.034 defunciones1.
Pero quizá esto no sea lo peor; lo peor son los pacientes dependientes o dementes tras un ictus. El ictus es, con diferencia, la causa principal de hospitalización neurológica y una de las que más gasto sanitario consumen (4%)2, tanto durante la fase aguda como posteriormente, ya que es la principal causa de discapacidad en el adulto (hasta el 53% de los pacientes quedan con distinto grado de dependencia) y la segunda causa de demencia (un 30-50% de los pacientes presentan deterioro cognitivo)3.
Más de 117.000 pacientes ingresaron en 2008 en los hospitales públicos españoles por un ictus o un ataque isquémico transitorio (AIT) como diagnóstico principal al alta4.
La FA es una verdadera epidemia mundial. Se estima que en Europa Occidental hay 4,5 millones de pacientes con FA, y esta cifra se puede triplicar o cuadriplicar para 20505. La prevalencia estimada es del 3,8% en mayores de 60 años y del 9% en mayores de 80 años6.
Las personas mayores de 40 años tienen un riesgo del 25% (1/4) de sufrir FA a lo largo de la vida7.
La etiología del ictus: importancia de la FATras la hipertensión arterial (HTA), la FA es el factor de riesgo (FR) causal más importante, lo que, junto con diabetes mellitus, sedentarismo y tabaquismo, supone los 2/3 de los primeros ictus8. La FA es la enfermedad causal más importante del ictus cardioembólico; el riesgo de ictus es independiente del tipo basal de FA (de novo, paroxística, persistente, permanente) o flutter9.
La FA incrementa el riesgo de ictus de 4 a 5 veces10. La tasa media anual de ictus isquémico en pacientes con FA no valvular es del 5%, de 2 a 7 veces más que los que no la padecen, y se incrementa a más del 23% en mayores de 80 años10.
Es un FR independiente de mayor gravedad del ictus isquémico, mayor recurrencia y mortalidad, y mayor dependencia11–13. Tras un ictus cardioembólico la mortalidad a los 2 años es del 45%14, y a los 5 años es del 80%, y con un riesgo de ictus recurrente del 32%15.
El ictus asociado a FA tiene un riesgo de dependencia (encamamiento) 2,2 veces más que por otros factores16, y el riesgo de ictus persiste incluso cuando la FA es asintomática17, así que la complicación más común y devastadora de la FA es el ictus.
Se calcula que la FA es causa del 20% de todos los ictus isquémicos18. El problema es que esta cifra muy probablemente sea inferior a la real, porque la etiología del ictus (aterotrombótico, cardioembólico, de pequeño vaso) no se investiga correctamente. En el estudio español DIAPRESIC19 se demostró que el 46% de los pacientes con infarto cerebral no tenían diagnóstico etiológico, a sólo el 25% se le realizó estudio con ecocardiograma transtorácico y sólo al 4% estudio Holter, de ahí que la series den al menos un 30% de ictus criptogénico9, por estudio incompleto19.
Se puede sospechar un origen cardioembólico de la isquemia cerebral cuando clínicamente es de comienzo súbito con déficit máximo desde el inicio, cuando los déficit son de localización cortical (hemianopsia, negligencia, afasia), en algunos casos disminuye la conciencia al inicio o regresan los síntomas rápidamente. La neuroimagen (TC/RM) es sospechosa cuando se afectan varios territorios de manera simultánea o secuencial o hay transformación hemorrágica. La neurosonología o angiografía cerebral es sospechosa cuando hay un trombo móvil carotídeo, una recanalización precoz de un vaso intracraneal ocluido o se observan microembolias en las dos arterias cerebrales medias20.
Pero la sospecha no es suficiente y hay que demostrar una fuente cardioembólica, pues la seguridad del tratamiento con anticoagulación oral, que es claramente superior a la antiagregación plaquetaria, conlleva el riesgo de hemorragia y las guías exigen una fuente cardioembólica definida21.
Una investigación rigurosa de las posibles fuentes cardioembólicas con ecocardiografía y detección de arritmias aumenta el porcentaje de pacientes con ictus causados por FA. Por ejemplo, la monitorización Holter de 24 h puede detectar FA de novo en el 9,4% de los pacientes con ictus22. La telemetría móvil (21 días) detecta rachas de FA asintomáticas en el 23% de los pacientes con infarto cerebral o AIT criptogénico23. Un estudio que analiza la detección de FA y flutter auricular de novo muestra porcentajes diferentes (2,5-7,7%), debido a que los estudios analizados no eran uniformes, tenían diferentes tiempos de inicio de la monitorización tras el ictus y se utilizaban diferentes tipos de monitorización y diferente definición de FA24.
De los cerca de 117.000 pacientes que ingresaron en 2008 en los hospitales públicos españoles por ictus o AIT4, unos 35.000 son ictus o AIT recurrentes, si extrapolamos la incidencia del estudio IBERICTUS25.
Las causas de la recurrencia del ictus son la inercia médica, la adherencia del paciente (cumplimiento y persistencia), lo que conlleva un control inadecuado de la modificación de los estilos de vida y de los factores de riesgo vascular, la indicación o fallo del tratamiento antitrombótico, y el diagnóstico etiológico incorrecto.
El diagnóstico etiológico es fundamental si queremos realizar una prevención secundaria correcta; de lo contrario, puede ser causa de recurrencias21.
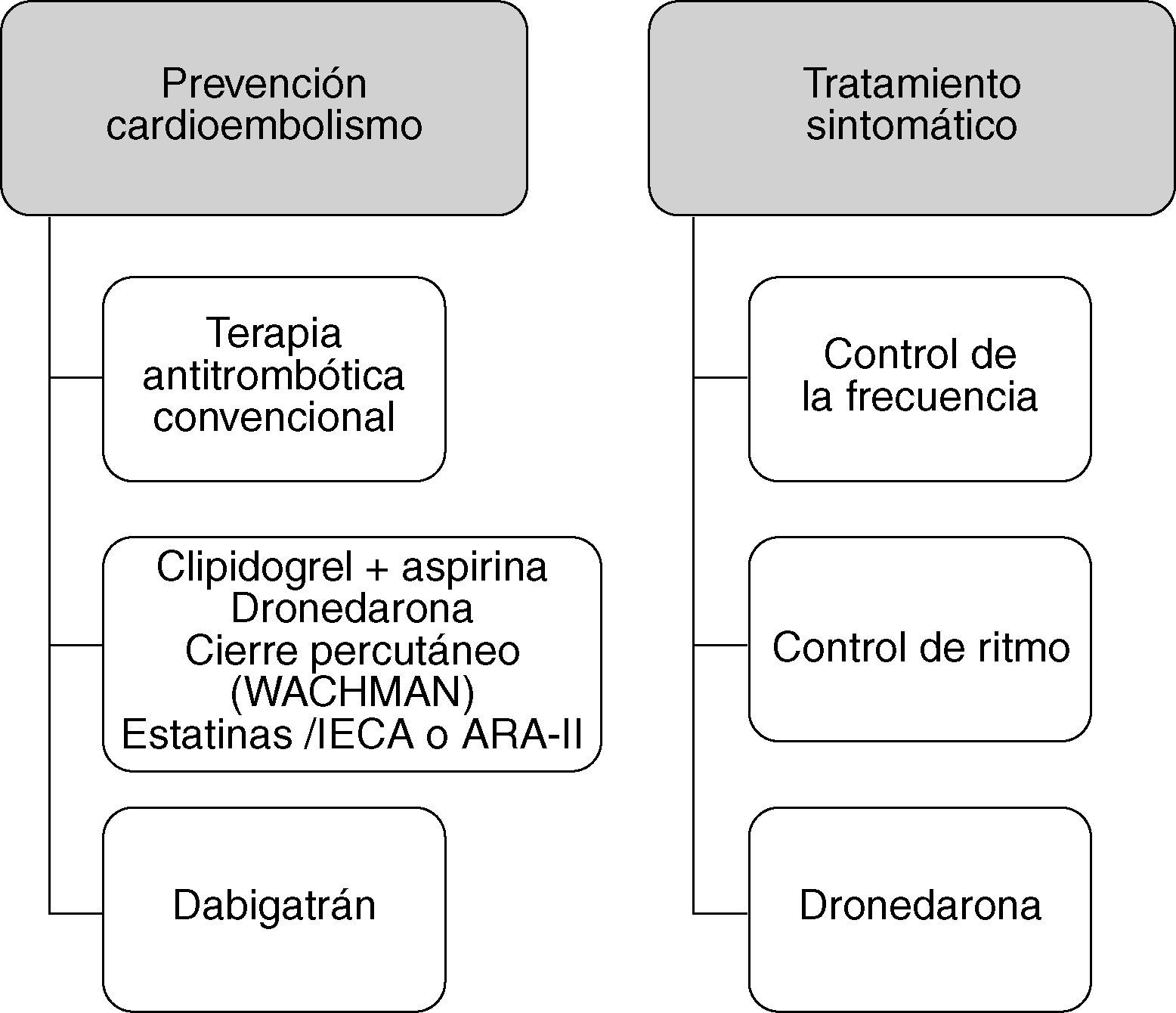
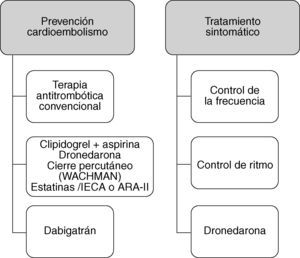
Estrategias en el tratamiento de la fibrilación auricular y el ictusEl esquema básico del tratamiento de la FA es la prevención de la cardioembolia con el tratamiento antitrombótico y el tratamiento sintomático con el control de la frecuencia y el control del ritmo26.
El tratamiento de elección para reducir el riesgo cardioembólico en la prevención del infarto cerebral o AIT asociado a FA es la anticoagulación oral (ACO), porque muestra un beneficio significativo superior a la aspirina, número de pacientes que es necesario tratar (NNT) para evitar un ictus al año —13 para la ACO y 50 para la aspirina27,28—; si la ACO está contraindicada, el tratamiento es la aspirina, como marcan las guías terapéuticas actuales21,29–31. Una posible alternativa sería el triflusal combinado con dosis bajas de anticoagulación32.
Con el tratamiento sintomático de la FA mediante el control de la frecuencia (farmacológico, ablación o marcapasos) y/o el control del ritmo (farmacológico, ablación, marcapasos, desfibriladores o cirugía), se mejora la tolerancia al ejercicio, la calidad de vida, otros síntomas relacionados con la FA y la función ventricular y se reduce la muerte súbita o de causa cardiaca26.
Pero hasta ahora los estudios que comparan control del ritmo y control de la frecuencia no muestran diferencias en cuanto al riesgo cardioembólico, incluidos ictus, mortalidad o hemorragia. Sorprendentemente, hay mayor tendencia a la tromboembolia con terapias del control del ritmo, posiblemente debido a un control temporal y a la retirada de la terapia anticoagulante33.
Los estudios AFFIRM34 y AF-CHF35 demostraron que la prevención de la FA no es necesariamente beneficiosa: la reducción de la FA no redujo la mortalidad ni el ictus. En el estudio AFFIRM34 el riesgo de ictus isquémico se relacionó con la ausencia de anticoagulación o anticoagulación a dosis infraterapéuticas. Se necesita algo más que la reducción de las recurrencias de la FA.
Los problemas de la anticoagulación oral (antagonistas de la vitamina K)Aunque evidentemente eficaces, los antagonistas de la vitamina K (dicumarínicos y warfarina) tienen importantes problemas que se evidencian en la practica clínica, lo que lleva a que estén infrautilizados o se utilicen en dosis terapéuticas inadecuadas debido a un comienzo lento en la actuación y metabolización, una ventana terapéutica estrecha, variación amplia del metabolismo con numerosas interacciones con alimentos y fármacos, polimorfismos genéticos comunes que afectan al requerimiento de dosis, la necesidad de monitorizar la coagulación de una manera regular y con frecuentes ajustes de dosis, con un coste añadido. En consecuencia, la inercia médica (indicación) y la adherencia del paciente (cumplimiento y persistencia) son pobres, lo que, junto con un cociente internacional normalizado (INR) infraterapéutico, lleva a una prevención inadecuada con nuevos ictus o recurrencias, y el intervalo de INR elevado incrementa el riesgo hemorrágico y miedo para indicar la ACO.
El riesgo hemorrágico es otro grave problema de la ACO, sobre todo el riesgo de hemorragia cerebral. Este se puede minimizar conociendo los predictores de hemorragia cerebral con el tratamiento de la hipertensión arterial, y sobre todo la intensidad de la ACO36. Si se consigue una ACO adecuada, INR entre 2 y 3, el riesgo de hemorragia cerebral es aceptable, con un riesgo del 0,5% anual con un NNT=200, sobre todo si se compara con el NNT=13 para evitar 1 ictus al año37.
Pero la dificultad para mantener el intervalo de INR, la accesibilidad de la monitorización, la variabilidad de los laboratorios y la percepción del riesgo de sangrado, sobre todo en los ancianos, llevan a la infrautilización de los actuales ACO.
Ejemplos de ello en la práctica diaria muestran que sólo el 15% de los pacientes tienen un INR adecuado38 y, lo que es peor, hasta el 73% de los pacientes con FA no reciben una terapia antitrombótica adecuada de manera injustificada39.
Una auditoría canadiense, en que todos los pacientes eran candidatos ideales para ACO por FA no valvular (FANV), mostró que el 60% de los pacientes que ingresaron por un primer ictus isquémico no estaba anticoagulados y, de los que la recibían, el 75% tenía un INR bajo (infraterapeútico). De los pacientes con AIT/ictus isquémico, el 40% no estaba con ACO, y de los que estaban, el 70% tenía dosis infraterapéuticas40. También se ha evidenciado una gran variabilidad en el INR entre países y centros41. La evidencia disponible indica que la falta de adhesión a la prevención secundaria de la medicación prescrita después del ictus es uno de los principales problemas. En una cohorte sueca, la utilización de warfarina disminuía en un 50% 2 años después del ictus42 y se suspendía al año en un porcentaje mucho mayor en pacientes mayores de 80 años que en los de menor edad43.
Otro mito es no utilizar ACO en el anciano con FA, cuando precisamente a esa edad el riesgo de ictus es muy superior44–46, y estudios como el BAFTA demuestran en ancianos con ictus o AIT previo y una media de edad de 82 años que la ACO es superior a la aspirina, con un riesgo hemorrágico similar47.
Estos datos y los de otros estudios similares48–50 reflejan un situación muy grave que acarrea graves consecuencias, por lo que son necesarias alternativas con un nuevo ACO ideal con efectividad similar o mayor, con mejor seguridad o igual, con dosis fija que no precise monitorización, poca interacción con comidas y fármacos, comienzo de acción y metabolización rápida y reversible y coste-efectivo; llevamos demasiados años con una prevención inadecuada del ictus cardioembólico.
Novedades en las estrategias del tratamiento de la FA y prevención del ictusRecientemente un fármaco antiarrítmico, la dronedarona, que no sólo controla el ritmo y está libre de riesgo de toxicidad de órganos, ha mostrado un impacto probado en la morbimortalidad, con una reducción del riesgo significativa en el objetivo primario (primera hospitalización por episodio vascular o muerte) del 24%51. Lo sorprendente fue un análisis posterior que demostró que la dronedarona reducía la frecuencia anual de ictus de manera significativa (el 1,19 frente al 1,79%; razón de riesgos [HR]=0,66; IC del 95%, 0,46-0,94; p=0,027), y de otros episodios combinados vasculares, esta diferencia existía a pesar de la igual proporción de utilización de fármacos en ambos grupos: bloqueadores beta, inhibidores de los canales del calcio, inhibidores de la enzima de conversión de angiotensina (IECA), antagonistas de los receptores de la angiotensina II (ARA-II), digoxina, estatinas y anticoagulantes orales o antiagregantes (92%)52.
El fármaco dronedarona es el primer antiarrítmico que reduce el ictus, por lo que es una novedad en el manejo del ictus cardioembólico por FA que abre una vía terapéutica distinta en la prevención del ictus cardioembólico, sumando un mayor beneficio a la prevención ya obtenida con fármacos antitrombóticos, y ello probablemente debido a un mejor control del ritmo. Por lo tanto, el neurólogo no sólo debe conocer los datos, sino que además debería aprender su manejo y aplicarlo cuando esté indicado.
Cada vez hay más evidencias, como muestran algunos estudios clínicos, de que la utilización de estatinas puede prevenir la FA y sus recurrencias53,54; también el bloqueo del sistema renina-angiotensina muestra en estudios con fármacos IECA o ARA-II una reducción del riesgo de FA de novo55–57, por lo que estos fármacos, que ya se utilizan en la prevención del ictus isquémico, pueden tener un beneficio añadido al prevenir la aparición de la FA o su recurrencia.
En la mayoría de los pacientes (90%) con FANV, los trombos se localizan en la orejuela58, de modo que un posible abordaje del problema es la exclusión de la orejuela. El estudio PROTECT AF59 (WATCHMAN Left Atrial Appendage System for Embolic Protection in Patients with Atrial Fibrillation) muestra que la implantación percutánea de un dispositivo que ocluye la orejuela es posible y que puede reducir el riesgo de ictus. Este estudio de no inferioridad compara, en 707 pacientes con FA, la implantación de dispositivo WATCHMAN (n=463) frente a dosis ajustadas (INR 2-3) de warfarina (n=244). El dispositivo se implanta con éxito en el 88% de los casos, y a la mayoría se retira la warfarina 45 días después. El resultado principal (combinado de ictus, muerte inexplicable o vascular o embolia sistémica) es similar en los dos grupos. La tasa anual de ictus isquémico es baja (1,6%), posiblemente debido al bajo riesgo (la mayoría con una puntuación en la escala de riesgo CHADS2 de 1 o 2).
Las complicaciones hemorrágicas o ligadas al procedimiento son más frecuentes en el grupo del dispositivo. La más común fue efusión cardiaca en 22 pacientes (5%), que requirió pericardiocentesis o cirugía.
Los resultados del estudio son prometedores, pero no incluyó a pacientes con alto riesgo de ictus, en los que podría tener un mayor beneficio. Aunque podría ser una alternativa en estos pacientes con contraindicación absoluta a la ACO, son precisos nuevos estudios.
Recientemente el estudio ACTIVE A ha dado un paso importante en pacientes con contraindicación de la ACO. La combinación de aspirina con clopidogrel ha mostrado un claro beneficio frente aspirina en la reducción de episodios vasculares graves, especialmente ictus, con un NNT=200 para evitar un ictus mortal o discapacitante en 1 año, aunque un incremento del riesgo hemorrágico, NNT=500 para una hemorragia intracraneal añadida en 1 año60. La combinación aspirina más clopidogrel tiene un beneficio neto claro frente a aspirina y estaría indicada en pacientes con contraindicación absoluta para la ACO.
La novedad más importante es el estudio RE-LY61 (Randomized Evaluation of Long-Term Anticoagulation Therapy), lo que puede significar el ACO ideal que esperábamos con anhelo. Se trata de un inhibidor directo de la trombina a dosis fijas, que no precisa monitorización (por lo tanto, de fácil administración) y tiene pocas interacciones (inhibidores de la glucoproteína P como la amiodarona) ni efectos secundarios importantes como la hepatotoxicidad.
Es un estudio aleatorizado y ciego de no inferioridad, que reclutó a 18.113 pacientes con FA (media de edad, 71 años) y al menos otro FR de infarto cerebral, como un infarto cerebral previo o un AIT, FEVI<40%, insuficiencia cardiaca clase II-IV de la NYHA en los 6 meses previos y edad > 75 años o entre 65 y 74 años con diabetes mellitus, HTA o enfermedad coronaria.
Se compararon dosis fijas de etexilato de dabigatrán, profármaco que se convierte rápidamente a dabigatrán (110 o 150mg dos veces al día) o en modalidad de estudio no ciego con warfarina ajustada a un INR de 2-3.
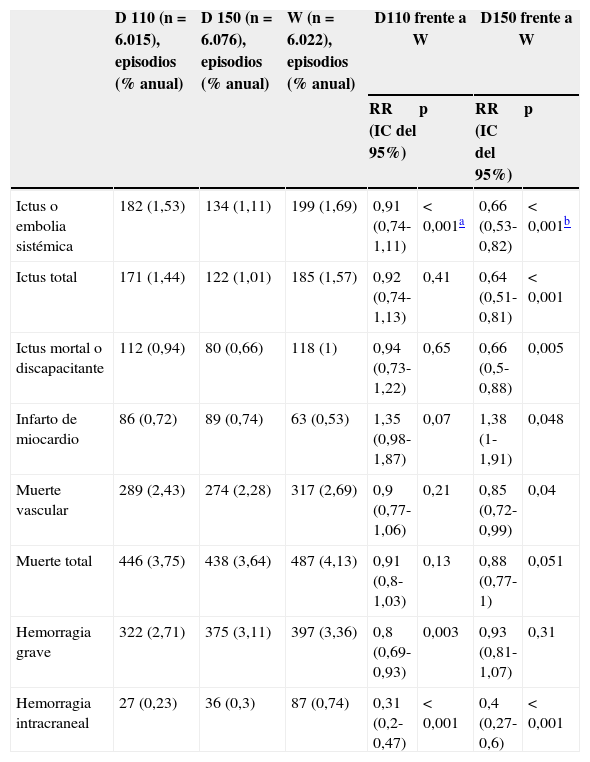
Durante un seguimiento medio de 2 años, las tasas anuales de la variable principal (ictus o embolia sistémica) fueron del 1,53% entre quienes tomaban la dosis baja de dabigatrán, el 1,11% con la dosis alta y el 1,69% entre quienes tomaban warfarina.
Los riesgos relativos frente a warfarina fueron 0,91 (0,74-1,11) para la dosis baja (p<0,001 para no inferioridad) y 0,66 (0,53-0,82) para el grupo que tomaba la dosis alta (p<0,001 para superioridad).
La mortalidad anual fue del 3,75 y el 3,64% para los grupos en dosis baja y alta, respectivamente, comparado con el 4,13% para warfarina. El riesgo relativo fue 0,91 (0,8-1,03) para la dosis baja (p=0,13) y 0,88 (0,77-1) para la dosis alta (p=0,051).
Las tasas anuales de infarto de miocardio fueron del 0,72, el 0,74 y el 0,53% para la dosis baja de dabigatrán, dosis alta de dabigatrán y warfarina respectivamente. La tendencia del riesgo fue más alta para la dosis baja de dabigatrán, en 1,35 (0,98-1,87; p=0,07) y significativamente más alta en el grupo con dosis alta, en 1,38 (1-1,91; p=0,048).
Las tasas de infarto hemorrágico fueron del 0,12% anual (p<0,001) y el 0,1% anual (p<0,001) para los grupos en las dosis baja y alta respectivamente, y el 0,38% para warfarina.
Las tasas de hemorragia grave fueron 2,71 (p=0,003 contra warfarina) para la dosis baja, 3,11 (no significativa frente a warfarina) para la dosis alta y 3,36 para warfarina (tabla 1).
Resultados del estudio RE-LY61
| D 110 (n=6.015), episodios (% anual) | D 150 (n=6.076), episodios (% anual) | W (n=6.022), episodios (% anual) | D110 frente a W | D150 frente a W | |||
| RR (IC del 95%) | p | RR (IC del 95%) | p | ||||
| Ictus o embolia sistémica | 182 (1,53) | 134 (1,11) | 199 (1,69) | 0,91 (0,74-1,11) | < 0,001a | 0,66 (0,53-0,82) | < 0,001b |
| Ictus total | 171 (1,44) | 122 (1,01) | 185 (1,57) | 0,92 (0,74-1,13) | 0,41 | 0,64 (0,51-0,81) | < 0,001 |
| Ictus mortal o discapacitante | 112 (0,94) | 80 (0,66) | 118 (1) | 0,94 (0,73-1,22) | 0,65 | 0,66 (0,5-0,88) | 0,005 |
| Infarto de miocardio | 86 (0,72) | 89 (0,74) | 63 (0,53) | 1,35 (0,98-1,87) | 0,07 | 1,38 (1-1,91) | 0,048 |
| Muerte vascular | 289 (2,43) | 274 (2,28) | 317 (2,69) | 0,9 (0,77-1,06) | 0,21 | 0,85 (0,72-0,99) | 0,04 |
| Muerte total | 446 (3,75) | 438 (3,64) | 487 (4,13) | 0,91 (0,8-1,03) | 0,13 | 0,88 (0,77-1) | 0,051 |
| Hemorragia grave | 322 (2,71) | 375 (3,11) | 397 (3,36) | 0,8 (0,69-0,93) | 0,003 | 0,93 (0,81-1,07) | 0,31 |
| Hemorragia intracraneal | 27 (0,23) | 36 (0,3) | 87 (0,74) | 0,31 (0,2-0,47) | < 0,001 | 0,4 (0,27-0,6) | < 0,001 |
D 110: dabigatrán 110mg; D 150: dabigatrán 150mg; W: warfarina.
El número de pacientes que tuvo que dejar dabigatrán fue significativamente mayor, quizá debido a la dispepsia, el principal efecto secundario que ocurrió más frecuentemente con dabigatrán (el 11,8 y el 11,3% por año, respectivamente) que con warfarina (el 5,8% por año).
En el estudio se incluyó a 3.623 pacientes con historia de ictus o AIT previo (aproximadamente un 20%). Los resultados fueron similares al estudio general para ictus o embolia sistémica (tasa anual para warfarina del 2,74%; dabigatrán 110 mg, del 2,32%; dabigatrán 150 mg, del 2,07%), sin diferencias significativas para los pacientes con o sin historia de ictus/AIT previo (p=0,34), aunque con unos márgenes de confianza amplios. Si hubo una diferencia significativa con menor riesgo de hemorragia intracraneal e ictus hemorrágico para dabigatrán a dosis bajas y altas. El tamaño del subgrupo no tiene poder estadístico para demostrar superioridad frente a warfarina62.
Las dudas sobre el estudio son que el diseño era abierto, pero era ciego para los evaluadores del estudio, el seguimiento corto (2 años), la reducción de riesgo absoluto pequeña, la falta de antídoto y el ligero incremento del infarto de miocardio. Estas objeciones potenciales se ven superadas por el perfil de fármaco, sobre todo por elevado número de pacientes con FA que en la actualidad no tienen un tratamiento adecuado por los problemas con los antagonistas de la vitamina K.
Las dosis bajas de dabigatrán (eficacia similar con menor riesgo hemorrágico que la warfarina) estarían indicadas en pacientes con mayor riesgo hemorrágico38 y factores favorecedores como la edad muy avanzada, la HTA mal controlada, la historia de hemorragia cerebral previa, neuroimagen (TC/RM) de leucoaraiosis o microhemorragias cerebrales e INR altos.
Las dosis altas de dabigatrán (eficacia superior con riesgo hemorrágico similar que la warfarina) en pacientes con mayor riesgo cardioembólico, además los pacientes con problemas con INR infraterapeútico o no anticoagulados injustificadamente, o por problemas con los antagonistas de la vitamina K. En el caso de pacientes con isquemia cerebral previa, no existe una dosis definida, aunque se podrían tomar las mismas consideraciones generales.
Según estos datos, es muy probable que se apruebe la indicación del dabigatrán para la prevención del ictus, con lo que muchas personas con FA estarán mejor controladas con régimen terapéutico adecuado, los médicos implementaremos mejor las indicaciones y los pacientes mejorarán la adherencia, con lo que se evitarán muchos ictus y sus consecuencias.
Finalmente, los nuevos fármacos anticoagulantes en estudio, como los inhibidores del factor Xa rivaroxaban, apixaban o edoxaban u otros, podrían añadirse al arsenal de la terapia antitrombótica de la FA63.
Alarma pensar en las consecuencias de millones de personas con FA con una prevención o diagnóstico del ictus inadecuado, pero los avances descritos abren un panorama de esperanza.
Puntos Clave- –
Es necesario realizar un diagnóstico etiológico adecuado de la isquemia cerebral y aumentar la detección de la fibrilación auricular en el ictus isquémico, con base en una eficacia de prevención con fármacos antitrombóticos muy diferente entre antiagregantes y anticoagulantes.
- –
Dronedarona es el primer fármaco antiarrítmico que reduce la mortalidad vascular y el ictus más allá de la terapia estándar, y los neurólogos debemos implicarnos en su indicación y su manejo.
- –
Las estatinas y el bloqueo del sistema renina-angiotensina pueden mejorar el manejo de los pacientes con fibrilación auricular e ictus, al reducir la fibrilación auricular de novo o sus recurrencias.
- –
Si la anticoagulación oral está contraindicada, la combinación de clopidogrel y aspirina puede ser una alternativa aceptable. También el dispositivo WATCHMAN puede ser una alternativa en pacientes muy seleccionados con contraindicación absoluta para la anticoagulación oral.
- –
El dabigatrán, inhibidor directo de la trombina, es un fármaco eficaz y seguro en la prevención del ictus cardioembólico por fibrilación auricular, que además minimiza los problemas de los antagonistas de la vitamina K, a los que muy probablemente desplazará.
- –
Los neurólogos somos cruciales en la implementación de las recomendaciones de la anticoagulación oral en la prevención de la isquemia cerebral cardioembólica, a cualquier edad, para evitar sufrimiento y dependencia, por lo que tenemos una gran responsabilidad para mejorar el pronóstico de millones de pacientes con isquemia cerebral y fibrilación auricular, en la actualidad con tratamientos preventivos inadecuados.
- –
Es necesario modificar las guías según estos avances; el panorama sigue abierto (fig. 1).