Los episodios de congelación de la marcha (CDM) normalmente aparecen durante el “off” y en general mejoran con tratamiento dopaminérgico a la par que mejoran otros síntomas parkinsonianos.
Pacientes y métodosPresentamos un grupo de 10 pacientes con enfermedad de Parkinson de larga evolución con episodios de CDM. Todos los pacientes presentaban las complicaciones motrices habituales tras años de enfermedad y tratamiento. En todos los pacientes, el síntoma más incapacitante era la aparición de episodios de CDM (freezing) durante el “on”. Los pacientes fueron sometidos a un test agudo de apomorfina por vía subcutánea; se consideró dosis eficaz la que inducía la reducción de al menos un 60% en la escala de motricidad de la UPDRS.
ResultadosLa UPDRS-III basal fue de 61,3±4,7, que se reducía a 21±4,3 tras la inyección de apomorfina s.c. a una dosis media de 5,5mg (intervalo, 3-7mg). Durante el “on” inducido por la inyección s.c. de apomorfina mejoraron los parámetros de la marcha relacionados con la bradicinesia, así como el tapping, también en extremidades inferiores, pero los episodios de CDM no variaron de forma significativa.
ConclusionesPresentamos un grupo de 10 pacientes con enfermedad de Parkinson de larga evolución con episodios de CDM que persistían durante el “on”, sin respuesta al estímulo dopaminérgico.
Freezing of gait unresponsive to dopaminergic stimulation in patients with severe Parkinsonism. The freezing of gait episodes (FOG) normally appear during the “off” period and generally improve with dopaminergic stimulus, at the same time as improving other Parkinsonian symptoms.
Patients and methodsWe report a group of 10 patients with severe Parkinson’s disease. All patients suffered motor fluctuations, dyskinesias and episodes of FOG during the “on” and “off” state. The patients received a subcutaneous apomorphine bolus, without other dopaminergic medication; an effective dose of apomorphine was considered as one that induced a reduction of at least a 60% in the UPDRS motor scale.
ResultsThe baseline motor UPDRS was 61.3±4.7, which dropped to 21±4.3 after the apomorphine injection. The mean dose of apomorphine was 5.5mg (3-7mg). The bolus of apomorphine improved the parameters of the gait related to bradykinesia and the tapping tests of the limbs, but the episodes of FOG did not vary significantly between the “off” and “on” state.
ConclusionsWe present a group of 10 patients with freezing of gait episodes that did not improve with treatment and persisted during the “on” period induced by dopaminergic stimulus with apomorphine.
La marcha y la estabilidad son dos aspectos que condicionan considerablemente la calidad de vida de los pacientes con enfermedad de Parkinson (EP)1. En el control de la marcha, en general se considera que intervienen tres niveles funcionales que actúan de manera integrada: sistema osteomuscular y neuromuscular, estructuras subcorticales del sistema nervioso central y estructuras corticales (sistemas aferente, integrativo y eferente)2. El sistema nervioso central utiliza e integra la información que recibe a través del sistema aferente y establece los planes motores necesarios para mantener la estabilidad y la postura y para desarrollar la marcha con un patrón motor y una velocidad adecuados, para lo que son fundamentales estructuras subcorticales como ganglios basales y cerebelo y las conexiones entre lóbulo frontal y estructuras subcorticales3. La alteración de estructuras subcorticales origina los trastornos de la marcha en la EP; así, la escasez de movimientos, pasos cortos, disminución o ausencia del braceo, anteflexión del tronco, etc., configuran la típica marcha parkinsoniana4–6. La alteración de la marcha en la EP que llamamos freezing, bloqueo de la marcha o congelación de la marcha (CDM) empezó a describirse de forma más explícita a partir de 1970, cuando el beneficio motor conseguido con la levodopa en otros síntomas de la EP no era tan evidente para este peculiar trastorno7. Los episodios de congelación de la marcha, en los que el paciente tiene la sensación de “quedar con los pies pegados en el suelo”, se caracterizan por su aparición episódica (al inicio de la marcha, con los obstáculos, con el giro, etc.) y su breve duración8. Con frecuencia, aunque no siempre, se asocian a festinación de la marcha con pasos sucesivamente más rápidos y cortos, con desplazamiento anterógrado incontrolado del centro de gravedad9,10. Los bloqueos de la marcha pueden ocurrir al inicio de la EP, pero siempre de forma leve; tanto es así que, en caso contrario, si son intensos de forma precoz, cuestionan el diagnóstico de EP idiopática y se debería considerar otro tipo de parkinsonismos11,12. En la mayoría de los enfermos observamos este fenómeno tras años de enfermedad y tratamiento, cuando sufren también complicaciones motrices tras el tratamiento crónico, como fluctuaciones motrices y discinesias13. Los bloqueos de la marcha suelen aparecer durante el “off” coincidiendo con el empeoramiento de otros síntomas motores, pero pueden aparecer también durante el “on”, cuando el paciente tiene una movilidad aceptable14. Curiosamente, no siempre la severidad de otros síntomas parkinsonianos se corresponde con la severidad de los bloqueos de la marcha15.
Presentamos un grupo de 10 pacientes con EP de larga evolución, con episodios muy incapacitantes de bloqueos de la marcha que no se modificaron tras estímulo dopaminérgico pese a la evidencia de mejoría de la acinesia en extremidades inferiores tras dicho estímulo.
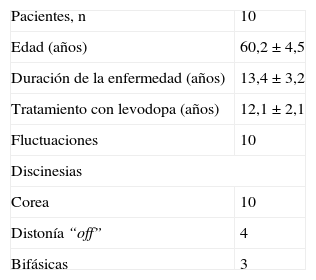
Pacientes y métodoLas características de los pacientes se recogen en la tabla 1. Estudiamos a 10 pacientes con una media de edad de 60,2 ± 4,5 años y una EP de larga evolución (13,4 ± 3,2 años), tratados con levodopa (LD) durante una media de 12,1 ± 2,1 años. Los pacientes estaban también en tratamiento con bromocriptina, pramipexol o ropinirol, y en 4 de ellos se combinaban con rasagilina. Todos los pacientes presentaban las complicaciones motrices habituales tras años de enfermedad y tratamiento, en forma de fluctuaciones motrices (8 pacientes, deterioros de fin de dosis y 2 fluctuaciones más complejas on-off) y discinesias (los 10 pacientes sufrían corea de beneficio de dosis, 4 distonía off y 3 discinesias bifásicas). En todos los pacientes el síntoma más incapacitante era la aparición de episodios de CDM (freezing) durante el “on”. Ninguno de los pacientes presentaba anomalías significativas en la RM craneal.
Tras el correspondiente consentimiento de los pacientes para participar en el estudio, éstos fueron sometidos a un test agudo de apomorfina por vía subcutánea; recibieron la dosis de apomorfina a primera hora de la mañana en situación “off”, después de transcurrida la noche sin haber tomado medicación, y se consideró dosis eficaz la que inducía la reducción de al menos un 60% en la escala de motricidad de la UPDRS. El test se repitió en días sucesivos hasta obtener la dosis eficaz para cada paciente. Durante los 3 días previos al estudio, los pacientes recibieron domperidona por vía oral, 30mg/día en tres dosis.
Los pacientes cuantificaban el tiempo “on” y “off” durante 1 semana antes del estudio rellenando las correspondientes fichas diarias de tiempo “on” y “off” (mejor y peor movilidad). Durante el estudio, para la valoración de los pacientes se utilizó la parte motora de la UPDRS (puntuando extremidades derechas e izquierdas, siendo 108 la máxima puntuación) y un tapping test (tiempo requerido para tocar 50 veces dos puntos separados 50cm en las extremidades superiores y 25cm en las extremidades inferiores). El freezing se cuantificó de 0 (ausente) a 4 (severa interferencia con la marcha). Esta valoración de la motricidad se hizo en situación basal y después durante el beneficio motor inducido por la inyección de apomorfina por vía subcutánea.
Para el estudio de la significación estadística de los resultados (p ≤ 0,05) se utilizó la prueba de la t de Student.
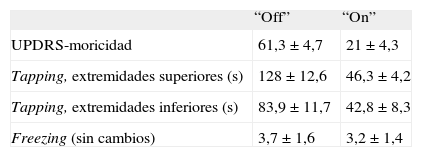
ResultadosLos pacientes tenían una media de 4,5 ± 1,3h “off” entre las 8.00 y las 22.00 con su medicación habitual. Los resultados del estudio quedan recogidos en la tabla 2.
Respuesta al tratamiento
| “Off” | “On” | |
| UPDRS-moricidad | 61,3 ± 4,7 | 21 ± 4,3 |
| Tapping, extremidades superiores (s) | 128 ± 12,6 | 46,3 ± 4,2 |
| Tapping, extremidades inferiores (s) | 83,9 ± 11,7 | 42,8 ± 8,3 |
| Freezing (sin cambios) | 3,7 ± 1,6 | 3,2 ± 1,4 |
Tapping: tiempo (s) requeridos para tocar 50 veces dos puntos separados 50cm en las extremidades superiores y 25cm para las inferiores; UPDRS: Unified Parkinson’s disease rating scale.
La UPDRS-III basal fue de 61,3 ± 4,7, que se reducía a 21 ± 4,3 tras la inyección de apomorfina s.c. a una dosis media de 5,5 (intervalo, 3–7) mg. El tapping también mejoró significativamente (p < 0,001) en las extremidades superiores (de 128 ± 12,6 a 46,3 ± 4,2s) e inferiores (de 83,9 ± 11,7 a 42,8 ± 8,3s). Durante el “on” inducido por la inyección s.c. de apomorfina mejoraron los parámetros de la marcha relacionados con la bradicinesia (incorporación de la silla, amplitud del paso, braceo, etc.), pero los episodios de CDM no variaron de forma significativa entre el “off” y el “on” (freezing, 3,2 ± 1,4 en el “off”; 3,7 ± 1,6 en el “on”).
DiscusiónPresentamos un grupo de 10 pacientes con EP de larga evolución con episodios de CDM que persistían durante el “on”, sin respuesta al estímulo dopaminérgico. Los episodios de CDM son frecuentes en pacientes con EP de larga evolución. Lamberti et al13 observaron este fenómeno en 60 pacientes de 100 parkinsonianos evaluados, y la duración de la enfermedad fue el principal factor determinante para su aparición. Del mismo modo, Giladi et al16 estudiaron consecutivamente a 172 pacientes con EP, todos ellos con un tiempo de evolución de la enfermedad de más de 5 años, y en el 53% eran evidentes los episodios de CDM. La levodopaterapia crónica y la existencia de otras complicaciones motrices (fluctuaciones y discinesias) también son factores de riesgo de que aparezca. Los episodios de CDM que aparecen durante el “off” pueden mejorar con tratamiento dopaminérgico, a la par que mejoran otros síntomas parkinsonianos, pero hay pacientes, como el grupo referido en este trabajo, en que la mejoría de la bradicinesia no se acompaña de mejoría en los episodios de congelación de la marcha. Hay autores que señalan la discordancia entre la severidad de la bradicinesia y los episodios de CDM15; de hecho, en nuestros pacientes la mejoría de la acinesia tras el estímulo dopaminérgico con apomorfina s.c. no se acompañó de mejoría en los episodios de CDM. Hace años, cuando se utilizaban dosis muy altas de LD en pacientes con EP avanzada, se observaba una mejoría de los episodios de bloqueo durante el “on” al disminuir la dosis de LD, y se consideraba que la sobrestimulación dopaminérgica era en gran medida la causa de la CDM durante el “on” en estos pacientes7,17. No es el caso de los enfermos descritos en este trabajo, que recibían una dosis de LD en ningún caso > 750mg/día y en los que el estudio se realizó tras más de 12h de haber tomado la última dosis de LD.
No se conoce bien la fisiopatología de la CDM. Aunque se asocia a la EP, la afección de la vía nigroestriada no es condición imprescindible para su aparición; así, hay una forma primaria de CDM en la que no se añaden otros síntomas o signos parkinsonianos18,19. Hay autores que señalan que los pacientes parkinsonianos en que aparece CDM tienen de fondo una alteración general en cuanto a secuencias, ritmo y simetría de movimientos durante la marcha, mucho más severa que los pacientes parkinsonianos sin este problema, y que los episodios de bloqueo son una exacerbación de este fenómeno ante determinados estímulos (inicio de la marcha, obstáculos, giros, etc.)20; el lóbulo frontal estaría muy implicado en su aparición21. Los estudios de neuroimagen funcional (tomografía por emisión positrónica [PET], resonancia magnética [RM] funcional), parecen apuntar a una afección de las vías frontocaudales predominantemente en el hemisferio derecho22, y algunos estudios implican también al lóbulo parietal, de lo que se deduce afección de la integración sensitivomotriz como parte de la génesis del problema22,23.
Durante los últimos años se está estudiando la posible implicación de la degeneración de las neuronas colinérgicas y glutamatérgicas del núcleo pedúnculo pontino, en estadios avanzados de la EP, como causa al menos parcial de los trastornos posturales y de la marcha que observamos en fases avanzadas de la EP y que no responden al tratamiento dopaminérgico24. Kuo et al25 han descrito recientemente a un paciente con infartos en ambos núcleos pedunculopontinos con CDM (frezing) como síntoma predominante.
Los estudios a nivel periférico también objetivan un patrón anómalo en la secuencia de contracción de músculos agonistas y antagonistas en las extremidades inferiores26.
Un fenómeno fascinante es la mejoría que experimentan los enfermos si utilizan pistas externas, habitualmente visuales o auditivas, para controlar los episodios de bloqueo de la marcha. En este sentido, Stern et al27 recogieron los trucos motores utilizados por 61 pacientes parkinsonianos con CDM. Los más frecuentes eran los de tipo verbal o auditivo, como marchas militares, o de tipo visual, como llegar al pie de otra persona colocada delante. Uno de nuestros pacientes era capaz de caminar por la casa al haber colocado líneas de color en el suelo e ir pisándolas. Hallet28 señala una pérdida en los automatismos motores y una alteración en los movimientos internamente inducidos en la EP en general y en el fenómeno de la CDM en particular, lo que explicaría la mejoría con las claves o señales externas27,29. Por otro lado, esta pérdida del automatismo explicaría también el empeoramiento de los bloqueos de la marcha cuando se pide al paciente que realice otra tarea simultáneamente, como contar de 7 en 7. Camicioni et al30 exploraron la marcha (tiempo necesario para caminar una distancia) en pacientes parkinsonianos con y sin CDM mientras realizaban tareas verbales, y el empeoramiento de la marcha fue mucho más acusado en pacientes parkinsonianos con CDM.
Lo que sí parece claro es que los episodios de CDM no son una mera consecuencia de la acinesia o la rigidez y, por lo tanto, la respuesta al tratamiento dopaminérgico puede no ser la misma. El conocimiento de la fisiopatología que subyace a este trastorno, fundamentalmente durante el “on”, podrá orientar el enfoque terapéutico de momento muy poco gratificante desde el punto de vista farmacológico7,8. En este sentido, estudios previos parecen indicar que el desarrollo de CDM es más frecuente en pacientes tratados con agonistas dopaminérgicos que en los tratados con LD31,32 y que la selegilina y la rasagilina podrían tener un cierto efecto beneficioso en los episodios de bloqueo de la marcha33,34. Se ha considerado que el sistema noradrenégico podría estar implicado en los trastornos de la marcha en la EP, y hay estudios que indican que el tratamiento crónico con dosis altas de metilfenidato podría beneficiar los parámetros de la marcha, incluida la CDM, en pacientes con EP avanzada35. También se ha referido un beneficio con cafeína, que actuaría como un antagonista de los receptores A2 de adenosina36. El beneficio referido inicialmente en un estudio abierto con la inyección de toxina botulínica en gemelos no se confirmó posteriormente en un estudio a doble ciego, incluso hubo más caídas en el grupo de pacientes parkinsonianos con CDM tratados con la toxina, al parecer por añadirse la debilidad muscular que este tratamiento produce37. La estimulación cerebral profunda en las dianas habituales no parece que mejore los episodios de CDM que aparecen durante el “on”38. Ya hay algún resultado esperanzador con la estimulación cerebral profunda en núcleo pedúnculo pontino39. Actualmente la rehabilitación de la marcha con la búsqueda de claves externas, con diversas estrategias adaptadas al entorno habitual del paciente, puede ser una alternativa terapéutica válida40.
PresentacionesEste trabajo se ha presentado parcialmente en la reunión anual de la Movement Disorders Society de 2008.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.