Diversas áreas cerebrales, como la corteza orbitofrontal y frontomedial, la ínsula y la amígdala, intervienen en el control del sistema nervioso autónomo sobre funciones cardiovasculares como la frecuencia cardíaca. El proceso degenerativo de la demencia frontotemporal (DFT) involucra estas estructuras anatómicas y, por tanto, podría producir síntomas cardiovasculares disautonómicos.
ObjetivoObservar si la bradicardia de origen cerebral es más frecuente en pacientes con DFT que en enfermos con deterioro cognitivo ligero o demencia de otra etiología.
Pacientes y métodoUna vez excluidos los pacientes con arritmia de origen cardíaco, se registró la frecuencia cardíaca de 258 pacientes con síntomas cognitivos (36 con DFT, 22 con enfermedad de Alzheimer, 23 con demencia vascular, 10 con otras demencias y 167 con deterioro cognitivo sin demencia).
ResultadosLa bradicardia (<60ppm) fue estadísticamente más frecuente en los pacientes con DFT. La diferencia se mantuvo significativa tras excluir a los que estaban en tratamiento con potencial efecto bradicardizante. La bradicardia fue más prevalente en la DFT conductual que en la DFT afásica, y hubo tendencia al predominio en los pacientes con mayor atrofia en el hemisferio derecho. La presión arterial sistólica de los pacientes con DFT fue inferior a la de los otros sujetos del estudio, y fue mayor la prevalencia de hipotensión sistólica (<120 y <100mmHg).
ConclusiónSe ha observado mayor frecuencia de bradicardia en los pacientes con DFT que en otros pacientes con síntomas cognitivos. Antes de considerar este dato semiológico como un signo de apoyo al diagnóstico de DFT, será necesario realizar nuevas observaciones.
Numerous regions of the brain, such as the medial frontal cortex, orbitofrontal cortex, insula, and amygdala, participate in the autonomic control of cardiovascular functions such as heart rate. The degenerative process in frontotemporal dementia (FTD) involves the listed anatomical structures and may therefore produce dysautonomic cardiovascular symptoms.
AimTo observe whether or not non-cardiogenic bradycardia was more frequent in a group of patients with FTD than in subjects with mild cognitive impairment or dementia of a different aetiology.
Patients and methodOnce patients with primary cardiac arrhythmia were excluded, we registered the heart rates of 258 patients with cognitive symptoms (36 with FTD, 22 with Alzheimer disease, 23 with vascular dementia, 10 with other dementias, and 167 with non-dementia cognitive impairment).
ResultsBradycardia (<60 beats/minute) was significantly more frequent in patients with FTD. This difference remained significant after excluding subjects undergoing treatment with a potentially bradycardic effect. Bradycardia was more prevalent in behavioural FTD cases than in cases of the aphasic variant, and we detected a trend toward higher frequency among patients with more pronounced right hemisphere atrophy. Moreover, mean systolic blood pressure in FTD patients was lower than in other participants, and systolic hypotension (<120 and <100mm Hg) was more prevalent.
ConclusionBradycardia was more frequent in the FTD sample than in other patients with cognitive symptoms. Further investigations will be necessary before we may consider bradycardia to be a sign supporting diagnosis of FTD or its behavioural variant.
Diversas áreas de la corteza cerebral y algunos subnúcleos subcorticales forman parte de circuitos neuronales que influyen en la actividad cardiovascular1. Entre otras funciones, ejercen una acción reguladora de la respuesta del sistema nervioso autónomo a las actividades cognitivas y los cambios emocionales. Una de las manifestaciones de esta modulación es la variación de la frecuencia cardíaca que acompaña a actos como, por ejemplo, el cálculo mental aritmético2,3 y otras tareas que requieren concentración4, así como situaciones estresantes5–7 o que entrañan amenaza8, y cambios afectivos o emocionales9,10.
Entre las áreas corticales que intervienen en la modulación cardiovascular cabe destacar la corteza orbitofrontal11,12 y frontomedial4,6–9,11,13 (incluido el cíngulo anterior8,13–15), la ínsula16–20 y la amígdala cerebral13. Determinados trastornos neurológicos que producen lesión o excitación de esas áreas cerebrales se acompañan de taquicardia, bradicardia, alteración de la reactividad cardíaca u otros síntomas de disfunción del sistema nervioso autónomo. Tal es el caso del síndrome de bradicardia ictal, observado en algunos pacientes con epilepsia del lóbulo temporal o del lóbulo frontal, que a veces cursa con asistolia21,22, o de las alteraciones del control del sistema nervioso autónomo sobre el corazón en ictus vasculares cerebrales que se localizan en la ínsula19.
En la demencia frontotemporal (DFT) subyace un proceso degenerativo que involucra varias de las áreas anatómicas mencionadas que intervienen en el control cerebral del sistema nervioso autónomo, tales como la corteza prefrontal y temporal, la ínsula y la amígdala23–25. Por este motivo, parece razonable intuir que la presencia de una disfunción cardiovascular podría ser más frecuente en estos enfermos que en otros con demencia, o con otras alteraciones cognitivas, en los que el asentamiento anatómico de la lesión se halla total o mayoritariamente fuera de las regiones mencionadas. En el trabajo que aquí se presenta se ha realizado una observación simple de la presencia o ausencia de bradicardia en pacientes con síntomas cognitivos, para ver si existían diferencias entre los que fueron diagnosticados de DFT y los que tenían otro diagnóstico.
Pacientes y métodoSe han examinado retrospectivamente los expedientes clínicos de 650 pacientes consecutivos que acudieron a una consulta de neurología por notar síntomas cognitivos. Se excluyeron los pacientes sin un diagnóstico claro (enfermos con diagnóstico incierto, o que rehusaron realizar pruebas necesarias o estaban pendientes de realizarlas). Asimismo, no se incluyeron los pacientes que no mostraron deterioro cognitivo ligero o demencia (exploración neuropsicológica dentro de la normalidad, frecuentemente con un diagnóstico final de enfermedad neurológica, psiquiátrica o sistémica con síntomas reactivos que indujeron la consulta de Neurología cognitiva). De los restantes, fueron seleccionados aquellos en quienes se registró la frecuencia cardíaca, y se rechazaron posteriormente los que tenían ritmo de marcapasos o pulso de aspecto irregular (la mayoría de estos eran pacientes con fibrilación auricular). El pulso fue registrado, a la vez que la presión arterial, con un aparato Omron M6 de manguito braquial. Además de tener en cuenta la frecuencia cardíaca observada, en el análisis se han reunido los pacientes con frecuencia <60ppm, para su comparación con el resto de los participantes.
En este estudio se han tenido en cuenta el sexo, la edad, el diagnóstico neurológico y el tratamiento que recibían en la fecha en que se anotó la frecuencia cardíaca. Para facilitar el análisis de los datos se agruparon algunos diagnósticos, considerando finalmente pacientes con DFT, enfermedad de Alzheimer, demencia vascular, otras demencias y enfermos sin demencia. Para el diagnóstico clínico de DFT se aplicaron los criterios de McKhann et al. de 200126. Todos los pacientes con DFT mostraron alteración en la neuroimagen compatible con la sospecha diagnóstica. Además, se registró si en el paciente destacaban los síntomas conductuales, los afásicos o ambos tipos de alteración.
En relación con el tratamiento, se dividieron los enfermos en función de que tomaran, o no, algún fármaco con acción potencialmente bradicardizante.
Se describen también los hallazgos en la medición de la presión arterial que se realizó simultáneamente al registro de las pulsaciones, pero este análisis no fue objeto del estudio y no se analizaron los posibles factores que pudieran influir en el resultado.
Por otra parte, en todos los enfermos con DFT se anotaron las regiones de la corteza cerebral que exhibían atrofia en la neuroimagen.
Atendiendo a la hipótesis del trabajo, mediante análisis estadístico se comparó la frecuencia cardíaca y la presencia de bradicardia de los pacientes con DFT con la de los otros grupos diagnósticos. En el análisis se tuvo en cuenta la posible influencia derivada de tomar algún fármaco con acción bradicardizante.
Se comparó la frecuencia cardíaca y la presión arterial (sistólica y diastólica) de los grupos sin DFT con la de los pacientes con DFT, usando la prueba t de Student una vez comprobado que los grupos mostraban una distribución normal, y la prueba U de Mann-Whitney cuando los subgrupos de comparación comprendían muy pocos elementos. Se realizó la misma comparación, considerando la presencia o ausencia de bradicardia y de hipotensión, aplicando en esta situación la prueba χ2 o la prueba exacta de Fisher. También se compararon por este procedimiento los resultados de los pacientes con DFT afásica y conductual y, finalmente, se observó si la bradicardia mostraba una mayor incidencia en los pacientes (DFT) con afectación de un lóbulo cerebral determinado, o de uno de los hemisferios. Para este fin se aplicó al conjunto la prueba no paramétrica de Kruskal-Wallis, por tratarse de subgrupos de tamaño dispar y varianza diferente.
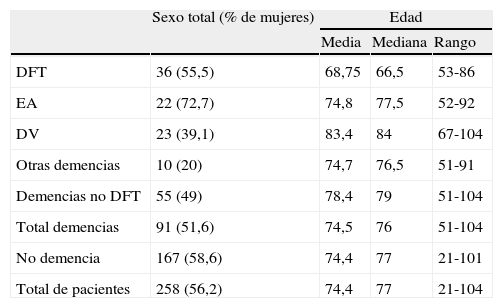
ResultadosLa muestra se compone de 258 pacientes con síntomas cognitivos, 91 con demencia y 167 con otros grados de alteración cognitiva (grados 2 o 3 en la Global Deterioration Scale de Reisberg27). De los enfermos con demencia, 36 cumplían criterios de DFT26, 22 fueron diagnosticados de enfermedad de Alzheimer, 23 de demencia vascular y a 10 se les atribuyeron otras causas. En la tabla 1 figuran algunos datos demográficos de los componentes de la muestra. La mayoría de los pacientes habían acudido anteriormente a una consulta de Neurología general y se dirigieron a la consulta de Neurología cognitiva por presentar un cuadro clínico diferente del esperado en la enfermedad de Alzheimer típica. Esto explica que la proporción de diagnósticos de la muestra difiera de la que es esperable en la población total de pacientes con deterioro cognitivo, donde la enfermedad de Alzheimer es la causa predominante.
Sexo y edad de los enfermos incluidos en el estudio
| Sexo total (% de mujeres) | Edad | |||
| Media | Mediana | Rango | ||
| DFT | 36 (55,5) | 68,75 | 66,5 | 53-86 |
| EA | 22 (72,7) | 74,8 | 77,5 | 52-92 |
| DV | 23 (39,1) | 83,4 | 84 | 67-104 |
| Otras demencias | 10 (20) | 74,7 | 76,5 | 51-91 |
| Demencias no DFT | 55 (49) | 78,4 | 79 | 51-104 |
| Total demencias | 91 (51,6) | 74,5 | 76 | 51-104 |
| No demencia | 167 (58,6) | 74,4 | 77 | 21-101 |
| Total de pacientes | 258 (56,2) | 74,4 | 77 | 21-104 |
DFT: demencia frontotemporal; DV: demencia vascular; EA: enfermedad de Alzheimer.
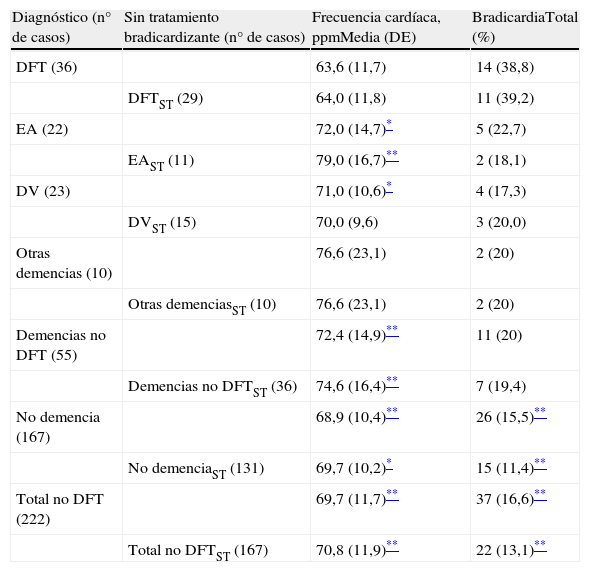
La frecuencia cardíaca de los pacientes, agrupados por diagnóstico, y el porcentaje de pacientes que tenía bradicardia (considerada como frecuencia <60 ppm), mostraron diferencias intergrupales, tal como se aprecia en la tabla 2. La frecuencia cardíaca fue menor y el porcentaje de pacientes con bradicardia mayor en el grupo DFT que en el resto de los participantes, aunque en algunos subgrupos con pocos elementos no se alcanzó significación estadística.
Datos sobre la frecuencia cardíaca y tratamiento bradicardizante en los diferentes grupos incluidos en el estudio
| Diagnóstico (n° de casos) | Sin tratamiento bradicardizante (n° de casos) | Frecuencia cardíaca, ppmMedia (DE) | BradicardiaTotal (%) |
| DFT (36) | 63,6 (11,7) | 14 (38,8) | |
| DFTST (29) | 64,0 (11,8) | 11 (39,2) | |
| EA (22) | 72,0 (14,7)* | 5 (22,7) | |
| EAST (11) | 79,0 (16,7)** | 2 (18,1) | |
| DV (23) | 71,0 (10,6)* | 4 (17,3) | |
| DVST (15) | 70,0 (9,6) | 3 (20,0) | |
| Otras demencias (10) | 76,6 (23,1) | 2 (20) | |
| Otras demenciasST (10) | 76,6 (23,1) | 2 (20) | |
| Demencias no DFT (55) | 72,4 (14,9)** | 11 (20) | |
| Demencias no DFTST (36) | 74,6 (16,4)** | 7 (19,4) | |
| No demencia (167) | 68,9 (10,4)** | 26 (15,5)** | |
| No demenciaST (131) | 69,7 (10,2)* | 15 (11,4)** | |
| Total no DFT (222) | 69,7 (11,7)** | 37 (16,6)** | |
| Total no DFTST (167) | 70,8 (11,9)** | 22 (13,1)** |
DFT: demencia frontotemporal; DV: demencia vascular; EA: enfermedad de Alzheimer; ST: sin tratamiento bradicardizante.
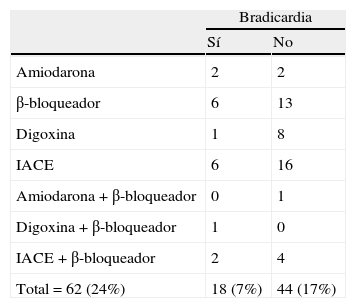
Para controlar el sesgo que podría derivarse de que el paciente tomara un fármaco con acción bradicardizante, se trataron por separado los pacientes que recibían, o no, este tipo de medicación. De los 62 casos con tratamiento bradicardizante (el 24% del total), 18 tenían bradicardia (7%) y 44 no (17%). La tabla 3 muestra una relación de los fármacos registrados y la presencia o ausencia de bradicardia en quienes los tomaban. Como se aprecia en la tabla 2, la bradicardia no solo fue más frecuente en el grupo de DFT considerado globalmente (n=36), sino también en el subgrupo que excluye a los pacientes con bradicardia influida por tratamiento bradicardizante (n=29).
Pacientes con frecuencia cardíaca normal o con bradicardia que recibían tratamiento bradicardizante
| Bradicardia | ||
| Sí | No | |
| Amiodarona | 2 | 2 |
| β-bloqueador | 6 | 13 |
| Digoxina | 1 | 8 |
| IACE | 6 | 16 |
| Amiodarona+β-bloqueador | 0 | 1 |
| Digoxina+β-bloqueador | 1 | 0 |
| IACE+β-bloqueador | 2 | 4 |
| Total=62 (24%) | 18 (7%) | 44 (17%) |
IACE: inhibidores de la colinesterasas.
Entre paréntesis figura el porcentaje respecto a los 258 pacientes del estudio.
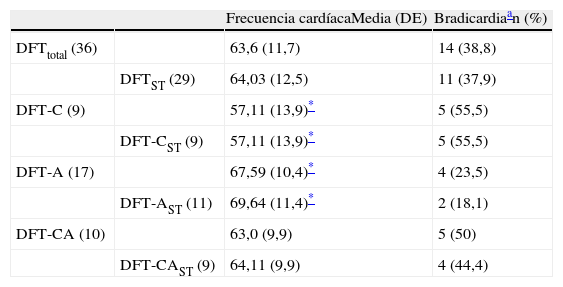
La distribución de los pacientes con DFT y bradicardia, al dividirlos en función de los síntomas predominantes (conductuales, afásicos o mixtos), se muestra en la tabla 4. Se aprecia menor frecuencia cardíaca y mayor incidencia de bradicardia en los enfermos con las formas conductual o mixta que en los afásicos. La diferencia solo es estadísticamente significativa entre las frecuencias medias de los grupos conductual y afásico.
Frecuencia cardíaca y presencia de bradicardia en los pacientes con DFT, atendiendo a los síntomas predominantes
| Frecuencia cardíacaMedia (DE) | Bradicardiaan (%) | ||
| DFTtotal (36) | 63,6 (11,7) | 14 (38,8) | |
| DFTST (29) | 64,03 (12,5) | 11 (37,9) | |
| DFT-C (9) | 57,11 (13,9)* | 5 (55,5) | |
| DFT-CST (9) | 57,11 (13,9)* | 5 (55,5) | |
| DFT-A (17) | 67,59 (10,4)* | 4 (23,5) | |
| DFT-AST (11) | 69,64 (11,4)* | 2 (18,1) | |
| DFT-CA (10) | 63,0 (9,9) | 5 (50) | |
| DFT-CAST (9) | 64,11 (9,9) | 4 (44,4) |
A: predominan los síntomas afásicos; C: predominan los síntomas conductuales; CA: síntomas conductuales y afásicos, sin predominio; DFT: demencia frontotemporal; ST: sin tratamiento bradicardizante.
Todos los enfermos de la muestra diagnosticados de DFT (36) tienen neuroimagen estructural (29 resonancia magnética y 7 tomografía computarizada). Quince de ellos tienen además neuroimagen funcional (12 SPECT y 3 PET). Las observaciones sobre topografía de la atrofia se fundamentan en la neuroimagen estructural, considerando de apoyo la neuroimagen funcional, en los casos en que fue realizada. En cuanto a los hallazgos detectados, hay que apuntar unas aclaraciones a los datos que figuran en la tabla 5a y 5b. Se ha excluido el lóbulo occipital, porque no hubo casos (DFT) con alteración ostensible en este lóbulo. No figuran la amígdala cerebral y la ínsula, que presuntamente influyen en el control de la frecuencia cardíaca, porque en las pruebas de neuroimagen realizadas no se aplicaron técnicas de cuantificación volumétrica de la sustancia gris y en algunos casos, además, las secciones obtenidas no eran óptimas para estudiar estas estructuras. Por estos motivos, se consideró poco fiable la apreciación de atrofia en esas áreas, cuando no era intensa. En el caso de la amígdala, una pérdida de volumen poco intensa puede ser difícil de valorar en función del grado de atrofia asociada del hipocampo. En el caso de la ínsula ocurre lo mismo, si las imágenes no son apropiadas, dependiendo del grado de atrofia de los opérculos frontal y temporal, y de las estructuras subcorticales adyacentes.
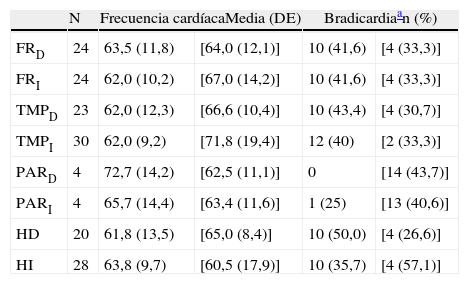
En el análisis de los resultados sobre la topografía de las anormalidades observadas en la neuroimagen, respecto a la presencia o ausencia de bradicardia, el examen estadístico no encontró diferencias significativas entre los distintos lóbulos cerebrales afectados (tablas 5a y 5b). Únicamente se aprecia una ligera menor frecuencia cardíaca y mayor porcentaje de bradicardia en los pacientes con alteraciones en el hemisferio derecho.
Topografía de las alteraciones halladas en la neuroimagen de los 36 pacientes con DFT
| N | Frecuencia cardíacaMedia (DE) | Bradicardiaan (%) | |||
| FRD | 24 | 63,5 (11,8) | [64,0 (12,1)] | 10 (41,6) | [4 (33,3)] |
| FRI | 24 | 62,0 (10,2) | [67,0 (14,2)] | 10 (41,6) | [4 (33,3)] |
| TMPD | 23 | 62,0 (12,3) | [66,6 (10,4)] | 10 (43,4) | [4 (30,7)] |
| TMPI | 30 | 62,0 (9,2) | [71,8 (19,4)] | 12 (40) | [2 (33,3)] |
| PARD | 4 | 72,7 (14,2) | [62,5 (11,1)] | 0 | [14 (43,7)] |
| PARI | 4 | 65,7 (14,4) | [63,4 (11,6)] | 1 (25) | [13 (40,6)] |
| HD | 20 | 61,8 (13,5) | [65,0 (8,4)] | 10 (50,0) | [4 (26,6)] |
| HI | 28 | 63,8 (9,7) | [60,5 (17,9)] | 10 (35,7) | [4 (57,1)] |
D: derecha; DFT: demencia frontotemporal; FR: corteza del lóbulo frontal; HD: hemisferio cerebral derecho; HI: hemisferio cerebral izquierdo; I: izquierda; N: número de pacientes con atrofia en la localización señalada al comienzo de la línea; PAR: corteza del lóbulo parietal; TMP: corteza del lóbulo temporal.
Entre corchetes figuran los valores correspondientes a los que tienen indemne ese lóbulo.
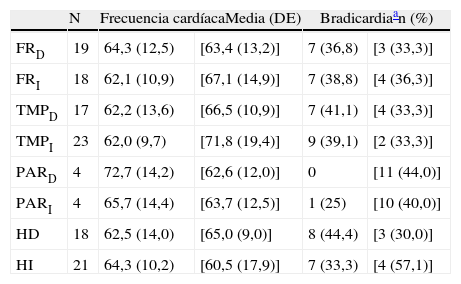
Topografía de las alteraciones halladas en la neuroimagen de los 29 pacientes con DFT sin tratamiento bradicardizante
| N | Frecuencia cardíacaMedia (DE) | Bradicardiaan (%) | |||
| FRD | 19 | 64,3 (12,5) | [63,4 (13,2)] | 7 (36,8) | [3 (33,3)] |
| FRI | 18 | 62,1 (10,9) | [67,1 (14,9)] | 7 (38,8) | [4 (36,3)] |
| TMPD | 17 | 62,2 (13,6) | [66,5 (10,9)] | 7 (41,1) | [4 (33,3)] |
| TMPI | 23 | 62,0 (9,7) | [71,8 (19,4)] | 9 (39,1) | [2 (33,3)] |
| PARD | 4 | 72,7 (14,2) | [62,6 (12,0)] | 0 | [11 (44,0)] |
| PARI | 4 | 65,7 (14,4) | [63,7 (12,5)] | 1 (25) | [10 (40,0)] |
| HD | 18 | 62,5 (14,0) | [65,0 (9,0)] | 8 (44,4) | [3 (30,0)] |
| HI | 21 | 64,3 (10,2) | [60,5 (17,9)] | 7 (33,3) | [4 (57,1)] |
D: derecha; DFT: demencia frontotemporal; FR: corteza del lóbulo frontal; HD: hemisferio cerebral derecho; HI: hemisferio izquierdo; I: izquierda; N: número de pacientes con atrofia en la localización señalada al comienzo de la línea; PAR: corteza del lóbulo parietal; TMP: corteza del lóbulo temporal.
Entre corchetes figuran los valores correspondientes a los que tienen indemne ese lóbulo.
Partiendo de la base teórica de que en la DFT se afectan estructuras cerebrales relacionadas con el control autonómico de la función cardíaca, en un grupo de pacientes con este diagnóstico se ha objetivado una mayor prevalencia de bradicardia e hipotensión arterial sistólica, al comparar con personas con alteración cognitiva de etiología diferente.
Tal como cabría esperar, la media de edad en el conjunto de enfermos con DFT es inferior a la de los demás pacientes (tabla 1), porque se trata de una enfermedad que comienza a menudo antes de los 65 años28.
Aunque se trata de muestras pequeñas, cabe mencionar que en el grupo de DFT no se observaron diferencias en cuanto al sexo, mientras que hubo predominio femenino en los pacientes con enfermedad de Alzheimer y masculino en los diagnosticados de demencia vascular (tabla 1). Esto es congruente con los datos epidemiológicos publicados sobre este aspecto26,29,30.
El hallazgo de bradicardia (<60ppm) en la población general de edad avanzada no está cuantificado, pero se sabe que no es infrecuente, y en la mayoría de los casos es asintomático, sobre todo si la frecuencia cardíaca es mayor de 50. El hallazgo puede tener relación con alteración cardíaca, o de los sistemas hormonales y electrolíticos cardio y vasorreguladores, o del sistema nervioso autónomo, a veces por lesiones orgánicas de índole diversa y a menudo como efecto colateral medicamentoso. En los pacientes con demencia, por tener frecuentemente edad avanzada y estar a menudo polimedicados, no resulta extraño encontrar casos de bradicardia. Así pues, puede considerarse dentro de márgenes previsibles que el 20% de los participantes de este estudio tuviera una frecuencia cardíaca inferior a 60. Sin embargo, la presencia de bradicardia cobraría interés si resultase significativamente más frecuente en los enfermos con un diagnóstico determinado, porque podría tener valor como signo clínico de apoyo a ese diagnóstico. Esta es la situación al observar una mayor prevalencia de la bradicardia en la muestra de enfermos con DFT, con respecto a los demás grupos diagnósticos. La diferencia es hipotética, puesto que los tamaños muestrales son insuficientes como para inferir del análisis que este acontecimiento sucede en la población general de enfermos con demencia. Pero anima a continuar las observaciones, para confirmar o rechazar este hallazgo preliminar.
Veintiséis de los 258 pacientes estudiados refirieron haber tenido síntomas de potencial relación con bradicardia, como caídas o pérdidas breves de conciencia sin causa determinada (3 pacientes con DFT, 3 con enfermedad de Alzheimer, 3 con demencia vascular, 3 con otras demencias y 14 sin demencia; de ellos, en la consulta mostraron bradicardia los 3 con enfermedad de Alzheimer, uno con otra demencia y 2 sin demencia). Estos datos apoyan que la presencia de bradicardia raramente cursa con síntomas (las manifestaciones descritas afectaron únicamente a 6 de los 51 pacientes con bradicardia registrada, y en alguno de ellos podrían no estar relacionadas con la bradicardia) y, a la vez, permiten sospechar que algunos pacientes podrían tener bradicardia sintomática en algunos momentos y no ser detectada en el momento de la consulta (20 pacientes con antecedente sintomático tenían frecuencia cardíaca normal en la consulta). A 2 de los pacientes con bradicardia posteriormente se les colocó un marcapasos cardíaco.
Las alteraciones cerebrales que pueden producir bradicardia son variadas, como, por ejemplo, la hipertensión intracraneal, convulsiones, tumores o lesiones vasculares con afectación de determinadas áreas cerebrales31. Si se acepta que en todos esos procesos la bradicardia procede de una estimulación excesiva de estructuras cerebrales ligadas al sistema nervioso parasimpático, o inhibición o lesión de las ligadas al simpático; que entre estas estructuras destacan la corteza prefrontomedial y frontobasal, la ínsula y la amígdala cerebral; y que en la DFT esas áreas cerebrales sufren una alteración degenerativa desde estadios no avanzados de la enfermedad, resulta razonable que muchos enfermos con este diagnóstico presenten bradicardia en algún momento evolutivo.
No obstante, la DFT sigue una progresión con gran variabilidad interindividual, de manera que en algunos pacientes comienza por las regiones prefrontales, mientras que en otros predomina inicialmente la alteración temporal, y en ambas situaciones puede ser bastante simétrica o muy asimétrica, al menos en las fases iniciales. Así se perfilan los fenotipos de la variante conductual de la DFT, la forma que comienza con afasia no fluente progresiva, la demencia semántica y otras variantes menos frecuentes. Teniendo en cuenta que la experiencia acumulada señala que en el hemisferio izquierdo predominan los circuitos cerebrales relacionados con el control parasimpático cardiovascular y en el derecho los relacionados con el control simpático32,33, es natural que, a tenor del fenotipo que se desarrolle, el enfermo sea más propenso a tener taquicardia o bradicardia, o a mantener el equilibrio entre ambos sistemas, siendo probable que existan siempre alteraciones, aunque sean sutiles, de la reactividad cardiovascular dependiente del control cerebral. Todo esto explica que la bradicardia no aparezca en muchos enfermos con DFT, pero, si se comprobase una mayor incidencia en estos pacientes con respecto a los que padecen otros tipos de demencia, podría constituir un elemento semiológico de valor clínico.
En muchos pacientes con demencia no DFT también se alteran algunas de las estructuras anatómicas mencionadas, pero generalmente no ocurre en todos los casos o no tan intensamente como en la DFT. Mientras que en la DFT se afecta precozmente el circuito frontoinsular y frontoamigdalino, involucrando el cíngulo anterior, en la enfermedad de Alzheimer se alteran predominantemente las vías límbicas posteriores, con mayor afectación del hipocampo y extensión a corteza cingular posterior y temporoparietal externa23; el proceso también invade áreas frontoinsulares34, pero en menor grado que la DFT, al menos en estadios no avanzados. Por otra parte, en la demencia vascular es característica la heterogeneidad de la topografía lesional. El trastorno puede asentar o predominar en territorios cerebrales posteriores o anteriores, corticales o subcorticales, siendo la afectación focal, multifocal o difusa. De este modo, en algunos casos podría haber un trastorno ostensible del control cardiovascular, como en los ictus insulares ya mencionados19, mientras que en otros pacientes este control permanecerá normal35,36, o dependerá de una cardiopatía asociada.
Existen algunas demencias en las que la alteración disautonómica forma parte del cortejo sintomático previsible, como la demencia con cuerpos de Lewy, la demencia asociada a enfermedad de Parkinson y la que aparece en algunos pacientes con atrofia multisistémica36,37. La mera presencia de bradicardia de origen cerebral, o de otros síntomas disautonómicos, no es suficiente para establecer un diagnóstico etiológico definido. Simplemente sirve de ayuda al facultativo, al conjuntarla con otros hallazgos clínicos, en su tarea de buscar los criterios de diagnóstico compatibles con el estado clínico del enfermo. Si se confirmase la hipótesis planteada en este trabajo, la DFT se añadiría a la lista de entidades nosológicas en las que la presencia de bradicardia constituye uno de los signos de sospecha o de apoyo al diagnóstico.
En relación con las variantes conductual y afásica de la DFT (tabla 4) es difícil extraer conclusiones, porque esa división reduce el tamaño de los grupos. En los pacientes con DFT es frecuente que inicialmente predominen las alteraciones de la conducta (social, alimentaria, sexual) o las alteraciones del lenguaje26. En nuestro conjunto de pacientes había 9 con la variante conductual y 17 con la afásica. Los 10 enfermos restantes acudieron a la consulta en una fase más avanzada, mostraban ambos tipos de alteración, y la anamnesis no permitió discernir con seguridad cuáles habían sido los síntomas iniciales predominantes. Presumiblemente, los enfermos con afasia progresiva notan claramente el problema del lenguaje y acuden inicialmente al neurólogo, mientras que muchos de los que comienzan la variante conductual son consultados en psiquiatría o atención primaria durante algún tiempo y son dirigidos a neurología posteriormente. Por tanto, es posible que la mayoría de estos 10 enfermos con evolución prolongada y síntomas mixtos comenzara con un trastorno conductual. Si así fuera, se cumplirían las expectativas que ofrece la bibliografía, donde se considera más frecuente la variante conductual. Sin olvidar que manejamos tamaños muestrales pequeños, observamos menor frecuencia cardíaca y mayor prevalencia de bradicardia en los grupos de pacientes con las variantes conductual o mixta, respecto a los afásicos (tabla 4). La similitud en la prevalencia de bradicardia en esos 2 subgrupos sería congruente con la sospecha de que los que presentan ambos síntomas hubieran comenzado con alteraciones conductuales, de manera que el mayor riesgo de bradicardia iría parejo con la faceta conductual. Si aceptamos, en una clasificación grosso modo, que las alteraciones del lenguaje dependen más de una hipofunción en el hemisferio izquierdo, y que las alteraciones conductuales aparecen con mayor frecuencia cuando se alteran estructuras del hemisferio derecho38, el resultado es congruente con la hipótesis de que en el hemisferio derecho hay una mayor representación de los circuitos neuronales que controlan la actividad simpática relacionada con la función cardiovascular, cuya lesión (en este caso atrofia) produce bradicardia.
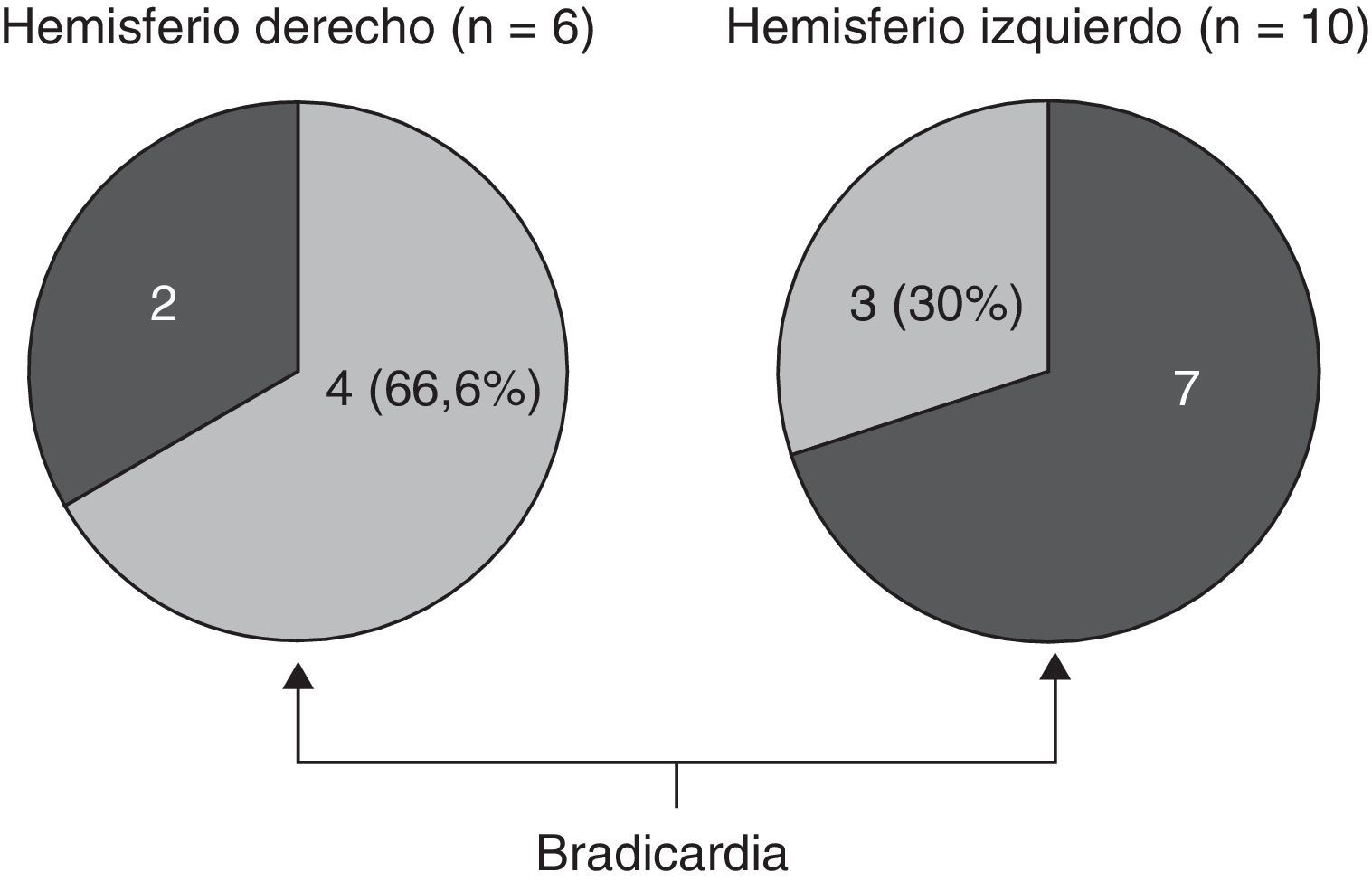
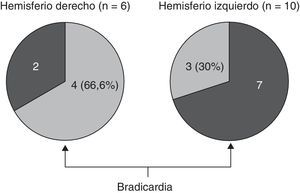
En lo relativo a la topografía de las alteraciones, se decidió considerar únicamente la obtenida en pacientes con DFT. En los enfermos sin demencia aparecen lesiones que pueden tener un efecto destructivo o inhibidor de función y otras de carácter irritativo, que pueden estimular la actividad de esa zona. Por otra parte, en las diferentes demencias degenerativas se afectan de distinto modo, generalmente sin traducción en la neuroimagen, núcleos subcorticales y del tronco encefálico relacionados con los sistemas adrenérgico y colinérgico que intervienen en el sistema nervioso autónomo. Así pues, al seleccionar únicamente los enfermos con DFT, aunque se reduce el tamaño muestral, se logra disminuir la heterogeneidad que pudiera tergiversar el valor del resultado. En otro sentido, debe recordarse que la DFT es una enfermedad degenerativa que afecta a ambos hemisferios cerebrales, aunque en muchos casos haya un predominio unilateral en los primeros estadios evolutivos. En esta observación no hemos encontrado asociación significativa de la bradicardia con la ubicación de la alteración estructural en un lóbulo cerebral concreto. No obstante, sí apreciamos menor frecuencia cardíaca y mayor presencia de bradicardia cuando hay afectación del hemisferio derecho, y ocurre lo contrario cuando se altera el hemisferio izquierdo (tablas 5a y 5b). Si seleccionamos los pacientes con DFT en los que se encontró un claro predominio unilateral de la atrofia, se nota una mayor proporción de enfermos con bradicardia no influenciada por tratamiento bradicardizante en los que tienen una atrofia destacada del hemisferio derecho (fig. 1). Estos 16 pacientes eran diestros. La diferencia no alcanza significación estadística, probablemente debido al pequeño número de pacientes comprendido en ambos subgrupos. Por tanto, el resultado solo permite apuntar una tendencia al predominio de la bradicardia en los enfermos con mayor afectación del hemisferio derecho, lo cual es congruente con la presunta localización en ese hemisferio de las áreas corticales que modulan el sistema nervioso simpático que actúa sobre el corazón32,33. En todo caso, debe destacarse que puede aparecer bradicardia en pacientes con mayor afectación del hemisferio cerebral derecho o del izquierdo, y algunos observadores de pacientes con epilepsia ictal no han encontrado una lateralidad específica asociada a la aparición de bradicardia39,40. En las figuras 2 y 3 se muestran 2 ejemplos de pacientes de este estudio con DFT y bradicardia, que tenían una clara lateralidad izquierda y derecha, respectivamente, de la atrofia del lóbulo temporal y de la ínsula. En ambos casos parece haber una atrofia más acusada de la parte anteroinferior interna de la corteza insular.
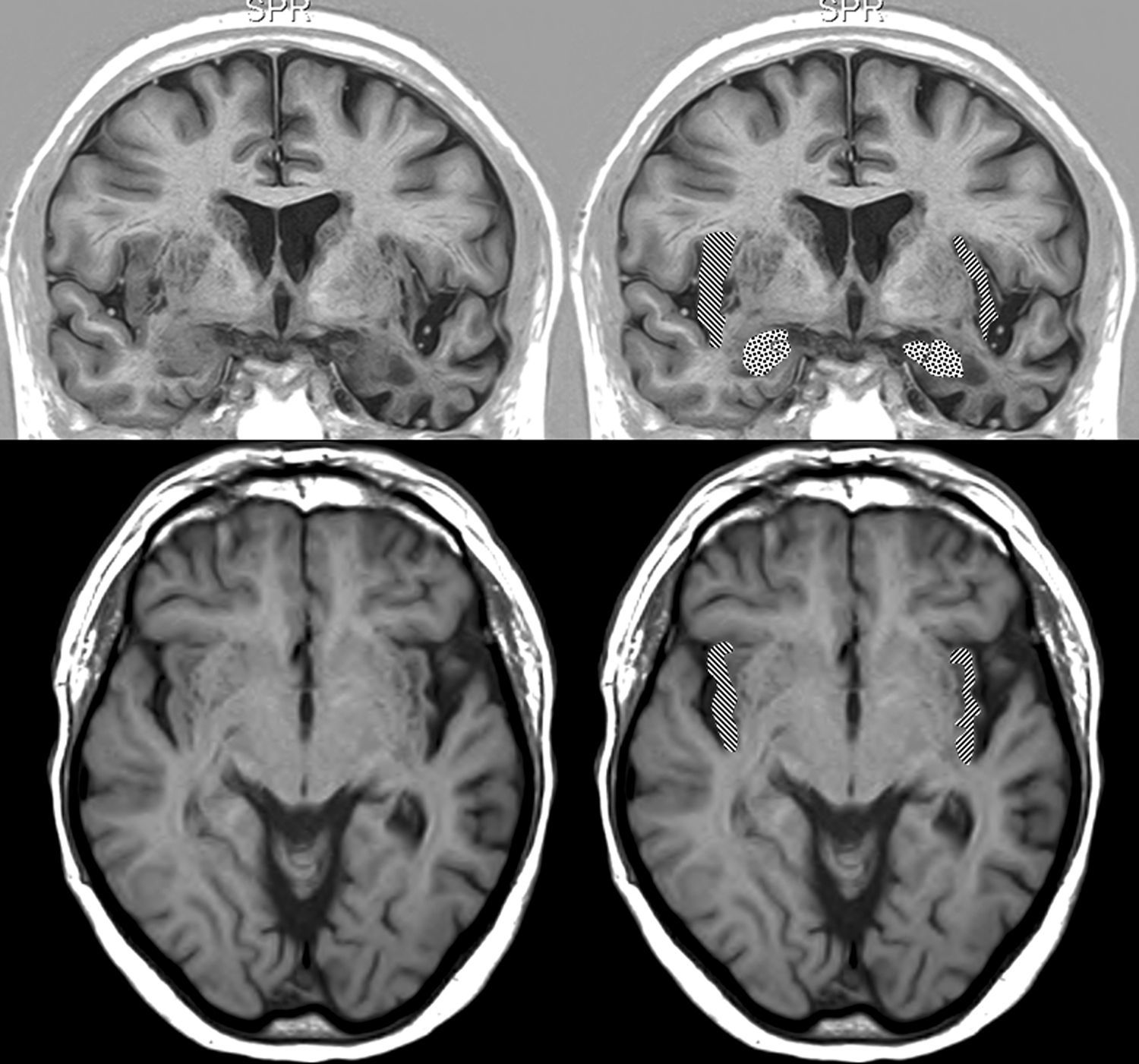
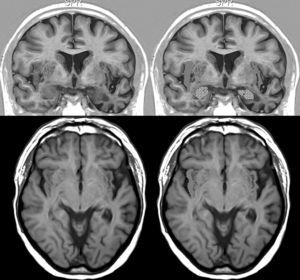
Resonancia magnética cerebral de un paciente con DFT y bradicardia.
Varón de 67 años con DFT–demencia semántica en estadio intermedio y 56ppm. Muestra atrofia destacada del lóbulo temporal izquierdo. Arriba: sección coronal en inversion recovery y abajo sección axial en FLAIR. En la parte derecha aparece la corteza insular rayada y la amígdala punteada.
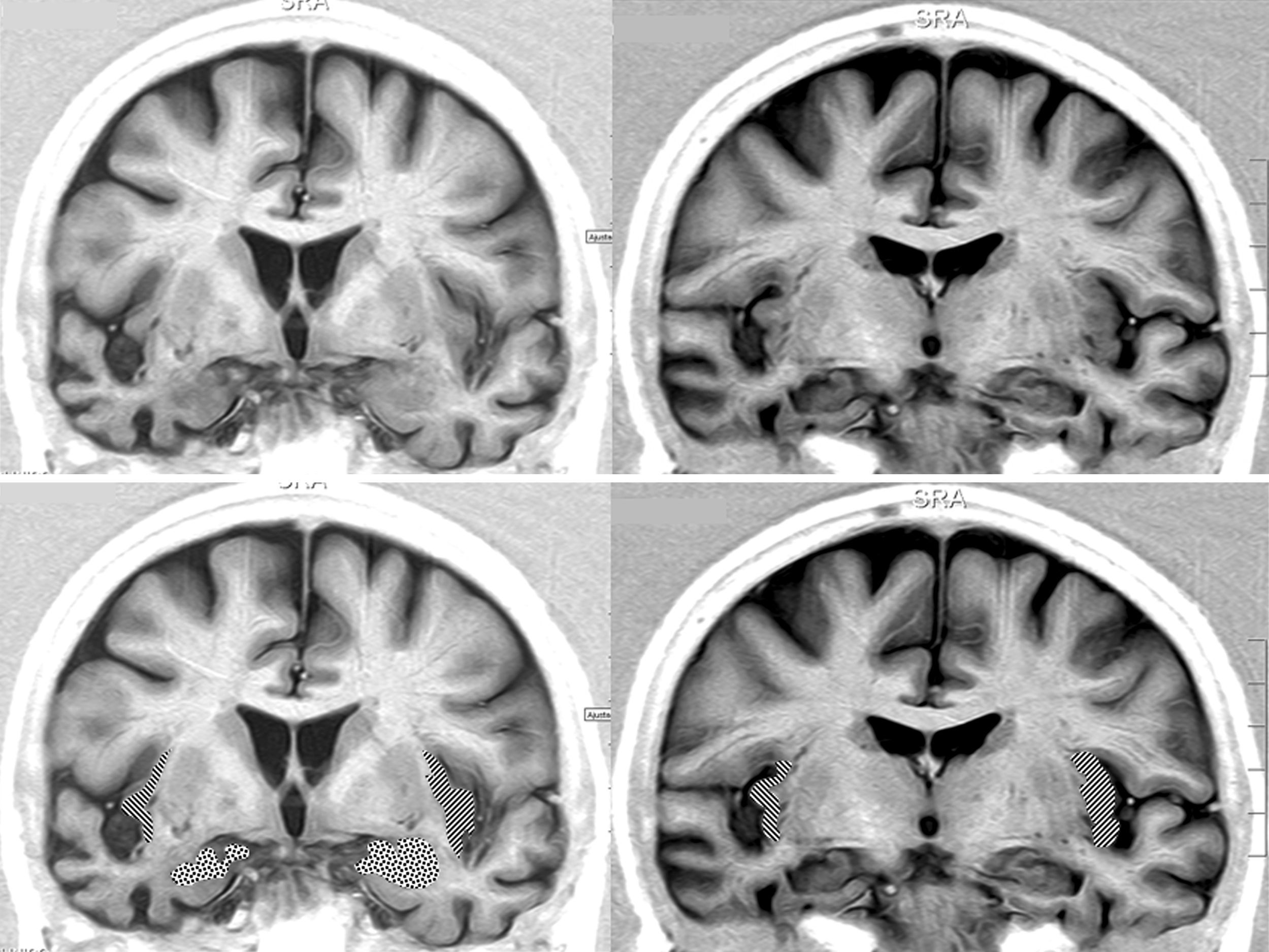
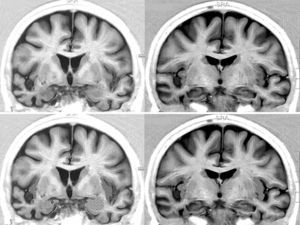
Resonancia magnética cerebral de una paciente con DFT y bradicardia.
Mujer de 65 años con DFT–variante conductual de 3 años de evolución. En 2 consultas sucesivas, 39 y 51ppm. Secciones coronales en inversion recovery. Se observa atrofia notable del lóbulo temporal derecho. En la parte inferior aparece la amígdala punteada y la corteza insular rayada.
Si en el futuro se confirmase una mayor propensión a la bradicardia de los enfermos con DFT, no solo tendríamos un nuevo signo de valor diagnóstico; además, se tendría que tener en cuenta en las decisiones terapéuticas. Por ejemplo, quedaría más alejada la posible indicación de los inhibidores de colinesterasa en estos pacientes, ya desaconsejados en 2011 por la British Association for Psychopharmacology41, debido a su potencial acción bradicardizante42. Sin olvidar que en este trabajo manejamos muestras pequeñas, cabe mencionar que, al consultar por primera vez a estos enfermos, 7 con DFT tomaban un inhibidor de colinesterasas y 3 de ellos tenían bradicardia (42,8%), mientras que de los restantes pacientes del estudio que recibían este tratamiento tenía bradicardia el 28,5% (6 de 21).
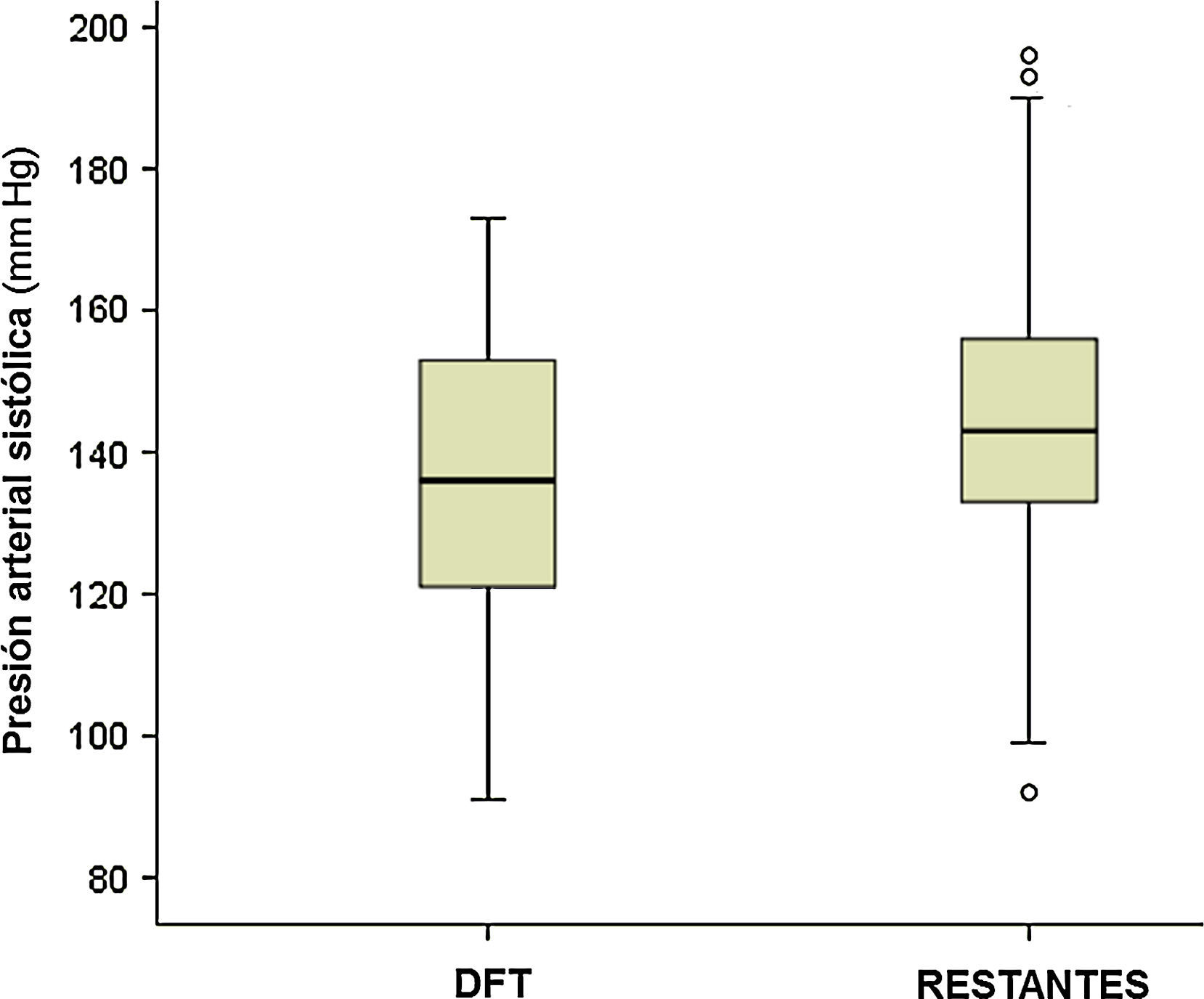
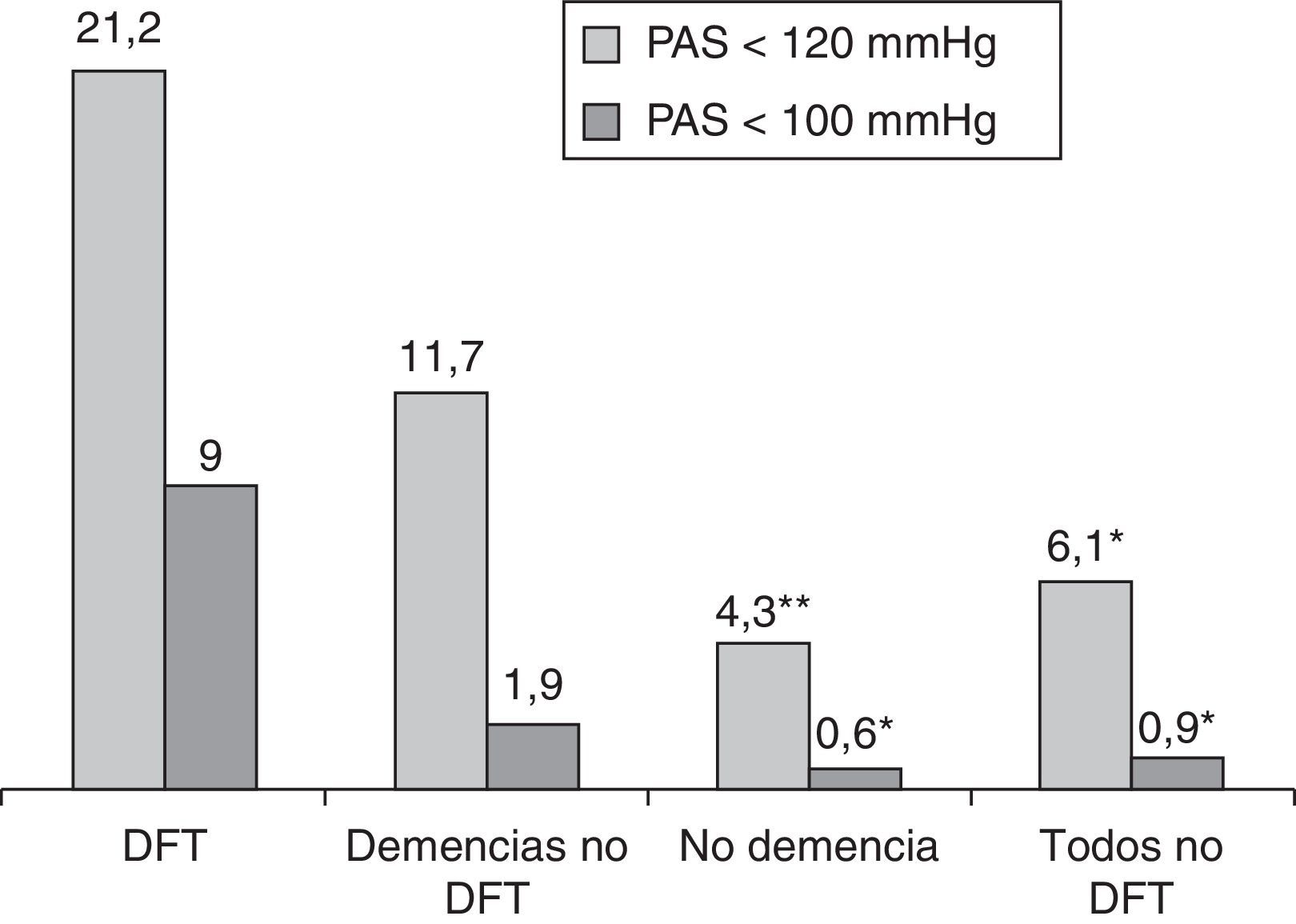
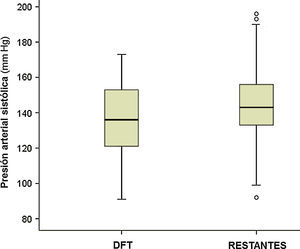
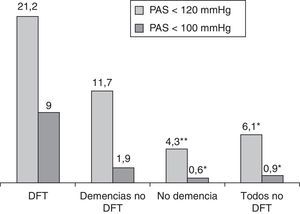
La observación de la presión arterial no ha sido un objetivo principal de este estudio, porque en sus alteraciones intervienen múltiples factores, cuyo registro y análisis sería objeto de una investigación independiente. No obstante, los resultados encontrados relativos a su medición simultánea con el pulso señalan una menor presión sistólica en el grupo de pacientes con DFT, al comparar con el resto de los participantes (p<0,01; fig. 4). Si estimamos inicialmente, de modo arbitrario, considerar hipotensión sistólica a la situación con presión menor de 120mmHg, su frecuencia en el grupo DFT fue del 21,2%, frente al 6,1% en los demás participantes (11,7% en las otras demencias, 4,3% en los enfermos sin demencia) (fig. 5). Si seleccionamos los enfermos con presión sistólica menor de 100, encontramos un 9% en el grupo DFT y un 0,9% en el resto (fig. 5). Estos datos podrían justificar la planificación de un estudio prospectivo para valorar si se trata de una alteración extrapolable a todos los enfermos con DFT y, si así fuera, si podría atribuirse a los mismos mecanismos por los que se sospecha que hay una mayor incidencia de bradicardia. Es decir, si se debe a la atrofia de estructuras del lóbulo temporal y/o frontal que intervienen en la modulación autonómica de funciones cardiovasculares.
En resumen, los resultados obtenidos a partir de registrar puntualmente la frecuencia cardíaca en pacientes con síntomas cognitivos revelan una mayor prevalencia de bradicardia en los enfermos con DFT. La alteración resulta más frecuente, pero no exclusiva, en quienes predominan los síntomas conductuales frente a los afásicos. Los resultados provienen de analizar observaciones puntuales en muestras pequeñas, por lo que simplemente invitan a ampliar la observación. Si el hallazgo se confirmase, la presencia de bradicardia podría constituir un signo de apoyo a la sospecha de esta entidad nosológica (DFT), en el diagnóstico diferencial etiológico de las personas con síntomas cognitivos y, además, obligaría a tomar precauciones cuando fuera necesario prescribir a estos pacientes fármacos con acción bradicardizante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.