La proproteína convertasa subtilisina kexina tipo 9 (PCSK9) desempeña un papel importante en la modulación de los niveles plasmáticos de colesterol unido a las lipoproteínas de baja densidad (LDLC). La PCSK9 se une al receptor del LDLC (LDL[R]) perturba su reciclado endocítico y lo dirige a la degradación lisosomal. Por tanto, la activación de PCSK9 disminuye la expresión de los LDL(R) a nivel hepático e inhibe la captación de LDLC, lo que provoca hipercolesterolemia.
DesarrolloHoy se sabe que diferentes polimorfismos de la PCSK9 se asocian a la aparición de ictus isquémico. Por otra parte, los fármacos inhibidores de PCSK9 inhiben la unión de PCSK9 con el LDL(R) y evitan la degradación del LDL(R) por lo que aumentan la captación hepática de LDLC, disminuyendo sus niveles en sangre.
Diferentes estudios con anticuerpos monoclonales en fase 2 y 3 como el OSLER y el ODYSSEY LONG TERM han demostrado la eficacia y seguridad de los nuevos anticuerpos monoclonales contra PCSK9 como el evolucumab y alirocumab, y los primeros análisis exploratorios ya evidencian su eficacia en la disminución de eventos vasculares, incluidos los ictus.
ConclusionesAunque el número de ictus recogidos en estos estudios ha sido bajo, en la actualidad existen varios ensayos centrados en resultados cardiovasculares en curso con evolocumab (estudio FOURIER), con alirocumab (estudio ODYSSEY OUTCOMES) y con bococizumab (estudios SPIRE-1 y SPIRE-2) que nos desvelarán el auténtico potencial de estos fármacos en la enfermedad cardiovascular y, en particular, en la prevención del ictus.
Proprotein convertase subtilisin/kexin type 9 (PCSK9) plays an important role in the modulation of plasma levels of low density lipoprotein cholesterol (LDLC). PCSK9 binds to the LDL receptor (LDLR), disrupts its endocytic recycling itinerary and directs it to lysosomal degradation. Activation of PCSK9 can thus decrease the expression of LDLR in the liver and inhibit LDL uptake, which leads to hypercholesterolaemia.
DevelopmentCurrently we now know that different polymorphisms of PCSK9 are associated with the occurrence of ischaemic stroke. On the other hand, PCSK9 inhibitors prevent binding of PCSK9 to LDLR and inhibit degradation of LDLR, which results in increased hepatic uptake of LDL and lower LDL levels in blood.
Different phase 2 and 3 studies, including OSLER and ODYSSEY LONG-TERM, have demonstrated the efficacy and safety of the new monoclonal antibodies against PCSK9 such as evolucumab and alirocumab, and the first exploratory analyses have shown evidence of their efficacy in decreasing vascular events, including stroke.
ConclusionsAlthough few strokes have been reported by these studies, new ongoing trials examining the cardiovascular effects of evolucumab (FOURIER study), alirocumab (ODYSSEY OUTCOMES study), and bococizumab (SPIRE-1 and SPIRE-2 studies) will reveal the true potential of these drugs, particularly for the prevention of stroke.
La aprobación en 2015 por la Food and Drugs Administration (FDA) y posteriormente por la European Medicines Evaluation Agency de los nuevos inhibidores de la proproteína convertasa subtilisina kexina tipo 9 (PCSK9) el alirocumab y el evolocumab, que consiguen reducciones de hasta un 60-70% de los niveles de colesterol unido a la lipoproteína de baja densidad (LDLC) ha abierto nuevas perspectivas en el tratamiento de la dislipidemia y de la enfermedad cardiovascular (CV), en particular del ictus, principal causa de mortalidad vascular a nivel mundial1.
Sin embargo, hasta llegar ese momento, el camino ha sido largo y ha sido necesario ir eliminando muchos paradigmas que estaban asumidos como ciertos.
Primero, durante muchos años no estaba claro que los niveles de colesterol se relacionaran con el riesgo de ictus, como se reflejaba en la mayoría de los estudios epidemiológicos y observacionales, así como los primeros metaanálisis2. Lo cual se explicaba, entre otras razones, por qué los ictus son un grupo heterogéneo de enfermedades y por los problemas metodológicos de los estudios3.
Posteriormente, durante años también se pensaba que la única terapia hipolipidemiante que reducía el riesgo de ictus eran las estatinas, siendo la dieta u otros fármacos inútiles para este fin4. Esto se basaba en el argumento de que la reducción de los accidentes cerebrovasculares en los ensayos con estatinas no era debido fundamentalmente a reducir el LDLC, sino a efectos «pleiotrópicos» de las mismas3.
No obstante, la reciente publicación del estudio IMPROVE-IT5 demostró que la adición a simvastatina de ezetimiba, un inhibidor de la absorción del colesterol, con la consecuente reducción del LDLC por fármacos distintos de la estatinas también reducían significativamente los eventos CV, incluido también el riesgo de ictus isquémico (hazard ratio [HR]: 0,79; p=0,008).
Así, un reciente metaanálisis que ha incluido los resultados del IMPROVE-IT, con más de 266.973 pacientes, demuestra que la reducción de un 1% del colesterol total, sin importar la forma como lo bajemos, consigue una reducción de un 0,8% del riesgo relativo de ictus6.
De hecho, los primeros ensayos clínicos con inhibidores de la PCSK9 en fase 2 y 3 han demostrado que estos agentes hipolipidemiantes también disminuyen la aparición de eventos CV, incluidos el ictus, por lo que se supone que a corto y medio plazo puedan desempeñar un papel clave en la terapia preventiva del ictus.
Mecanismo de acción de los inhibidores de la PCSK9Cuando en el año 2003 la PCSK9 fue descrita por primera vez, se consideró como una proteína importante para la regeneración del hígado y la diferenciación neuronal, por lo que originalmente se denominó convertasa-1 neuronal regulada por apoptosis7, aunque hoy se sabe que es miembro de una familia de serinas proteasas secretoras, y que desempeña un papel esencial en la maduración proteolítica de varias proteínas secretoras como neuropéptidos, factores de crecimiento, citocinas y prohormonas8. Los miembros de las PCSK escinden residuos de aminoácidos y modulan la actividad de proteínas precursoras. Además, algunos miembros de las PCSK están implicados en la regulación de la actividad de importantes moduladores del metabolismo lipídico (PCSK1, PCSK3, PCSK5, PCSK6 y PCSK9)9.
La PCSK9 desempeña un papel importante en la modulación de los niveles plasmáticos de LDLC a través de un mecanismo postranscripcional al actuar como inhibidor del receptor LDL (LDL[R]). La PCSK9 se une al dominio de repetición del factor de crecimiento epidérmico A del LDL(R) posicionado sobre la superficie del hepatocito. Una vez que se une con el LDL(R) en la superficie de las células del hígado, lo acompaña al sistema lisosómico de las células del hígado para su destrucción, evitando así que pueda volver a la superficie de las células del hígado. El resultado neto es una disminución en la población de LDL(R) hepática.
Por lo tanto, al existir un menor número de LDL(R) en la superficie de las células del hígado para limpiar LDLC, aumentarán los niveles en sangre de LDLC, provocando hipercolesterolemia8,9.
La proteína PCSK9 se expresa en varios órganos, principalmente en el hígado, y en menor medida en el intestino y los riñones. El gen de la PCSK9 se encuentra en el cromosoma 1p32.3, incluye 12 exones y codifica una glucoproteína inactiva de 692 aminoácidos8.
Los fármacos inhibidores de PCSK9 inhiben la unión de PCSK9 con el LDL(R) y evitan la degradación de LDL(R), por lo que aumentan la captación hepática de LDLC, disminuyendo sus niveles en sangre3,8.
Por lo tanto, los inhibidores de PCSK9 tendrían el mismo mecanismo final para la reducción de LDLC que las estatinas, al incrementar la actividad de LDL(R) en la superficie de hepatocitos. No obstante, las estatinas, al inhibir la enzima HMG-CoA (3-hidroxi-3-metil-glutaril-CoA reductasa), aumentarían el número de LDL(R) en la superficie del hepatocito y a su vez los niveles de PCSK9 aumentarían para regular el número de LDL(R), contribuyendo así a una limitación en la eficacia de las estatinas en la reducción de los niveles de LDLC y facilitando la eficacia de los inhibidores de PCSK9 al asociarse a las estatinas3.
Papel de los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9. Relación proproteína convertasa subtilisina/kexina tipo 9 e ictus isquémicoComo se ha comentado, la PCSK9 fue descubierta en el año 2003. Ese año, el grupo de Seidah et al.7 identificó el noveno miembro de la familia PCSK. Ese mismo año, se evidenció el papel clave de la molécula en el metabolismo del colesterol con la identificación de dos mutaciones en PCSK9 con ganancia de función en 2 familias francesas con el diagnóstico de hipercolesterolemia familiar heterocigota y sin mutaciones detectables en los genes del receptor de LDL ni en la apo B10010. Posteriormente, se descubrió el papel potencial de la inhibición de la proteína PCSK9 en el descenso del LDLC, cuando en 2005 se descubrió la primera mutación con pérdida de función de la PSCK9. Se vio que dicha mutación se asociaba a una menor concentración de LDLC11 y, lo que es más importante, según se demostró en el estudio Ateherosclerosis Risk in Comunities (ARIC) ese descenso del LDLC se asociaba a una disminución del riesgo de entre un 28-47% de enfermedad coronaria12, o lo que es lo mismo, que tenía una fuerte correlación con la enfermedad CV. Por lo que parecía, por tanto, que la supresión de la acción de la PCSK9 podría ser una diana terapéutica muy atractiva en pacientes con hipercolesterolemia.
Tal es así que, fruto de numerosas investigaciones, en el verano del 2015, a los 12 años de la fecha de su descubrimiento, la FDA aprobó por primera vez el uso comercial de los primeros inhibidores de la PCSK9.
Por otra parte, desde hace casi una década contamos con la evidencia de que existe una clara relación entre los diferentes polimorfismos del gen de PCSK9 y el riesgo de ictus isquémico. Abboud et al.13 demostraron por primera vez un papel potencial del polimorfismo E670G (rs505151) del gen PCSK9 en la enfermedad cerebrovascular. En el Belgium Stroke Study se incluyó a 237 pacientes de edad media (45-60) con enfermedad cerebrovascular de pequeño vaso y aterosclerosis de gran vaso, y se comparó con 326 controles pareados sin antecedentes de ictus. En el análisis multivariante, los portadores de alelo menor (G) aparecieron como un predictor significativo de aterosclerosis de gran vaso (OR=3,52; IC del 95%: 1,25-9,85; p=0,017). Además, utilizando una serie finlandesa de autopsias consecutivas de 604 varones y mujeres (edad media 62,5 años), los portadores de alelo G tendieron a tener una aterosclerosis más severa en el polígono de Willis y en sus ramas, por lo que concluían que el gen PCSK9 se asocia con el riesgo de ictus isquémico aterotrombótico por aterosclerosis de arteria grande e indicaban que el riesgo estaría mediado por la severidad de la aterosclerosis intracraneal.
Posteriormente, los resultados se han confirmado en otras poblaciones, como en la población Han en China, donde se ha visto que los polimorfismos rs1711503 como rs2479408 de PCSK9 se correlacionan con la aparición de ictus isquémico14. O en un estudio de cohorte en Túnez, donde el alelo G670 del gen de PCSK9 también parece ser un factor de riesgo independiente de aparición de ictus isquémico15.
Un reciente metaanálisis16 sobre el polimorfismo rs505151 del gen PCSK9 sobre 3 estudios que incluyó a 759 casos y 906 controles; concluyó que la variante del alelo PCSK9 rs505151 A>G (resultado una sustitución de aminoácidos del glutamato a la glicina en la posición 670 [p.E670G] del exón 12, y que provoca una actividad enzimática alterada de PCSK9) puede contribuir a la susceptibilidad al ictus isquémico, aumentando su riesgo un 36% (OR=1,36, IC del 95%: 1,01-1,58).
Por lo que los diferentes polimorfismos del gen PCSK9 podrían convertirse no solo en factores de riesgo del ictus isquémico, sino además en un potencial marcador de riesgo predictivo de ictus isquémico.
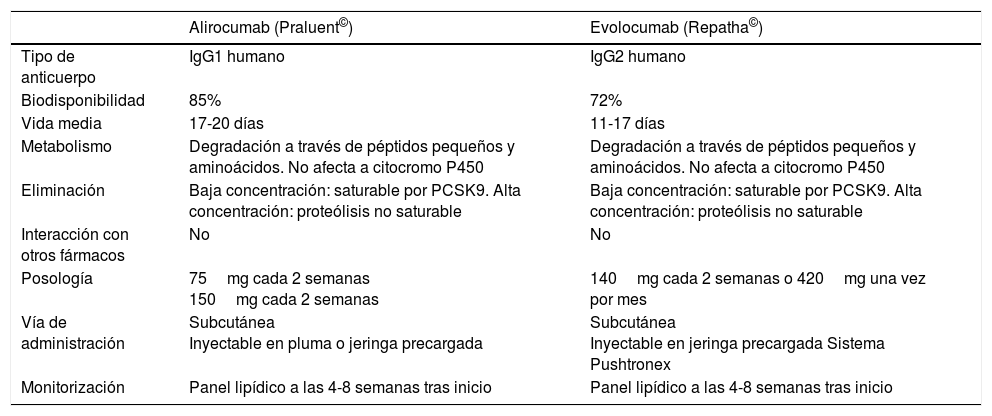
Ensayos clínicosEn la actualidad existen 2 anti-PCSK9 comercializados, alirocumab y evolucumab (tabla 1) y aproximadamente una decena de estos anticuerpos monoclonales en distintas etapas de desarrollo con numerosos estudios de fase 2 y 3, además de estudios de poscomercialización que se están realizando y que se prevé que se publiquen en el 2017 y el 2018.
Comparación de los inhibidores de la PCSK9 comercializados
| Alirocumab (Praluent©) | Evolocumab (Repatha©) | |
|---|---|---|
| Tipo de anticuerpo | IgG1 humano | IgG2 humano |
| Biodisponibilidad | 85% | 72% |
| Vida media | 17-20 días | 11-17 días |
| Metabolismo | Degradación a través de péptidos pequeños y aminoácidos. No afecta a citocromo P450 | Degradación a través de péptidos pequeños y aminoácidos. No afecta a citocromo P450 |
| Eliminación | Baja concentración: saturable por PCSK9. Alta concentración: proteólisis no saturable | Baja concentración: saturable por PCSK9. Alta concentración: proteólisis no saturable |
| Interacción con otros fármacos | No | No |
| Posología | 75mg cada 2 semanas 150mg cada 2 semanas | 140mg cada 2 semanas o 420mg una vez por mes |
| Vía de administración | Subcutánea Inyectable en pluma o jeringa precargada | Subcutánea Inyectable en jeringa precargada Sistema Pushtronex |
| Monitorización | Panel lipídico a las 4-8 semanas tras inicio | Panel lipídico a las 4-8 semanas tras inicio |
Entre los estudios de fase 2 y 3 más prolongados realizados hasta el momento con estos anticuerpos están los estudios OSLER (Open-Label Study of Long-Term Evaluation against LDL Cholesterol)17 con evolucumab, comercializado en España con el nombre de Repatha© (Angen) y que comprenden el estudio OSLER-1 (pacientes en fase 2) y el OSLER-2 (pacientes en fase 3), y el estudio ODYSSEY LONG TERM (Long-term Safety and Tolerability of Alirocumab in High Cardiovascular Risk Patients with Hypercholesterolemia Not Adequately Controlled with Their Lipid Modifying Therapy)18, con alirocumab comercializado con el nombre de Praluent® (Sanofi).
El estudios OSLER 1 y 217 asignaron al azar en conjunto a 4.465 pacientes que habían participado anteriormente en «ensayos padres» de evolocumab para recibir durante aproximadamente un año, ya sea la terapia estándar sola (n=1.489) o unida a una inyección de evolocumab subcutánea (n=2.976) una vez cada 2 semanas a una dosis de 140mg o una vez al mes a 420mg. El objetivo final primario fue la incidencia de eventos adversos relacionados con el tratamiento. Los objetivos secundarios incluyeron los cambios en los niveles de LDLC y resultados clínicos CV, que se consideraron preespecificados y «exploratorios». Los resultados de ambos estudios OSLER fueron analizados en conjunto.
Los investigadores encontraron que en los pacientes que recibieron evolocumab disminuyó su LDLC en un 61%, de una media de 120mg/dl a 48mg/dl. Las reducciones se mantuvieron durante el período medio de seguimiento de 11 meses. Los investigadores del estudio también observaron evidencias de reducción en la tasa de eventos CV entre los pacientes en el grupo evolocumab. Al año, la tasa de eventos CV fue menor (0,95%) en el grupo evolocumab, en comparación con el grupo de tratamiento estándar (2,18%), con una reducción próxima al 50% (HR 0,47; IC del 95%: 0,28-0,78; p=0,003).
En relación con el alirocumab, aunque estudios previos habían mostrado niveles significativamente más bajos de LDLC después de 8 a 12 semanas de tratamiento con alirocumab más estatina, los investigadores de ODYSSEY18 buscaron evaluar la combinación durante un seguimiento más largo. El estudio incluyó a 2.341 pacientes (63,2% hombres, edad media 60 años) considerados de alto riesgo CV, con niveles de LDLC de al menos 70mg/dl y recibiendo una dosis máxima tolerada de estatinas. Todos fueron asignados al azar a recibir también 150mg de alirocumab por inyección subcutánea cada 2 semanas (n=1.553) o placebo (n=788). El criterio principal de valoración fue el cambio en los niveles de LDLC desde el inicio hasta la semana 24. En ese momento, los resultados mostraron que el nivel de LDLC calculado se redujo en un 61% para el grupo de alirocumab frente a un 0,8% para el grupo de placebo (p < 0,001). El nivel medio absoluto de LDLC a las 24 semanas fue de 48mg/dl frente a 119mg/dl, respectivamente. Además, los niveles reducidos permanecieron constantes durante las 78 semanas completas observadas. Al igual que en el estudio con evolocumab, los que recibieron alirocumab presentaron menor número de eventos CV (1,7% frente al 3,3% de los que recibieron placebo, HR 0,52; p=0,02). Es importante destacar que, entre los efectos adversos, además de reacciones locales en el sitio de inyección y mialgias (sobre un 4 y un 3%, respectivamente), ambos anti-PCSK9 presentaron como efecto adverso eventos neurocognitivos (0,9 vs. 0,3% con evolocumab y 1,2% vs. 0,5% con alirocumab). Estos incluían la amnesia y el deterioro de la memoria y no variaron de forma significativa según el nivel de LDLC alcanzado17,18. El efecto de los inhibidores de la PCSK9 sobre la función cognitiva está siendo estudiado con el ensayo EBBINGHAUS (Evaluating PCSK9 Binding antiBody Influence oN coGnitive HeAlth in High cardiovascular Risk Subjects)19, un subestudio del estudio FOURIER con evolocumab y con el análisis del ensayo ODYSSEY OUTCOMES trial, con alirocumab20.
No obstante, aunque en los estudios OSLER y ODYSSEY se vio que los inhibidores de la PCSK9 también disminuían el riesgo de eventos cerebrovasculares, el número de pacientes con un ictus en ambos estudios fue pequeño: en los estudios de OSLER, un total de 3 ictus en el grupo de tratamiento activo frente a 2 en el de tratamiento estándar, y un accidente isquémico transitorio (AIT) frente a 5, respectivamente, mientras que en el estudio ODYSSEY el número ictus isquémicos fue de 2 en el grupo de alirocumab frente a 9 en el control17,18.
De hecho, un reciente metaananálisis21 sobre los primeros resultados de los inhibidores de la PCSK9 en el ictus, que ha incluido a los 6.806 pacientes recogidos en los estudio OSLER y ODYSSEY, no han demostrado un efecto claro en la reducción de ictus (razón de riesgo [RR] 1,43; IC del 95%: 0,45-4,57, p=0,55). Tampoco se observaron diferencias significativas en el riesgo de accidente cerebrovascular cuando se incluyeron los AIT en el análisis (RR 0,65; IC del 95%: 0,25-1,68, p=0,37). Es muy probable que la falta de asociación se pueda explicar por el escaso número de ictus acontecidos, un tiempo de seguimiento muy corto —de media 1,5 años—, y que la mayoría de los enfermos (más del 75%) estaban ya tomando estatinas, entre otros.
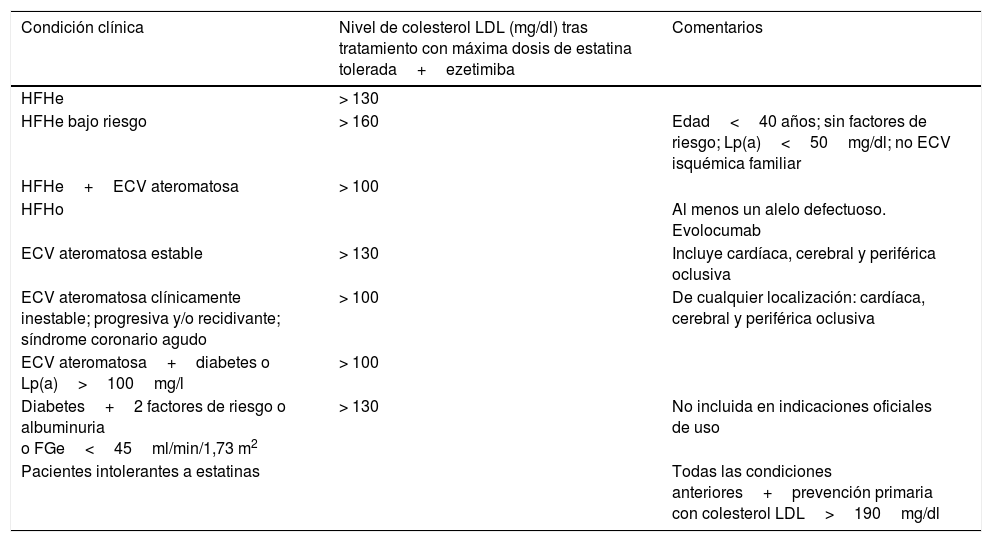
Conclusiones: Presente y futuro de los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 en el ictusEn la actualidad, existen diferentes directrices y recomendaciones para el uso de los inhibidores de la PCSK9, como la de la Sociedad Española de Arteriosclerosis (SEA)22 (tabla 2). Aunque, en general, los grupos de pacientes en los cuales estos fármacos parecen tener un papel central son 3: los sujetos portadores de una hipercolesterolemia familiar, los pacientes que hayan presentado eventos CV o de alto riesgo CV que con el tratamiento estatinas de alta potencia no se logran los objetivos terapéuticos, y, por último, los pacientes que son intolerante a las estatinas.
Indicaciones de los inhibidores de la PCSK9 según el documento de consenso de la Sociedad Española de Arteriosclerosis (SEA)
| Condición clínica | Nivel de colesterol LDL (mg/dl) tras tratamiento con máxima dosis de estatina tolerada+ezetimiba | Comentarios |
|---|---|---|
| HFHe | > 130 | |
| HFHe bajo riesgo | > 160 | Edad<40 años; sin factores de riesgo; Lp(a)<50mg/dl; no ECV isquémica familiar |
| HFHe+ECV ateromatosa | > 100 | |
| HFHo | Al menos un alelo defectuoso. Evolocumab | |
| ECV ateromatosa estable | > 130 | Incluye cardíaca, cerebral y periférica oclusiva |
| ECV ateromatosa clínicamente inestable; progresiva y/o recidivante; síndrome coronario agudo | > 100 | De cualquier localización: cardíaca, cerebral y periférica oclusiva |
| ECV ateromatosa+diabetes o Lp(a)>100mg/l | > 100 | |
| Diabetes+2 factores de riesgo o albuminuria o FGe<45ml/min/1,73 m2 | > 130 | No incluida en indicaciones oficiales de uso |
| Pacientes intolerantes a estatinas | Todas las condiciones anteriores+prevención primaria con colesterol LDL>190mg/dl |
ECV: enfermedad cardiovascular; FGe: filtrado glomerular estimado; HFHe: hipercolesterolemia familiar heterocigota; HFHo: hipercolesterolemia familiar homocigota; LDL: lipoproteínas de baja densidad; Lp(a): lipoproteína(a); PCSK9: proproteína convertasa subtilisina/kexina tipo 9.
Tomado de Masana et al.22
En la actualidad, también existe un debate sobre el costo-eficacia de los inhibidores de PCSK9, si se asume un costo anual de $ 10.000 por año, según algunos autores sería necesaria la reducción del precio anual de estos medicamentos un 50-60% para que fueran coste-efectivos23. Lo cual es una limitación importante a la hora de su uso y hace que el inicio y la continuación de tratamiento se deban ajustar a unos criterios de uso restringidos.
No obstante, el valor final real de los inhibidores de PCSK9 se medirá por su efecto en los resultados clínicos sobre eventos CV. El análisis exploratorio prospectivo de los estudios con anti-PCSK9ha demostrado ya una reducción en los eventos CV mayores entre los que se incluye el ictus, y, aunque el número de ictus recogidos ha sido bajo, en la actualidad existen varios ensayos centrados en resultados CV en curso con evolocumab (FOURIER24; NCT01764633), alirocumab (ODYSSEY OUTCOMES20; NCT01663402), y bococizumab25 (SPIRE-1; NCT01975376 y SPIRE-2; NCT01975389) que nos desvelarán el auténtico potencial de estos fármacos en la enfermedad CV y, en particular, en la prevención del ictus.
Conflicto de interesesLos autores declaran no tener conflicto de interés.