Revisar los fundamentos actuales para el diagnóstico, en la práctica médica, del vasospasmo y la isquemia cerebral tardía por hemorragia subaracnoidea espontánea.
DesarrolloSe revisan las pruebas disponibles para investigar el vasospasmo (Doppler transcraneal, métodos angiográficos) y la isquemia cerebral tardía (examen clínico, tomografía computarizada convencional, resonancia magnética, tomografía computarizada de emisión, electroencefalografía, microdiálisis) en cuanto al tipo y calidad de la información que brindan, además de sus ventajas y limitaciones. Se aborda el diagnóstico diferencial, graduación y pautas de aplicación.
ConclusionesEn la práctica clínica actual la pauta más recomendable para el diagnóstico y la monitorización del vasospasmo y la isquemia cerebral tardía consiste, en primer lugar, en el examen clínico y por Doppler transcraneal. La monitorización electroencefalográfica, las técnicas de tomografía computarizada y resonancia magnética multimodal son apropiadas en situaciones específicas. La angiografía por sustracción digital es el estándar para el diagnóstico del vasospasmo cerebral. Se insiste en la necesidad de mejorar la calidad de los futuros artículos sobre la utilidad de las pruebas diagnósticas señaladas.
A review of current foundations for the medical diagnosis of vasospam and delayed cerebral ischaemia due to spontaneous subarachnoid haemorrhage.
DevelopmentA review of available tests for the investigation of vasospasm (transcraneal Doppler, angiographic methods) and delayed cerebral ischaemia (clinical exam, computerised tomography by X rays, magnetic resonance, emission computerised tomography, electroencephalography, microdialysis) based on type and quality of information, advantages and limitations. Grading and trends for application were also considered for differential diagnosis.
ConclusionsIn current clinical practice the most advisable guideline for screening and diagnosis monitoring of vasospasm and delayed cerebral ischaemia is in the first place, based on clinical examination and transcraneal Doppler. The electroencephalographic monitoring, computerised tomography techniques and multi-modal magnetic resonance are justified in specific situations. Digital subtraction angiography is the current gold standard for diagnosis of cerebral vasospasm. There is a need for more and higher quality articles about the utility of diagnostic tests in this context.
La isquemia cerebral tardía (ICT) es una causa importante de morbilidad y mortalidad para los pacientes que sufren de hemorragia subaracnoidea (HSA)1. La entidad incentiva el interés científico actualmente debido a que se reconoce la complejidad de su etiopatogenia, clásicamente atribuida al vasospasmo cerebral, y la incertidumbre o controversia en varias áreas del manejo diagnóstico porque hay datos imprecisos o equívocos2–5.
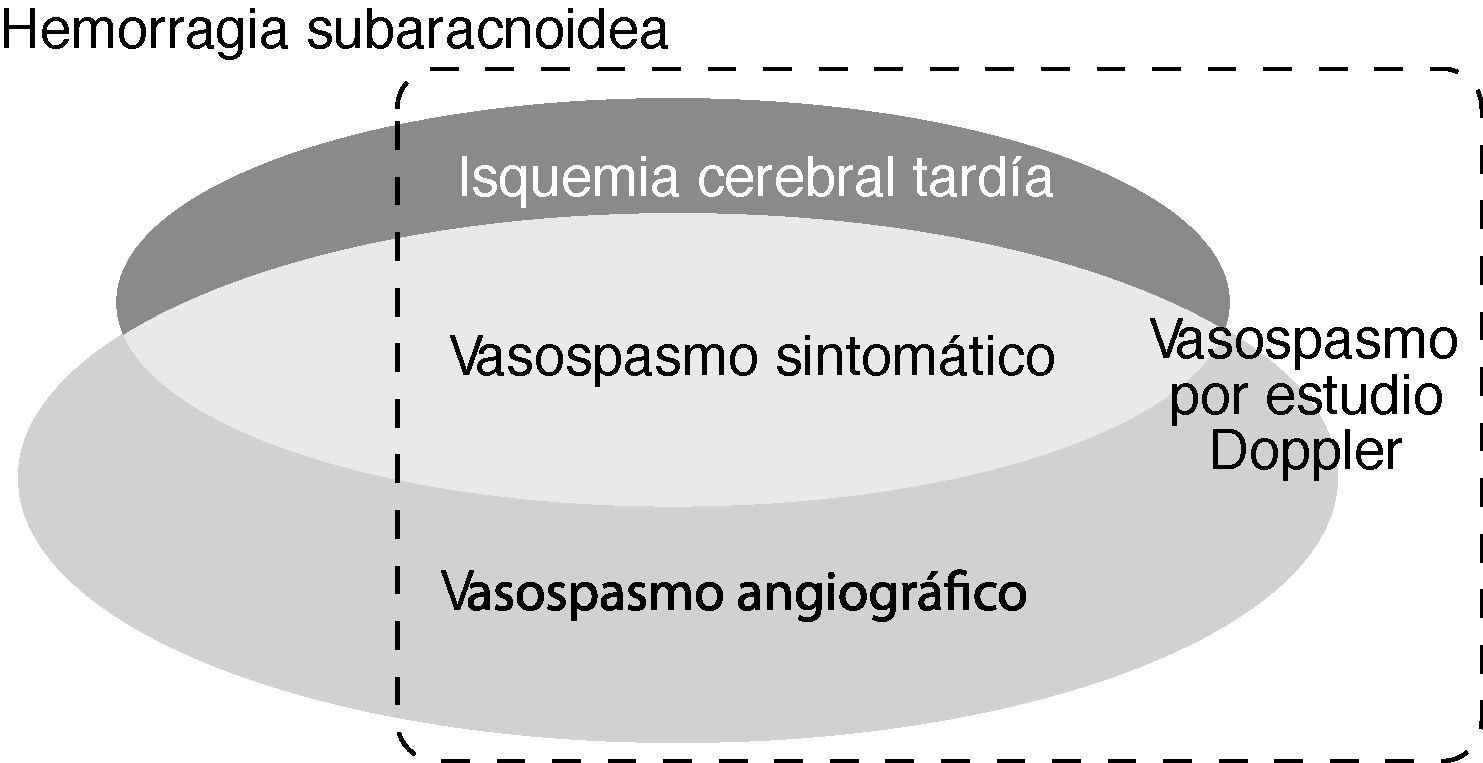
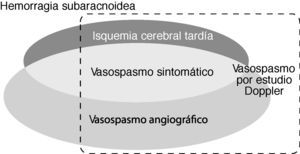
Un aspecto clave en el manejo de los pacientes con HSA radica en el diagnóstico de la ICT y el vasospasmo porque la institución oportuna del tratamiento puede prevenir el infarto cerebral. Por otro lado, el reconocimiento precoz y preciso de ambos trastornos permite valorar los efectos de las intervenciones terapéuticas (fig. 1). A continuación se revisan los fundamentos actuales para el diagnóstico en la práctica médica del vasospasmo cerebral y la ICT.
Esquema que refleja la relación y relevancia clínica de las principales definiciones relacionadas con el vasospasmo cerebral. La isquemia cerebral tardía (ICT) comprende el vasospasmo sintomático y/o el infarto cerebral secundario a vasospasmo. Puede haber pacientes con vasospasmo angiográfico, vasospasmo por estudio sonográfico o con hemorragia subaracnoidea sin ICT.
Los artículos se identificaron a través de los servicios de PubMed e Imbiomed con términos de búsqueda acorde al idioma inglés (cerebral vasospasm, delayed cerebral ischemia, subarachnoid hemorrhage) o su equivalencia al español, respectivamente. Se seleccionaron las investigaciones originales, metaanálisis y revisiones de los últimos 10 años, accesibles a texto completo, y que emiten valoraciones específicas sobre las pruebas diagnósticas de interés. Las revisiones generales sobre las pruebas diagnósticas abordadas, aunque cumplen la mayoría de los criterios expresados, se escogieron a partir de los vínculos brindados por los artículos primariamente identificados.
Manifestaciones clínicasLas manifestaciones clínicas de la ICT son esencialmente neurológicas. Consisten en disminución del estado de conciencia o déficit neurológico focal (síntomas nuevos o empeoramiento de la manifestación previamente detectada). Son distintivas las afecciones de la arteria cerebral anterior (ACA) (abulia, mutismo acinético y, ocasionalmente, paraparesia) y de la arteria carótida interna (ACI) o la cerebral media (ACM) (hemiparesia o hemiplejía, que pueden asociarse con déficit sensitivo, hemianopsia y afasia)1,6–8. La paresia faciobraquial y la disartria pueden deberse al espasmo de los tercios superior y medio del tronco basilar con infarto pontino paramediano9. No obstante, en la circulación vertebrobasilar los signos clínicos son más infrecuentes y pueden ser sutiles, difusos e inespecíficos10. Con la isquemia del tronco cerebral ocurren trastornos hemodinámicos y respiratorios. El espasmo de las arterias perforantes que irrigan el sistema reticular activador ascendente se ha relacionado con la alucinosis peduncular (alucinaciones visuales vívidas, ritmos anormales de sueño, vigilia o insomnio). La cuadrantanopsia superior se relaciona con trastornos de la circulación posterior11.
Los síntomas de ICT se relacionan con manifestaciones sistémicas (clínicas y analíticas) que no deben considerarse como datos indicativos para el diagnóstico. La aparición de vómitos, el aumento de intensidad de la cefalea y de la rigidez de nuca coinciden temporalmente con el vasospasmo, pero se explican mejor por la progresión de la irritación de las meninges y la hipertensión intracraneal. La fiebre, el aumento de la frecuencia del pulso y la leucocitosis indican, en primer lugar, una infección. Asimismo, la hiponatremia, la hipovolemia, la hipotensión arterial, las alteraciones cardíacas y la hipoxia se implican como factores predisponentes7,12,13.
La intensidad de la disfunción neurológica depende del grado, la localización y la extensión de la afección arterial, el estado compensatorio de la circulación colateral y la presión de perfusión cerebral y de la gravedad de la lesión cerebral. El déficit focal puede fluctuar en intensidad o aparecer y desaparecer. En los pacientes con una peor graduación clínica o bajo los efectos de los sedantes es difícil diagnosticar el deterioro neurológico por las limitaciones para ejecutar el examen clínico. El infarto cerebral asintomático puede ocurrir en los pacientes con deterioro de la conciencia y constituye cerca del 25% de las ICT1,14–16. Otro factor involucrado en la detección clínica es el adiestramiento neurológico del personal médico y la ejecución de las valoraciones con la frecuencia y profundidad apropiada.
La ICT cursa con manifestaciones clínicas, súbitas o insidiosas, generalmente a los 7-10 días del sangrado. Cuando aparece un déficit neurológico en los primeros 3 días después de ocurrir la HSA o después del día 12, hay que revalorar la fecha y plantear la posibilidad de un sangrado inadvertido. El déficit neurológico agudo se puede explicar por otros factores (tabla 1). Estos factores causales o concurrentes se precisan usualmente por los caracteres clínicos, los datos de laboratorio y de neuroimagen estructural5–7,12,13,17,18. Sin embargo, varios de estos factores pueden combinarse.
Diagnóstico diferencial del vasoespasmo cerebral y la isquemia cerebral tardía.
| Trastornos neurológicos |
| Hemorragia cerebral parenquimatosa, intraventricular, subdural y epidural |
| Progresión del edema cerebral e hipertensión intracraneal |
| Hidrocefalia, resangrado subaracnoideo, isquemia cerebral difusa |
| Crisis epilépticas clínicas y subclínicas, estado postictal |
| Hiperemia |
| Vasoconstricción cerebral reversible posparto y por sustancias vasoactivas |
| Vasospasmo acompañado de migraña y vasospasmo espontáneo |
| Estenosis ateromatosa, hipoplasia, otras anomalías preexistentes del polígono de Willis, variaciones de la técnica angiográfica |
| Complicaciones de la angiografía (embolia cerebral, disección arterial) |
| Retracción quirúrgica y oclusión arterial transitoria |
| Oclusión vascular por el clip |
| Compresión directa por el aneurisma |
| Embolia de los dispositivos endovasculares |
| Efecto secundario de los fármacos sedantes |
| Trastornos no neurológicos |
| Hipernatremia, hiponatremia, hipovolemia, hipotensión, hipoxia, arritmias cardíacas, insuficiencia cardíaca |
| Infecciones (especialmente pulmonar y urinaria) y fiebre |
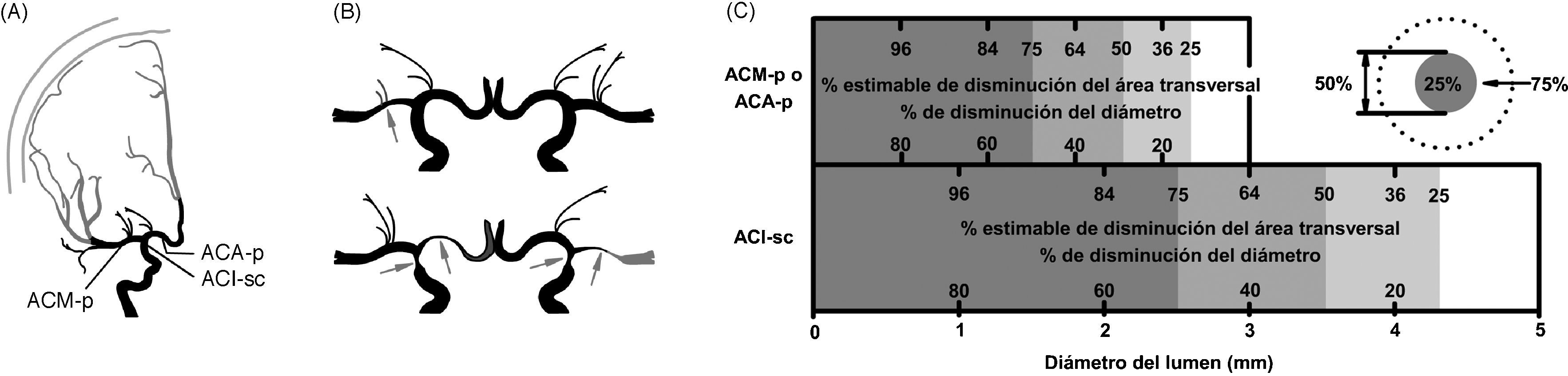
La angiografía cerebral por sustracción digital (ASD) es la prueba estándar para diagnosticar el vasospasmo cerebral5–7,16,19,20. La evidencia radiográfica de vasospasmo consiste en la atenuación del calibre y/o pobre visualización de la arteria con prolongación del tiempo de circulación en comparación con un angiograma previo o con los valores estándar. El estrechamiento del calibre puede ser: ligero (1-25%), moderado (25-50%), severo (50-75%) y muy severo (> 75%) (fig. 2).
Representación del método para graduar el vasospasmo en la arteriografía del sistema carotídeo. A: esquema de la ubicación de las principales ramas de la carótida interna en una vista anteroposterior. ACA-p: segmento proximal de la arteria cerebral anterior; ACI-sp: segmento supraclinoideo de la arteria carótida interna; ACM-p: segmento proximal de la arteria cerebral media. B: diferentes grados de vasospasmo. C: método práctico para estimar el porcentaje de estenosis acorde al diámetro del lumen arterial. Una reducción del 50% del diámetro se estima que equivale al 75% de disminución del área transversal. Porcentaje de estenosis=[1−((D estenosis 1×D estenosis 2)/(D normal 1×D normal 2))]×100. Donde D estenosis 1 y D estenosis 2 = diámetros del segmento estenótico en dos planos, y D normal 1 y D normal 2 = diámetros de la arteria normal en dos planos. En la práctica se requiere de la magnificación de las imágenes para delinear claramente los bordes de las arterias y apreciar diferencias de 0,1mm.
El “vasospasmo sintomático” se define por las manifestaciones clínicas neurológicas de ICT que corresponden con la ubicación del vasospasmo radiológico (usualmente, la luz arterial es ≤ 1mm). El “vasospasmo angiográfico” se desarrolla en el 30-75% de los pacientes con HSA, pero sólo la mitad de éstos tienen síntomas clínicos de ICT (fig. 1). El espasmo arterial suele evidenciarse a los 3-5 días tras la HSA, se hace máximo a los 5-14 días y, gradualmente, se resuelve en 2-4 semanas. El trastorno se ubica preferentemente en las arterias proximales, situadas en la base del cerebro y cercanas al aneurisma intracraneal; luego puede extenderse a otras localizaciones o deteriorarse la reactividad de las arterias más distales con reducción adicional del flujo sanguíneo cerebral (FSC). Su localización se correlaciona con la región afectada por el infarto cerebral en el 25-80% de los casos1,6,7,12,20–25.
La variabilidad del diagnóstico angiográfico del vasospasmo se explica por: a) la falta de uniformidad en las muestras y en los valores para su definición y graduación (tabla 2); b) la escasa diferenciación del momento en que se realiza la angiografía; c) una técnica angiográfica deficiente, y d) escasa correlación con las otras técnicas diagnósticas o con un angiograma inicial precoz10. Algunos autores definen una reducción específica en la luz arterial como significativa (por ej., el 25, el 30 o el 50%), otros aceptan cualquier estrechamiento, y en algunos el calibre no se mide por dificultades prácticas o no se comunica17,19–23.
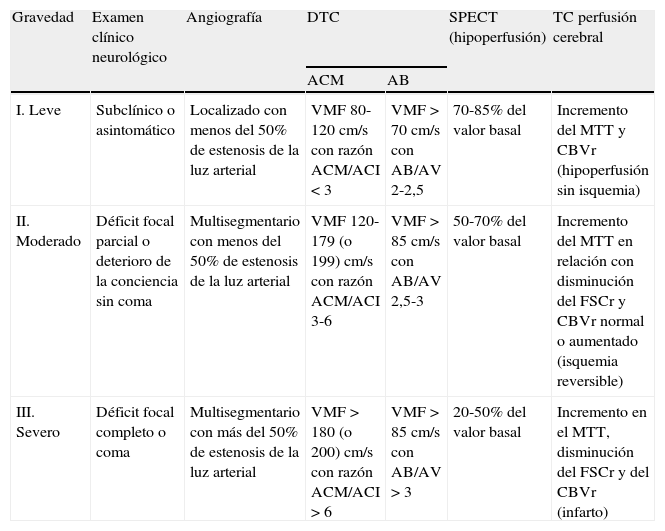
Clasificación abreviada de la gravedad del vasospasmo y la isquemia cerebral tardía6,12,20,36,37.
| Gravedad | Examen clínico neurológico | Angiografía | DTC | SPECT (hipoperfusión) | TC perfusión cerebral | |
| ACM | AB | |||||
| I. Leve | Subclínico o asintomático | Localizado con menos del 50% de estenosis de la luz arterial | VMF 80-120cm/s con razón ACM/ACI < 3 | VMF > 70cm/s con AB/AV 2-2,5 | 70-85% del valor basal | Incremento del MTT y CBVr (hipoperfusión sin isquemia) |
| II. Moderado | Déficit focal parcial o deterioro de la conciencia sin coma | Multisegmentario con menos del 50% de estenosis de la luz arterial | VMF 120-179 (o 199) cm/s con razón ACM/ACI 3-6 | VMF > 85 cm/s con AB/AV 2,5-3 | 50-70% del valor basal | Incremento del MTT en relación con disminución del FSCr y CBVr normal o aumentado (isquemia reversible) |
| III. Severo | Déficit focal completo o coma | Multisegmentario con más del 50% de estenosis de la luz arterial | VMF > 180 (o 200) cm/s con razón ACM/ACI > 6 | VMF > 85 cm/s con AB/AV > 3 | 20-50% del valor basal | Incremento en el MTT, disminución del FSCr y del CBVr (infarto) |
AB: arteria basilar; ACI: arteria carótida interna; ACM: arteria cerebral media; AV: arteria vertebral; CBVr: volumen sanguíneo cerebral relativo; DTC: Doppler transcraneal; FSCr: flujo sanguíneo cerebral regional; MTT: tiempo de tránsito medio; SPECT: tomografía computarizada por emisión monofotónica; TC: tomografía computarizada; VMF: velocidad media de flujo.
La graduación del vasospasmo por DTC es difícil por las limitaciones técnicas y la heterogeneidad de los valores utilizados. Para el diagnóstico se debe contrastar un segundo estudio con el basal obtenido dentro de las primeras 72h del inicio de la hemorragia subaracnoidea.
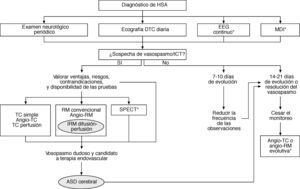
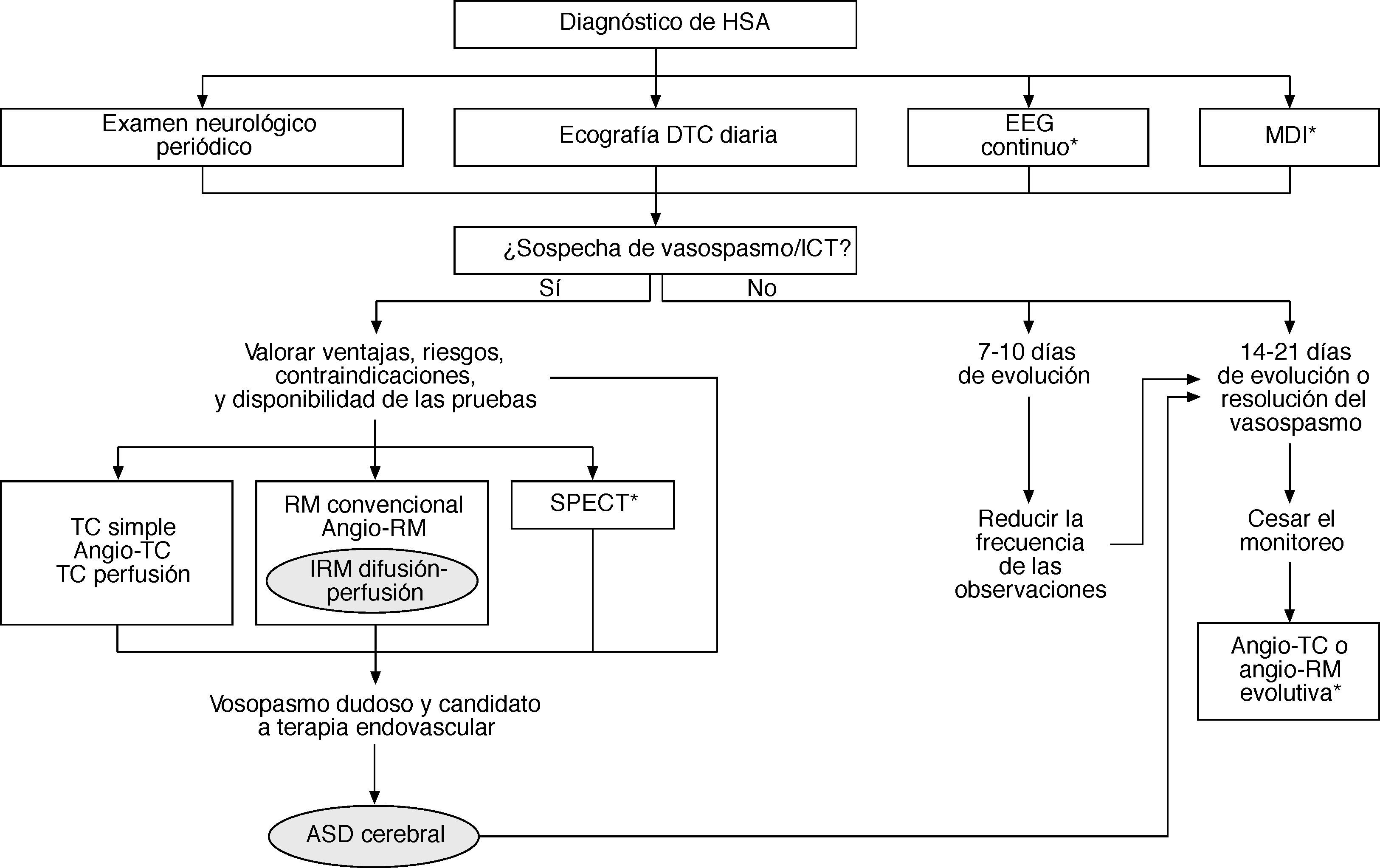
Actualmente, no es aconsejable realizar de forma sistemática o diariamente la angiografía con el único propósito de precisar si hay vasospasmo debido a: a) el riesgo ocasional de complicaciones (como inducción del vasospasmo, embolia cerebral, disección arterial y alteraciones cardíacas); b) el tiempo y los recursos requeridos para el procedimiento; c) la facilidad con que el trastorno se reconoce mediante las pruebas neurovasculares diagnósticas modernas menos invasivas; d) la demostración del estrechamiento arterial no prueba que el deterioro clínico haya sido causado por isquemia, y e) la angiografía no permite monitorizar al vasospasmo. Así, con el uso razonado de las pruebas neurovasculares no invasivas se puede restringir la indicación de la ASD al paciente que no responda al tratamiento médico del vasospasmo y sea candidato de la terapia endovascular (fig. 3).
Algoritmo diagnóstico del vasospasmo cerebral y la isquemia cerebral tardía (ICT). Se señalan las pautas convencionales más recomendables y las alternativas aplicables en situaciones específicas (*). ASD: angiografía por sustracción digital; DTC: Doppler transcraneal; EEG: electroencefalografía; HSA: hemorragia subaracnoidea; MDI: microdiálisis intracerebral; RM: resonancia magnética; TC: tomografía computarizada.
El Doppler transcraneal (DTC) permite medir las velocidades de la sangre en las porciones proximales de las grandes arterias cerebrales e inferir que los incrementos en las velocidades medias de flujo (VMF) son causados por la reducción de la luz del vaso. Comparado con el DTC convencional, el equipo de eco-Doppler color transcraneal es más sensible al permitir la visualización de las estructuras vasculares intracraneales en tiempo real. Las principales ventajas del DTC radican en que no es invasivo, no requiere de medios especiales (agentes de contraste, gases o fármacos), tiene un mínimo riesgo de efectos secundarios, su coste es relativamente bajo y se puede realizar seriadamente en pacientes encamados, en la habitación del enfermo y en el periodo intraoperatorio24,26–32.
Las VMF detectadas pueden ser particularmente informativas para el diagnóstico del vasospasmo. Generalmente las VMF de la ACM muy bajas o muy altas (< 120 o > 200cm/s) son útiles para predecir de forma negativa o positiva el vasospasmo angiográfico, y las velocidades intermedias tienen un bajo valor predictivo6,12,26,33. En contraste, Scherle et al23 obtuvieron un valor predictivo positivo bajo (42%) y un valor predictivo negativo bueno (87%) al correlacionar el vasospasmo angiográfico tomando como punto de corte las VMF de 120cm/s. El criterio de corte de la VMF recomendado para el vasospasmo varía en las restantes arterias cerebrales: 130cm/s (ACA), 110cm/s (arteria cerebral posterior), 80cm/s (arteria vertebral) y 95cm/s (arteria basilar)33.
El incremento de la VMF resulta también de la hiperemia, aislada o combinada con el vasospasmo proximal en el mismo vaso, y que usualmente se relaciona con la terapia hipertensión-hemodilución-hipervolemia. Para la precisión de estos estados son útiles los valores del índice de Lindegaard (razón de la VMF en el vaso cerebral del sistema carotídeo seleccionado con la VMF en la ACI extracraneal homolateral) y la razón de VMF de la arteria basilar con el promedio de las VMF de las arterias vertebrales (suma de la VMF de ambos lados/2) (tabla 2)27–34.
En el metaanálisis efectuado por Lysakowski et al.19, se concluyó que el DTC puede usarse con certeza para identificar a los pacientes con espasmo de la ACM (alto valor predictivo positivo), que no hay seguridad de normalidad cuando la técnica no indica el espasmo de dicha arteria y que para las restantes situaciones y arterias es escasa la evidencia de exactitud o utilidad. La mayoría de las investigaciones sobre el tema tienen baja calidad metodológica, las muestras de pacientes son pequeñas y con bajo riesgo del fenómeno, el prejuicio no puede descartarse en ausencia de observadores ciegos, y el reporte de los datos originales no puede valorarse frecuentemente. Clásicamente, hay que confiar en las definiciones de vasospasmo arbitrariamente emitidas y que no necesariamente se correlacionan con la ICT y otros datos importantes. Así, probablemente serían más informativos los coeficientes de correlación en comparación con las tablas de 2×2 basadas en criterios de corte arbitrarios.
De forma general los métodos de DTC tienen varias limitaciones importantes: a) no ofrecen el detalle estructural de los métodos angiográficos; b) no diagnostican la isquemia cerebral; c) sólo estudian los segmentos proximales de los grandes vasos intracraneales; d) los resultados pueden tener importantes variabilidad e imprecisión entre observadores porque el procedimiento depende del operador y de la definición de umbrales críticos y control de la calidad en cada institución; e) la ventana acústica puede ser inadecuada, y f) los aumentos de la VMF pueden relacionarse con diversos factores individuales (presión arterial, volumen sanguíneo, hematocrito, presión intracraneal, edad, tiempo de evolución) o con la autorregulación alterada durante la manipulación hemodinámica19,31–33.
Teniendo en cuenta las limitaciones del DTC, al iniciar los tratamientos intensivos, no deben utilizarse aisladamente los valores de VMF de las arterias cerebrales; asimismo, se hace necesario valorar los datos clínicos, iniciales y evolutivos, y los resultados de las otras pruebas diagnósticas factibles de aplicar. Para evaluar el tratamiento dirigido al vasospasmo hay que considerar la aplicación de la ASD cuando:
- •
Durante el periodo de riesgo del vasospasmo el DTC es normal y aparece deterioro neurológico clínico, sin otra explicación obvia, o hay discordancia clínico-sonográfica.
- •
Hay valores normales de VMF de la ACA y de la ACM en pacientes con aneurismas de la arteria comunicante anterior.
Ante un déficit neurológico retardado isquémico las imágenes de la tomografía computarizada (TC) de cráneo simple evidencian el infarto cerebral causado por vasospasmo en el 20-40% de los casos35,36. Mediante la prueba, Rabinstein et al35 describen dos patrones comunes de distribución del infarto cerebral después de la HSA: a) el cortical único, típicamente cerca del aneurisma roto, y b) las lesiones múltiples difusas, incluidas las de localización subcortical, y frecuentemente no relacionadas con el sitio de la rotura del aneurisma. La mayoría de las lesiones detectadas eran corticales con distribución territorial o limítrofe. Los infartos profundos tuvieron la tendencia de ser clínicamente asintomáticos en la fase aguda. La distribución focal o difusa del vasospasmo por el DTC o el angiograma no sirvió para predecir de forma fiable el patrón subsiguiente de infarto cerebral. El infarto hemorrágico por vasospasmo es raro y ocurre especialmente en los pacientes sometidos a terapia hipertensiva inducida.
La TC de cráneo convencional es menos precisa que la resonancia magnética (RM) y la TC por emisión monofotónica (SPECT), pero está ampliamente disponible y sus imágenes son más fáciles de obtener e interpretar. Con el desarrollo de las tecnologías que han expandido el uso de la TC, específicamente la angio-TC y la imagen de TC por perfusión, es posible integrar la información de la localización del espasmo con la medición cuantitativa del FSC. Todo esto puede realizarse en un relativo corto periodo y sin movilizar al paciente20–22,35.
La TC de perfusión contrastada se utiliza crecientemente en situaciones de emergencia para valorar la ICT. Los mapas de tiempo de tránsito medio (MTT) son muy sensibles en el cribado de los pacientes con isquemia cerebral aguda, mientras que los mapas de FSC relativo (FSCr) y volumen sanguíneo cerebral relativo (CBVr) son más específicos para el diagnóstico del infarto. El vasospasmo angiográfico cursa con disminución del FSCr, particularmente cuando es severo. Entre las anormalidades de la perfusión posiblemente relacionadas con el vasospasmo se distinguen tres patrones distintivos (tabla 2). La técnica no es invasiva, brinda una correlación anatómica directa e informa el estado hemodinámico con una resolución relativamente alta, cuantitativa y reproducible20–22,36.
La determinación del FSCr con TC de perfusión realzada con xenón se ha propuesto para guiar el tratamiento médico del vasospasmo y para diferenciar la ICT de otros procesos en los pacientes con HSA. Las principales desventajas de la técnica son: a) la alta sensibilidad a los artefactos de movimiento asociados a un tiempo de adquisición de varios minutos; b) la exposición a relativamente altas concentraciones de radiación; c) está contraindicada ante enfermedad respiratoria severa o ventilación mecánica con volumen corriente menor de 250ml; d) el cuestionamiento de la cuantificación precisa de los parámetros, y e) los efectos adversos que puede causar el xenón (náuseas, mareos o sedación), lo que obstaculiza la fijación de la cabeza. Estas razones hacen de la TC-xenón un estudio experimental alternativo de las restantes pruebas de perfusión36.
Por lo tanto, la TC de cráneo convencional, combinada con TC de perfusión contrastada y angio-TC, representa un técnica diagnóstica precisa y ventajosa en los pacientes con sospecha de vasospasmo secundario a HSA. El protocolo multimodal de TC es particularmente útil en los pacientes inconscientes, en que el examen clínico es poco informativo.
Angiografía por tomografía computarizadaLa angio-TC ha emergido como un método rápido, preciso y poco invasivo para la descripción anatómica precisa de los vasos intracraneales, el diagnóstico de los aneurismas intracraneales y el diagnóstico y la monitorización del vasospasmo. En pequeñas series se comunica que la técnica es perfecta para detectar el espasmo severo proximal, y es muy sensible y exacta en el diagnóstico de los vasos normales. La sensibilidad y la precisión se reducen significativamente para el vasospasmo proximal ligero-moderado. La concordancia es excelente al comparar la gravedad del vasospasmo determinada por angiografía por tomografía computarizada multicorte y angiografía convencional en los segmentos arteriales proximales y distales20,22,23.
Frecuentemente, ante la sospecha de vasospasmo, se indica un estudio de TC de cráneo convencional, a lo que se puede añadir inmediatamente después la angio-TC y la TC de perfusión. Estas posibilidades convierten a la angio-TC en una técnica útil en situaciones urgentes donde son necesarias medidas terapéuticas precisas y precoces. El método angiográfico supera las limitaciones de la ASD y la angio-RM, especialmente en los pacientes neurocríticos o poco cooperadores, debido a que consume menos tiempo y recursos, no obstaculiza el tratamiento del paciente, tiene menos contraindicaciones, los artefactos por el movimiento son menos frecuentes, no conlleva riesgos neurológicos serios y requiere de una sedación mínima en caso de agitación psicomotriz20,22,26.
Sus desventajas incluyen: a) la necesidad de trasladar al paciente donde está el equipo; b) la exposición a la radiación; c) la administración de contraste intravenoso y sus potenciales efectos adversos; d) la menor resolución de las imágenes con respecto a la ASD; e) la dificultad para valorar las imágenes con artefactos causados por los objetos metálicos (por ej., artefactos del clip); f) la opacificación de las estructuras venosas dificulta la evaluación de la ACI intracavernosa y en la porción silviana de la ACM; g) la demanda de más tiempo para la selección de las imágenes útiles y el procesamiento posterior, y h) la variabilidad entre observadores en la preparación y la interpretación de la imagen. Por estas razones, la angio-TC es recomendable como estudio angiográfico de control para diagnosticar cuando se sospecha vasospasmo y la ASD no está disponible o no involucra un tratamiento endovascular20,22.
Resonancia magnética cranealEl estudio de RM multimodal consiste en las secuencias de imágenes de RM estándar, imágenes ecoplanares de RM de difusión, angio-RM por tiempo de vuelo, imagen de RM de perfusión dinámica con gadolinio y puede incluir la imagen espectroscópica. Este protocolo ha permitido describir los siguientes hallazgos:
- •
Las lesiones isquémicas son visibles en la RM de difusión muy tempranamente después de la oclusión arterial y antes de que las anormalidades aparezcan en las imágenes potenciadas en T2. Las lesiones en ambos estudios pueden ser concomitantes y evidenciar reducciones del coeficiente de difusión aparente en el territorio correspondiente al espasmo arterial con ausencia de anomalías concomitantes en la RM de difusión.
- •
Las anormalidades en la perfusión son más marcadas que las anomalías de la difusión (mismatch, perfusión/difusión). Usualmente, se describen lesiones isquémicas focales, pequeñas y, a veces, múltiples en la RM de difusión rodeadas por un área mayor de disminución del FSCr y un aumento del MTT en todos los pacientes con vasospasmo sintomático. El indicador más útil en la RM de perfusión es la medición del MTT, mientras que el CBV usualmente es normal o con una disminución no prominente.
- •
El lactato, el edema y el incremento del CBVr ocurren en la misma área y se correlacionan entre sí y con el déficit neurológico clínico36–39.
A pesar de las limitaciones propias de la técnica (traslado del paciente, costes, duración, ambiente del examen), la RM de difusión-perfusión puede aplicarse con seguridad en pacientes seleccionados con HSA y provee información más amplia que las demás técnicas de neuroimagen36–39.
Angiografía por resonancia magnéticaLa concordancia de la angio-RM con la ASD es sustancial. Cuando se considera cada vaso independientemente, es excelente la especificidad para todas las localizaciones y la sensibilidad para la ACA, aunque es inferior la sensibilidad para la ACI y la ACM40. Dentro de sus ventajas esta la ausencia de exposición a la radiación ionizante, el no requerimiento de la administración de contraste intravenoso, y la posibilidad de estudios seriados.
La aplicación práctica de la técnica por tiempo de vuelo para el diagnóstico del vasospasmo tiene las siguientes dificultades:
- •
La señal incrementada por la metahemoglobina en la HSA adyacente a las arterias puede ocasionar resultados falsos negativos de vasospasmo en la fase subaguda. La afección más severa por el vasospasmo ocurre precisamente en esas arterias.
- •
Los coils endovasculares o clips de aneurismas compatibles frecuentemente ocasionan la falta de visualización de las arterias adyacentes, y los artefactos pueden aumentar los falsos negativos de estenosis significativas.
- •
La presencia de dispositivos metálicos no compatibles, como los clips de aneurismas y los aparatos menos avanzados para la monitorización de pacientes neurocríticos, impiden su indicación.
- •
El estudio completo requiere de un tiempo de adquisición prolongado y la cooperación del paciente. La limitación del tiempo de adquisición es mayor en los pacientes críticos sometidos frecuentemente a ventilación mecánica. El tiempo de examen se puede reducir al limitar el área arterial observable a la circulación anterior, pero esto es una fuente de errores.
- •
En el vasospasmo difuso resulta en una angio-RM pobremente definida que, a menudo, es difícil de interpretar y no debe confundirse con artefactos o problemas técnicos.
La angio-RM no es una alternativa a la ASD y la angio-TC en la evaluación precisa del vasospasmo cerebral, pero tiene una aplicación potencial como técnica diagnóstica no invasiva en pacientes seleccionados26,40,41.
Tomografías de emisiónLa SPECT y la tomografía por emisión de positrones (PET) pueden ser útiles en pacientes con pobre graduación clínica, y ofrecen una sensibilidad superior a la TC de cráneo simple para el diagnosticar los infartos cerebrales y su extensión. La SPECT es una técnica confortable para el paciente, brinda imágenes multiplanares y ante un estudio negativo de isquemia cerebral, puede obviarse la arteriografía cerebral5,42.
La SPECT y la PET están limitadas para aplicarlas sistemáticamente en la detección de la ICT debido a: a) los factores técnicos; b) la menor disponibilidad; c) el coste económico; d) la posibilidad de errores en el análisis; e) La necesidad de correlacionar los resultados con la neuroimagen estructural, y f) la carencia de ensayos clínicos que confirmen la utilidad. Además, la PET no es factible en las situaciones de emergencia y se desconoce su exactitud diagnóstica36,42,43.
ElectroencefalografíaLa monitorización electroencefalográfica de la HSA brinda información sostenida sobre el funcionamiento cerebral y puede posibilitar la detección de la ICT reversible. En la fase aguda del infarto cerebral la electroencefalografía (EEG) puede mostrar una actividad delta polimorfa y la atenuación de la actividad rápida. Además, se ha constatado una alta correlación entre el vasospasmo angiográfico y el enlentecimiento focal en la EEG14,15.
Los gráficos de EEG digital pueden servir para monitorizar los efectos de los sedantes y antiepilépticos, para detectar precozmente las crisis epilépticas y la disfunción cerebral secundaria al vasospasmo, e indican la necesidad de aplicar pruebas neurodiagnósticas adicionales o de variaciones terapéuticas. Los cambios cuantitativos de la EEG tienden a preceder en 2-3 días a las manifestaciones de ICT detectables por el examen clínico o por otras técnicas de monitorización continua. La disminución de la razón alfa/delta tras estimulación (potencia alfa/potencia delta) mayor del 50% en una sola medición es un parámetro con sensibilidad y especificidad altas para detectar la ICT en los pacientes en estupor o coma. La razón alfa/delta puede suplementar el examen clínico en los pacientes con HSA para el diagnóstico de cabecera de la disfunción por ICT. En dicho trastorno también se ha apreciado una disminución de la variabilidad relativa del ritmo alfa (6-14/1-20Hz)14,15.
La EEG continua no se incluye en la monitorización neurointensiva habitual debido al escepticismo por la supuesta vulnerabilidad a los artefactos, el coste de los equipos y la dependencia del personal entrenado en neurofisiología44. A pesar de esto, puede recomendarse la monitorización electroencefalográfica continua en los pacientes con alto riesgo de vasospasmo y deterioro de la conciencia.
Microdiálisis intracerebralEl monitorio neuroquímico mediante la microdiálisis intracerebral (MDI) de cabecera en los 7-10 días subsiguientes a la cirugía del aneurisma intracraneal se ha propuesto como una herramienta útil para caracterizar en la HSA los patrones de los marcadores del metabolismo energético (glucosa, piruvato y lactato), excitotoxinas (glutamato y aspartato) y derivados del daño neuronal (glicerol). En comparación con el DTC y la angiografía, la MDI tiene una alta especificidad, pero una baja sensibilidad como herramienta para el diagnóstico del déficit neurológico isquémico retardado. El patrón isquémico cerebral (incremento de la razón lactato/glucosa y lactato/piruvato mayor del 20%, seguido por un incremento del 20% de la concentración de glicerol) precedió a la manifestación de la ICT con un intervalo promedio de 11 h. Se ha constatado que las reducciones transitorias del FSC se correlacionan con la elevación extracelular del glutamato y el glicerol, mientras que la razón lactato/piruvato es solamente sensible después de una hipoperfusión prolongada43,44.
Aunque se describen resultados alentadores, la MDI tiene varias limitaciones que invalidan su recomendación como método sistemático neurointensivo: a) la necesidad de colocar el catéter en el lugar preciso que puede sufrir la isquemia; b) no permite la evaluación de más de una región cerebral; c) es difícil extrapolar las mediciones realizadas en un volumen cerebral restringido; d) son imprecisas las ventajas como indicador precoz o más sensible de ICT en comparación con otros métodos de detección; e) los valores neuroquímicos basales tienen variabilidad entre los sujetos; f) ocurre un amplio intervalo de valores desde los subclínicos de isquemia a los de isquemia severa; g) la escasa precisión de los procesos neuroquímicos que se desarrollan en la ICT; h) la disminución de la precisión de las mediciones por el desarrollo de gliosis reactiva alrededor de la punta del catéter; i) el traumatismo tisular secundario al procedimiento invasivo, y j) es costoso, consume tiempo, y demanda experiencia neuroquirúrgica y analítica5,43,44.
ConclusionesEl razonamiento clínico y el análisis del diseño de las investigaciones efectuadas son aspectos clave al indicar las pruebas para el diagnóstico del vasospasmo y la ICT en la HSA espontánea. El uso de términos médicos múltiples e imprecisos para calificar el vasospasmo puede dificultar la valoración y el manejo del paciente. El método de graduación acorde con la prueba diagnóstica que se propone puede servir para la estandarización de las principales investigaciones sobre el tema.
En la práctica clínica actual la pauta más recomendable y asequible para el diagnóstico y la monitorización del vasospasmo y la ICT es el uso racional de las pruebas abordadas. El algoritmo expuesto enfatiza, en primer lugar, en el examen clínico y por DTC, y perfila la monitorización con EEG en casos con alto riesgo de vasospasmo y deterioro de la conciencia. Se concluye que las técnicas de TC y RM multimodal son apropiadas en situaciones específicas para la identificación precoz y adecuada de la afección parenquimatosa y/o arterial cerebral. La ASD es la prueba de referencia para el diagnóstico del vasospasmo cerebral y se recomienda cuando no haya respuesta al tratamiento médico y el paciente sea candidato para terapia endovascular. No obstante, se requieren de investigaciones adicionales con un diseño adecuado para perfeccionar las pautas de aplicación de las pruebas delineadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.






![Representación del método para graduar el vasospasmo en la arteriografía del sistema carotídeo. A: esquema de la ubicación de las principales ramas de la carótida interna en una vista anteroposterior. ACA-p: segmento proximal de la arteria cerebral anterior; ACI-sp: segmento supraclinoideo de la arteria carótida interna; ACM-p: segmento proximal de la arteria cerebral media. B: diferentes grados de vasospasmo. C: método práctico para estimar el porcentaje de estenosis acorde al diámetro del lumen arterial. Una reducción del 50% del diámetro se estima que equivale al 75% de disminución del área transversal. Porcentaje de estenosis=[1−((D estenosis 1×D estenosis 2)/(D normal 1×D normal 2))]×100. Donde D estenosis 1 y D estenosis 2 = diámetros del segmento estenótico en dos planos, y D normal 1 y D normal 2 = diámetros de la arteria normal en dos planos. En la práctica se requiere de la magnificación de las imágenes para delinear claramente los bordes de las arterias y apreciar diferencias de 0,1mm. Representación del método para graduar el vasospasmo en la arteriografía del sistema carotídeo. A: esquema de la ubicación de las principales ramas de la carótida interna en una vista anteroposterior. ACA-p: segmento proximal de la arteria cerebral anterior; ACI-sp: segmento supraclinoideo de la arteria carótida interna; ACM-p: segmento proximal de la arteria cerebral media. B: diferentes grados de vasospasmo. C: método práctico para estimar el porcentaje de estenosis acorde al diámetro del lumen arterial. Una reducción del 50% del diámetro se estima que equivale al 75% de disminución del área transversal. Porcentaje de estenosis=[1−((D estenosis 1×D estenosis 2)/(D normal 1×D normal 2))]×100. Donde D estenosis 1 y D estenosis 2 = diámetros del segmento estenótico en dos planos, y D normal 1 y D normal 2 = diámetros de la arteria normal en dos planos. En la práctica se requiere de la magnificación de las imágenes para delinear claramente los bordes de las arterias y apreciar diferencias de 0,1mm.](https://static.elsevier.es/multimedia/02134853/0000002500000005/v1_201305151029/S0213485310000228/v1_201305151029/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)