La enfermedad de Parkinson es un trastorno neurodegenerativo progresivo caracterizado por la pérdida de neuronas dopaminérgicas de la sustancia nigra pars compacta, promoviendo una disminución significativa en los niveles de dopamina y en consecuencia el deterioro funcional del circuito motor.
DesarrolloAunque su etiología no está bien esclarecida, se han propuesto varios mecanismos patogénicos, entre ellos destaca el estrés oxidativo. La terapia actual se basa en medicamentos que reemplazan la dopamina, sin embargo, no son capaces de detener o incluso ralentizar la progresión de la enfermedad. En la actualidad están siendo investigados nuevos enfoques terapéuticos con la intención de influir en las vías que conducen a la disfunción y muerte neuronal.
ConclusionesEn los últimos años, se ha evidenciado el efecto neuroprotector de moléculas naturales debido a sus propiedades antioxidantes y antiinflamatorias dentro de los cuales destacan los polifenoles, los alcaloides y las saponinas. El objetivo de esta revisión es recopilar los estudios más importantes a nivel mundial que establecen las propiedades benéficas de algunos fitoquímicos utilizados en modelos in vitro de la enfermedad de Parkinson.
Parkinson's disease is a progressive neurodegenerative disorder characterised by a loss of dopaminergic neurons in the substantia nigra pars compacta, which results in a significant decrease in dopamine levels and consequent functional motor impairment.
DevelopmentAlthough its aetiology is not fully understood, several pathogenic mechanisms, including oxidative stress, have been proposed. Current therapeutic approaches are based on dopamine replacement drugs; these agents, however, are not able to stop or even slow disease progression. Novel therapeutic approaches aimed at acting on the pathways leading to neuronal dysfunction and death are under investigation.
ConclusionsIn recent years, such natural molecules as polyphenols, alkaloids, and saponins have been shown to have a neuroprotective effect due to their antioxidant and anti-inflammatory properties. The aim of our review is to analyse the most relevant studies worldwide addressing the benefits of some phytochemicals used in in vitro models of Parkinson's disease.
La enfermedad de Parkinson (EP) es la segunda enfermedad neurodegenerativa más común después de la enfermedad de Alzheimer. Aproximadamente afecta al 1-2% de los adultos mayores a 60 años; actualmente se estima que 5-6 millones de personas la presentan alrededor del mundo1-3. La neurodegeneración de las células dopaminérgicas de la sustancia nigra pars compacta y la degeneración de las fibras nerviosas hacia el cuerpo estriado promueven una disminución significativa en los niveles de dopamina (DA), un neurotransmisor importante en la modulación neural; en consecuencia, provoca el deterioro funcional del circuito motor, la bradicinesia, la inestabilidad postural, la rigidez y el temblor característico de la enfermedad, así como síntomas no motores, los trastornos del sueño, la depresión y el déficit cognitivo3-7. Se han propuesto varios mecanismos patogénicos a través de los cuales las neuronas dopaminérgicas (NDA) pueden ser dañadas, tales como disfunción mitocondrial, apoptosis, acumulación de metales de transición, estrés oxidativo (EO), inflamación, agregación y mal plegamiento de proteínas. Asimismo, estudios recientes han demostrado que el EO es el mecanismo más favorecido por el aumento de las especies reactivas de oxígeno (ERO) que conducen a la célula neuronal a una muerte por apoptosis8-10.
El tratamiento farmacológico para la EP se basa en medicamentos que reemplazan la DA aliviando eficientemente los síntomas motores, el dolor y la depresión. Sin embargo, estos tratamientos solo proporcionan un control sintomático eficaz por aproximadamente 10 años; además, el uso por periodos prolongados conduce a la formación de ERO y otros metabolitos tóxicos que se forman a partir del metabolismo de la DA. Y resulta aún más importante que estos fármacos no son capaces de detener o incluso ralentizar la progresión de la enfermedad3,11-14. Por lo anteriormente expuesto, el objetivo de esta revisión es recopilar los estudios más importantes a nivel mundial con evidencia neuroprotectora de algunos fitoquímicos utilizados en modelos in vitro de la EP.
Moléculas naturales que ejercen neuroprotección sobre las neuronas dopaminérgicasAlrededor del mundo existen un gran número de sustancias bioactivas contenidas en las partes aéreas o subterráneas de las plantas con actividades biológicas importantes, como antioxidante, antiinflamatorio, anticancerígeno, antimutagénico, entre otras; actualmente estos compuestos son denominados fitoquímicos. Una forma de clasificar los fitoquímicos es mediante el impacto que tienen sobre la salud humana y para ello se han clasificado en cuatro grupos: 1) terpenoides y polienos; 2) polifenoles; 3) compuestos organosulfurados, y 4) nitrogenados. Los polifenoles constituyen el grupo más abundante e incluye: flavonoides, flavonas, flavanonas, isoflavonas, antocianinas, catequinas, ácidos fenólicos, taninos, fitoestrógenos, estilbenos y curcuminoides15,16.
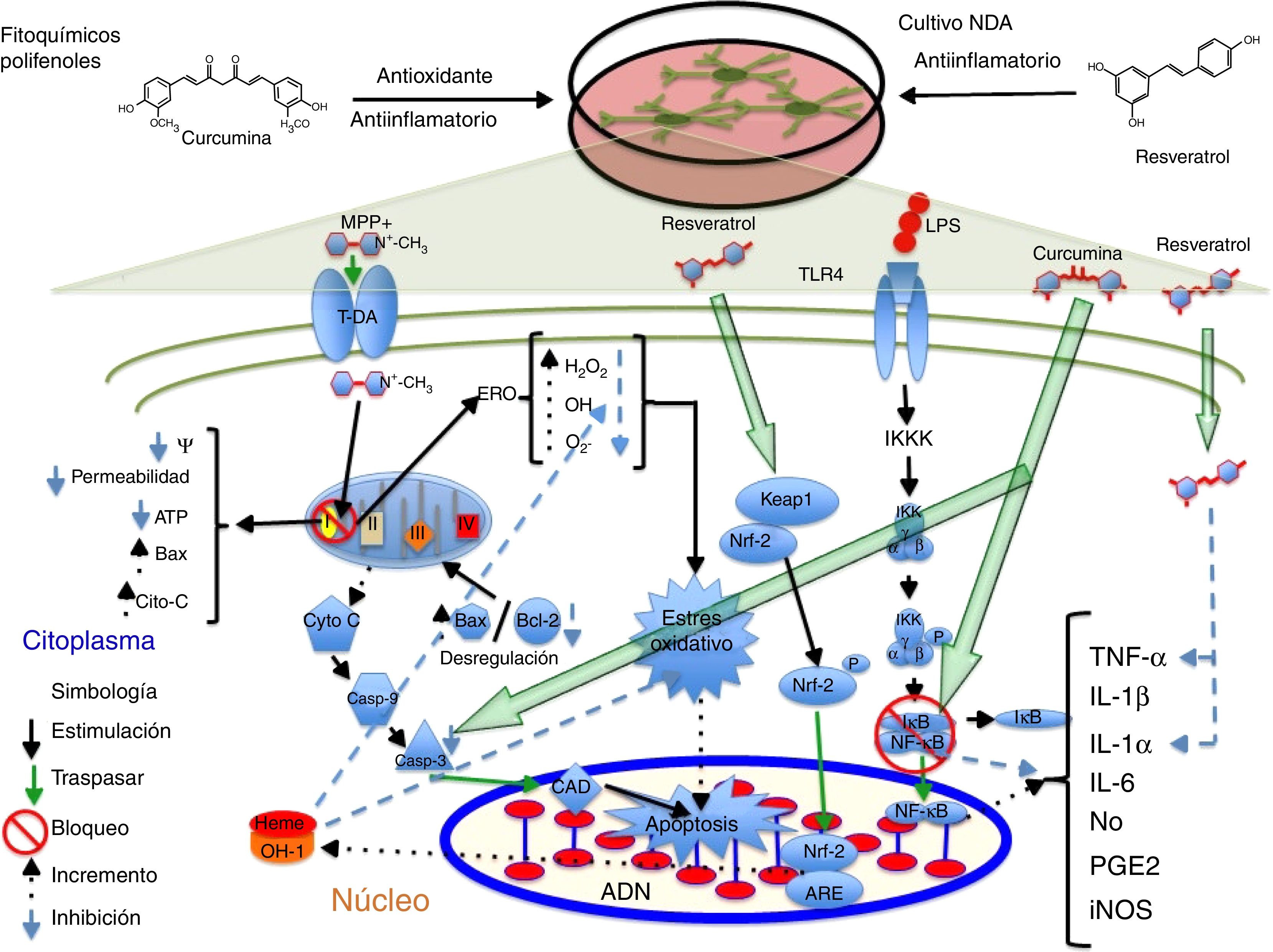
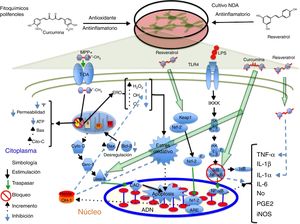
PolifenolesLos polifenoles son moléculas que poseen propiedades antioxidantes y antiinflamatorias capaces de barrer con los radicales libres por su capacidad de donar electrones y átomos de hidrógeno, además poseen actividad inmunomoduladora17,18. Se ha reportado que tienen actividad terapéutica en enfermedades cardiovasculares, diabetes, cáncer y enfermedades neurodegenerativas19. Uno de estos compuestos es el resveratrol, presente en las uvas, el vino tinto y otros productos alimentarios20. Se ha documentado que a concentraciones de 30 y 100μM el resveratrol confiere un efecto neuroprotector sobre las NDA de mesencéfalo al mantener los niveles de glutatión, reducir la concentración de ERO y el EO inducido por el metabolito neurotóxico 1-metil-4-fenilpiridinio (MPP+) a 20μM. Por otra parte, el resveratrol suprime la acetilación de la proteína p53 evitando la apoptosis inducida por el agente alquilante N-metil-Ń-nitro-N-nitrosoguadinida21. En este mismo sentido, el equipo de Moldzio et al. en el 2013 demostraron que el resveratrol (0,01, 0,1 y 1μM) confiere neuroprotección sobre las células mesencefálicas de ratón frente al glutamato al disminuir el número de células muertas al contrarrestar la reducción de la longitud de las neuritas y evitar la degeneración celular al reducir la formación del radical superóxido (O2−) en un 68%22. Recientemente, se ha demostrado que el resveratrol (20μM) aumenta parcialmente la expresión de la enzima hemooxigenasa-1 (OH-1) en las NDA SH-SY5Y provocando una disminución sobre la expresión de ERO y EO, y la inducción secuencial de la autofagia, evitando así la muerte celular inducida por el neurotóxico rotenona1. Además, se ha documentado que el resveratrol incrementa la expresión de OH-1 vía Nfr-2 en un modelo de isquemia cerebral en rata23. Por otro lado, existe evidencia de que la administración conjunta de resveratrol y quercetina en cultivo de células PC12 diferenciadas a NDA reduce significativamente la expresión de las citocinas proinflamatorias interleucina (IL)-1 alfa (IL-1α) y el factor de necrosis tumoral alfa (TNF-α) mediada por lipopolisacárido (LPS), previniendo la muerte celular de las neuronas24; en la figura 1 se resume un posible mecanismo de acción. En este mismo sentido, el flavonoide quercetina con capacidad de eliminar radicales libres y actividad antiapoptótica25, en conjunto con la sesamina, que posee actividad protectora frente al EO26, al ser expuestos en cocultivo de células microgliales N9 y PC12 diferenciadas hacia un destino dopaminérgico en presencia del metabolito MPP+ provocó una reducción significativa sobre la expresión génica y la concentración de las citocinas proinflamatorias IL-6, IL-1 (IL-1β) y TNF-α, así como la disminución sobre la expresión de la enzima óxido nítrico sintasa inducible (iNOS) y la producción de O2− rescatando a las NDA de una muerte celular tipo apoptótica27. Por otra parte, se ha demostrado que la sesamina confiere efecto neuroprotector a células dopaminérgicas diferenciadas a partir de células PC12. En el estudio realizado por Lahaie-Collins et al. en 2008 se demostró que un pretratamiento de 3 h con sesamina antes de la exposición a MMP+ confiere efecto neuroprotector al provocar una disminución sobre los niveles de EO y la expresión génica de IL-6, así como un incremento en la actividad de la enzima catalasa y la expresión de la proteína tirosina hidroxilasa (TH)26.
Propuesta del posible mecanismo de acción neuroprotector de los polifenoles. Se ilustran los fitoquímicos antiinflamatorios curcumina y resveratrol sobre los blancos moleculares que confieren neuroprotección sobre las NDA en diferentes vías de señalización que conducen a la formación de citocinas proinflamatorias y la apoptosis celular. La curcumina actúa principalmente bloqueando las proteínas NF-κB, evitando la producción de citocinas proinflamatorias, y la caspasa 3 inhibiendo el proceso apoptótico. Por otro lado, el resveratrol disminuye los niveles de las citocinas proinflamatorias TNF-α e IL-1α y provoca el incremento OH-1, este incremento protege a las células del daño oxidativo mediante la reducción de los niveles de las especies reactivas de oxigeno.
La curcumina, otro compuesto polifenólico obtenido de la planta Curcuma longa, posee propiedades antioxidantes y antiinflamatorias28; esta molécula a una concentración de 5μM muestra un efecto neuroprotector sobre las NDA SH-SY5Y a través de la reducción de la proteína proapoptótica caspasa 3 inducida por el insecticida natural rotenona29. Por otra parte, Meesarapee et al. en 2014 evidenciaron que la curcumina, aparte de tener efecto neuroprotector y provocar una reducción significativa sobre la producción de la proteína caspasa 3 frente a la exposición del neurotóxico 6- hidroxidopamina (6-OHDA) sobre las NDA SH-SY5Y, protege contra el daño oxidativo mediante la reducción en los niveles de p-p38 y la formación de quinoproteínas toxicas, llevando a un aumento de la viabilidad celular y restauración en los niveles de TH30. Por otra parte, el equipo de Yang et al., en 2008, demostraron que la curcumina (10μM) tiene un efecto neuroprotector sobre las NDA mesencefálicas incrementando la captación del neurotransmisor DA, una reducción en la expresión de los niveles de las citocinas proinflamatorias óxido nítrico (NO), prostaglandina E2 (PGE2), IL-1β y TNF-α e inhibe la transcripción de los factores NF-κB y AP-1 responsables del EO. Sin embargo, se observó una mayor neuroprotección en el conjunto de células con microglía, por lo que al parecer la microglía en este estudio desempeñó un papel importante contra la neurotoxicidad producida por LPS31. Por otro lado, se ha identificado un posible blanco molecular de la curcumina que podría estar involucrado en la neuroprotección de las células dopaminérgica SH-SY5Y durante el proceso de citotoxicidad inducida por el neurotóxico MPP+ (3mM); este posible mecanismo de acción es a través de la inhibición de la activación de la vía JNK y la escisión de la caspasa 3 que evita la muerte celular32 (fig. 1). Por su parte, el compuesto picante del jengibre el 6-shogaol, que posee efectos antiinflamatorios, al ser probado en un cultivo primario de NDA mesencefálicas de rata en presencia de MPP+ impidió la pérdida de células tiroxina hidroxilasa inmunorreactivas (TH-IR), así como, la disminución significativa de los niveles de NO y TNF-α33.
El flavonol «fustin», obtenido del duramen de Rhus verniciflua, posee propiedades antiinflamatorias34 y antimutagénicas35. En el presente estudio, el fustin en concentraciones superiores a 50μM confiere neuroprotección a las NDA SK-N-SH pretratadas por 30min antes de la exposición a 6-OHDA (125μM) por 24 h, observándose una inhibición sobre los niveles de las ERO y el aumento de calcio intracelular (Ca2++). Además, impidió el incremento en la relación Bax/Bcl-2, así como la actividad de caspasa 3 y el bloqueo de la fosforilación de p3836. Por otra parte, la isoflavona biocanina A, obtenida de la planta Trifolium pratense con propiedades antiinflamatorias, confiere neuroprotección a las NDA obtenidas de mesencéfalo de rata, a concentraciones de 0,25, 1 y 2,5μM, se observó que puede proteger de manera efectiva las células dopaminérgicas contra la neurotoxicidad inducida por LPS (10 ng/ml), que produce una reducción del 36,7% sobre la captación de DA, así como una disminución del 52% sobre la población celular, mientras que la biocanina A mejora significativamente la captación de DA (el 55,9, el 77,9 y el 88,7%) y protege a las células del daño por el LPS (el 62,5, el 81,9 y el 89,4%); además, inhibe la producción de las citocinas proinflamatorios TNF-α y NO, así como el O2− de manera dependiente de la concentración37. La acacetina es una flavona que posee propiedades anticancerígenas y antiinflamatorias; se encuentra en plantas como crisantemos y cártamos. En un cultivo primario de NDA mesencefálicas de rata expuestas al neurotóxico MPP+ (10μM) y tratadas con acacetina (50-200nM) se observó un mayor número de células dopaminérgicas TH-IR y preservación de la morfología neuronal, incluyendo el acortamiento de las dendritas, en comparación con el grupo control. Además, inhibe de manera dependiente de la concentración la sobreproducción de los factores proinflamatorios NO, PGE2 y TNF-α38. La baicaleína es un flavonoide extraído de la raíz de la planta Scutellaria baicalensis; se lo ha considerado como un excelente antioxidante barredor de radicales libres y antiinflamatorio. Se probó la resistencia a la toxicidad in vitro con 6-OHDA (100μM) en cultivo de NDA SH-SY5Y previamente tratadas con baicaleína (0,05, 0,5 y 5μg/ml), comprobándose un efecto neuroprotector a partir de la dosis de 0,5μg/ml, con un 64% de supervivencia respecto al control. Además, el pretratamiento a 5μg/ml disminuye significativamente el porcentaje de células apoptóticas39 (tabla 1).
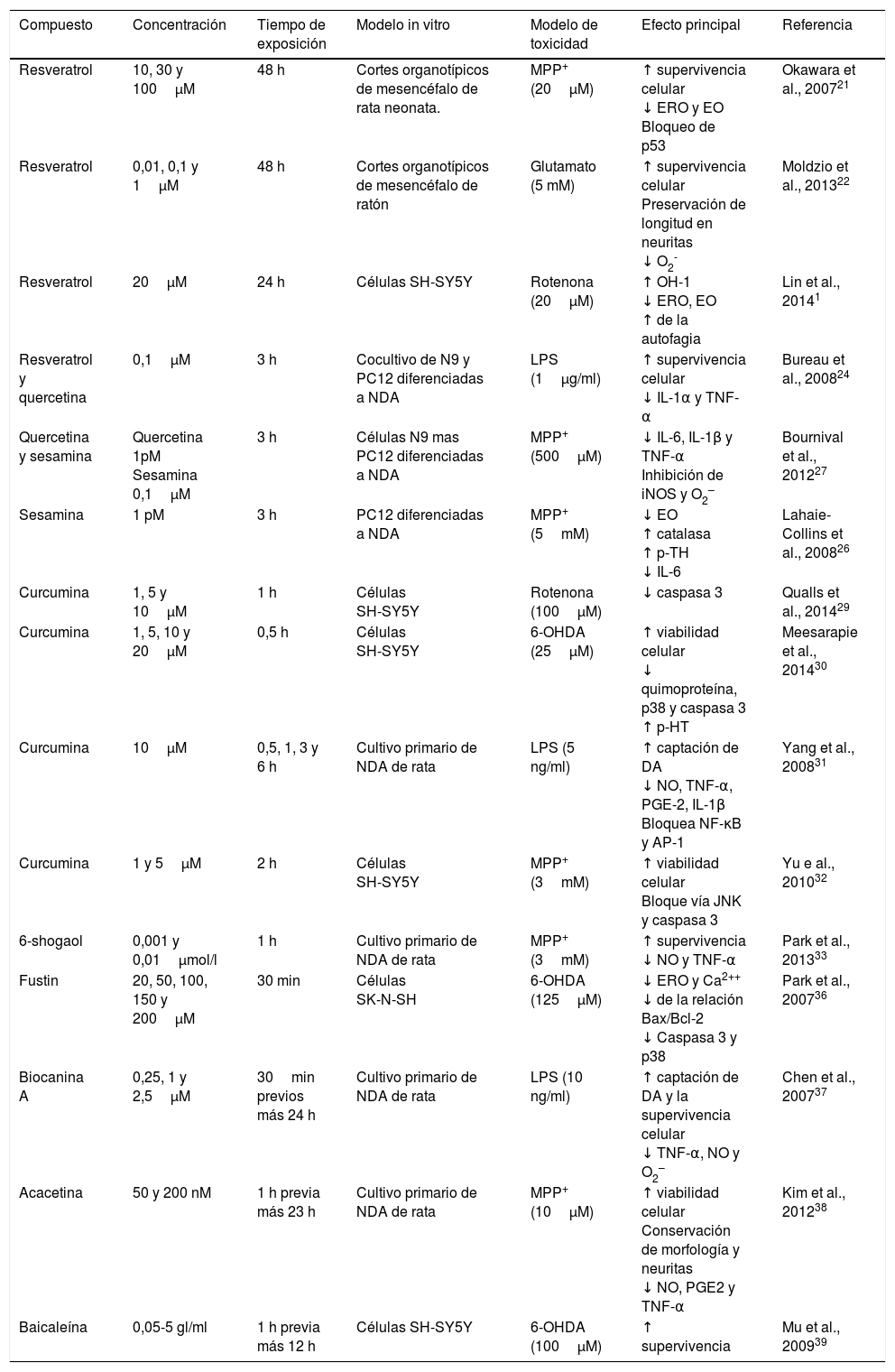
Lista de compuestos fitoquímicos del tipo polifenoles con actividad neuroprotectora
| Compuesto | Concentración | Tiempo de exposición | Modelo in vitro | Modelo de toxicidad | Efecto principal | Referencia |
|---|---|---|---|---|---|---|
| Resveratrol | 10, 30 y 100μM | 48 h | Cortes organotípicos de mesencéfalo de rata neonata. | MPP+ (20μM) | ↑ supervivencia celular ↓ ERO y EO Bloqueo de p53 | Okawara et al., 200721 |
| Resveratrol | 0,01, 0,1 y 1μM | 48 h | Cortes organotípicos de mesencéfalo de ratón | Glutamato (5 mM) | ↑ supervivencia celular Preservación de longitud en neuritas ↓ O2- | Moldzio et al., 201322 |
| Resveratrol | 20μM | 24 h | Células SH-SY5Y | Rotenona (20μM) | ↑ OH-1 ↓ ERO, EO ↑ de la autofagia | Lin et al., 20141 |
| Resveratrol y quercetina | 0,1μM | 3 h | Cocultivo de N9 y PC12 diferenciadas a NDA | LPS (1μg/ml) | ↑ supervivencia celular ↓ IL-1α y TNF-α | Bureau et al., 200824 |
| Quercetina y sesamina | Quercetina 1pM Sesamina 0,1μM | 3 h | Células N9 mas PC12 diferenciadas a NDA | MPP+ (500μM) | ↓ IL-6, IL-1β y TNF-α Inhibición de iNOS y O2– | Bournival et al., 201227 |
| Sesamina | 1 pM | 3 h | PC12 diferenciadas a NDA | MPP+ (5mM) | ↓ EO ↑ catalasa ↑ p-TH ↓ IL-6 | Lahaie-Collins et al., 200826 |
| Curcumina | 1, 5 y 10μM | 1 h | Células SH-SY5Y | Rotenona (100μM) | ↓ caspasa 3 | Qualls et al., 201429 |
| Curcumina | 1, 5, 10 y 20μM | 0,5 h | Células SH-SY5Y | 6-OHDA (25μM) | ↑ viabilidad celular ↓ quimoproteína, p38 y caspasa 3 ↑ p-HT | Meesarapie et al., 201430 |
| Curcumina | 10μM | 0,5, 1, 3 y 6 h | Cultivo primario de NDA de rata | LPS (5 ng/ml) | ↑ captación de DA ↓ NO, TNF-α, PGE-2, IL-1β Bloquea NF-κB y AP-1 | Yang et al., 200831 |
| Curcumina | 1 y 5μM | 2 h | Células SH-SY5Y | MPP+ (3mM) | ↑ viabilidad celular Bloque vía JNK y caspasa 3 | Yu e al., 201032 |
| 6-shogaol | 0,001 y 0,01μmol/l | 1 h | Cultivo primario de NDA de rata | MPP+ (3mM) | ↑ supervivencia ↓ NO y TNF-α | Park et al., 201333 |
| Fustin | 20, 50, 100, 150 y 200μM | 30 min | Células SK-N-SH | 6-OHDA (125μM) | ↓ ERO y Ca2++ ↓ de la relación Bax/Bcl-2 ↓ Caspasa 3 y p38 | Park et al., 200736 |
| Biocanina A | 0,25, 1 y 2,5μM | 30min previos más 24 h | Cultivo primario de NDA de rata | LPS (10 ng/ml) | ↑ captación de DA y la supervivencia celular ↓ TNF-α, NO y O2– | Chen et al., 200737 |
| Acacetina | 50 y 200 nM | 1 h previa más 23 h | Cultivo primario de NDA de rata | MPP+ (10μM) | ↑ viabilidad celular Conservación de morfología y neuritas ↓ NO, PGE2 y TNF-α | Kim et al., 201238 |
| Baicaleína | 0,05-5 gl/ml | 1 h previa más 12 h | Células SH-SY5Y | 6-OHDA (100μM) | ↑ supervivencia | Mu et al., 200939 |
En este grupo de fitoquímicos destacan los alcaloides, las aminas, los aminoácidos no proteicos, los glucósidos cianogénicos y los glucosinolatos.
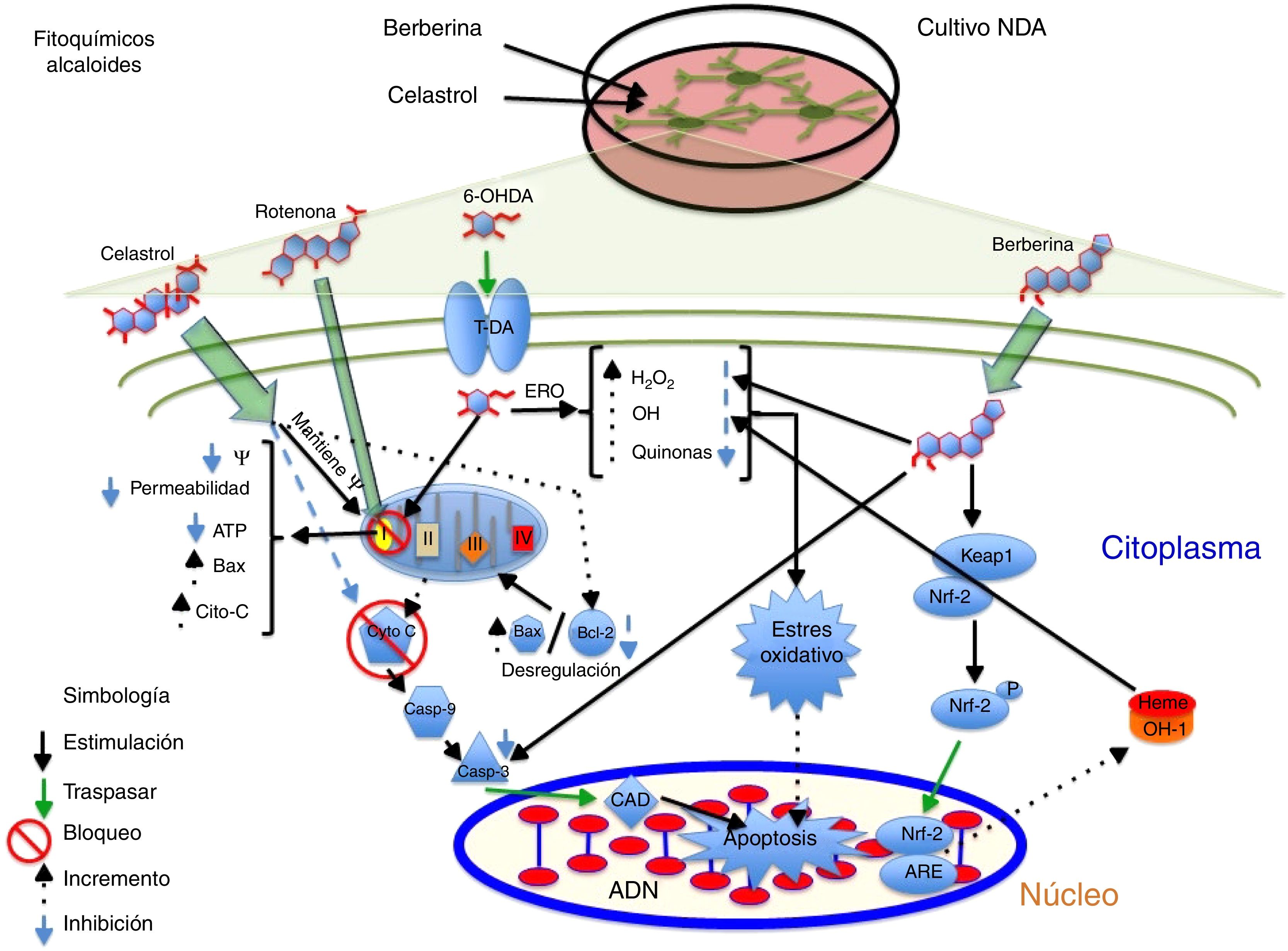
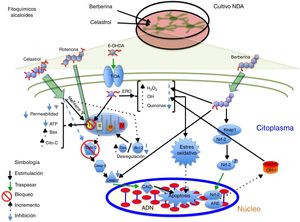
AlcaloidesEl alcaloide tetrahidroberberina (THB), un compuesto aislado de la planta tradicional china Rhizoma corydalis, tiene efectos neuroprotectores mediante el bloqueo de los canales KATP neuronales40,41. En el estudio realizado por Wu et al., en 2010, se demostró en NDA que el THB en presencia del neurotóxico rotenona tiene la capacidad de restaurar la hiperpolarización de membrana a condiciones fisiológicas (–46,1mV) a través de los canales KATP despolarizando la membrana de –61,7mV a –46,7mV. Por otra parte, se evidenció que el THB restaura la hiperpolarización de la membrana a través del receptor D2, ya que en las células expuestas al agonista del receptor D2 (sulpirida), el THB restauró significativamente la hiperpolarización y el potencial de acción fue disparado41. Por otra parte, la berberina, un compuesto aislado de Coptis xhinensis y usado en la medicina tradicional china como un antidiarreico, posee propiedades antiinflamatorias y antitumorales, y confiere protección cardiovascular. En el estudio realizado por Bae et al., en 2013, se demostró que la berberina tiene efectos neuroprotectores sobre las células SH-SY5Y frente a la muerte neuronal inducida por 6-OHDA, encontrándose un incremento de la supervivencia celular de manera dependiente de concentración, una reducción de la apoptosis celular por un decremento de la actividad de caspasa 3 y una disminución de ERO después de 3h de pretratamiento frente a 6-OHDA. Por otro lado, se identificó que la berberina aumenta la expresión del mRNA de la enzima OH-1 mediante el incremento de la translocación del factor de transcripción Nrf242; en la figura 2 se resume un posible mecanismo de acción.
Efecto neuroprotector de los fitoquímicos alcaloides celastrol y berberina frente al neurotóxico rotenona. Se ilustra la inhibición del complejo i de la cadena de transporte de electrones, la disminución de producción de ATP, el incremento de ERO, la disminución de los sistemas antioxidantes endógenos y, por consiguiente, la generación de EO que contribuyen a la apoptosis. El celastrol mantiene el potencial de membrana mitocondrial, incrementa los niveles de Bcl-2 e inhibe la liberación de citocromo C al citosol, evitando la apoptosis. Por otro lado, la berberina inhibe la escisión de caspasa 3, e induce el incremento de OH-1 vía Nfr-2, evitando el daño oxidativo al disminuir las especies reactivas de oxigeno.
El triterpenoide celastrol aislado de los extractos de raíz de Tripterygium wilfordii posee actividades antiinflamatorias y anticancerígenas43. Se ha reportado que el celastrol (10nM) evita la muerte celular inducida por el neurotóxico rotenona (10μM) a través de la reducción en los niveles de ERO, bloquea la liberación del citocromo C al citosol e inhibe la expresión de Bax. Además, confiere protección a la pérdida del potencial de membrana (Ψ), así como el aumento de la proteína antiapoptótica Bcl-22, posible mecanismo de acción (fig. 2 y tabla 2).
Fitoquímicos de tipo alcaloides que muestran efecto neuroprotector en NDA
| Compuesto | Concentración | Tiempo de exposición | Modelo in vitro | Modelo de toxicidad | Efecto principal | Referencia |
|---|---|---|---|---|---|---|
| Tetrahidro-berberina | 100μM | Cultivo primario de NDA de rata | Rotenona (1μM) | THB restaura la hiperpolarización inducida por rotenona | Wu et al., 201041 | |
| Berberina | 1, 5 y 10μM | 12 h | Células SH-SY5Y | 6-OHDA (50μM) | ↑ supervivencia ↓ ERO y caspasa 3 ↑ OH-1 | Bae et al., 201342 |
| Celastrol | 1 y 10 nM | 24 h | Células SH-SY5Y | Rotenona (10μM) | ↓ muerte celular ↓ ERO, Bax, caspasa 3 y 9 Protege la pérdida del Ψ Evita la liberación de citocromo C al citosol y la activación de p38 MAPK | Choi et al., 20142 |
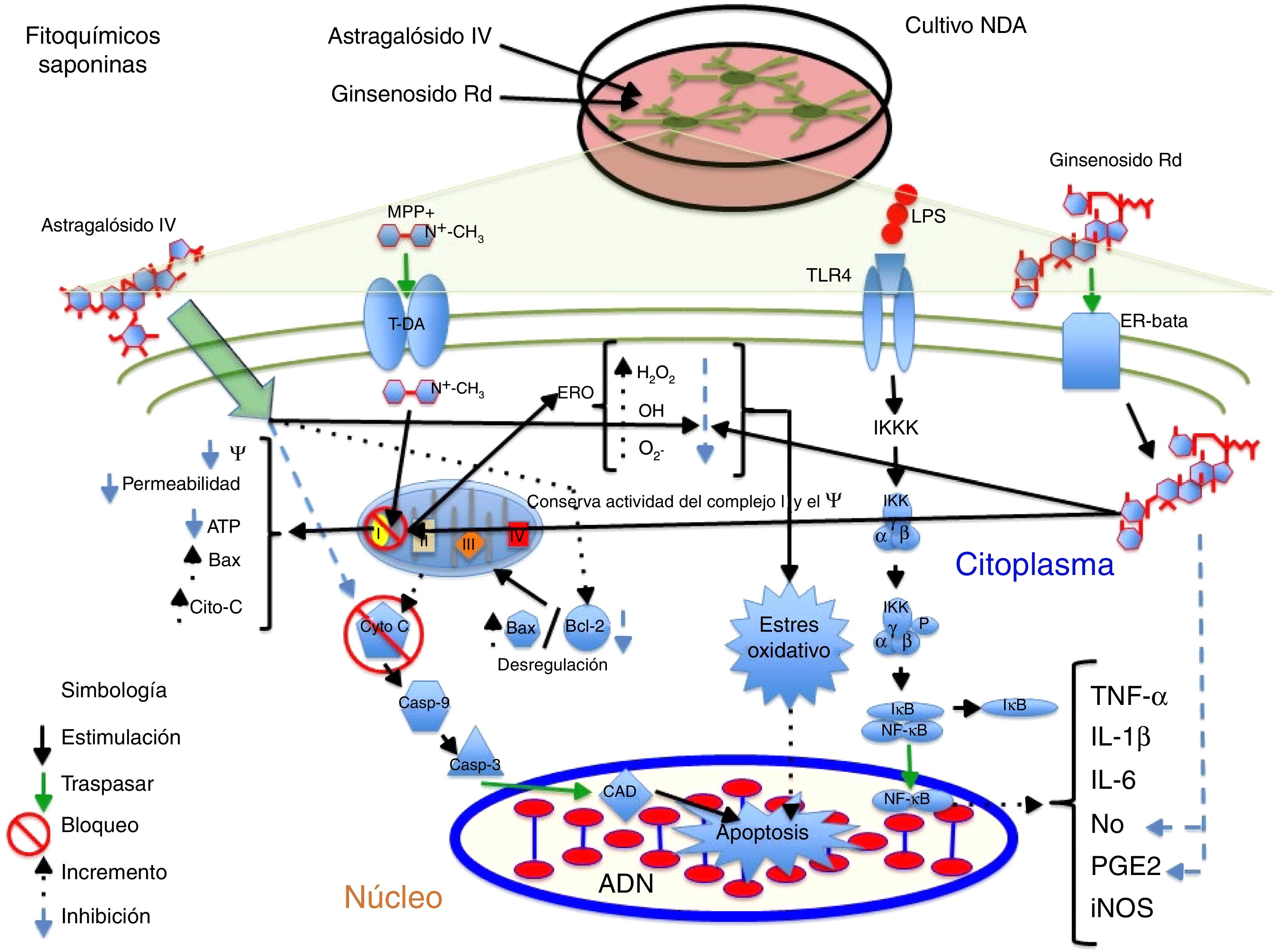
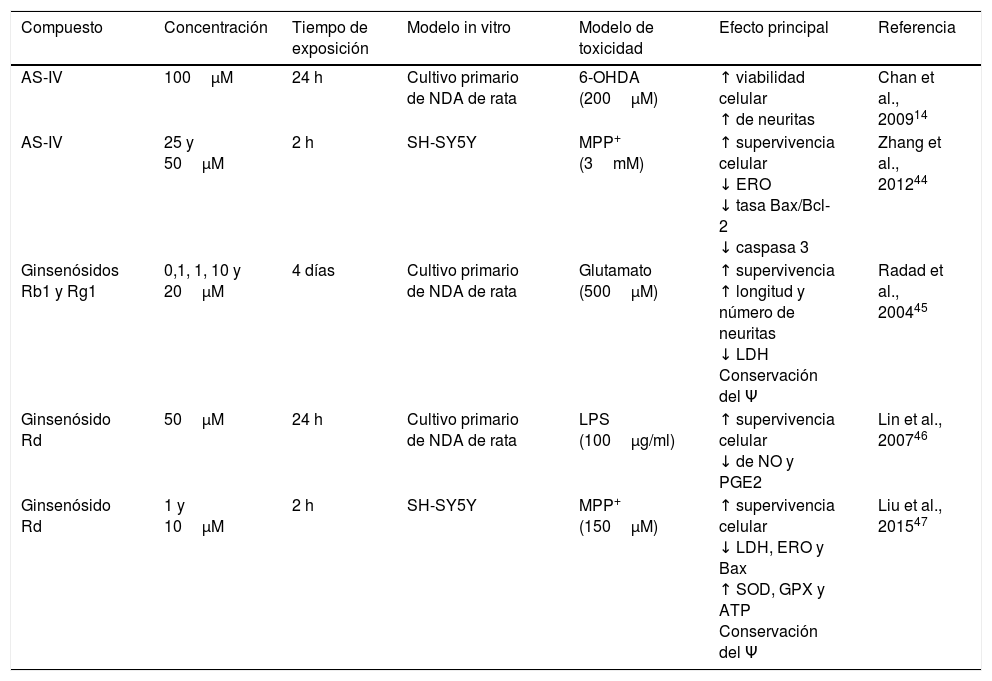
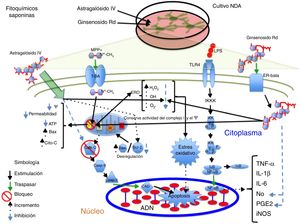
La saponina astragalósido-IV (AS-IV), un derivado de la raíz seca de Astragalus membranaceus, es una planta utilizada en medicina china para enfermedades neurodegenerativas; al probarse AS-IV en cultivos primarios de NDA mesencefálicas y frente a la exposición a 6-OHDA, se encontró un fuerte efecto neuroprotector, a una concentración de 100μM, probablemente relacionado con su efecto antioxidante, mejora en la supervivencia celular y evita la pérdida y el acortamiento de neuritas14. Por otra parte, el grupo de Zhang et al., en 2012, probó el mismo compuesto en NDA SH-SY5Y frente al neurotóxico MPP+, observando que el AS-IV posee efectivamente un efecto neuroprotector al provocar un incremento en la supervivencia de las células mediante la disminución del tamaño nuclear, la condensación de la cromatina y la fragmentación nuclear, así como una reducción sobre las ERO y la tasa de Bax/Bcl-2, e inhibe la actividad de caspasa 344; en la figura 3 se presenta un posible mecanismo de acción.
Neuroprotección de los fitoquímicos de tipo saponina en los modelos de daño neuronal MPP+ y LPS. Astragalósido IV disminuye las ERO y evita el EO, incrementa la proteína Bcl-2 e inhibe la liberación de citocromo C al citosol, evitando la muerte celular. Ginsenósido Rd conserva la actividad del complejo i y el potencial membrana mitocondrial, disminuye los niveles ERO evitando el EO y provoca decremento en los niveles de NO y PGE2, aumentando la viabilidad celular.
El ginseng, obtenido de la raíz de Panax ginseng, contiene más de 30 ginsenósidos dentro de los cuales al Rb1, el Rg1 y el Rd se les atribuyen las actividades farmacológicas por poseer un efecto barredor de radicales libres y mejorar el metabolismo energético de las neuronas. Se ha encontrado que los ginsenósidos Rb1 y Rg1 tienen acciones neurotróficas y neuroprotectoras parciales en cultivos de NDA, al incrementar la supervivencia celular mediante la disminución de LDH y prevenir la pérdida del potencial de membrana mitocondrial. Además, promovió el aumento de la longitud y el número de neuritas en las células SH-SY5Y supervivientes a la toxicidad por glutamato45. Por otra parte, el ginsenósido Rd (GSRd) a concentración de 50μM presentó un efecto neuroprotector en el daño causado por el LPS (100μg/ml) sobre las NDA mediante el aumento de la supervivencia celular y la reducción de la formación de NO y PGE2 mediante la acción antiinflamatoria de este compuesto46. Recientemente, el equipo de trabajo de Liu et al. demostraron que el GSRd a concentraciones de 1 y 10μM confiere efecto neuroprotector frente al neurotóxico MMP+ en células SH-SY5Y al disminuir la muerte neuronal, mediante la disminución de los niveles de LDH, ERO y Bax, así como un incremento de las enzimas antioxidantes superóxido dismutasa y glutatión peroxidasa; por otra parte, estabilizó el potencial de membrana e incrementó los niveles de ATP y, finalmente, se evidenció que la vía de supervivencia PIK3/Akt está implicada en dicho efecto protector47; en la figura 3 se ilustra un posible mecanismo de acción (tabla 3).
Algunas saponinas con efecto neuroprotector en células dopaminérgicas
| Compuesto | Concentración | Tiempo de exposición | Modelo in vitro | Modelo de toxicidad | Efecto principal | Referencia |
|---|---|---|---|---|---|---|
| AS-IV | 100μM | 24 h | Cultivo primario de NDA de rata | 6-OHDA (200μM) | ↑ viabilidad celular ↑ de neuritas | Chan et al., 200914 |
| AS-IV | 25 y 50μM | 2 h | SH-SY5Y | MPP+ (3mM) | ↑ supervivencia celular ↓ ERO ↓ tasa Bax/Bcl-2 ↓ caspasa 3 | Zhang et al., 201244 |
| Ginsenósidos Rb1 y Rg1 | 0,1, 1, 10 y 20μM | 4 días | Cultivo primario de NDA de rata | Glutamato (500μM) | ↑ supervivencia ↑ longitud y número de neuritas ↓ LDH Conservación del Ψ | Radad et al., 200445 |
| Ginsenósido Rd | 50μM | 24 h | Cultivo primario de NDA de rata | LPS (100μg/ml) | ↑ supervivencia celular ↓ de NO y PGE2 | Lin et al., 200746 |
| Ginsenósido Rd | 1 y 10μM | 2 h | SH-SY5Y | MPP+ (150μM) | ↑ supervivencia celular ↓ LDH, ERO y Bax ↑ SOD, GPX y ATP Conservación del Ψ | Liu et al., 201547 |
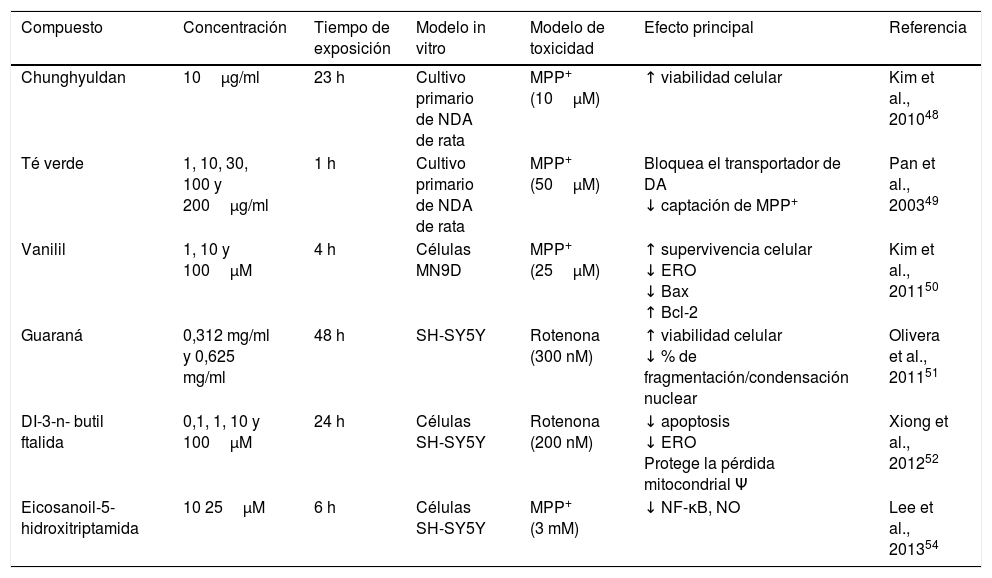
La utilización de Chunghyuldan (CHD), un compuesto herbal utilizado en medicina tradicional china, ha demostrado tener un efecto neuroprotector importante. El CHD está compuesto de rizoma de Coptis japonica, corteza de Phellodendron amurense, raíz de Scutellaria baicalensis, frutos de Gardenia jasminoides y rizoma de Rheum palmatum. Químicamente, esta mezcla es un compuesto de distintos flavonoides y alcaloides, como berberina, baicaleína, wogonina, genipósido y senósido A. Al realizar un ensayo en un cultivo primario de NDA de rata frente al metabolito MPP+, se encontró un efecto neuroprotector a dosis de 10μg/ml, al ser evidenciado mediante el incremento en la viabilidad celular48. Por otra parte, los polifenoles encontrados en el té verde también confieren efectos neuroprotectores sobre las células dopaminérgicas al bloquear los transportadores de DA impidiendo de manera dependiente de la concentración la captación del neurotóxico MPP+ a partir de 10μg/ml49. El extracto alcohólico de vanilil confiere neuroprotección a las NDA NM9D frente a la neurotoxicidad producida por el MPP+, observándose una disminución en el número de células apoptóticas por la supresión de los niveles de ERO y un decremento en los niveles de Bax; por otra parte, se observó un incremento en los niveles de Bcl-2; además, se demostró que el vanilil puede neuroproteger mediante la inhibición de la vía apoptótica mitocondrial50. Por otro lado, el extracto alcohólico de Paullinia cupana Mart. var. Sorbilis, comúnmente llamado guaraná, posee propiedades antioxidantes. Dicho extracto mostró efectos neuroprotectores sobre las NDA SH-SY5Y, tales como incremento de la viabilidad celular (83% y 95%) y disminución significativa del porcentaje de condensación/fragmentación nuclear (30,88% y 36,56%) a concentraciones 0,312mg/ml y 0,625mg/ml, respectivamente, frente a la exposición de rotenona51. El antioxidante natural DI-3-n-butil ftalida (NBP), desarrollado a partir del I-3-n- butil ftalida, que se extrae de las semillas de Apium graveolens, es un potente y novedoso eliminador de radicales libres. En este estudio se encontró que el NBP mejoró la supervivencia de las NDA SH-SY5Y frente a la toxicidad inducida por rotenona de manera dependiente de la concentración, disminuyendo la tasa de apoptosis y la producción de ERO, y evitando la pérdida del potencial de membrana mitocondrial52. Un miembro de la familia morácea la «mora» (Morus alba), con altas cantidades de antocianinas, se ha documentado que mejora los parámetros relacionados con la inflamación en ratas artríticas. El grupo de Kim et al., en 2010, demostró que el extracto alcohólico de mora protege contra la neurotoxicidad inducida por 6-OHDA en las NDA SH-SY5Y, encontrándose un efecto neuroprotector al disminuir la muerte celular inducida por el neurotóxico, e inhibe la generación de ERO y NO de manera dependiente de la concentración, así como la inhibición de la apoptosis por la disminución de la actividad de la caspasa 3 y la tasa Bax/Bcl-2. Además, evita la despolarización de la membrana mitocondrial53. Uno de los componentes del café, el eicosanoil-5-hidroxitriptamida (EHT), ha demostrado tener efectos antiinflamatorios directos al reprimir la activación de NF-κB inducida por MPP+, la inducción de iNOS y la producción de NO, así como una fuerte actividad antioxidante; un cultivo de células SH-SY5Y expuestas a MPP+ resultaron protegidas al ser tratadas con EHT (10-25μM). Los mecanismos de acción neuroprotectores se basan en la actividad tanto antiinflamatoria como antioxidante del EHT, así como su capacidad para modular la metilación de fosfoproteína fosfatasa 2A (PP2A)54 (tabla 4).
Efectos neuroprotectores de fitoquímicos en células NDA
| Compuesto | Concentración | Tiempo de exposición | Modelo in vitro | Modelo de toxicidad | Efecto principal | Referencia |
|---|---|---|---|---|---|---|
| Chunghyuldan | 10μg/ml | 23 h | Cultivo primario de NDA de rata | MPP+ (10μM) | ↑ viabilidad celular | Kim et al., 201048 |
| Té verde | 1, 10, 30, 100 y 200μg/ml | 1 h | Cultivo primario de NDA de rata | MPP+ (50μM) | Bloquea el transportador de DA ↓ captación de MPP+ | Pan et al., 200349 |
| Vanilil | 1, 10 y 100μM | 4 h | Células MN9D | MPP+ (25μM) | ↑ supervivencia celular ↓ ERO ↓ Bax ↑ Bcl-2 | Kim et al., 201150 |
| Guaraná | 0,312 mg/ml y 0,625 mg/ml | 48 h | SH-SY5Y | Rotenona (300 nM) | ↑ viabilidad celular ↓ % de fragmentación/condensación nuclear | Olivera et al., 201151 |
| DI-3-n- butil ftalida | 0,1, 1, 10 y 100μM | 24 h | Células SH-SY5Y | Rotenona (200 nM) | ↓ apoptosis ↓ ERO Protege la pérdida mitocondrial Ψ | Xiong et al., 201252 |
| Eicosanoil-5-hidroxitriptamida | 10 25μM | 6 h | Células SH-SY5Y | MPP+ (3 mM) | ↓ NF-κB, NO | Lee et al., 201354 |
Los estudios in vitro anteriormente mencionados demuestran que algunos fitoquímicos confieren neuroprotección en modelos de EP al prevenir la muerte celular dopaminérgica a través de múltiples mecanismos de acción, principalmente la inhibición de NF-κB, caspasa 3, Bax y disminución ERO, así como el aumento sobre la expresión de las enzimas antioxidantes endógenas y el mantenimiento de la actividad mitocondrial. En esta revisión se compilan los resultados de potenciales candidatos naturales para el futuro tratamiento de la EP, como los polifenoles, los alcaloides, las saponinas y otros fitoquímicos. En la actualidad, no existen terapias neuroprotectoras probadas como tratamientos disponibles para la EP, por lo que quizás la combinación de varios fitoquímicos podría ofrecer nuevos enfoques terapéuticos al actuar en múltiples blancos moleculares que conducen a la degeneración de las NDA de la sustancia nigra pars compacta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.