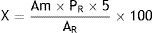Se evaluó el efecto protector de 2 presentaciones comerciales de Ginkgo biloba sobre las alteraciones motoras inducidas por el consumo de jugo de yuca (Manihot esculenta Crantz) en ratas macho Wistar.
MétodoLos efectos se evaluaron en las pruebas de campo abierto y nado a los 0, 7, 14, 21 y 28 días de tratamiento, una hora después de la administración correspondiente.
ResultadosA partir del día 21 del consumo de jugo de yuca incrementó el número de cuadros cruzados en campo abierto y, en la prueba de nado, produjo el nado lateral a partir del día 7, con respecto al grupo control.
ConclusiónLos extractos de Ginkgo biloba previnieron las alteraciones motoras asociadas al consumo de jugo de yuca, probablemente por el contenido de flavonoides presentes en ambas presentaciones de Ginkgo biloba.
This study evaluated the protective effects of 2 commercial formats of Ginkgo biloba on motor alterations induced by cassava (Manihot esculenta Crantz) juice consumption in male Wistar rats.
MethodsThe effects were evaluated with the open field and swim tests at 0, 7, 14, 21, and 28 days of treatment, one hour after administering the product.
ResultsCompared to controls, open field crossings increased after day 21 of cassava juice consumption, and lateral swimming in the swim test was reported after day 7.
ConclusionGinkgo biloba extracts prevented motor alterations associated with cassava juice consumption, probably due to the flavonoid content in both formats of Ginkgo biloba.
La yuca (Manihot esculenta Crantz) también llamada mandioca o cassava es un arbusto leñoso perenne de la familia Euphorbiaceae1. Debido a su alto contenido de almidón en la raíz y a su adaptación a cultivos en suelos pobres y climas secos, es una opción alimenticia en regiones tropicales de Asia, África y América2. No obstante, en la yuca se encuentran los glucósidos cianogénicos linamarina y lotaustralina3. La linamarina, por acción de la enzima linamarasa, también contenida en la planta, libera ácido cianhídrico al hidrolizar el glucósido4. El procesamiento inadecuado de yuca, así como su consumo excesivo, han sido asociados con enfermedades como el hipotiroidismo y con 2 enfermedades neurológicas relacionadas con la presencia de cianuro: la neuropatía atáxica tropical, que es una polineuropatía periférica que cursa con sordera sensitivoneural y atrofia óptica y el konzo, una paraparesis espástica5. En la investigación experimental, se ha encontrado que el jugo de yuca produce un hiperactividad motora en la prueba de campo abierto, así como alteraciones motoras en la prueba de nado evidenciadas por el nado lateral en la rata macho Wistar. Se ha propuesto que estas alteraciones podrían estar relacionadas con el contenido de linamarina en el jugo de yuca, sin descartar la participación de otros compuestos químicos contenidos en el jugo6.
Por otro lado, el Ginkgo biloba es una planta de la familia Ginkgoaceas que posee diversos principios activos con actividad biológica y farmacológica7. Diversos estudios fitoquímicos reportan que el extracto de las hojas de Ginkgo biloba, contiene 24% de flavonoides, 6% de terpenoides, 5-10% de ácidos orgánicos y menos de un 5% de polímeros con base flavonoide8-10. El extracto ha sido utilizado por sus propiedades antioxidantes y estabilizadoras de la membrana neuronal, en personas que han sufrido accidente cerebrovascular8. También se ha utilizado en el tratamiento de Alzheimer, por sus propiedades benéficas sobre los procesos de atención, memoria y psicomotricidad11. El extracto de Ginkgo biloba posee además una actividad antioxidante destacable. Mohanta et al.12 demostraron que el extracto de esta planta protege contra el efecto de la oxidación presente en una emulsión. El grado de peroxidación lipídica de la grasa presente en la emulsión se retrasa entre 24 y 43 h, en función de la concentración del antioxidante. Además, el tratamiento con Ginkgo biloba protege a las neuronas de la excitotoxicidad inducida por la sobreactivación de los receptores N-metil-D-aspartato (NMDA) y la isquemia focal cerebral. El efecto neuroprotector del Ginkgo biloba podría correlacionarse también con su capacidad inhibitoria de las especies reactivas de oxígeno, además de evitar las convulsiones13. Lo anterior hace suponer que el extracto de Ginkgo biloba podría prevenir el deterioro motor y cognitivo asociado al consumo del jugo de yuca, una posibilidad que requiere ser explorada.
En el mercado existen diversas presentaciones comerciales del extractos estandarizados o no estandarizados de Ginkgo biloba12,14, en cuanto a sus componentes químicos. Sin embargo, en la mayoría de los casos se carece de estudios que sustenten sus propiedades terapéuticas que se les atribuyen, lo cual podría poner en riesgo a las personas que los consumen. Es por ello que es necesario explorar sus efectos farmacológicos y compararlos entre diferentes presentaciones comerciales, es decir, aquellas que están sustentadas por un laboratorio farmacéutico y aquellos que se venden sin este respaldo. Por lo anterior, nuestro objetivo fue evaluar si el tratamiento con 2 presentaciones comerciales de Ginkgo biloba ejercen un efecto protector contra las alteraciones motoras inducidas por el consumo crónico del jugo de yuca (Manihot esculenta Crantz) en la rata Wistar.
MétodosSujetosSe utilizaron 48 ratas macho adultas de la cepa Wistar con un peso aproximado de 250g al inicio del experimento. Las ratas fueron mantenidas en cajas de acrílico translúcidas en el bioterio de la Facultad de Química Farmacéutica Biológica de la Universidad Veracruzana, con temperatura ambiente y ciclo de luz-oscuridad de 12/12 h (la luz se encendía a las 7:00 am). El acceso al agua y alimento fue ad libitum. Todas las manipulaciones experimentales, así como el cuidado y el manejo de las ratas se realizaron de acuerdo a las especificaciones nacionales de la Norma Oficial Mexicana NOM-062-ZOO-199915 e internacionales de la Guía para el Cuidado y Uso de Animales de Laboratorio (National Research Council, 1996)16.
Obtención del jugo de yucaLas raíces de yuca fueron colectadas en el poblado de la Defensa, situado en el Municipio de Yecuatla, en el estado de Veracruz, a una altitud de 260 m sobre el nivel del mar. La autentificación de la yuca fue realizada en el Instituto de Ecología A.C. (INECOL) como Manihot esculenta Crantz por el Dr. Sergio Avendaño Reyes, curador del herbario XAL.
El jugo de yuca se obtuvo de acuerdo con estudios previos. Para evitar cualquier proceso de degradación, se preparó todos los días antes de la administración. Los tubérculos se lavaron justo después de la recolección, fueron pelados y cortados en piezas de aproximadamente 5×2×2cm para facilitar y estandarizar las dosis administradas, el jugo de yuca se obtuvo con un extractor de jugos (Moulinex Modelo Centri III, Celaya, Guanajuato, México), e inmediatamente se administró a las ratas6.
Extractos de Ginkgo bilobaSe utilizó el medicamento VASODIL®-25ml (Laboratorios ALTANA Pharma, México) en forma alópata con extracto seco de Ginkgo biloba 40mg y estandarizado a 9,6mg de glucósidos flavónicos calculados como quercetina y canferol. Adicionalmente, se utilizó un suplemento alimenticio «Ginkgo biloba» como fórmula naturista elaborado a base del extracto de Ginkgo biloba (Laboratorio AVANFARMA COHONASA, México).
Cuantificación de flavonoides por espectrofotometríaSe reflujó 1mL de muestra de cada uno de los ginkgos durante 2h con 20mL de ácido sulfúrico al 10% y 20mL de etanol al 50%, luego se enfrió y se filtró con ayuda de vacío. El residuo se lavó con 30mL de etanol al 50%, el filtrado se evaporó hasta la mitad del volumen inicial, se enfrió y filtró, lavando el precipitado con 40mL de agua destilada, el precipitado se disolvió con 70mL de etanol al 96%, finalmente la solución se aforó a 100mL. Posteriormente, se leyeron las absorbancias a 258nm. Como patrón se emplearon 0,04g de quercetina, los cuales se disolvieron con etanol al 96% hasta completar un volumen de 50mL, de esta solución se tomó 1mL y se diluyó a 100mL con etanol al 50%. El blanco consistió en una solución de etanol al 50%17. La expresión empleada para el cálculo fue la siguiente:
donde:
X: contenido de flavonoides totales expresados como quercetina (%).
Am: absorbancia de la solución muestra (nm).
PR: peso de la sustancia de referencia (g).
AR: absorbancia de la solución de referencia (nm).
Identificación y cuantificación de quercetina, catequina y ácido gálico por cromatografía líquida de alta resoluciónSe tomaron 20mL de los extractos obtenidos para la anterior medición, los cuales fueron filtrados a través de un microfiltro de 0,45mm para poder inyectarlos. Se utilizó un equipo de cromatografía de líquidos (HPLC) Varian model ProStar 210, equipado con un detector UV y 2 bombas. Una columna C18 de fase reversa 4,6×250mm, 5μm (Agilent, Wilmington, EE. UU.). La fase móvil A fue agua:acetonitrilo 80:20 y la B acetonitrilo grado HPLC. Se usó una velocidad de flujo de 0,8mL, longitud de onda de acuerdo con el compuesto de interés y un volumen de inyección de 20μL18. Para la cuantificación de cada uno de los flavonoides se utilizó la metodología de enriquecimiento de pico mediante estándares de quercetina, ácido gálico y catequina (Sigma-Aldrich).
Pruebas conductualesActividad locomotoraLa prueba consistió en colocar a la rata en una caja de acrílico opaca de 44×33×20cm cuya base estuvo dividida en 12 cuadros de 11×11cm, por un periodo de 5min. En esta prueba fueron evaluados el número y la duración de conducta vertical, que corresponde a los periodos en los cuales la rata adquirió una postura vertical respecto al piso, apoyada en sus extremidades posteriores. También se evaluó el número de cuadros cruzados tomando como criterio que la rata pasara al menos 3 cuartas partes de su cuerpo de un cuadro a otro. Esta última variable fue utilizada para identificar o descartar efectos de hipoactividad, hiperactividad o no cambios en la motricidad inducida por los tratamientos. La conducta vertical fue utilizada para detectar posibles alteraciones de coordinación motora.
Prueba de nadoLas ratas fueron colocadas individualmente en un estanque de vidrio (26×29×50cm) lleno con agua (25±1°C) durante 5min. La profundidad del agua se ajustó de tal manera que la rata pudiera tocar el fondo del estanque con una o 2 de sus extremidades posteriores incluyendo la cola. Al inicio de la prueba, la rata fue colocada en la esquina del estanque. La rata nadó vigorosamente tan pronto fue colocada en el agua. Ninguno de los animales se ahogó. Después de la conducta inicial de nado, la rata desplegó el nado lateral. La variable dependiente fue el número de veces que la rata desplegó el nado lateral en esta prueba. El nado lateral es definido operacionalmente como la conducta en la cual la rata nada lentamente sobre uno de sus costados sin mantener un equilibrio horizontal. Durante esta conducta, la rata nadó sobre su costado derecho o izquierdo, manteniendo su cabeza horizontalmente. Sus extremidades posteriores permanecían extendidas y rígidas, paralelas a la superficie del agua, por breves periodos. Las extremidades posteriores se movían incoordinadamente para lograr su desplazamiento en el agua6. Una o ambas extremidades anteriores permanecían retraídas (replegadas). Después de este nado lateral, las ratas eventualmente nadaron «normalmente» por breves periodos.
Todas las sesiones en campo abierto y nado fueron videograbadas para posteriormente realizar el registro de las variables por 2 observadores independientes hasta lograr una concordancia mayor del 95%.
Grupos experimentalesSe realizó un diseño mixto con 6 grupos de ratas. Un grupo (VEH, n = 8) recibió el vehículo (agua purificada), un segundo grupo recibió el jugo de yuca (YUC, n = 8) equivalente a 28,56mg de yuca por kg de peso de la rata, otro grupo recibió el extracto alópata de Ginkgo biloba (GINK-AL, n = 8), un grupo más recibió el extracto de Ginkgo biloba naturista (GINK-NAT, n = 8). Finalmente, se incluyeron 2 grupos más que recibieron la combinación de tratamientos Ginkgo biloba alópata más jugo de yuca (GINK-AL+YUC, n = 8) y Ginkgo biloba naturista más jugo de yuca (GINK-NAT+YUC, n = 8). La cantidad de jugo de yuca fue seleccionada de un estudio previo6 en el cual se identificó que es la dosis mínima efectiva para producir alteraciones motoras en las pruebas de campo abierto y nado. Todos los tratamientos se administraron por vía oral en un volumen de 4mL/kg. La dosis utilizada de los extractos de Ginkgo biloba se ajustaron de tal manera que a una rata con un peso de 250g recibiera una dosis de 160mg/kg por vía oral, la cual es equiparable con la dosis recomendada para el consumo humano de acuerdo con las especificaciones del proveedor. Los tratamientos fueron administrados diariamente entre 9:00 y 9:30 am, durante 28 días consecutivos, primero el Ginkgo biloba y media hora después el jugo de yuca. Los efectos fueron evaluados en los días 0, 7, 14, 21 y 28 de tratamiento en las pruebas de campo abierto y nado.
Análisis estadísticoLos datos fueron analizados mediante ANOVA de 2 vías considerando como factor A los tratamientos y como factor B los días de tratamiento. Cuando en la ANOVA se alcanzaron valores de p≤ 0,05, se aplicó la prueba post hoc de Student-Newman-Keuls. Los resultados se presentan como la media±el error estándar de cada variable.
ResultadosContenido de flavonoidesEn la tabla 1 se muestran las concentraciones de los flavonoides que se cuantificaron en las 2 presentaciones comerciales del extracto de Ginkgo biloba. Como se puede observar en la tabla, no hubo diferencias significativas en cuanto al contenido de ácido gálico. Para catequina y quercetina sí hubo diferencias, siendo mayor el contenido para el ginkgo alópata; sin embargo, el contenido de flavonoides totales para la muestra naturista fue casi el doble de la muestra alópata, lo que podría suponer que dicho porcentaje es superior debido a la presencia de otros flavonoides, los cuales podrían corresponder a canferol como ha sido reportado en este tipo de producto.
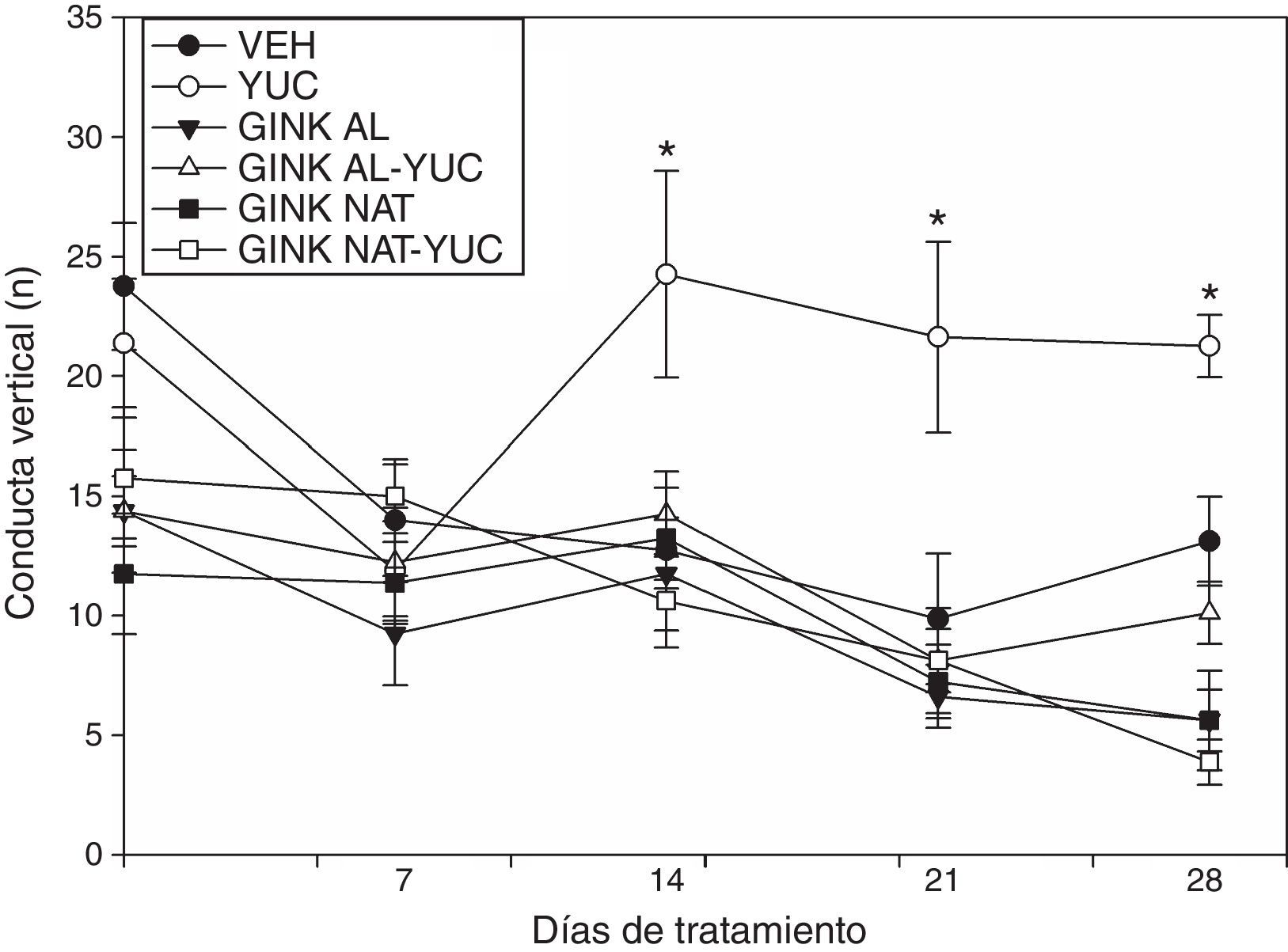
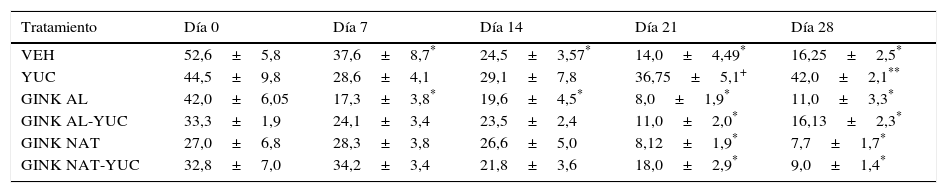
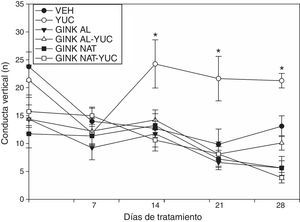
Actividad locomotriz en campo abiertoCuadros cruzadosEl análisis del número de cuadros cruzados reveló diferencias significativas de acuerdo a los tratamientos (F [5,210] = 13.816; p<0,001), a los días de tratamiento (F[4,210] = 17.145; p<0,001) y a la interacción de factores (F[20,210]=2,44; p < 0.001). La prueba post hoc reveló que el grupo yuca no modificó significativamente el número de cuadros cruzados a lo largo del experimento con respecto a su sesión basal. No obstante, el grupo yuca en los días 21 y 28 de tratamiento tuvo un mayor número de cuadros cruzados con respecto al grupo vehículo, GINK-AL y GINK-NAT. Adicionalmente, se observó que el efecto producido por el jugo de yuca sobre esta variable fue prevenido por el tratamiento simultáneo con GINK-AL y GINK-NAT (tabla 2).
Número de cuadros cruzados en la prueba de campo abierto
| Tratamiento | Día 0 | Día 7 | Día 14 | Día 21 | Día 28 |
|---|---|---|---|---|---|
| VEH | 52,6±5,8 | 37,6±8,7* | 24,5±3,57* | 14,0±4,49* | 16,25±2,5* |
| YUC | 44,5±9,8 | 28,6±4,1 | 29,1±7,8 | 36,75±5,1+ | 42,0±2,1** |
| GINK AL | 42,0±6,05 | 17,3±3,8* | 19,6±4,5* | 8,0±1,9* | 11,0±3,3* |
| GINK AL-YUC | 33,3±1,9 | 24,1±3,4 | 23,5±2,4 | 11,0±2,0* | 16,13±2,3* |
| GINK NAT | 27,0±6,8 | 28,3±3,8 | 26,6±5,0 | 8,12±1,9* | 7,7±1,7* |
| GINK NAT-YUC | 32,8±7,0 | 34,2±3,4 | 21,8±3,6 | 18,0±2,9* | 9,0±1,4* |
Los valores representan la media±el error estándar de 8 ratas.
GINK AL: Ginkgo alópata; GINK AL-YUC: Ginkgo alópata-yuca; GINK NAT: Ginkgo naturista; GINK NAT-YUC: Ginkgo naturista-yuca; VEH: vehículo; YUC: yuca.
El análisis de la conducta vertical reveló diferencias significativas de acuerdo con los tratamientos (F [5,210] = 12,95; p<0,001), a los días de tratamiento (F[4,210] = 8,21; p<0,001) y en la interacción de factores (F[20,210]=1,719; p<0,001). La prueba post hoc reveló que el grupo yuca no modificó significativamente el número de conducta vertical a lo largo del experimento con respecto a su sesión basal. No obstante, este grupo a partir del día 14 de tratamiento tuvo un mayor número de cuadros cruzados con respecto al grupo vehículo, GINK-AL y GINK-NAT. También se observó que el efecto producido por el jugo de yuca sobre el número de conducta vertical fue prevenido por el tratamiento simultáneo con GINK-AL y GINK-NAT (fig. 1).
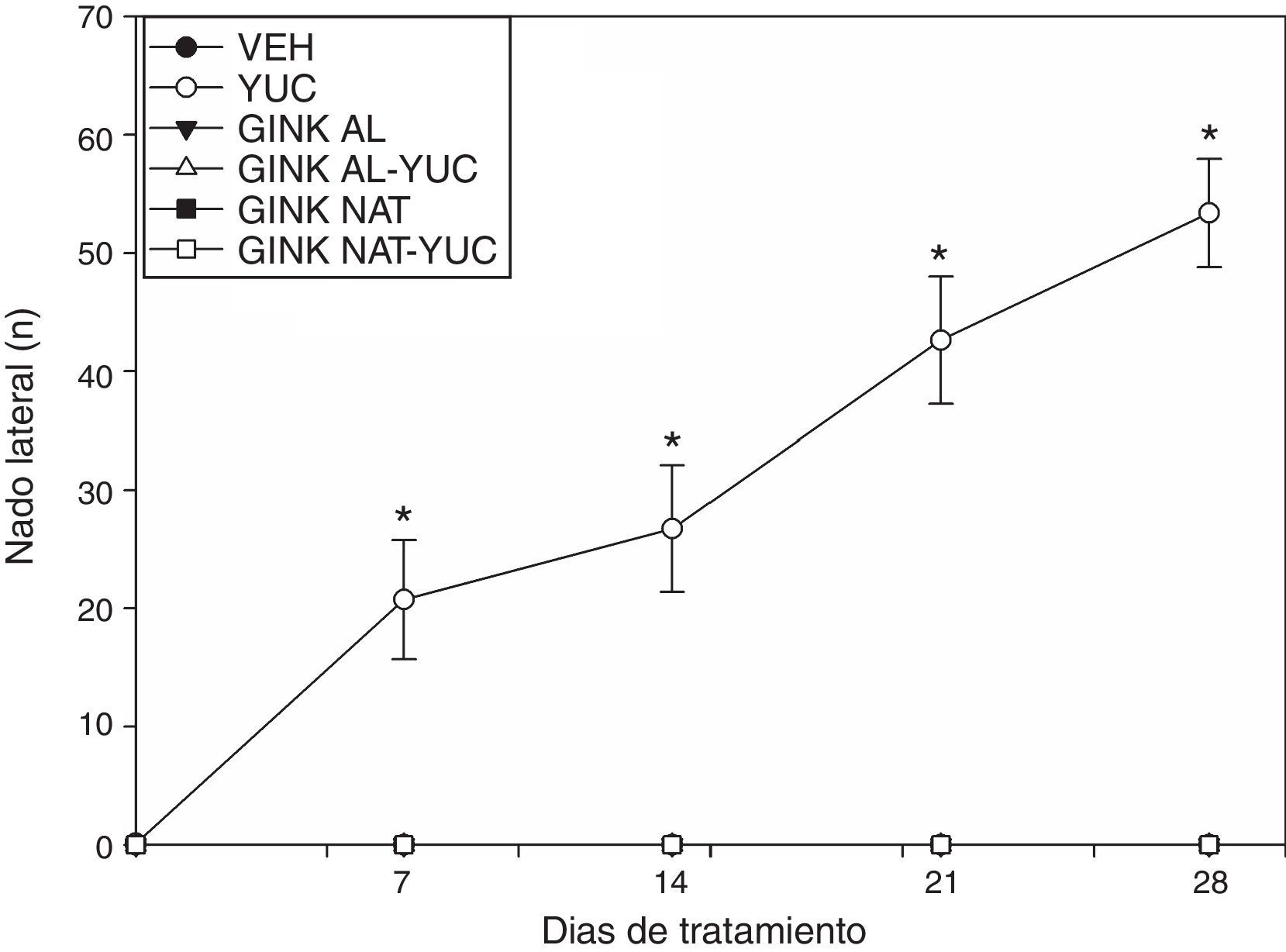
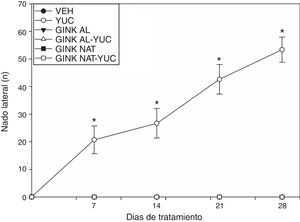
Prueba de nadoNado lateralEl nado lateral solo fue desplegado por los animales que fueron tratados con el jugo de yuca. El análisis estadístico de esta variable reveló diferencias significativas de acuerdo al tratamiento (F [5,220]=237,76; p < 0,001), a los días de tratamiento (F [4,210] = 24.256; p<0,001) y a la interacción de factores (F[20,210]=24.325; p < 0.001) (fig. 2). La prueba post hoc reveló que a partir del día 7 de tratamiento, el grupo tratado con el jugo de yuca incrementó significativamente el número de episodios de nado lateral, respecto al día basal y a las sesiones respectivas del grupo vehículo. El efecto producido por el jugo de yuca sobre esta variable fue prevenido por el tratamiento simultáneo con los extractos de Ginkgo biloba (fig. 2).
DiscusiónLa prueba de campo abierto es empleada para medir la motricidad de los organismos, una conducta innata y específica que depende de la maduración del sistema nervioso central, así como de la integridad de las vías motoras que controlan el movimiento19,20. La motricidad representa el desplazamiento de un animal en respuesta a estímulos ambientales19,20 o tratamientos farmacológicos que inhiben o estimulan la actividad motriz19,20. Se ha encontrado que las ratas evaluadas repetidamente en campo abierto disminuye la exploración debido a un proceso de habituación a las condiciones de la caja21. La habituación se caracteriza por la disminución del número de cuadros cruzados y otras conductas asociadas a la exploración, como la conducta vertical22. En tanto que los animales sometidos a estrés o al consumo de sustancias con actividad neurotóxica como el metilazoximetanol (un principio activo de la cicada Dioon spinulosum) o la linamarina contenida en el jugo de yuca no se habitúan a las condiciones de prueba6,22, lo cual al parecer está asociado con alteraciones en las vías y sistemas de neurotransmisión involucrados en el control del movimiento y en la locomoción. Lo anterior al parecer puede estar relacionado con un incremento en la producción de radicales libres a nivel neuronal19,23.
En el presente trabajo se encontró que los animales que consumieron el jugo de yuca tuvieron un estado de hiperactividad motora en la prueba de campo abierto, lo cual es concordante con estudios previos6. Al parecer, estas alteraciones en la motricidad están relacionadas con la toxicidad de la linamarina contenida en la yuca6. La conducta vertical evaluada en campo abierto representa una respuesta a estímulos novedosos en donde participa la consolidación de la memoria de corto y largo plazo24. En el presente estudio se observó que el grupo que recibió el jugo de yuca fue el único que mantuvo la conducta vertical a lo largo del estudio. Lo anterior sugiere un posible déficit de memoria en el cual la rata no reconoce las condiciones de la caja, por lo cual despliega esta conducta indicadora de exploración como si fuera la primera vez que es expuesta a estas condiciones experimentales. Esta posibilidad se sustenta en el hecho de que en el ser humano que consume la yuca o sus derivados, además de tener alteraciones motoras, también desarrolla alteraciones en los procesos de memoria6,25. Es de resaltar, que las ratas tratadas con el jugo de yuca simultáneamente con los extractos de Ginkgo biloba no desarrollaron las alteraciones conductuales en la prueba de campo abierto, lo que sugiere un efecto protector que será discutido más adelante.
La prueba de nado forzado ha sido utilizada principalmente para evaluar el efecto de sustancias con potencia antidepresiva26. No obstante, la prueba de nado ha sido utilizada también para estudiar alteraciones motoras asociadas al consumo de sustancias que dañan el sistema vestibular27,28 o neurotóxicas6,22,29. En la rata el consumo de semillas de Dioon spinulosum a largo plazo o la microinyección de uno de sus componentes químicos (metilazoximetanol) inducen un nado anormal representado por la conducta de giro22,29. En un estudio previo, se reportó que la administración de jugo de yuca promueve un nado anormal representado por el nado lateral, el cual es propuesto como un indicador del daño en la coordinación motora6. En el presente trabajo, el grupo tratado con el jugo de yuca fue el único en presentar el nado lateral, confirmando el daño motor asociado al consumo de los metabolitos de la yuca como la linamarina. Este principio activo al ser metabolizado produce cianuro, el cual causa una serie de cambios en la bioquímica del cerebro y estrés oxidativo que predispone a la muerte neuronal, lo cual se asocia con alteraciones en la motricidad30. En este sentido, la exposición a cianuro en la rata produce neurodegeneración en médula espinal y ganglios en el sistema nervioso central, además de inhibir la cadena transportadora de electrones, provocando así la generación de especies reactivas de oxígeno, causantes del estrés oxidativo; uno de los mecanismos implicados en la neurodegeneración, la incapacidad motora y cognitivas31-33, entre otras. Cabe señalar que, al igual que en campo abierto, la alteración motora identificada en la prueba de nado, fue prevenida por el tratamiento conjunto con los extractos de Ginkgo biloba, sustentando el efecto neuroprotector atribuido a esta planta34.
Aunque el mecanismo por el cual los extractos de Ginkgo biloba ejercen el efecto protector contra la alteraciones motoras asociadas al consumo del jugo de yuca no fue explorado, es posible que se deba al alto contenido de flavonoides y lactonas sesquiterpénicas, los cuales actúan como agentes neuroprotectores ya que previenen el daño neuronal inducido por excitotoxicidad producto de la sobreactivación de los receptores N-metil-D-aspartato (NMDA), además, los flavonoides actúan como agentes antioxidantes, inhibiendo la formación del radical hidroxilo en un 65% y del radical adriamicilo en un 50% con la consiguiente reducción de la peroxidación lipídica35,36. El extracto de Ginkgo biloba también ha mostrado reducir la neuroinflamación, así como promover la memoria, el aprendizaje y la función cognitiva mediante la disminución de la velocidad de desaparición de los receptores muscarínicos y α-adrenérgicos, además de incrementar los niveles de colina-acetiltransferasa y somatostatina en la corteza y región de hipocampo13,37,38. Considerando que ambos productos de Ginkgo biloba tuvieron un alto contenido de flavonoides, se sugiere que el conjunto de acciones farmacológicas del Ginkgo biloba pudiera estar involucrado en el efecto protector contra la toxicidad asociada a los metabolitos neurotóxicos contenidos en la yuca, evitando así las alteraciones motoras identificadas en el presente estudio.
En conclusión, los extractos estandarizados de Ginkgo biloba previenen las alteraciones motoras asociadas al consumo del jugo de yuca (Manihot esculenta Crantz) en la rata Wistar. Lo anterior puede contribuir al desarrollo futuro de estrategias preventivas o terapéuticas para el manejo de las alteraciones motoras asociadas al consumo de yuca y sus derivados en poblaciones vulnerables.
FinanciaciónEste estudio fue apoyado parcialmente con recursos financieros del Cuerpo Académico Biología, Química y Funcionalidad Molecular de Metabolitos Vegetales (UV-CA-368) de la Universidad Veracruzana.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.