La isquemia cerebral es una de las enfermedades neurológicas más frecuentes a nivel mundial. Las múltiples secuelas abarcan desde lo motor y la sensibilidad hasta un deterioro cognitivo y la demencia. Los modelos animales de isquemia-hipoperfusión cerebral tienen su efecto sobre la memoria a largo plazo, sin embargo, aún no están claros sus efectos a corto plazo y, en el caso de algunos modelos de hipoperfusión, se desconocen por completo.
MétodosSe valoraron los efectos de 2 modelos de hipoperfusión cerebral sobre la memoria en ratas macho de 3 meses de edad. Se evaluó la memoria episódica y de trabajo empleando las pruebas de reconocimiento de objetos nuevos y alternancia espontánea, respectivamente, así como una valoración neurológica y una prueba de locomoción en una arena para campo abierto.
ResultadosSe encontró que en los 2 modelos de hipoperfusión las ratas no presentan una alteración cognitiva. A pesar de que existe una tendencia en las ratas con ligadura unilateral izquierda más ligadura transitoria de la carótida derecha a presentar una leve alteración negativa en la prueba de reconocimiento de objetos nuevos al segundo día después de la oclusión, mientras que el grupo con ligadura unilateral permanente tiende a presentar alteraciones en la memoria de trabajo y episódica a los 9 días luego de la isquemia, con una posterior recuperación.
ConclusiónSin embargo hay una clara afectación motora 2 días después de la cirugía, reflejada por una disminución en la actividad locomotora en la prueba de campo abierto, en ambos grupos con hipoperfusión.
Cerebral ischaemia is one of the most common neurological diseases worldwide. Its many sequelae range from motor and sensory symptoms to cognitive decline and dementia. Animal models of cerebral ischaemia/hypoperfusion elicit effects on long term memory; however, the effects of these procedures on short term memory are not clearly understood and effects induced by alternative hypoperfusion models are completely unknown.
MethodsWe evaluated the effects of 2 cerebral hyperperfusion models on memory in 3-month-old male rats. Episodic memory and working memory were assessed using the new object recognition test and the spontaneous alteration test, respectively. Neurological assessment was also performed, along with an open field test to evaluate locomotor activity.
ResultsRats in both hyperperfusion models displayed no cognitive changes. Rats with unilateral left-sided ligation plus temporary ligation of the right carotid tended to show slightly impaired performance on the new object recognition test on the second day after the procedure. In contrast, the group with permanent unilateral ligation tended to display alterations in working and episodic memory 9 days after the procedure, but they subsequently recovered.
ConclusionDespite these differences, both hypoperfusion groups displayed clear signs of motor impairment 2 days after the procedure, as reflected by their decreased locomotor activity during the open field test.
El ictus es el padecimiento neurológico más frecuente a nivel mundial, causando aproximadamente 5 millones de muertes al año1, mientras que la Organización Mundial de la Salud (OMS) reporta que es la segunda causa de muerte en el mundo con un 9,7% del total de los decesos y que 4,95 millones de defunciones ocurren solo en los países con ingresos medios y bajos2,3.
Déficit cognitivo asociado a isquemia cerebralLa presencia de un déficit cognitivo posterior a sufrir un ictus es frecuente y repercute considerablemente en la calidad de vida de la persona afectada y sus familiares. Algunos de los déficit cognitivos más frecuentes son el déficit de atención, negligencia espacial, inatención visual, apraxia, síndrome amnésico y la demencia vascular4.
Este tipo de alteraciones cognitivas es provocada por la muerte de grupos neuronales, secundaria a ictus tanto hemorrágicos como isquémicos5.
Según el tamaño del infarto, si es superior a 100ml de reblandecimiento, se produce la demencia, si es menor de 50ml no aparece y entre 50 y 100 ml es incierto, pero posible. Sin embargo, lesiones menores de 50ml en zonas estratégicas como la lesión única talámica en ganglios basales pueden provocar alteraciones cognitivas como déficit de atención, negligencia espacial, inatención visual, apraxia6,7.
Se calcula que aproximadamente el 25-50% de las personas con ictus desarrollan una demencia vascular que provoca, agrava o contribuye a desenmascarar un fallo cognitivo previo8. Generalmente es de aparición súbita posterior al infarto, trombosis o hemorragia cerebral. El deterioro suele ser gradual, con presencia de manifestaciones neurológicas focales, una posible recuperación parcial y un agravamiento secundario a un nuevo ictus. En los casos de infartos de pequeñas dimensiones, casi silentes, la evolución del cuadro es indistinguible de la enfermedad de Alzheimer9.
En el síndrome amnésico, al contrario que en la demencia, no existe una afectación cognitiva global, ya que únicamente se ve afectada la memoria. Se caracteriza por la incapacidad para adquirir nuevos conocimientos, retener y recuperar información, pudiendo afectar a la memoria de trabajo o a la memoria episódica.
Memoria de trabajo y episódicaLa memoria de trabajo se refiere a un tipo de memoria empleada para mantener la información por cortos periodos de tiempo mientras está siendo utilizada en la realización de una tarea específica. Abarca la memoria a corto plazo, lo que en la teoría de Baddeley se refiere únicamente al almacenamiento pasivo de la información por periodos breves. La memoria de trabajo cuenta con un sistema de control con capacidad de atención limitada denominado componente central ejecutivo, el cual sirve para manipular la información y es asistido por 3 componentes separados de almacenamiento: el circuito fonológico (basado en sonido y lenguaje), el circuito visual-espacial (similar al circuito fonológico, excepto que almacena información visual y espacial en lugar de acústica) y el buffer episódico (es un almacenamiento de corto plazo de la información de distintas modalidades que se recupera de la memoria episódica a largo plazo). Para probar la memoria de trabajo se usan tareas que requieran el almacenamiento de información y su manipulación a corto plazo10.
La memoria episódica está implicada en los recuerdos de hechos concretos que tienen lugar en el espacio y tiempo, así como en los procesos cognitivos subyacentes y los mecanismos neuronales que participan en el recuerdo de estos eventos, responde a las preguntas «¿qué?», «¿cuándo?» y «¿dónde?» de un acontecimiento determinado en la vida del individuo10–12. Se trata de una asociación entre diversos sistemas de información (sensorial, temporal y espacial) que forman una configuración compleja llamada «suceso»12.
Para realizar la investigación de la relación entre la hipoperfusión cerebral y su relación con las alteraciones locomotoras y cognitivas, específicamente en la memoria de trabajo y episódica, se hace uso de los modelos animales13–18.
El modelo de hipoperfusión por oclusión de 2 vasos (ambas arterias carótidas) ha sido ampliamente estudiado en su relación con los trastornos del aprendizaje y la memoria, especialmente con la memoria espacial, ya que afecta severamente al hipocampo, demostrado en las pruebas de laberinto acuático y laberinto radial de 8 brazos19–21. Con lo que se establece firmemente que la hipoperfusión cerebral experimental compromete la capacidad de aprendizaje espacial en ratas. En cuanto a la memoria episódica y de trabajo, se han evaluado en ratas con la prueba de reconocimiento de objetos y el laberinto-Y respectivamente, en la cual se observa que la oclusión de las 2 carótidas de forma permanente afecta este tipo de memoria22.
En conjunto estos datos prueban que la hipoperfusión cerebral grave afecta de manera negativa al hipocampo y esto conlleva un deterioro en el aprendizaje visual-espacial y la memoria episódica y de trabajo. Esta afectación puede ser dependiente del tiempo, ya que en algunos estudios a largo plazo reportaron que una semana después de la hipoperfusión no existía una diferencia entre los animales con doble oclusión de carótida y el grupo Sham, y que el deterioro cognitivo se hacía evidente 16 meses más tarde23.
Sin embargo, el modelo de la oclusión unilateral de la arteria carótida no se ha estudiado con relación a sus efectos sobre la locomoción o la memoria, a pesar de ser de una sencilla realización y un gran parecido con aspectos fisiopatológicos con la estenosis carotídea aterosclerótica.
Material y métodosSe utilizaron 25 ratas Wistar macho con peso de 270 a 370 g y 3 meses de edad, aproximadamente. Todos los experimentos fueron conducidos con la aprobación y de acuerdo a las regulaciones vigentes para el uso y cuidado de animales investigación de la NOM-062-ZOO-1999 y del manual de la Society For Neuroscience.
Grupos experimentalesLas ratas se asignaron a los siguientes tratamientos: grupo LCCI, se les realizó una cirugía para producir hipoperfusión cerebral mediante ligadura permanente de la arteria carótida común izquierda (n=6); grupo DLCC, se les indujo la hipoperfusión a través de la ligadura permanente de la arteria carótida común izquierda y oclusión transitoria de la carótida común derecha por 10 min (n=6); grupo SHAM, se les realizó la cirugía hasta exponer ambas arterias carótidas sin ligadura de las mismas (n=6). Antes de realizar la cirugía, se realizaron las pruebas conductuales en todos los individuos intactos para realizar la comparación con los distintos intervalos de tiempo después de la cirugía. Dichas pruebas consistieron en prueba de campo abierto, reconocimiento de objetos nuevos y la prueba de alternancia espontánea en el laberinto-T. Se realizó la manipulación de los sujetos experimentales por un lapso de 5 min al día por sujeto, durante 5 días antes del inicio de las pruebas conductuales, para aclimatarlos a la manipulación.
Prueba de campo abiertoPara evaluar la actividad locomotora espontánea en las ratas se utilizó la prueba de campo abierto, la cual fue desarrollada por Calvin Hall en 1934. Cada rata fue colocada de manera individual en una caja de acrílico opalino con las siguientes dimensiones: 75 × 75 × 50 cm de alto, en base a la arena24 con algunas modificaciones, la cual cuenta con líneas divisoras en el piso, que forman 25 cuadros idénticos de 15 cm por lado.
La prueba de campo abierto se realizó en 2 sesiones. La primera sesión conocida como habituación, en la cual se colocó a la rata en el centro de la caja y posteriormente se le permitió deambular libremente durante 5 min. Esta sesión es descartada para el análisis estadístico, ya que solo cumple con la función de habituar al animal a un ambiente nuevo. En la segunda sesión de prueba realizada 24 h después, el sujeto experimental es nuevamente ingresado en la caja de acrílico bajo las mismas circunstancias ya descritas en la fase de habituación durante 5 min25.
En la segunda sesión se evaluaron el número de cuadros cruzados (se consideró que la rata cruzaba un cuadro cuando 3 cuartas partes de su cuerpo se encontraban en el cuadro siguiente), tiempo total que el animal permaneció en alguna de las 2 regiones de la arena (para medir estas 2 variables se consideraron tanto los tiempos de inmovilidad, desplazamiento, como cualquier conducta realizada en cada área), las cuales se dividen en 2: la región central (determinada por los 9 cuadros centrales) y la región periférica (formada por los 16 cuadros que rodean al área central), frecuencia y tiempo dedicado a realizar la conducta vertical (considerada como los lapsos en que la rata adopta una postura vertical con respecto al piso). El número de cuadros cruzados se utilizó para evaluar el grado de la actividad espontánea, los tiempos de permanencia y exploración en el centro o la periferia, la actividad vertical se usó para evaluar la motivación a la exploración y la coordinación motora.
Prueba de reconocimiento de objeto nuevoPara evaluar la memoria episódica se realizó la prueba de reconocimiento de objeto nuevo26,27, esta prueba tiene como fundamento la tendencia natural de las ratas a explorar objetos nuevos durante mayor tiempo que los objetos que les son conocidos o familiares. Se usaron 2 objetos idénticos y un objeto nuevo diferentes para cada día en que se realizó la prueba, siendo un total de 4 pares de objetos idénticos entre ellos que consistieron en frascos de plástico de medidas entre 10 y 15cm y 4 objetos nuevos también de plástico de dimensiones similares a los anteriores.
La prueba se divide en 3 fases, una fase de habituación, fase de familiarización con 2 objetos idénticos y la fase de prueba de reconocimiento del objeto nuevo. Cada fase tiene una duración de 5 min. La fase de habituación fue la misma usada como sesiones en la prueba de campo abierto, esta fase se descarta para el análisis estadístico de la prueba de reconocimiento de objeto nuevo, ya que solo sirve para que el animal se familiarice con el ambiente novedoso.
Después de los 5 min de habituación, el animal es llevado a su caja hogar en donde aguarda durante 20 min para la siguiente fase de familiarización (en esta se colocaron 2 objetos idénticos (objeto A1 y objeto A2) a 15 cm de las paredes en las posiciones 1 y 2.
Prueba de alternancia espontánea en el laberinto-TPara evaluar la memoria de trabajo se utilizó la prueba de alternancia espontánea en el laberinto-T. El fundamento de la prueba es que los roedores exploran alternadamente cada uno de los brazos del laberinto, pero dependen de la memoria de trabajo para recordar cuál es el brazo visitado y por lo tanto explorar el brazo no visitado en el segundo intento.
Para la prueba de alternancia espontánea se empleó el protocolo de Deacon y Rawlins (2006), para el cual no se realizó habituación al laberinto. Al iniciar cada ensayo se elevaron todas las puertas y se colocó al roedor en la caja de salida, después de 20 s en la caja de salida se le permitió elegir libremente un brazo meta. Una vez hecha la elección, el animal permaneció encerrado en el brazo elegido, cerrando la puerta de guillotina correspondiente, durante 30 s. A continuación se levantó la puerta de guillotina del brazo muestra o conocido, al mismo tiempo que se trasladó al sujeto experimental de forma gentil a la zona de salida, de espalda a los brazos meta. Nuevamente se le permitió realizar la elección libre de uno de los 2 brazos. Después se colocó a la rata en la caja de salida en donde pasó el periodo entre ensayos durante 1 min.
En total se realizaron 5 ensayos por sujeto experimental en los días 7 antes de la cirugía y los días posquirúrgicos 2, 9 y 15. Se evaluó el porcentaje de aciertos que obtuvo cada rata al alternar entre los brazos meta; se considera un acierto cuando la rata visita el brazo que no había visitado previamente.
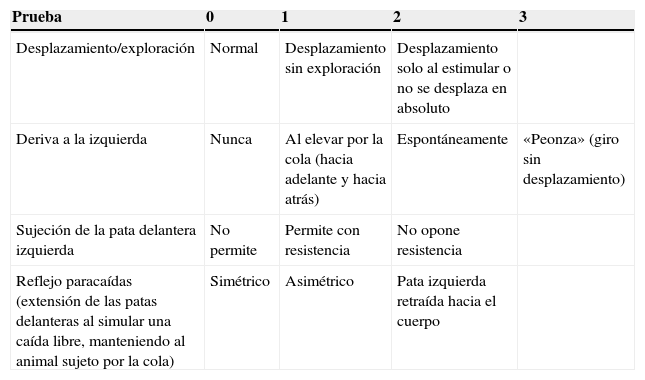
Valoración neurológicaSe realiza una rápida valoración neurológica en los 3 grupos de ratas (SHAM, LCCI y DLCC), 7 días antes de realizarles la cirugía y en el momento de su recuperación de la anestesia, así como a las 24 y 48 h y a los 8, 9, 14 y 15 días después de la cirugía. La evaluación se realizó con un test que permite cuantificar el grado de deterioro neurológico, en una escala de 0 a 9, siendo 0 la ausencia de afectación neurológica y 9 la máxima afectación28.
La valoración se realiza en una serie de pruebas que se basan en la observación de las respuestas recogidas en la tabla 1.
Valoración neurológica en ratas
| Prueba | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| Desplazamiento/exploración | Normal | Desplazamiento sin exploración | Desplazamiento solo al estimular o no se desplaza en absoluto | |
| Deriva a la izquierda | Nunca | Al elevar por la cola (hacia adelante y hacia atrás) | Espontáneamente | «Peonza» (giro sin desplazamiento) |
| Sujeción de la pata delantera izquierda | No permite | Permite con resistencia | No opone resistencia | |
| Reflejo paracaídas (extensión de las patas delanteras al simular una caída libre, manteniendo al animal sujeto por la cola) | Simétrico | Asimétrico | Pata izquierda retraída hacia el cuerpo |
Se realizaron nuevamente las pruebas conductuales en los días 2, 9 y15 posteriores a la cirugía en los 3 grupos, con la finalidad de evaluar nuevamente la memoria episódica y de trabajo, así como la prueba de campo abierto para evaluar la actividad locomotora y valoraciones neurológicas subsecuentes.
Procesamiento estadísticoLa supervivencia de los distintos grupos quirúrgicos fue representada mediante porcentaje al igual que los resultados de la valoración neurológica. Los resultados de los demás ensayos (campo abierto, reconocimiento de objeto nuevo, alternancia espontánea en laberinto-T) se expresaron a través de la media±desviación estándar. Los mismos se procesaron mediante un análisis de varianza de medidas repetidas de 2 vías (ANOVA de medidas repetidas de 2 vías). Las 2 vías o factores fueron los días transcurridos con respecto a la cirugía y el tipo de cirugía y posteriormente se realizó la prueba de Student-Newman-Keuls cuando el nivel de significación fue de p<0,05. Los datos se expresan como porcentajes de cambio.
ResultadosValoración neurológicaLos animales de grupo SHAM y LCCI presentaron 0 puntos en la valoración neurológica que se les realizó antes y después del procedimiento quirúrgico (7 días antes de la cirugía y después de recuperarse de la anestesia, así como a las 24 y 48 h y a los 8, 9, 14 y 15 días posteriores a la cirugía), mientras que el grupo DLCC solo 2 animales presentaron un puntaje de 1 para un individuo y 2 puntos para otro, a las 24 y 48 h posquirúrgicas, y 0 en el resto de las valoraciones.
El animal que presentó un puntaje de 2 puntos fue retirado para el resto de las pruebas debido a que en el día 2 no realizó las pruebas adecuadamente ya que presentó una hipomotilidad severa; posteriormente se recuperó a partir del día 9. Durante la exploración física se detectó la caída del párpado superior izquierdo, conocida técnicamente como ptosis. En el grupo LCCI lo mostró una rata (16,6%), en el grupo DLCC lo mostraron 3 individuos (42,8%) de los sobrevivientes a la hipoperfusión inducida, mientras que en el grupo SHAM, ninguno.
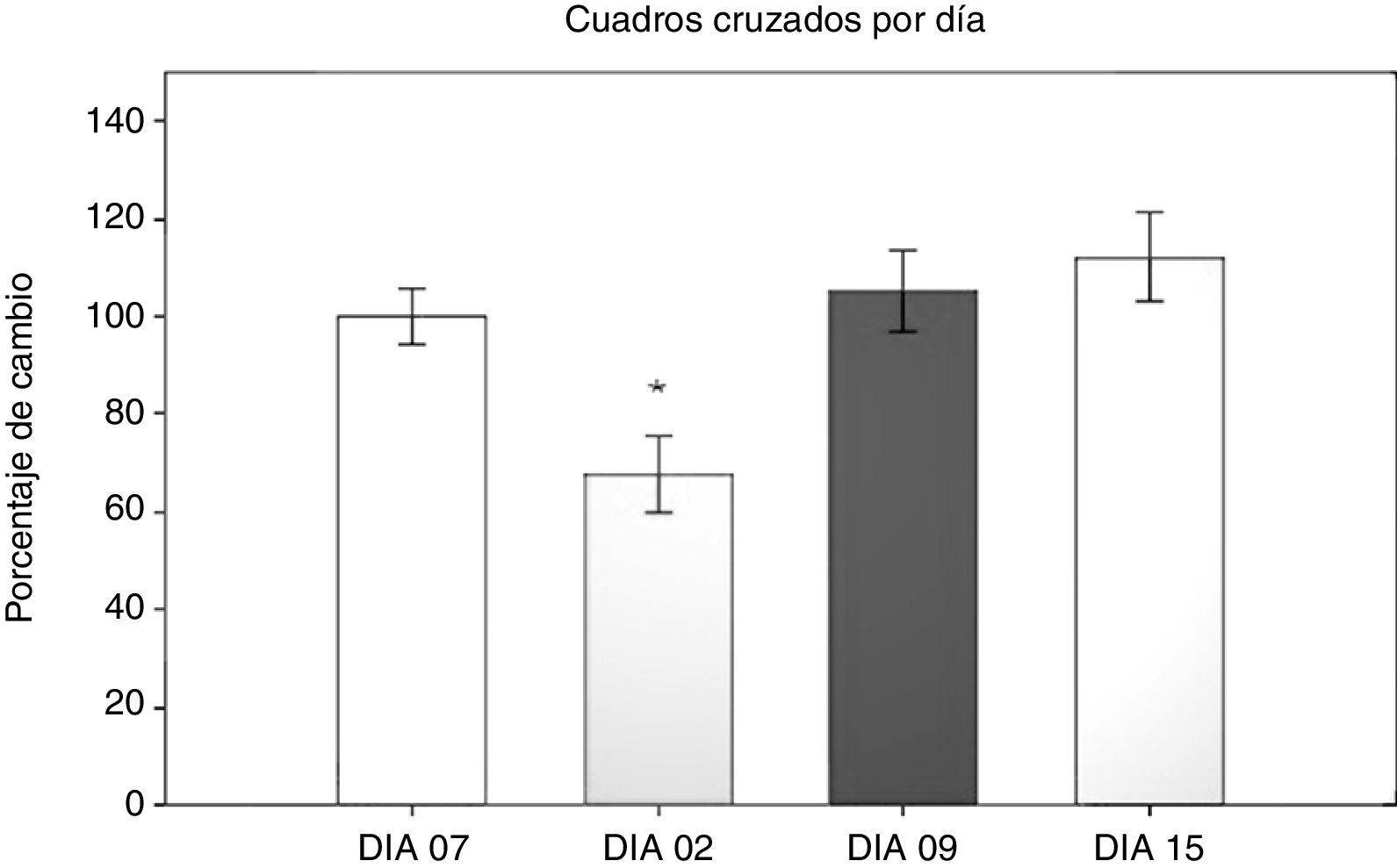
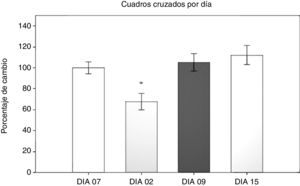
Prueba de campo abierto: número de cuadros cruzadosPara la prueba de campo abierto se analizaron en primer lugar el número de cuadros cruzados en 5 min, mediante un ANOVA de MR 2 vías, siendo los 2 factores los días transcurridos con respecto a la cirugía y el tipo de cirugía al que fueron sometidas. El test de equidad de varianzas fue aprobado (p=0,499). El análisis encontró que existe una diferencia con respecto al factor días (F[3,45]=13,558; p<0,001) (fig. 1). La prueba post-hoc de Student-Newman-Keuls (fig. 1) reveló que existe una diferencia significativa en el factor del tiempo en días entre el día 2 y los días 9 y 15, así como el día 7 antes de la cirugía (p<0,001).
En el día 2 posquirúrgico los grupos sujetos a hipoperfusión cerebral mostraron una disminución de la actividad locomotora, que se normalizó a partir del día 9 posquirúrgico. En el grupo SHAM también se observó un efecto de hipomotilidad en el día 2, aunque menor que en los otros 2 grupos y sin diferencia con el día 7 antes de la cirugía. Específicamente en el grupo SHAM se encontró que existe una diferencia entre el día 2 con los días 9 y 15 (p=0,038). En el grupo LCCI hay una diferencia entre el día 7 antes de la cirugía y el día 2 posquirúrgico (p=0,015), entre el día 2 y el día 15 (p=0,008), así como entre el día 2 y el día 9 (p=0,006). En el grupo DLCC existen diferencias entre los días 2 y 15 (p<0,001), 2 y menos 7 (p=0,003), y el día 2 con el día 9 (p=0,008).
Prueba de campo abierto: tiempo total periferiaPara la prueba de campo abierto se analizó el tiempo total que el animal permaneció en la periferia. Se realizó un ANOVA de MR de 2 vías. El test de equidad de varianzas fue pasado (p=0,865). El análisis encontró que existe una diferencia con respecto al factor días (F[3,45]=3,906; p=0,015), pero no entre en las cirugías (F[2,45]=0,265; p=0,771) o la interacción de ambos (cirugía × días) (F[6,45]=0,418; p=0,863). La prueba post-hoc reporta que existe una diferencia en el factor tiempo entre los días 2 y 15 (p=0,009) y una tendencia entre los días menos 7 y 2 (p=0,077). No se reporta diferencia entre los grupos por día. Lo que indica una tendencia de los roedores a permanecer un menor tiempo en la periferia con respecto al día 2, que fue el día en que más tiempo pasaron los grupos en promedio en la periferia.
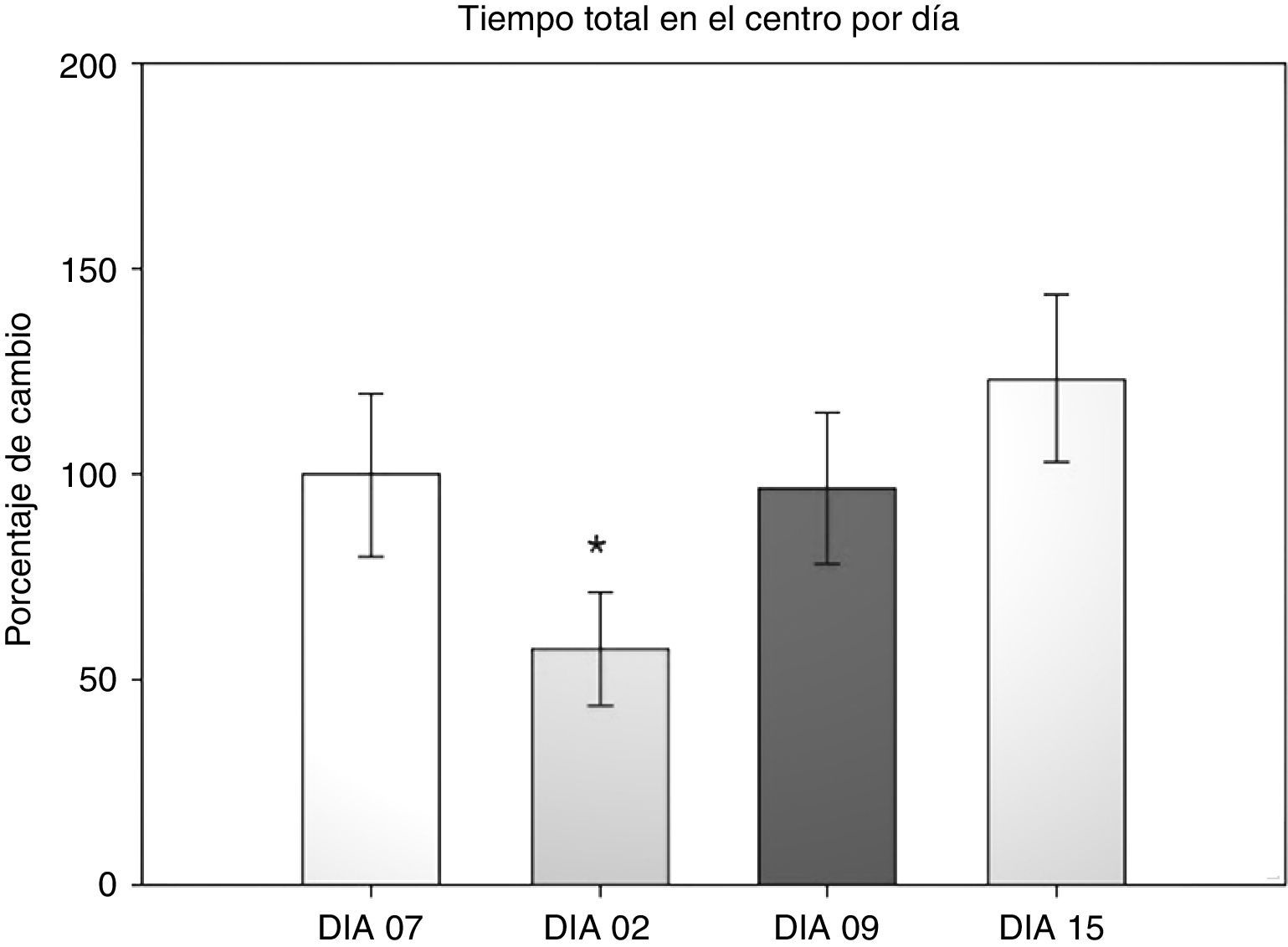
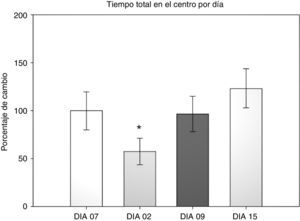
Prueba de campo abierto: tiempo total centroEn esta variable se cuantificó el tiempo que dedicó al acicalamiento, la conducta vertical, la ambulación y el reposo dentro del área central durante los 5 min que duró la prueba. Se realizó un ANOVA de MR de 2 vías. El test de equidad de varianzas fue aprobado (p=0,911). El análisis encontró que existe una diferencia con respecto al factor día (F[3,45]=3,894; p=0,015), pero no entre las cirugías (F[2,45]=0,231; p=0,797) o la interacción de ambos (cirugía × días) (F[6,45]=0,408; p=0,870). El análisis post-hoc de Student-Newman-Keuls (fig. 2) encontró que existe una diferencia significativa en el factor días entre los días 2 y 15 (p=0,008), correspondiendo con el análisis anterior de la permanencia en la periferia. Lo que indica que los roedores dedicaron un menor tiempo a explorar el centro en el día 2 después de la cirugía, pero esta conducta aumentó conforme avanzaban las sesiones hasta el día 15. Sin embargo no hay diferencia entre los grupos. Solo una tendencia en el grupo DLCC (p=0,078 do not test) entre el día 2 y 15 posquirúrgico.
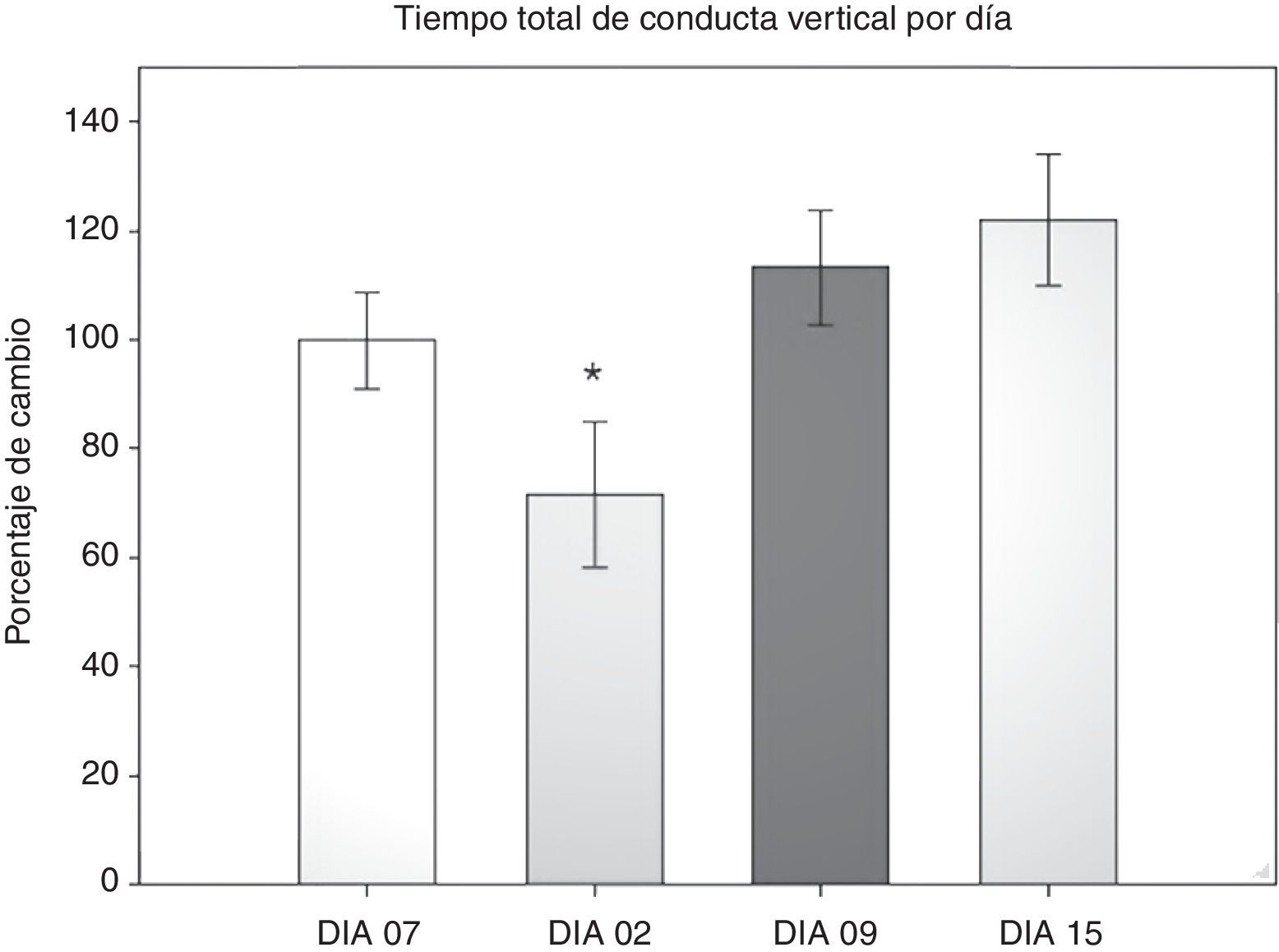
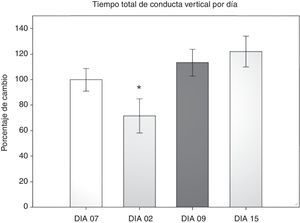
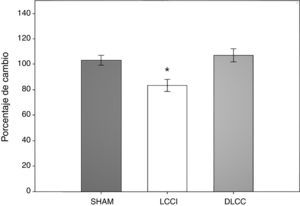
Prueba de campo abierto: tiempo total de conducta verticalSe cuantificó el tiempo que dedicaron los roedores a la conducta vertical durante 5 min en cualquier área de la arena, ya fuera centro o periferia. Se realizó un ANOVA de MR de 2 vías. El test de equidad de varianzas fue pasado (p=0,224). El análisis encontró que existe una diferencia muy significativa con respecto al factor tiempo (días) (F[3,45]=7,932; p<0,001) y entre la interacción (cirugía × días) (F[6,45]=2,628; p=0,029), sin embargo no la hay entre las cirugías (F[2,45]=2,775; p=0,094). El análisis post-hoc de Student-Newman-Keuls (fig. 3) reportó una diferencia entre los días 2 y 9 (p=0,001), el día 2 contra el 15 (p<0,001) y el día 2 con el menos 7 (p=0,014). En el grupo LCCI hay una tendencia entre los días 7 antes de la cirugía y el día 2 (p=0,071). Mientras que en el grupo DLCC hay diferencia del día 2 con los días menos 7 (p=0,007), día 9 (p=0,003) y el día 15 (p<0,001). También hay una diferencia al comparar los factores cirugía con los días en el día 2 de evaluación entre los grupos SHAM vs. DLCC (p=0,023) y SHAM vs. LCCI (p=0,015). Así como en el día 15 SHAM vs. LCCI (p=0,050) y DLCC vs. LCCI (p=0,026).
Prueba de campo abierto: frecuencia total de conducta verticalPara evaluar la frecuencia total de conducta vertical se consideraron todas las veces que el animal realizó esta conducta tanto en el centro como en la periferia durante los 5 min que duró la prueba de campo abierto. Se realizó un ANOVA de MR de 2 vías. El test de equidad de varianzas no fue aprobado (p<0,050). El análisis encontró que existe una diferencia muy significativa con respecto al factor días (F[3,45]=9,674; p<0,001), pero no entre las cirugías (F[2,45]=0,391; p=0,683) o la interacción de ambos (cirugía × días) (F[6,45]=1,344; p=0,258). La prueba post-hoc de Student-Newman-Keuls reportó que existe una diferencia en factor días entre el día 2 con respecto a los 7 días antes de la cirugía y los días 9 y 15 posquirúrgicos (p=<0,001). En grupo LCCI hay diferencia del día 2 con el día menos 7 (p=0,018), el día 9 (p=0,019) y el día 15 (p=0,015). En el grupo DLCC de igual forma existe una diferencia entre el día 2 con respecto al día menos 7 (p=0,003), el día 9 (p=0,003) y el día 15 (p<0,001).
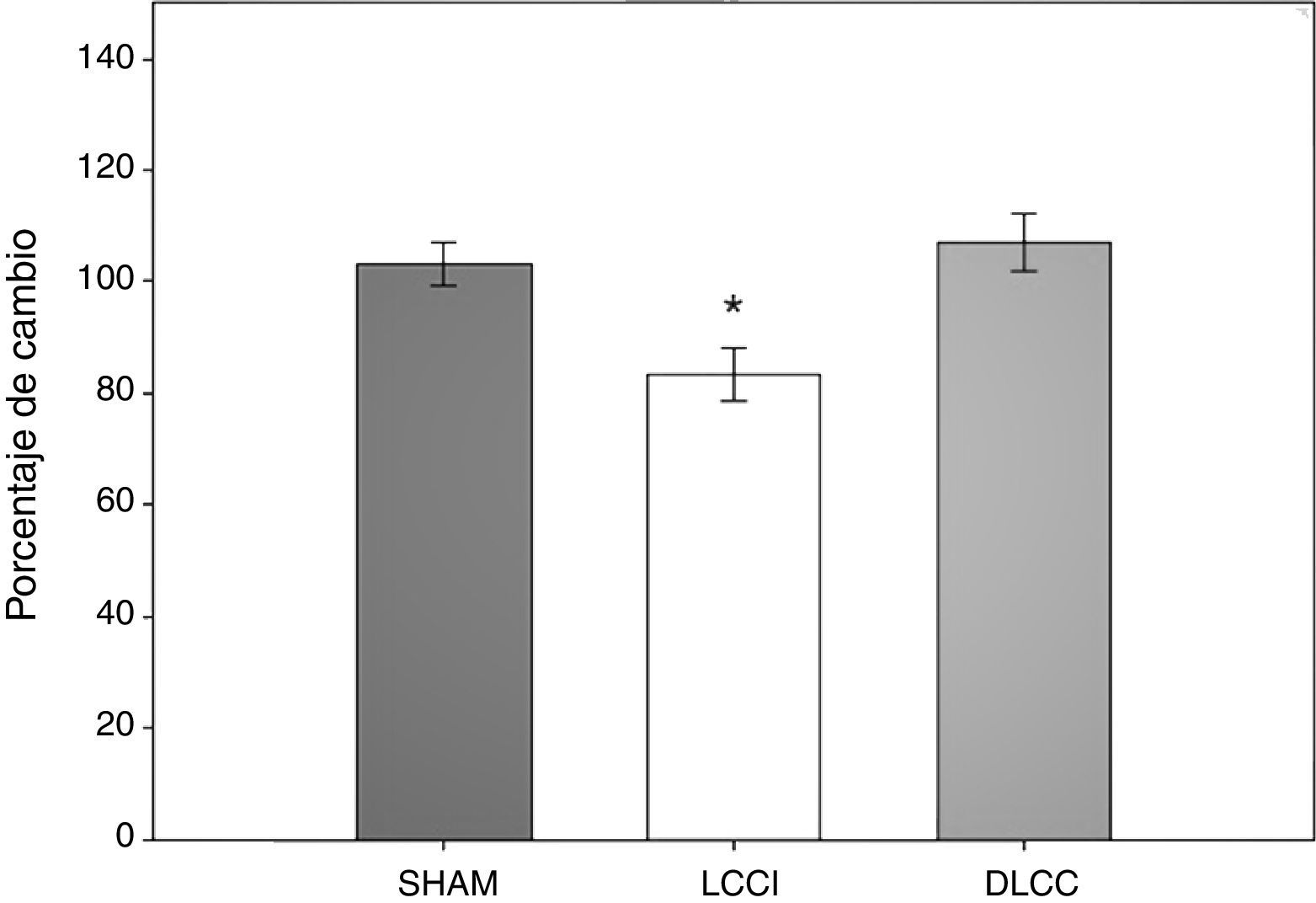
Prueba de alternancia espontánea en laberinto-TEn la prueba de alternancia espontánea se analizó el porcentaje de aciertos que obtuvieron los sujetos experimentales durante dicha prueba. Se realizó un ANOVA de MR de 2 vías. El test de equidad de varianzas fue aprobado (p=0,320). El análisis encontró que existe una diferencia significativa con respecto al tipo de cirugía (F[2,45]=5,399; p=0,017) y entre la interacción (cirugía × días) (F[6,45]=3,015; p=0,015), pero no en el factor días (F[3,45]=0,205; p 0,892) (fig. 4).
En el estudio post-hoc de Student-Newman-Keuls se reportó que existe una diferencia estadística entre la cirugía LCCI vs. SHAM (p=0,022) y DLCC (p=0,020). Así como una tendencia en el grupo LCCI entre el día 7 antes de la cirugía y el día 9 después de la cirugía (p=0,061), al igual que en el grupo DLCC hay una tendencia a ser menor el porcentaje de aciertos en el día 2 con respecto al día 15 (p=0,075). En la interacción (cirugía × días) durante el día 2 existe una diferencia entre el grupo LCCI contra el grupo SHAM (p=0,040), en el día 9 de LCCI comparado con los grupos SHAM (p=0,009) y DLCC (p≤0,001) y en el día 15 de nuevo el grupo LCCI es diferente al grupo DLCC (p=0,012), también se reporta una tendencia entre el grupo SHAM y el DLCC (p=0,069).
DiscusiónEn el presente estudio evaluamos los efectos de 2 modelos de hipoperfusión sobre la memoria episódica y de trabajo, así como sobre la actividad locomotriz espontánea. Los modelos empleados fueron la ligadura unilateral permanente de la arteria carótida común izquierda y en el segundo modelo se agregó al anterior una oclusión transitoria durante 10 min de la arteria carótida común derecha para realizar una doble oclusión.
La oclusión de la arteria carótida en ratas ha sido ampliamente estudiada en cuanto a su efecto sobre el flujo sanguíneo cerebral tanto unilateral17,29 como bilateral30-32, sin embargo solo se ha estudiado el modelo de oclusión bilateral con relación a su efecto sobre la conducta, especialmente sobre su efecto sobre la memoria espacial, episódica y de trabajo19-23 y, en la gran mayoría de los estudios, a largo plazo. Por lo que se realizó la evaluación de la memoria episódica y de trabajo en el modelo de oclusión permanente unilateral de la carótida común y en un nuevo modelo que combina la oclusión permanente con la transitoria en ambas carótidas y a intervalos de tiempo relativamente cortos.
En cuanto a la memoria de trabajo y episódica, no se muestran cambios significativos.
En cambio, en la prueba de locomoción espontánea en la arena de campo abierto, la actividad locomotora se vio considerablemente disminuida durante el día 2 posquirúrgico en los grupos con hipoperfusión (LCCI y DLCC) con respecto al SHAM. Por lo que se deduce que la oclusión de la arteria carótida probablemente afectó en mayor medida a la corteza motora en comparación con el hipocampo durante los primeros días de la hipoperfusión, siendo aún mayor la disminución en la actividad locomotora en el grupo DLCC. Este resultado tiene sentido si consideramos los cambios en el flujo sanguíneo cerebral documentados por otros autores, en los que encuentran que después de la oclusión de la arteria carótida común el flujo sanguíneo cerebral desciende de 1,41+0,17 a 0,99+0,08ml por g por min. Hay una reducción aproximada del 75% con respecto a los valores normales, la cual se mantiene en 1,15+0,08 durante 24 h, regresando a valores normales al quinto día33, lo cual es bien tolerado por las ratas por lo que no hubo mortalidad en este grupo y las manifestaciones en la memoria fueron tardías.
En cambio, la alta mortalidad que presenta el grupo DLCC demuestra que existe un daño isquémico grave en algunos de los animales sujetos a la doble oclusión. Algunos autores reportan que el flujo sanguíneo llega a descender en promedio en la corteza cerebral al 33,6%, en hipocampo al 58,3% y en tálamo al 69,5% después de la oclusión bilateral en ratas Wistar34 y del 62 al 69% luego de 30 min de hipoperfusión, también en ratas Wistar35, lo que en muchos casos lleva a un daño neuronal irreparable que provoca la muerte de algunos sujetos experimentales, mientras que los roedores sobrevivientes tienen una mayor probabilidad de presentar secuelas en la actividad locomotora. Esto también está apoyado por la valoración neurológica, en la que se encontraron animales con mayor puntaje que en los otros 2 grupos y la disminución en la conducta exploratoria vertical, aunque existe una recuperación a partir del día 9, lo que sugiere mecanismos de plasticidad y neurogénesis que ayudan en la compensación y recuperación a mediano plazo.
Otro resultado que corresponde con la severidad de la hipoperfusión es la presencia de signos similares al conocido síndrome de Horner.
Una explicación que dan algunos autores a este signo en ratas es la lesión del nervio vago durante las cirugías de cuello36, sin embargo en el caso del presente estudio consideramos que los signos presentados se deben a la hipoperfusión per se, ya que se presentó con mayor porcentaje (42,8%) en el grupo con doble ligadura de carótida y el 16,6% con oclusión unilateral permanente de la carótida común izquierda, en todos los casos en el lado ipsilateral a la oclusión permanente, el lado izquierdo. Mientras que ningún animal del grupo SHAM presentó ptosis, pese a ser diseccionadas ambas carótidas comunes y por lo tanto manipulados ambos nervios vagos y, en el caso de la doble ligadura, ninguna presentó ptosis del lado derecho a pesar de ser manipulado el nervio vago y tener una isquemia transitoria de 10 min. Lo que indica que es secundario a la hipoperfusión debido a un infarto a nivel de hipocampo, como ocurre en seres humanos al verse afectado el lóbulo temporal5,37. Otra posibilidad es la afectación de la región de la arteria basilar por un trombo sanguíneo inducido por la oclusión de la carótida38.
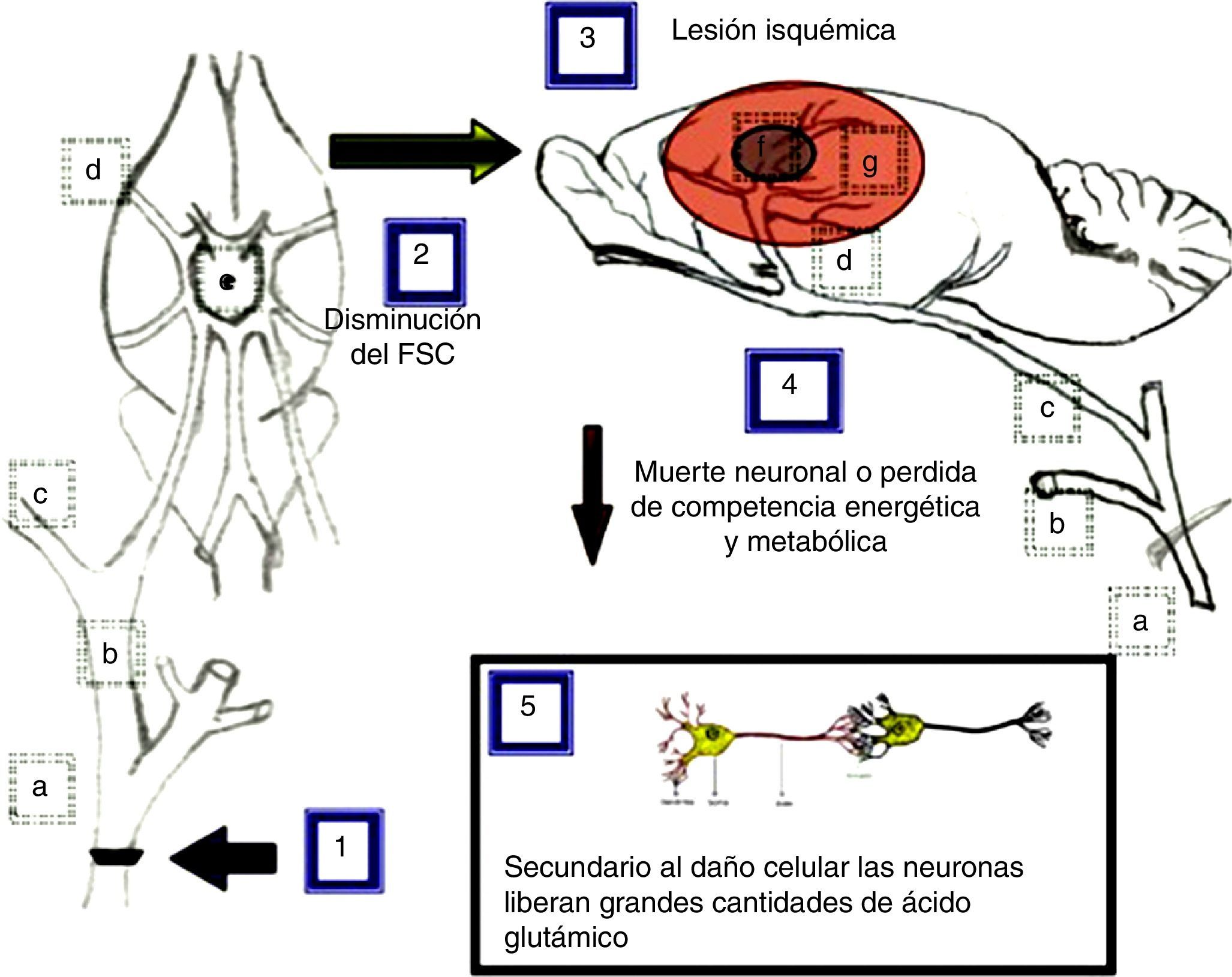
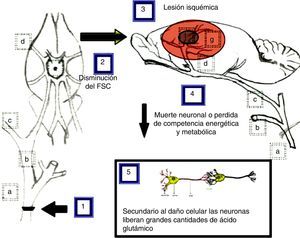
El modelo propuesto como explicación a los resultados obtenidos tras la oclusión de la arteria carótida común se ilustra en la figura 5 y se describe a continuación.
Modelo propuesto como explicación a los efectos ocasionados por la oclusión unilateral y bilateral de la arteria carótida común en su bifurcación. a) arteria carótida común; b) arteria carótida externa; c) arteria carótida interna; d) arteria cerebral media; e) polígono de Willis; f) núcleo isquémico; g) área de penumbra isquémica.
La oclusión unilateral de la arteria carótida común (1), para simular las consecuencias de la estenosis carotídea aterosclerótica, provoca una disminución del flujo sanguíneo cerebral (2) de aproximadamente el 25%33, mientras que la doble oclusión de las arterias carótidas provoca una disminución del flujo sanguíneo de aproximadamente el 66,4%34, lo que induce una o múltiples lesiones de tipo isquémico (3) en las cuales existe muerte neuronal o hace que estas pierdan competencia energética y metabólica (4). Como consecuencia de este daño celular las neuronas podrían liberar grandes cantidades de ácido glutámico (5)28.
Las principales zonas afectadas que se han reportado tras la ligadura unilateral de la arteria carótida presentan una disminución del flujo sanguíneo al 75% en corteza medial, 86% corteza dorso-lateral, 90% corteza lateral, 85% hipocampo, 56% tálamo medial, 62% tálamo lateral, 78% estriado medial y 85% estriado lateral en ratas Wistar17. En cambio, en la doble ligadura se reporta que el flujo sanguíneo llega a descender en promedio en la corteza cerebral al 33,6%, en hipocampo al 58,3% y en tálamo al 69,5% en ratas Wistar34, que corresponden con las principales áreas irrigadas por la arteria cerebral media, rama terminal de la arteria carótida interna que es la más afectada por la oclusión en la bifurcación de la arteria carótida común que, al mismo tiempo, son regiones involucradas con la locomoción y la memoria. Sin embargo en nuestro modelo de doble ligadura, se demuestra que es más afectada la locomoción que la memoria.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.