El diagnóstico de parkinsonismo vascular (PV) se realiza en función de una serie de criterios clínicos y hallazgos de neuroimagen compatibles. El aumento en el índice de pulsatilidad (IP) determinado por doppler transcraneal se ha descrito como hallazgo en los pacientes con PV. El objetivo de este trabajo ha sido comprobar en nuestro laboratorio de neurosonología dicha relación y determinar el valor de IP con mayor sensibilidad y especificidad para el diagnóstico de PV.
MétodoSe realizó una medición del IP en todos los pacientes remitidos por parkinsonismo al Hospital Universitari i Politècnic La Fe entre enero de 2012 y junio de 2016. En los pacientes finalmente diagnosticados de PV y enfermedad de Parkinson idiopática (EPI) estudiamos la probabilidad de padecer PV en función del valor IP, y elaboramos una curva ROC para determinar el valor de IP con mayor sensibilidad y especificidad.
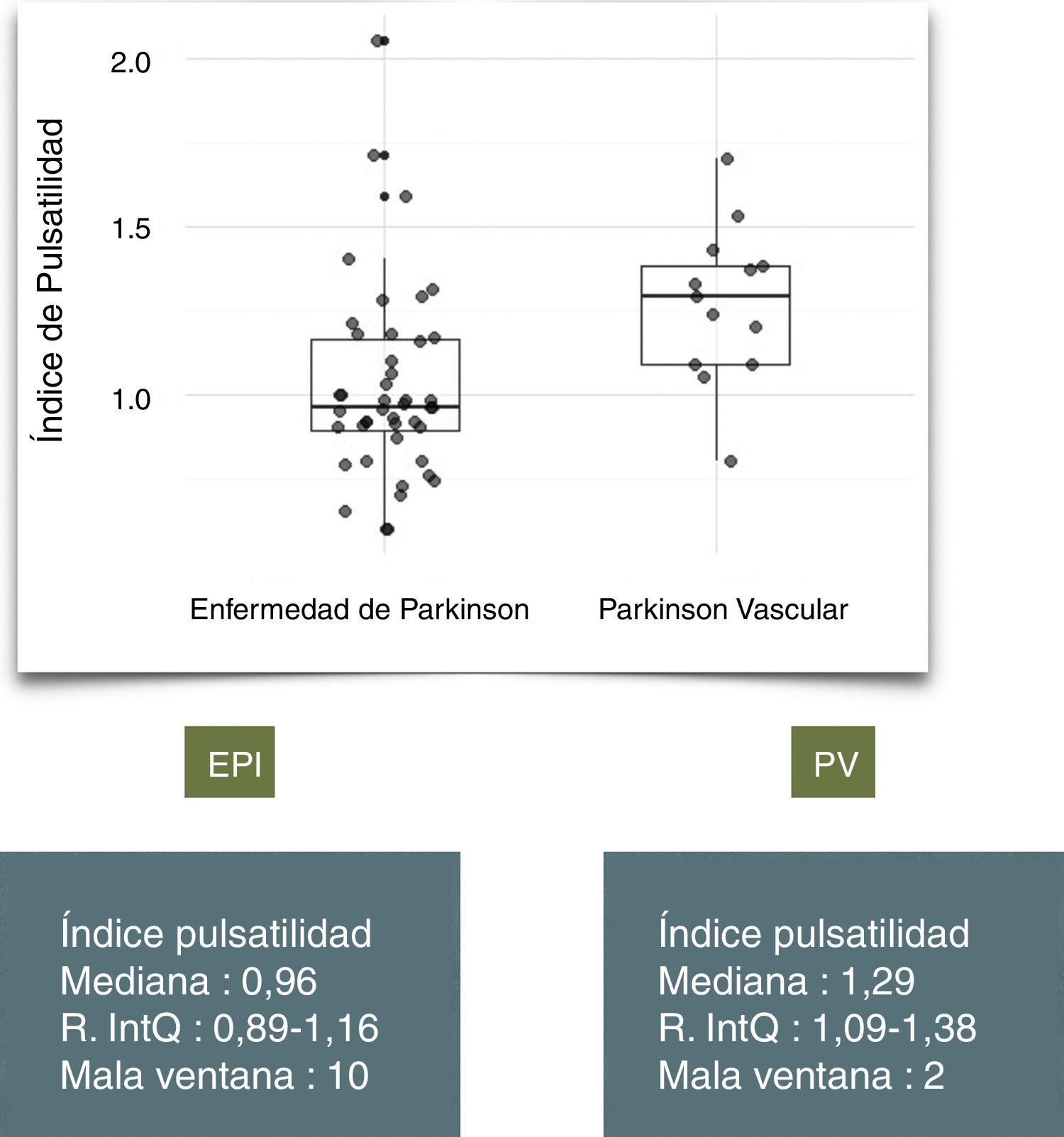
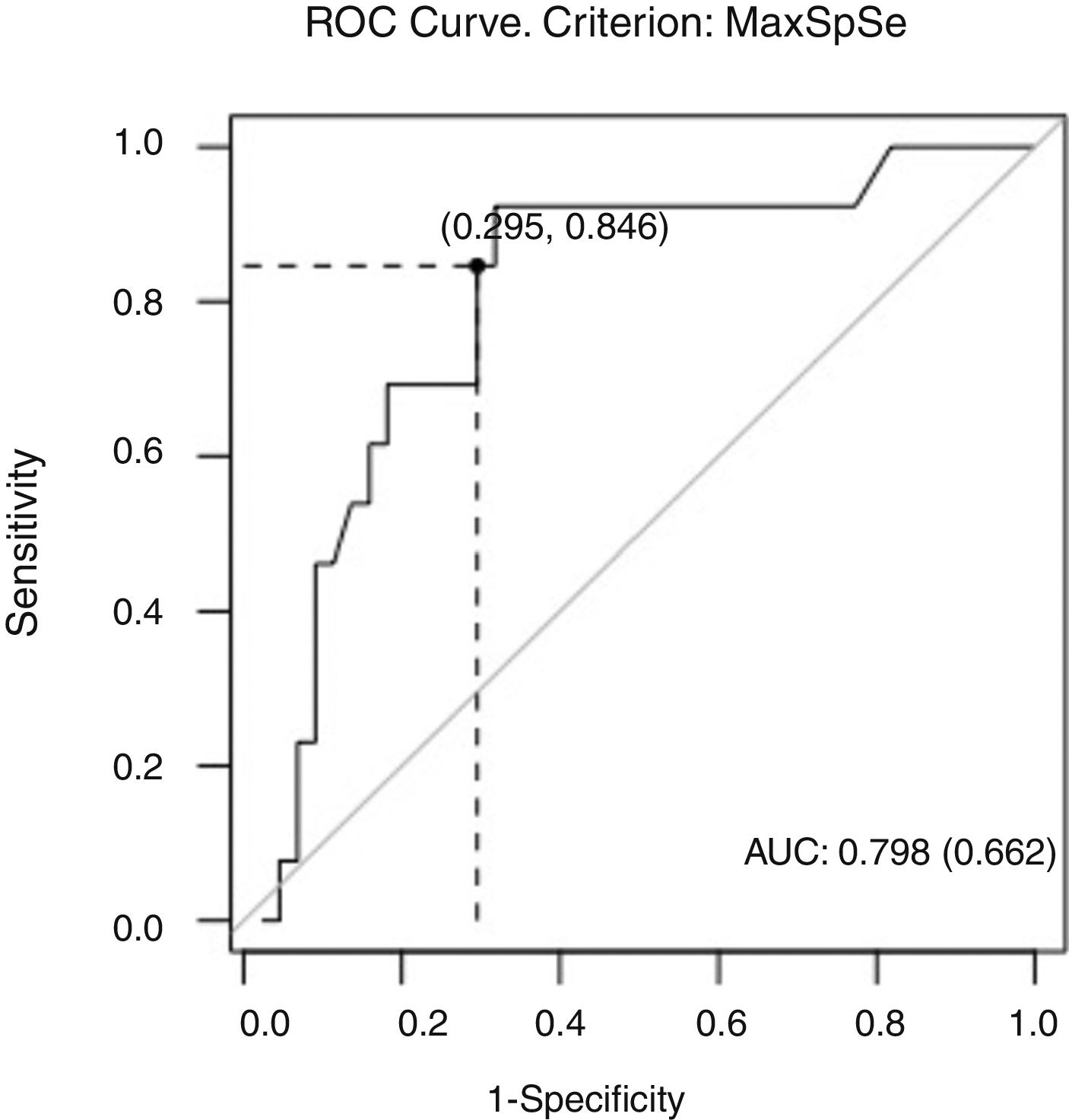
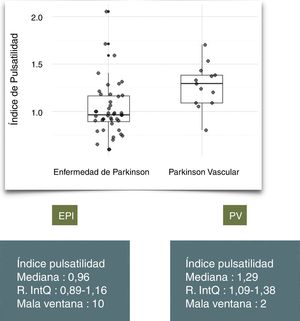
ResultadosSe evaluaron 146 pacientes remitidos por parkinsonismo; 54 (37%) fueron diagnosticados de EPI y 15 (10%) de PV. La media de edad fue mayor en el grupo de PV (79 vs 68,5; p=0,00144). Encontramos un IP mayor en los pacientes con PV: mediana 1,29 (Q1-Q3: 1,09-1,38) vs 0,96 (Q1-Q3 0,89-1,16), p=0,01328. En nuestra muestra un valor de IP de 1,09 presenta una sensibilidad y especificidad del 84% y del 70% respectivamente.
ConclusionesEn nuestra serie el IP es significativamente mayor en los pacientes con PV que con EPI. Apoyamos la inclusión sistemática del doppler transcraneal en la valoración inicial de pacientes con síndrome rígido-acinético.
The diagnosis of vascular parkinsonism (VP) is based on a series of clinical criteria and neuroimaging findings. An increase in transcranial Doppler ultrasonography pulsatility index (PI) has been described as a frequent finding in patients with VP. We aimed to confirm this association and to determine the PI value with the highest sensitivity and specificity for diagnosis of VP.
MethodPI was determined in all patients admitted to Hospital Universitari i Politècnic La Fe due to parkinsonism between January 2012 and June 2016. We assessed the probability of having VP based on PI values in patients with a definite diagnosis of either VP or idiopathic Parkinson's disease (IPD). A ROC curve was created to determine the PI value with the highest sensitivity and specificity.
ResultsWe assessed a total of 146 patients with suspected parkinsonism; 54 (37%) were diagnosed with IPD and 15 (10%) with VP. Patients with VP were significantly older than those with IPD (mean age of 79 vs 68.5, P=.00144) and had a higher PI (median of 1.29 [IQR: 1.09-1.38] vs 0.96 [IQR: 0.89-1.16], P=.01328). In our sample, a PI of 1.09 conferred 84% sensitivity and 70% specificity.
ConclusionsIn our series, the PI was significantly higher in patients with VP than in those with IPD. We therefore support the use of transcranial Doppler ultrasonography for the initial assessment of elderly patients with akinetic-rigid syndrome.
El diagnóstico de parkinsonismo vascular (PV) es complejo, basado en variables clínicas y radiológicas que permiten diferenciarlo de la enfermedad de Parkinson idiopática (EPI).
En los principales trabajos de revisión1,2 la entidad se describe como un síndrome extrapiramidal en un paciente con varios factores de riesgo cardiovascular, mayor a la edad de inicio habitual para la EPI, que presenta lesiones isquémicas en las pruebas de neuroimagen.
Entre las características clínicas del fenotipo PV destaca3: rigidez de predominio en las extremidades inferiores, con distribución simétrica y respuesta incompleta a levodopa; menor incidencia de temblor de reposo y presencia de signos de afectación de vía piramidal como hemiparesia e hiperreflexia; aparición con frecuencia síndrome pseudobulbar o demencia desde el inicio del cuadro4,5.
El uso de la neurosonología6 en el diagnóstico del parkinsonismo ha cobrado importancia desde que se asociara el aumento de hiperecogenicidad en la sustancia negra mesencefálica con la EPI. Actualmente es una variable extensamente validada como marcador de neurodegeneración, ayudando a diferenciar la EPI de los parkinsonismos atípicos7.
Se ha propuesto que el índice de pulsatilidad (IP) en las arterias del polígono de Willis, determinado por doppler transcraneal, se encuentra elevado en los pacientes con PV y que ayuda a diferenciarlos de los pacientes con EPI.
El objetivo de este trabajo es estudiar la relación entre el valor de IP y la probabilidad de padecer PV en nuestra población, determinando además mediante una curva ROC la validez de esta variable (sensibilidad, especificidad y valores preditivos).
De forma secundaria estudiamos la diferencia en el valor de la hiperecogenicidad en la sustancia negra (HSN) entre los pacientes con PV y EPI.
MétodoIncluimos en nuestra base a todos los pacientes remitidos por parkinsonismo a la unidad de trastornos del movimiento del HUP La Fe entre enero de 2012 y junio de 2016.
El criterio para dicha sospecha fue la presencia de al menos uno de los signos clínicos establecidos por el UK Brain Bank Criteria: bradicinesia, temblor de reposo asimétrico, rigidez axial o de miembros e inestabilidad postural.
Se estableció el diagnóstico de PV al cumplirse todos los siguientes criterios: 1) presencia de 2 o más factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus, dislipidemia, historia de tabaquismo); 2) lesiones isquémicas en neuroimagen (infartos lacunares, infarto territorial, leucoaraiosis extensa); 3) respuesta a levodopa mínima o no sostenida en el tiempo; y 4) ausencia de signos clínicos que hagan sospechar parkinsonismo atípico.
Dada la ausencia de unos criterios universales nuestra definición de PV supone una adaptación en función de los trabajos de Winikates y Jankovic8 y Ziljmans9.
El diagnóstico de enfermedad de EPI probable o posible se realizó siguiendo los criterios de Hughes et al.
Los pacientes con historia de tratamiento con neurolépticos o antecedente de traumatismo craneoencefálico grave en el año previo al diagnóstico fueron excluidos del análisis posterior.
Además del estudio bioquímico y de neuroimagen habitual se realizó, al inicio del seguimiento de cada paciente, un dúplex transcraneal con determinación del IP en ambas arterias cerebrales medias y medición del área de hiperecogenicidad (mm2) de sustancia negra por ambas ventanas transtemporales.
Tomamos el mayor valor hallado de cada variable para realizar la comparación entre diagnósticos.
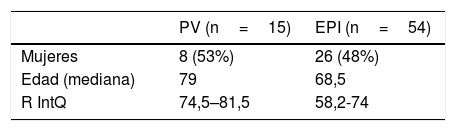
Se analizaron las características demográficas y las variables ultrasonográficas IP y HSN en los pacientes finalmente diagnosticados de EPI y PV (tabla 1).
Empleamos el paquete estadístico «pROC»10 del entorno de programación RStudio 1.0.143 para realizar el análisis de datos (R: A language and environment for statistical computing. R Foundation for Statistical Computing, Viena, Austria; disponible en: https://www.R-project.org).
Mediante una regresión logística univariable se determinó la probabilidad de ser diagnosticado de PV (variable respuesta versus EPI) en función del valor de IP hallado.
Elaboramos una curva ROC para hallar el valor de IP con mayor sensibilidad y especificidad para el diagnóstico de PV.
Mediante un modelo de regresión lineal mixto multivariable se analizó la diferencia en el área de HSN en función de las covariables diagnóstico, edad y sexo.
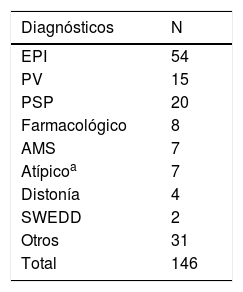
ResultadosSe evaluaron un total de 146 pacientes remitidos por parkinsonismo, 54 de los cuales fueron diagnosticados de EPI (37%) y 15 de PV (10%). Los principales diagnósticos definitivos en los 77 pacientes restantes fueron parkinsonismo atípico (20 PSP, 7 AMS, 7 parkinson-plus sin epecificar) así como de temblor o síntomas extrapiramidales de origen farmacológico (8) (tabla 2).
Diagnósticos en la cohorte de pacientes estudiados por parkinsonismo
| Diagnósticos | N |
|---|---|
| EPI | 54 |
| PV | 15 |
| PSP | 20 |
| Farmacológico | 8 |
| AMS | 7 |
| Atípicoa | 7 |
| Distonía | 4 |
| SWEDD | 2 |
| Otros | 31 |
| Total | 146 |
AMS: atrofia multisistema; EPI: enfermedad de Parkinson idiopática; PSP: parálisis supranuclear progresiva; PV: parkinsonismo vascular; SWEDD: pacientes con parkinsonismo sin evidencia radiológica de déficit dopaminérgico.
La proporción de sexos entre los pacientes con EPI y PV fue equiparable (mujeres 48% vs 53%, p=0,9494), si bien se observa una diferencia en la edad (p=0,00144) con una mediana de 79 en el grupo de PV (Q1-Q3: 74,4-81,5) y de 68,5 en los pacientes con EPI (Q1-Q3: 58,2-74).
No se compara el número de lesiones en ganglios basales entre ambos diagnósticos, ya que no se cuantificaron de forma sistemática.
La mediana en el IP en los pacientes con PV fue 1,29 (Q1-Q3: 1,09-1,38), y en los pacientes con EPI 0,96 (Q1-Q3 0,89-1,16) (fig. 1). La proporción de mala ventana acústica en ambos grupos fue equiparable (13% vs 18%, p=0,67). Hallamos una diferencia significativa en el valor de IP entre ambos diagnósticos (p=0,01328).
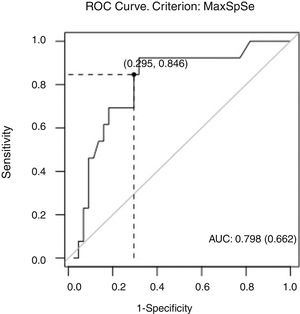
El valor de IP en el punto de corte en la curva ROC con mayor sensibilidad (84%) y especificidad (70%) fue de 1,09. Se observa un área bajo la curva de 0,798, aproximándose a una buena precisión global de la prueba (fig. 2). No hallamos diferencias en el valor de HSN entre ambos diagnósticos (p=0,14), o en función de la edad (p=0,91).
DiscusiónEl diagnóstico diferencial entre EPI y PV sigue siendo dificultoso. Además de las peculiaridades clínicas citadas en la «Introducción», la distinción se apoya en gran medida en la presencia de hallazgos en resonancia11,12, esencialmente lesiones periventriculares y en sustancia blanca subcortical.
En nuestra cohorte de pacientes estudiados por parkinsonismo hallamos una relación proporcional y significativa entre el índice de pulsatilidad en el segmento proximal de la ACM y la probabilidad de diagnóstico de PV. El estudio del IP como medida para apoyar la etiología vascular del parkinsonismo ha sido propuesto por varios autores5. Los trabajos donde se reportan los resultados de doppler transcraneal en pacientes con PV (comparados con EPI) se señala un IP mayor, además de una mayor frecuencia de estenosis intracraneales cuya incidencia nosotros no reportamos. Hallazgos que correlacionaron además con una mayor presencia de leucoaraiosis e infartos lacunares subcorticales en la RM.
La principal hipótesis que explica el aumento del IP en estos pacientes es el incremento de resistencia en el lecho vascular distal (arteriolar) que ocasiona la enfermedad de pequeño vaso en los pacientes con PV. El aumento de resistencia global ocasionaría un aumento relativo de la velocidad picosistólica respecto a la velocidad media en las ramas del polígono de Willis. Este hallazgo concuerda con el concepto de PV como enfermedad de pequeño vaso. El estudio anatomopatológico de pacientes con PV, en comparación con los que sufren EPI, muestra una mayor atrofia de giros corticales, dilatación de ventrículos13, ateromatosis en grandes vasos intracraneales y mayor prevalencia de hallazgos compatibles con enfermedad de pequeño vaso (hialinosis de media, agrandamiento y gliosis de espacios perivasculares) independientemente del sexo o edad al fallecimiento.
Por otra parte, se ha propuesto que la incidencia de eventos cerebrovasculares14,15 entre los pacientes con EPI pudiera ser menor a la de la población general. Esta afirmación es aún controvertida16.
Si bien el aumento en el IP puede explicarse, al menos parcialmente, por la presencia de lesiones isquémicas en el parénquima, la fisiopatología del síndrome rígido-acinético no ha logrado asociarse a un locus concreto de las lesiones lacunares. Yamanouchi y Nagura4 describe mayor palidez y menor densidad de oligodendrocitos en la sustancia blanca frontal de los pacientes con PV al compararlos con controles sin parkinsonismo (ajustados por edad y sexo). Sin embargo, no halla diferencias en la cantidad y distribución de lesiones vasculares en los ganglios basales. Por otra parte, son múltiples los reportes de casos describiendo la aparición aguda de parkinsonismo en el contexto de una lesión focal17,18, cada cual en diferente localización (territorial, tálamo, sustancia negra…).
En nuestro laboratorio de neurosonología el valor de IP 1,09 supone un punto de corte con buena sensibilidad (84%) y especificidad (70%) para del diagnóstico de PV. Este valor de sensibilidad es superponible al de la HSN en el diagnóstico de EPI referido por Tsai et al. (83%), si bien el IP es menos específico, probablemente en relación con lo prevalente de su incremento en la tercera edad.
En la cohorte que recogida se presenta un número anormalmente elevado de parkinsonismos atípicos. Esta sobrerrepresentación se debe a que la muestra proviene de una consulta especializada en trastornos del movimiento en un hospital terciario. La proporción que guarda el número de pacientes con PV y EPI, sin embargo, es similar a la que se describe habitualmente en la literatura.
Contrariamente a lo esperado el análisis multivariante no mostró diferencias significativas en la hiperecogenicidad de la sustancia negra en función del diagnóstico o la edad.
En conclusión, actualmente sigue siendo necesaria la elaboración de unos criterios diagnósticos de PV más fiables, dadas las implicaciones en cuanto a respuesta al tratamiento dopaminérgico y evolución. La introducción del IP como uno de estos criterios depende de realización de más estudios donde el doppler transcraneal se incluya de forma sistemática en la valoración inicial de pacientes con síndrome rígido-acinético.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de los datos del trabajo han sido presentados como comunicación oral en la LXVIII reunión anual de la Sociedad Española de Neurología.