En el campo de las cefaleas, onabotulinumtoxinA (onabotA) tiene indicación bien establecida en la migraña crónica (MC). Además, en los últimos años su uso se está extendiendo a otras cefaleas primarias (migraña episódica de alta frecuencia, cefaleas trigémino-autonómicas, cefalea numular) y a la neuralgia del trigémino. Al ser una opción terapéutica que se va a ir incorporando de forma progresiva en el manejo de estas entidades, creemos que es necesario reflejar con un carácter eminentemente práctico cuáles son las posibles indicaciones de onabotA, más allá de la MC, así como su protocolo de administración, que diferirá en función del tipo de cefalea y/o neuralgia.
DesarrolloA partir de una revisión de la bibliografía existente y de nuestra propia experiencia clínica, se ha elaborado este documento de consenso cuyo objetivo es servir de guía a aquellos profesionales que quieran aplicar estas técnicas en su actividad asistencial. En la primera parte se abordará el mecanismo de acción de onabotA y la razón de su utilización en diversas cefaleas distintas de la MC desde un punto de vista fisiopatológico y clínico. En la segunda parte se hará una revisión de la evidencia disponible y los estudios publicados en los últimos años. Para cada una de estas entidades, se añadirá una «recomendación de experto», basada en la propia experiencia clínica, que refleje el perfil de paciente que puede ser candidato a este tratamiento, las dosis y el protocolo de administración de onabotA.
ConclusiónEl tratamiento con onabotA en entidades distintas a la MC debe ser siempre individualizado y se planteará en pacientes seleccionados que no hayan respondido a la terapia convencional.
In the field of headaches, onabotulinumtoxinA (onabotA) is well established as a treatment for chronic migraine (CM). In recent years, it has been used increasingly to treat other primary headaches (high-frequency episodic migraine, trigeminal-autonomic cephalalgias, nummular headache) and trigeminal neuralgia. As this treatment will progressively be incorporated in the management of these patients, we consider it necessary to reflect, with a fundamentally practical approach, on the possible indications of onabotA, beyond CM, as well as its administration protocol, which will differ according to the type of headache and/or neuralgia.
DevelopmentThis consensus document was drafted based on a thorough review and analysis of the existing literature and our own clinical experience. The aim of the document is to serve as guidelines for professionals administering onabotA treatment. The first part will address onabotA's mechanism of action, and reasons for its use in other types of headache, from a physiopathological and clinical perspective. In the second part, we will review the available evidence and studies published in recent years. We will add an “expert recommendation” based on our own clinical experience, showing the best patient profile for this treatment and the most adequate dose and administration protocol.
ConclusionTreatment with onabotA should always be individualised and considered in selected patients who have not responded to conventional therapy.
Uno de los objetivos del Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología (GECSEN) es elaborar documentos de consenso para establecer unas «guías de buena práctica clínica» a partir de la experiencia y la evidencia contrastada. OnabotulinumtoxinA (onabotA) se aprobó en nuestro país en el año 2012 como tratamiento preventivo de la migraña crónica (MC) en pacientes que no han respondido adecuadamente o que son intolerantes a los preventivos orales de la migraña. En la Guía Oficial de Práctica Clínica en Cefaleas del GECSEN del año 20151 se propone, tras la publicación de los estudios Phase III Research Evaluating Migraine Profilaxis Therapy (PREEMPT)2,3, iniciar dicho tratamiento en pacientes con falta de respuesta, intolerancia o contraindicación de al menos 2 fármacos preventivos (un betabloqueante y topiramato) que se habrán utilizado a las dosis mínimas recomendadas y durante al menos 3 meses (nivel de evidencia iv, grado de recomendación GECSEN).
En estos últimos años, la aplicación de onabotA se ha ido extendiendo en la práctica clínica asistencial a otras cefaleas primarias distintas de la MC (migraña episódica de alta frecuencia [MEAF], cefaleas trigémino-autonómicas [CTA], cefalea numular [CN]) y a la neuralgia del trigémino (NT). Al ser una opción terapéutica que se va a ir incorporando de forma progresiva en el manejo de estas entidades, creemos que es necesario reflejar con un carácter eminentemente práctico cuáles son las posibles indicaciones de onabotA, más allá de la MC, así como su protocolo de administración, que diferirá en función del tipo de cefalea y/o neuralgia.
El objetivo de este documento de consenso, elaborado a partir de una exhaustiva revisión de la bibliografía existente y de nuestra propia experiencia clínica, es servir de guía a todos aquellos profesionales que quieran aplicar estas técnicas en su actividad asistencial.
MetodologíaUn grupo de neurólogos expertos en el manejo y tratamiento de pacientes con cefalea hemos trabajado en colaboración para seleccionar aquellas cefaleas primarias y neuralgias incluidas en la Clasificación Internacional de Cefaleas (tercera edición, versión beta; CIC-3 beta)4 que pudieran beneficiarse del tratamiento con onabotA, describir la base fisiopatológica que avalaría su uso y, finalmente, establecer un protocolo de administración basado en nuestra experiencia y en la evidencia científica publicada.
De esta forma, en la primera parte del documento se abordará el mecanismo de acción de onabotA y el porqué de su uso en otras cefaleas desde un punto de vista fisiopatológico y clínico. En la segunda parte se hará una revisión de la evidencia disponible y de los estudios publicados en los últimos años en relación con el tratamiento de la MEAF, las CTA, la CN y la NT. Para cada una de estas entidades, se añadirá además una «recomendación de experto», basada en la propia experiencia clínica, que refleje el perfil de paciente que puede ser candidato a este tratamiento, las dosis y el protocolo de administración de onabotA. En las tablas 1 y 2 se exponen los principales estudios realizados con onabotA en distintas cefaleas primarias y NT.
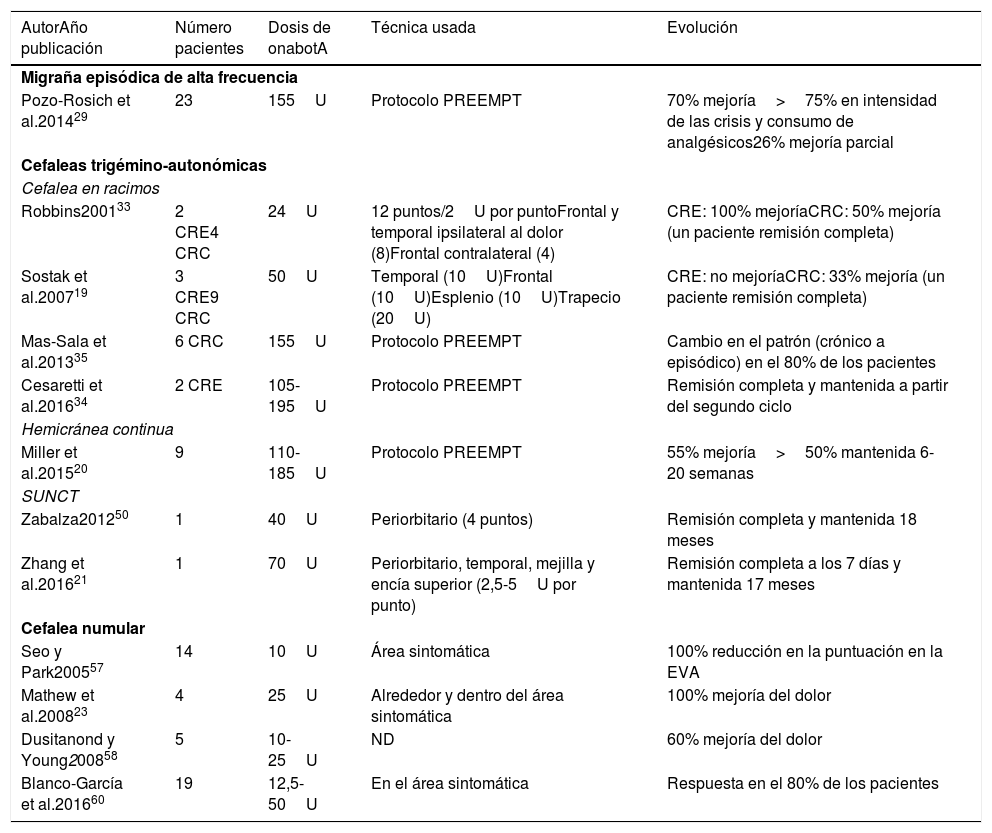
Resumen de los principales estudios clínicos sobre el uso de onabotulinumtoxinA en distintas cefaleas primarias sin respuesta al tratamiento convencional
| AutorAño publicación | Número pacientes | Dosis de onabotA | Técnica usada | Evolución |
|---|---|---|---|---|
| Migraña episódica de alta frecuencia | ||||
| Pozo-Rosich et al.201429 | 23 | 155U | Protocolo PREEMPT | 70% mejoría>75% en intensidad de las crisis y consumo de analgésicos26% mejoría parcial |
| Cefaleas trigémino-autonómicas | ||||
| Cefalea en racimos | ||||
| Robbins200133 | 2 CRE4 CRC | 24U | 12 puntos/2U por puntoFrontal y temporal ipsilateral al dolor (8)Frontal contralateral (4) | CRE: 100% mejoríaCRC: 50% mejoría (un paciente remisión completa) |
| Sostak et al.200719 | 3 CRE9 CRC | 50U | Temporal (10U)Frontal (10U)Esplenio (10U)Trapecio (20U) | CRE: no mejoríaCRC: 33% mejoría (un paciente remisión completa) |
| Mas-Sala et al.201335 | 6 CRC | 155U | Protocolo PREEMPT | Cambio en el patrón (crónico a episódico) en el 80% de los pacientes |
| Cesaretti et al.201634 | 2 CRE | 105-195U | Protocolo PREEMPT | Remisión completa y mantenida a partir del segundo ciclo |
| Hemicránea continua | ||||
| Miller et al.201520 | 9 | 110-185U | Protocolo PREEMPT | 55% mejoría>50% mantenida 6-20 semanas |
| SUNCT | ||||
| Zabalza201250 | 1 | 40U | Periorbitario (4 puntos) | Remisión completa y mantenida 18 meses |
| Zhang et al.201621 | 1 | 70U | Periorbitario, temporal, mejilla y encía superior (2,5-5U por punto) | Remisión completa a los 7 días y mantenida 17 meses |
| Cefalea numular | ||||
| Seo y Park200557 | 14 | 10U | Área sintomática | 100% reducción en la puntuación en la EVA |
| Mathew et al.200823 | 4 | 25U | Alrededor y dentro del área sintomática | 100% mejoría del dolor |
| Dusitanond y Young200858 | 5 | 10-25U | ND | 60% mejoría del dolor |
| Blanco-García et al.201660 | 19 | 12,5-50U | En el área sintomática | Respuesta en el 80% de los pacientes |
CRC: cefalea en racimos crónica; CRE: cefalea en racimos episódica; EVA: escala visual analógica de dolor; ND: no disponible; onabotA: onabotulinumtoxinA; PREEMPT: Phase III Research Evaluating Migraine Profilaxis Therapy; SUNCT: cefalea neuralgiforme unilateral de breve duración con inyección conjuntival y lagrimeo; U: unidades.
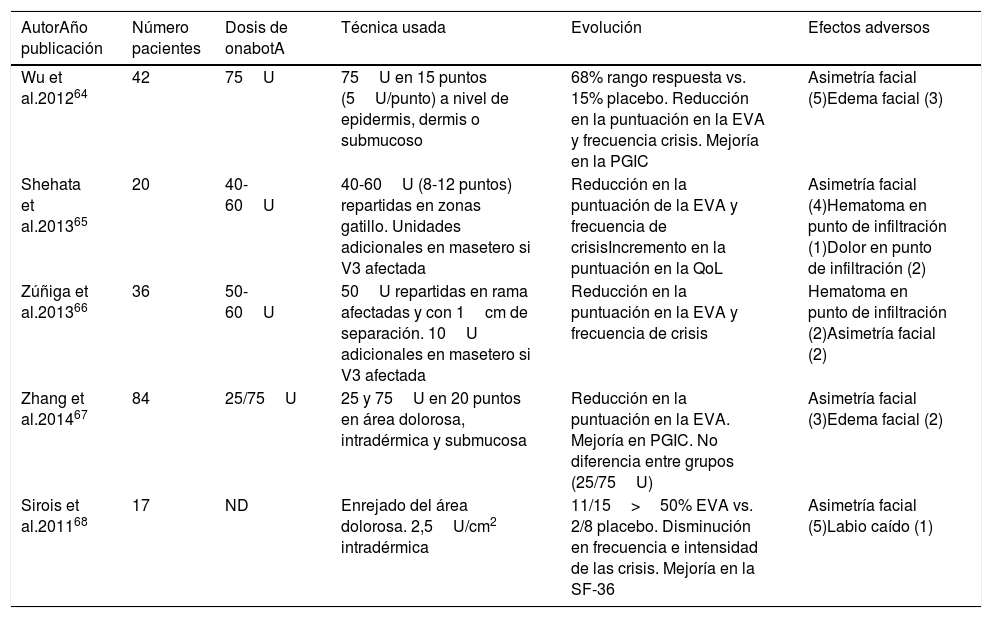
Ensayos clínicos aleatorizados, doble ciego y controlados con placebo de onabotulinumtoxinA en pacientes con neuralgia del trigémino
| AutorAño publicación | Número pacientes | Dosis de onabotA | Técnica usada | Evolución | Efectos adversos |
|---|---|---|---|---|---|
| Wu et al.201264 | 42 | 75U | 75U en 15 puntos (5U/punto) a nivel de epidermis, dermis o submucoso | 68% rango respuesta vs. 15% placebo. Reducción en la puntuación en la EVA y frecuencia crisis. Mejoría en la PGIC | Asimetría facial (5)Edema facial (3) |
| Shehata et al.201365 | 20 | 40-60U | 40-60U (8-12 puntos) repartidas en zonas gatillo. Unidades adicionales en masetero si V3 afectada | Reducción en la puntuación de la EVA y frecuencia de crisisIncremento en la puntuación en la QoL | Asimetría facial (4)Hematoma en punto de infiltración (1)Dolor en punto de infiltración (2) |
| Zúñiga et al.201366 | 36 | 50-60U | 50U repartidas en rama afectadas y con 1cm de separación. 10U adicionales en masetero si V3 afectada | Reducción en la puntuación en la EVA y frecuencia de crisis | Hematoma en punto de infiltración (2)Asimetría facial (2) |
| Zhang et al.201467 | 84 | 25/75U | 25 y 75U en 20 puntos en área dolorosa, intradérmica y submucosa | Reducción en la puntuación en la EVA. Mejoría en PGIC. No diferencia entre grupos (25/75U) | Asimetría facial (3)Edema facial (2) |
| Sirois et al.201168 | 17 | ND | Enrejado del área dolorosa. 2,5U/cm2 intradérmica | 11/15>50% EVA vs. 2/8 placebo. Disminución en frecuencia e intensidad de las crisis. Mejoría en la SF-36 | Asimetría facial (5)Labio caído (1) |
EVA: escala visual analógica de dolor; ND: no disponible; onabotA: onabotulinumtoxinA; PGIC: Patient Global Impression of Change scale; QoL:10-point Quality of Life scale; SF-36: Short Form-36 Health Survey; U: Unidades.
Aunque no se conoce del todo el mecanismo de acción de onabotA en el dolor, hasta la fecha se acepta que se debe fundamentalmente al bloqueo de la liberación del péptido relacionado con el gen de la calcitonina (CGRP), glutamato y otros neuropéptidos y neurotransmisores algógenos desde las neuronas del sistema trigeminovascular5. Además, onabotA reduce la expresión de determinados canales iónicos (receptor vaniloide TRPV1, receptor purinérgico P2X3) en neuronas del sistema trigeminovascular que regulan la respuesta a estímulos nociceptivos mecánicos6 y químicos7. Esta modulación en neuronas trigeminales (neurona sensitiva de primer orden) inhibe la sensibilización periférica y secundariamente la sensibilización central, mecanismo implicado en la cronificación del dolor craneofacial. Por tanto, si tenemos en cuenta que en la mayoría de los dolores craneofaciales crónicos también se produce una sensibilización periférica y central, el uso de onabotA podría estar justificado desde el punto de vista fisiopatológico en otras entidades distintas de la MC.
Además, es posible que onabotA actúe de forma indirecta también en el sistema nervioso central regulando la liberación de neurotransmisores excitadores como el glutamato y la actividad del sistema opioide endógeno, reduciendo la percepción del dolor8,9. Aún más, se ha documentado la presencia de fragmentos de la proteína SNAP-25 en células gliales satélites en el ganglio trigeminal. Por lo tanto, la acción de onabotA no se limitaría a las neuronas periféricas sino que actuaría también sobre células gliales en el ganglio trigeminal, bloqueando a este nivel la liberación de glutamato10,11.
Migraña episódica de alta frecuenciaPartiendo de la hipótesis de que la fisiopatología de la MEAF no difiere significativamente de la fisiopatología de la MC, estaría justificado el uso de onabotA en «fases precoces» del proceso de cronificación de la migraña.
El aumento en el número de ataques al mes es uno de los factores que favorecen la cronificación de la migraña12. Se ha documentado que un 50% de pacientes con migraña episódica presentan alodinia cutánea entre los episodios de dolor, tanto en territorio trigeminal (por sensibilización periférica) como en territorio extratrigeminal (por sensibilización central)13. Por tanto, cualquier acción terapéutica que reduzca la frecuencia de los ataques y la consiguiente sensibilización puede impedir la progresión a una forma crónica.
Cefaleas trigémino-autonómicasDebido a las características clínicas comunes que presentan, se argumenta que todas las CTA probablemente comparten una fisiopatología similar. Se considera que el dolor y los fenómenos autonómicos son debidos a la participación de los sistemas trigeminal y parasimpático por activación patológica del reflejo trigémino-autonómico14. Dicho reflejo estaría bajo el control modulador del hipotálamo, lo que explica la ritmicidad particular de cada una de las entidades incluidas. En todos los casos, durante las crisis se produce una activación del sistema trigeminovascular con la consiguiente elevación en los niveles plasmáticos de CGRP, similar a lo observado durante los ataques de migraña5,15.
OnabotA podría actuar en 2 niveles disminuyendo la señal de dolor en las CTA: por un lado, a nivel de las terminaciones sensitivas periféricas, bloqueando la liberación de neuropéptidos y neurotransmisores implicados en la nocicepción (CGRP, sustancia P, glutamato) y, por otro, en el sistema nervioso autónomo modulando la actividad parasimpática16,17. La acción sobre el sistema nervioso autónomo queda patente en los resultados del estudio que ha explorado la inyección de onabotA en el ganglio esfenopalatino en casos de cefalea en racimos (CR) crónica, con resultados positivos18.
Se han publicado algunas series cortas de pacientes y observaciones de casos aislados que indican que onabotA puede ser de utilidad en el tratamiento preventivo de la CR, la hemicránea continua (HC), la hemicránea paroxística (HP) y la cefalea neuralgiforme unilateral de breve duración con inyección conjuntival y lagrimeo (SUNCT)19–21. En estos trabajos la respuesta ha sido siempre parcial y los protocolos de inyección, en lo referente a la localización de los puntos de infiltración y dosis, no han sido homogéneos. En todo caso, conviene hacer notar que onabotA se ha utilizado en pacientes con CTA que habían sido refractarios a las terapias habituales. En nuestro criterio, y teniendo en cuenta su excelente tolerabilidad, las infiltraciones de onabotA podrían aplicarse en pacientes con intolerancia o falta de respuesta a las terapias orales habituales antes de plantearse procedimientos más agresivos.
Cefalea numularPor su particular topografía se considera que el dolor de la CN tiene un origen epicraneal, por afectación de las terminaciones nerviosas sensitivas del cuero cabelludo o el cráneo22. Este tipo de cefalea es especialmente atractiva para el uso de onabotA ante la facilidad de acceso a las terminales nerviosas periféricas, origen del dolor. Se han publicado series cortas y abiertas de pacientes que demuestran que onabotA puede ser efectiva en la CN de forma clara y consistente23.
Neuralgia del trigéminoAproximadamente el 90% de las NT clásicas se deben a la compresión o distorsión de la raíz trigeminal por un vaso sanguíneo, lo que genera un fenómeno de desmielinización de la raíz dorsal trigeminal en su entrada a la protuberancia. El 5-10% de los casos de NT son secundarios a otros procesos como tumores, esclerosis múltiple o isquemia, que distorsionan o lesionan las vías trigeminales a nivel periférico o central. En todos los casos la fisiopatología subyacente apunta a la hiperexcitabilidad de las fibras trigeminales y la transmisión de impulsos efápticos desde las fibras que transmiten información táctil a otras que trasmiten impulsos dolorosos24. El hecho de que onabotA sea eficaz en modelos animales de dolor neuropático justifica su uso en la NT25. Además, la infiltración de onabotA en la periferia podría contribuir a la desensibilización de los puntos gatillo.
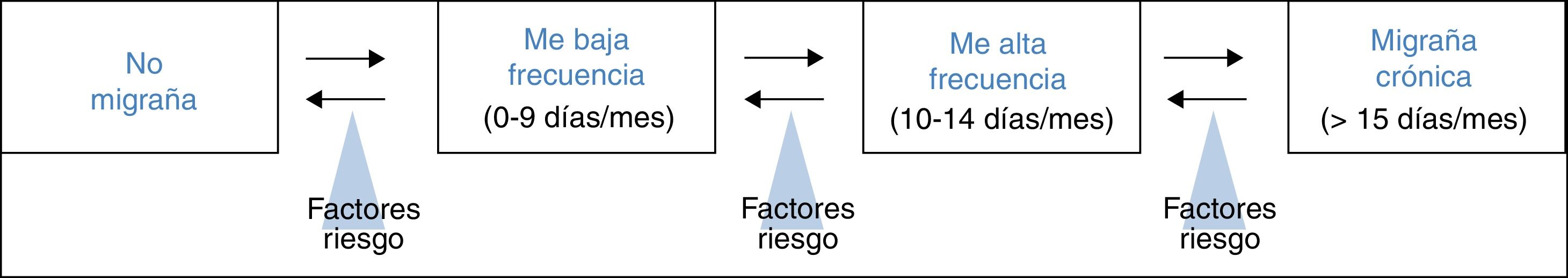
Tratamiento de la migraña episódica de alta frecuencia con onabotulinumtoxinALa MEAF se define por una frecuencia de más de 10 días de cefalea de características migrañosas al mes, pero menos del requisito mínimo de 15 días de la MC. Forma parte del continuum en la frecuencia de la migraña y refleja la transición que se produce entre la migraña episódica de baja frecuencia y la MC (fig. 1)26. Torres-Ferrus et al. describieron que los pacientes con MEAF compartían más características clínicas, epidemiológicas y de comorbilidades con la MC que con la migraña episódica de baja frecuencia27.
En la práctica clínica diaria nos encontramos con pacientes con MEAF en los que los tratamientos preventivos utilizados no son efectivos o no son bien tolerados. Por este motivo, nos podemos plantear otras opciones terapéuticas cuyo fundamento se basa en su uso en la MC. Dado que la MEAF se parece clínicamente a la MC, hace tiempo que consideramos que podríamos ofrecer infiltraciones con onabotA a los pacientes con MEAF28.
Esto se ha comunicado en reuniones internacionales29 y nacionales. En la serie mencionada27 se demuestra que los pacientes con MEAF responden a onabotA mejorando la frecuencia de los ataques, la intensidad del dolor, el consumo de analgésicos y la discapacidad.
Nuestra recomendación es utilizar onabotA en pacientes con MEAF, a una dosis de entre 155-195U siguiendo un patrón de infiltración según el protocolo PREEMPT30, con infiltraciones cada 12 semanas, en aquellos pacientes que no respondan a otros tratamientos preventivos descritos para la migraña o no los toleren.
Tratamiento de la cefalea en racimos con onabotulinumtoxinALas primeras observaciones sobre el posible efecto de onabotA en la CR se obtuvieron a partir de casos aislados. Así, Freund y Schwartz31 administraron 50U de onabotA a nivel exclusivamente temporal ipsilateral al dolor en 2 pacientes con CR episódica. La toxina se infiltró durante la primera semana tras el inicio del racimo observándose una mejoría a lo largo de los primeros 9 días y con una duración de 12 semanas. Como único efecto secundario los pacientes refirieron debilidad con la masticación. También Smuts et al.32, en una serie de pacientes con diferentes tipos de cefalea resistentes al tratamiento convencional, trataron a 4 personas con CR (se desconoce si con forma episódica o crónica). Los investigadores observaron beneficio en 2 de ellos. Posteriormente, Robbins33 comunicó su experiencia en 6 pacientes refractarios al tratamiento convencional, 4 con CR crónica y 2 con patrón episódico. El protocolo utilizado fue la infiltración de 24U de onabotA a nivel frontal y temporal ipsilateral al dolor (16U) y el resto en la región frontal contralateral. Dos de los pacientes con CR crónica respondieron al tratamiento con un efecto de entre 3-4 meses. En los pacientes con patrón episódico se observó un beneficio en ambos casos, que apareció de forma casi inmediata a la infiltración. Más recientemente Cesaretti et al.34 describieron a 2 pacientes con CR episódica que respondieron a onabotA durante varios años. Los pacientes fueron tratados con 105-195U de onabotA según protocolo PREEMPT30.
Las conclusiones más importantes sobre la utilidad de onabotA en la CR se han extraído del estudio de Sostak et al.19. En este estudio abierto se evaluó la eficacia y tolerabilidad de onabotA en pacientes con CR. Se trataron 12 pacientes varones, 3 de ellos con CR episódica y 9 con formas crónicas. El tratamiento con toxina botulínica se añadió a su terapia habitual para la CR. Se infiltraron 50U de onabotA en musculatura temporal (10U), frontal (10U), esplenio (10U) y trapecio (20U), ipsilateral al dolor. Se observó mejoría en 3 de los pacientes con CR crónica, pero en ningún paciente con patrón episódico. Los pacientes con formas crónicas que respondieron tenían una evolución de la enfermedad menor de 2 años. En un caso las crisis remitieron, mientras que en los otros 2 mejoraron la intensidad y la frecuencia de forma significativa. En ninguno de los pacientes fue posible suspender su medicación habitual para la CR. La duración del tratamiento fue de entre 2-3 meses. Los autores concluyeron que onabotA infiltrada a dosis de 50U en musculatura pericraneal ipsilateral al dolor podría ser eficaz en CR crónica como tratamiento adyuvante a la terapia convencional. En la serie de Vall d’Hebron se infiltraron 155U de onabotA según protocolo PREEMPT en 6 pacientes con CR crónica35. Se obtuvo en el 80% de los pacientes mejoría en la frecuencia del dolor con cambio del patrón temporal (de forma crónica a episódica) y en el consumo de tratamiento sintomático.
En la actualidad no existen ensayos clínicos controlados con placebo, prospectivos y realizados sobre un número de pacientes representativo que permitan establecer una recomendación definitiva sobre la eficacia de la toxina botulínica en CR. El beneficio obtenido en los pacientes tratados podría deberse a la propia remisión de la enfermedad y no puede excluirse un efecto placebo. De acuerdo con nuestra guía, onabotA se considera un tratamiento preventivo de utilidad dudosa o cuestionada en la CR, por la escasa evidencia científica existente36.
Nuestra recomendación es utilizar onabotA en pacientes con CR crónica y refractaria al tratamiento preventivo convencional, antes de plantear medidas terapéuticas más invasivas. Aunque la dosis y los puntos de infiltración no están claramente establecidos, parece razonable infiltrar al menos 50U en la región frontal bilateral (para evitar el efecto estético) y temporal, occipital y cervical ipsilateral al dolor. En las últimas series se ha aplicado la dosis, mapa de infiltración y periodicidad del protocolo PREEMPT30.
Tratamiento de otras cefaleas trigémino-autonómicas con onabotulinumtoxinALa HC y la HP son 2 tipos de cefalea primaria incluidos en el apartado de las CTA de la CIC-3 beta4. Ambas comparten el carácter estrictamente unilateral del dolor y la asociación con sintomatología autonómica ipsilateral, aun cuando se ha descrito la alternancia del dolor en algunas series37,38.
La respuesta absoluta a la indometacina es criterio diagnóstico en ambas entidades. Sin embargo, hasta el 30% de los pacientes tienen efectos adversos, habitualmente de carácter gastrointestinal39, y el 20% acaba suspendiendo dicho tratamiento40. Por otro lado, se encuentran en la literatura casos descritos de pacientes cuya cefalea cursa con características típicas de HC o HP pero sin respuesta a la indometacina41–44. En las series de HC publicadas42,43, la frecuencia de no respondedores a la indometacina oscila entre el 31 y el 61%; en HP se ha descrito en un 5%38. En este sentido, Pareja et al. proponen un modelo nosológico de cefalea unilateral continua que incluiría tanto la HC con respuesta a la indometacina como aquella que no responde (hemicrania incerta)45,46.
Prácticamente todos los antiinflamatorios no esteroideos se han ensayado en la HP, y, a dosis equipotentes, ninguno ha proporcionado el extraordinario beneficio de la indometacina. Otros fármacos en los que se ha constatado diverso grado de eficacia son: aspirina, piroxicam, naproxeno, celecoxib, rofecoxib, flunarizina, verapamilo, acetazolamida y corticosteroides36. El verapamilo y otros antiinflamatorios no esteroideos son las mejores alternativas en pacientes con intolerancia a la indometacina (nivel de evidencia iv, grado de recomendación C). Los pacientes con HC e intolerancia a la indometacina pueden responder aceptablemente a inhibidores de la COX-2, como celecoxib, rofecoxib o etoricoxib36.
Tras algunas observaciones aisladas47,48, el grupo de Matharu20 ha publicado los resultados de un estudio abierto con 9 pacientes con HC que no habían tolerado indometacina por efectos gastrointestinales (8 pacientes) o por empeoramiento de su migraña asociada (2 pacientes). En todos ellos se administró onabotA al menos en 2 ciclos separados 12 semanas (2-6 ciclos de media) siguiendo el protocolo PREEMPT (dosis media: 167U; rango: 110-185U). El 55,5% de los pacientes experimentó una mejoría superior al 50% en el número de días de cefalea de intensidad moderada-grave, manteniéndose la respuesta una media de 11 semanas (rango: 6-20 semanas). Aquellos pacientes que continuaban con indometacina (44,4%) en el momento de iniciarse los ciclos de onabotA pudieron suspenderla. De forma secundaria se registró una mejoría en las puntuaciones en las escalas de discapacidad. Respecto a la HP crónica, se ha publicado un caso aislado con buena respuesta al tratamiento con 30U de onabotA que se infiltraron en la región temporal ipsilateral al dolor49.
En relación con el SUNCT, se ha descrito la respuesta al tratamiento con onabotA en un paciente refractario a los tratamientos habituales. Se infiltraron un total de 40U alrededor de la órbita ipsilateral en 4 puntos (10U por punto), sin aparentes efectos secundarios y con beneficio sostenido durante varios meses y tras varios ciclos50. En el 2016 se publicó la experiencia con onabotA en un paciente de 12 años con SUNCT de corta evolución; se infiltraron un total de 70U distribuidas en el área periorbitaria, temporal, mejilla y encía superior ipsilaterales (2,5-5U en cada punto separados 1,5cm). La respuesta fue completa con remisión del dolor en la siguiente semana sin presentar recurrencia, con buena tolerancia, tras un único ciclo y un seguimiento de 17 meses21.
Nuestra recomendación es utilizar onabotA en pacientes con HC o HP con intolerancia a la indometacina, o que no hayan respondido a las dosis habituales ni a terapias de segunda línea, utilizando el protocolo de infiltración, dosis y periodicidad del protocolo PREEMPT30. A pesar de disponer solo de experiencias aisladas, dicho tratamiento podría ser útil en pacientes con SUNCT refractario en monoterapia o como terapia adyuvante, a menor dosis (40-70U) y con un patrón de infiltración ipsilateral al dolor.
Tratamiento de la cefalea numular con onabotulinumtoxinALa CN no es una entidad infrecuente. Representa el 4,6% del total de pacientes que acuden a una Unidad de Cefaleas51 y el 6% de aquellos que lo hacen por dolor estrictamente unilateral52.
Su fisiopatología está aún abierta a debate. Su localización tan precisa, las alteraciones sensitivas acompañantes y los cambios tróficos locales que se han observado en algunos casos van a favor de un origen periférico del dolor. Estudios con algometría han demostrado un menor umbral del dolor limitado de forma exclusiva al área sintomática, incluso en las cefaleas numulares multifocales53,54. Sin embargo, no existe un aumento de sensibilización en los nervios epicraneales, y prueba de ello es la ausencia de respuesta al bloqueo anestésico de nervio periférico55. De este modo podemos suponer que existe una disfunción epicraneal de fibra pequeña, sin implicación del tronco nervioso periférico y señalar a los mecanorreceptores de los tejidos periféricos como origen del dolor y posible diana terapéutica en estos pacientes.
No hay ensayos clínicos en tratamiento sintomático o preventivo en la CN. En nuestra Guía Oficial de Práctica Clínica se propone la gabapentina (dosis de 600-1.200mg/día) como primera elección en el tratamiento preventivo (nivel de evidencia iv, grado de recomendación C56). En cuanto a otros preventivos orales, amitriptilina o topiramato han sido utilizados con escasa respuesta en al menos 10 pacientes, y hay descripciones anecdóticas con resultados variables con nortriptilina, clomipramina, lamotrigina, duloxetina, valproato, fenitoína, pregabalina, oxcarbacepina, o carbamacepina55. Sin embargo, en cerca del 20% de los pacientes la respuesta que se consigue con preventivos orales es insuficiente51.
Hay varias descripciones de pacientes con CN tratados con onabotA. Seo y Park infiltraron 10U de onabotA en el área dolorosa en 14 pacientes y obtuvieron en todos ellos una reducción en la escala visual analógica de dolor57. Mathew et al. trataron a 4 mujeres que no habían obtenido respuesta con gabapentina y/o bloqueos anestésicos; inyectaron 2,5U en 10 puntos en o alrededor del área sintomática (dosis total: 25U), con reducción del dolor en todos los casos y resultados similares al repetir el procedimiento23. Dusitanond y Young infiltraron onabotA (entre 10 y 25U) en 5 mujeres con CN resistente a preventivos orales y bloqueos, obteniendo respuesta en 3 de ellas58. Ruscheweyh et al. trataron una mujer con Onabot A sin que se especifique el procedimiento, con una importante mejoría de la intensidad del dolor59.
La serie de pacientes con CN tratados con onabotA más extensa es de 19 pacientes (14 mujeres) con ausencia de respuesta o mala tolerancia a preventivos orales y con una mejoría al menos parcial en el 80% de los casos tras un primer procedimiento. Se infiltraron dosis de entre 12,5 y 50U en varios puntos dentro del área sintomática60.
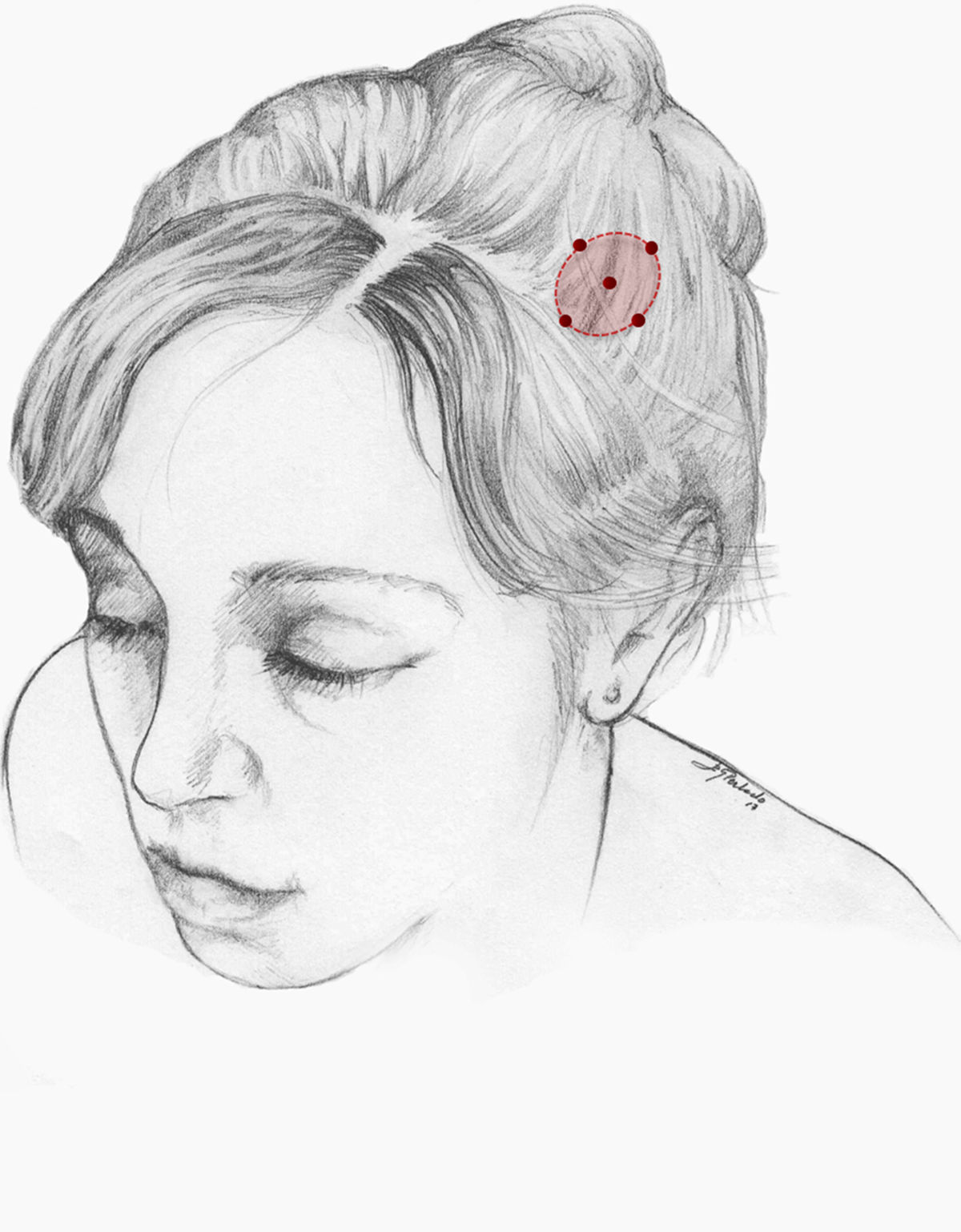
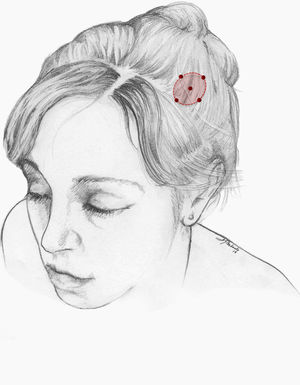
Nuestra recomendación es utilizar onabotA en pacientes con CN con falta de respuesta o intolerancia a preventivos orales, preferiblemente gabapentina. Podría considerarse asimismo su uso como primera opción en pacientes ancianos. Un procedimiento razonable es inyectar en 5 puntos, a razón de 2,5-5 U por punto, 4 en el perímetro de la zona dolorosa y el último en el centro, como se propone en la Guía Oficial de Práctica Clínica en Cefaleas de la SEN (fig. 2). El número de puntos así como la dosis de onabotA dependerán del tamaño del área sintomática. Inyectar en ambos lados de la calota siguiendo la parte frontal u occipital del protocolo PREEMPT30es una opción a tener en cuenta para evitar efectos adversos en esas localizaciones.
Tratamiento de la neuralgia del trigémino con onabotulinumtoxinALa primera vez que se menciona el efecto analgésico de la toxina botulínica en pacientes con NT fue en 199861. Desde entonces se han publicado casos aislados, series de casos, estudios abiertos y, en los últimos años, ensayos clínicos aleatorizados frente a placebo. Son 7 los estudios abiertos realizados con NT, en todos los casos con pacientes farmacorresistentes a los que se administró una dosis única de toxina. En el estudio de Li et al.62 se incluyeron 88 pacientes con NT clásica con afectación de una sola rama y un periodo de seguimiento de 14 meses. Se administraron entre 25 y 170U en el lado afecto (2,5-5U por punto separados 15mm). A los 3 meses el 52% de los pacientes presentaban un control total de dolor; a los 14 meses el 39% seguían siendo respondedores y el 25% mantenían un control total.
En 2016 el grupo de Xia63 publicó los datos de un estudio abierto con 87 pacientes de las mismas características (13 de ellos habían pasado por un proceso intervencionista). Los pacientes fueron tratados con 15-20 puntos en el lado afecto separados por 15mm (se desconoce la dosis utilizada). La tasa de respuesta (reducción≥50% de la puntuación en la escala visual analógica de dolor) fue del 80% a las 8 semanas.
Desde 2011 se han publicado 5 ensayos clínicos aleatorizados, doble ciego y controlados con placebo, en los que se ha administrado una dosis única de toxina botulínica (25-75U) en pacientes con NT clásica y con un periodo de seguimiento de 8 semanas a 3 meses64–69(tabla 2). El ensayo de mayores dimensiones ha sido el de Zhang et al.67, en el que se aleatorizaron 84 pacientes en 3 brazos para recibir placebo (28 pacientes), dosis de 25U (27 pacientes) y dosis de 75U (29 pacientes). A las 8 semanas la tasa de respondedores fue del 32, 70 y 86%, respectivamente. No se encontraron diferencias significativas entre los grupos tratados en relación con la dosis. Las principales reacciones adversas, comunicadas también por otros autores, fueron la asimetría facial, la debilidad en la masticación y la ptosis palpebral, todas ellas de carácter leve y transitorio. En el año 2014 se ha iniciado un nuevo ensayo clínico en pacientes con NT clásica refractaria cuyos resultados todavía no se han publicado70.
Este año se han publicado los resultados de un estudio abierto que compara una dosis única de 70-100U de onabotA (44 pacientes con NT) frente a una dosis de 50-70U repetida 2 semanas después (37 pacientes). A los 6 meses no se encontraron diferencias significativas en la frecuencia de las crisis, puntuación en la escala visual analógica de dolor, tiempo transcurrido hasta el inicio de la mejoría y efectos adversos; sin embargo, la duración de la respuesta fue significativamente mayor en el grupo tratado con una dosis única de onabotA71. Finalmente, Cuadrado et al.72 trataron con éxito a 4 pacientes con odontalgia atípica con una dosis de 15-30U distribuida en 6-12 puntos en mucosa de encías, paladar duro y labio superior, ampliándose por tanto las posibilidades terapéuticas de onabotA a otros cuadros de dolor facial distintos de la NT. En la NT la infiltración de los puntos gatillo del interior de la cavidad oral podría ser útil, permitiendo reducir la dosis y los efectos estéticos.
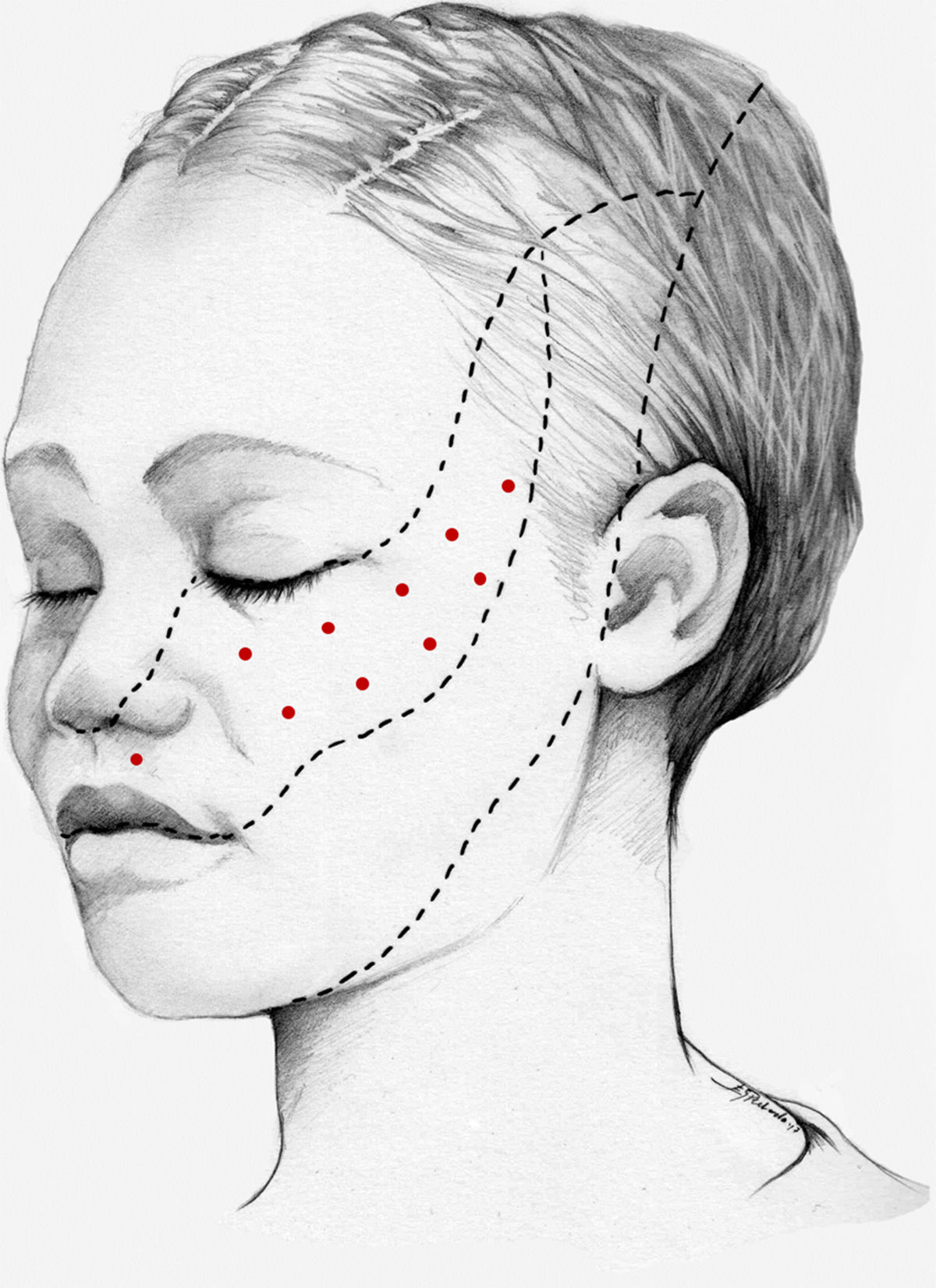
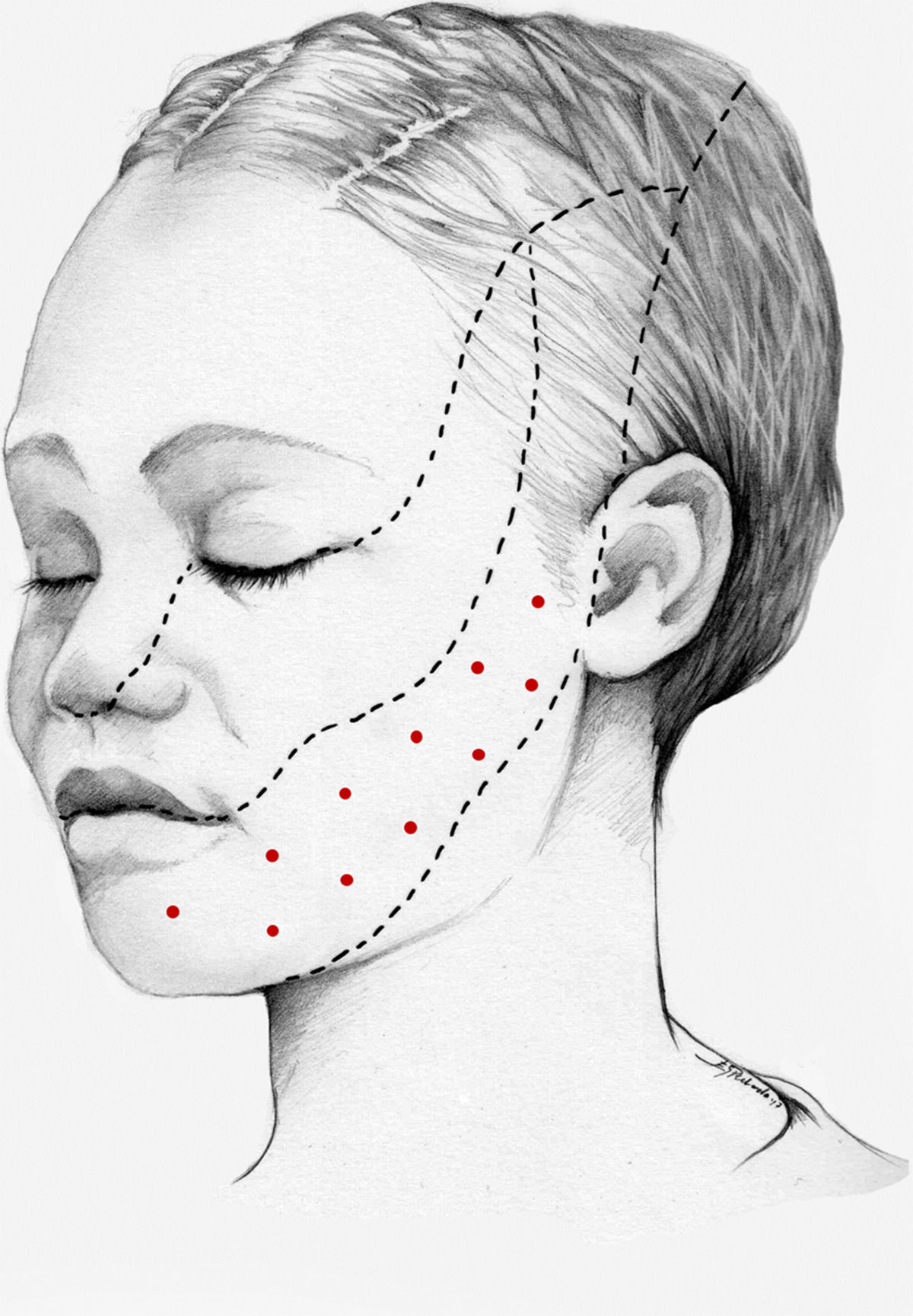
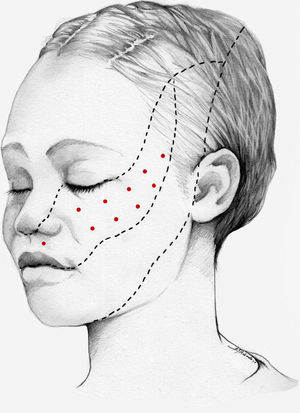
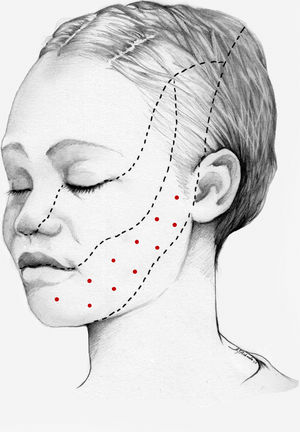
Nuestra recomendación es utilizar onabotA en pacientes con NT clásica farmacorresistente, a una dosis de 25-75U, a razón de 2,5-5U por punto, separados 15mm, en el área dolorosa (figs. 3 y 4). El mapa de infiltración se puede ampliar a puntos gatillo de la cavidad oral. La dosis deberá ajustarse en función de la superficie que se va a infiltrar, la aparición de efectos secundarios y la respuesta del paciente. Se debe valorar la posibilidad de infiltrar algunos puntos de la hemifacies contralateral para reducir la probabilidad de asimetría facial. Si bien no hay estudios concluyentes en cuanto a la periodicidad del tratamiento, parece razonable establecer un periodo mínimo de 12 semanas entre ciclos.
Esquema de infiltración en territorio V2 en pacientes con neuralgia del trigémino. El mapa de infiltración se puede ampliar a puntos gatillo de la cavidad oral. Se debe valorar la posibilidad de infiltrar algunos puntos de la hemifacies contralateral para reducir la probabilidad de asimetría facial.
Esquema de infiltración en territorio V3 en pacientes con neuralgia del trigémino. El mapa de infiltración se puede ampliar a puntos gatillo de la cavidad oral. Se debe valorar la posibilidad de infiltrar algunos puntos de la hemifacies contralateral para reducir la probabilidad de asimetría facial.
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Esperanza González Perlado por su implicación en el proyecto y la belleza de sus diseños