El envejecimiento, consustancial con la demencia, se asocia comúnmente a patologías dolorosas. Sin embargo, por las dificultades de comunicación, el uso de analgésicos está reducido. Por otra parte, las lesiones de las demencias asientan en áreas comunes con las vías nociceptivas. Ello condiciona una modificación de la experiencia dolorosa, diferente para distintas lesiones.
DesarrolloDe las vías dolorosas, la lateral (núcleos talámicos laterales y cortex parietal primario) se encarga de la percepción primaria; está respetada en las demencias. De aquí que la percepción dolorosa, intensidad y umbrales estén preservados. Las vías dolorosas mediales, incluyen núcleos laminares talámicos, protuberancia (locus ceruleus:LC), mesencéfalo (sustancia gris periacaueductal:SGP), hipotálamo (núcleos paraventriculares, tubérculos mamilares) y zonas del cortex parietal (primario y secundario, opérculos), temporal (amigdala e hipocampo) y frontal (cortex cingular anterior:CCA). Coinciden con áreas de lesiones de las demencias. Por lo tanto, se verán afectados aspectos del dolor representados en estas zonas: cognitivo-evaluativo, emocional-vivencial, de memoria dolorosa y autonómico. En la enfermedad de Alzheimer (EA), hay un aplanamiento de respuestas autonómicas y una reducción de las de anticipación y evitación del dolor; se relaciona con los cambios degenerativos mediales temporales (memoria del dolor), y también con los afectivos y cognitivo-evaluativos, por afectación del CCA. En la demencia vascular, existe una desaferentización, por lesiones de sustancia blanca fronto-subcortical; la consecuencia, es un estado de hiperalgesia e hiperpatía. En la demencia frontotemporal, está reducida la expresividad del dolor, ligada al componenente afectivo-emocional, consecuencia de la lesión orbtofrontal y temporal anterior. La enfermedad de Parkinson, caracterizada por un exceso de síndromes dolorosos, se vincula con lesiones precoces del LC y atenuación de su acción antinociceptiva. Por otra parte, en el paciente demente no existe el componente de expectativa ante un tratamiento analgésico, es decir, no hay respuesta placebo que, sumada al efecto farmacocinético, se añade a toda respuesta analgésica. Está ligada a activación preferente de CCA y SGP, asiento lesional común en demencias. La consecuencia, es que en la EA se requerirán dosis mayores de analgésicos.
ConclusionesLa evaluación del dolor en la demencia es compleja. Ello explica las carencias de analgesia. Ha de ser sistematizada. Las escalas la facilitan: en pacientes comunicativos, formas simples (verbales o visuales), en pacientes no comunicativos escalas multidimensionales. Examinan aspectos expresivos, motores, emocionales, funcionales y de interacción social. El dolor puede condicionar un deterioro o progresividad de la demencia. Es una causa tratable y reversible, por lo que no debe dudarse en iniciar tratamiento analgésico si se sospecha. Será intensivo y cuidadoso, para minimizar el alto riesgo de efectos secundarios.
Ageing, a common background in dementia, is usually associated with painful disorders. Nevertheless, the use of analgesics is limited due to poor communication. On the other hand, dementia lesions are placed in the nociceptive pathways. For this reason, the painful experience becomes different and distinctive for every lesional type.
CourseThe lateral nociceptive pathway (lateral thalamic nuclei and primary parietal cortex), which is in charge of the primary pain perception, is preserved in dementia. Thereafter, the shear painful perception, including pain intensity and threshold, remains unmodified. Distinctly, the medial pain pathways are affected by dementia lesions. In this pathway are included: the intralaminar thalamic nuclei, the pons (locus ceruleus:LC), the mesencephalon (periaacueductal grey substance: PGS), the hypothalamus (paraventricular nuclei, mamilary tuberculum) and different areas of the parietal (primary, secondary, operculum), temporal (amigdala, hypoccampus) and frontal (anterior cingular: ACC). As a consequence, the features of pain executed by these areas will be compromised: the cognitive assessment, the mood and emotion inherent to pain, the pain memory or the autonomic responses are modified in dementia. Specifically, in Alzheimer's disease (AD) there is a reduction in the anticipatory and avoidance responses and also a flattening of the autonomic responses. These are essentially secondary to the degenerative changes in the medial temporal (pain memory) and ACC (cognitive and mood aspects) areas. In vascular dementias, there is a cortico-subcortical deafferentation secondary to the white matter lesions. The consequence is the presence of hyperpathy and hyperalgesia. In the frontotemporal dementias, there is a reduction in pain expressivity. It is linked to the lesions in the orbitofrontal and anterior temporal areas, which are responsible of the emotional aspects of pain. In Parkinson's disease, painful conditions are a common characteristic. They are attributed to an early lesion in the LC, which reduces its prominent antinociceptive activity. Finally, in the demented patients there is a lack of expectations to analgesic treatments. This means an absence of the placebo effect, which is, alongside the pharmacokinetic action, an inherent part of the analgesic response. The placebo response is related to activity in the ACC and PGS. Giving its lack, higher doses of analgesics are necessary in dementias.
ConclusionsThe assessment of pain in dementia is rather complex, which is the main reason for the scarcity of the analgesic treatment in dementias. It must be specific and systematic. For this purpose, the pain scales are a useful tool. For communicative patients, simple visual scales are helpful, meanwhile in the non-communicative patients the multidimensional scales are the most suitable. By this means, the expressive, motor, emotional, functional and social interactions are evaluated. Pain may be responsible of progression and cognitive deterioration in dementia. This evolution could be reversible, and consequently it has to be foreseen in order to implement analgesic treatment. Trying to minimize adverse events, it has to be potent but closely monitored.
Demencia y trastornos dolorosos van ligados al envejecimiento. Ambos grupos de patología aumentan de modo casi exponencial con la edad. De hecho, el envejecimiento, que se caracteriza por ser un proceso de deterioro multiorgánico, con descenso de respuestas adaptativas, trae consigo la afectación de diversos tejidos, entre ellos el osteoarticular – con la consecuente patología dolorosa- y el tejido nervioso1; y en este último, tanto el periférico, con afectación de nociceptores, como el propio sistema nervioso central, éste particularmente en las demencias. De modo que si por un lado vemos aparecer patologías dolorosas de manera casi sistemática al envejecer, por otro se producen cambios en estructuras nerviosas relacionadas con la experiencia dolorosa, que pueden condicionar y modificar su expresividad. Con el presente trabajo intentamos precisamente dilucidar esta interacción, y describir rasgos específicos de la patología dolorosa en el envejecimiento normal y en las demencias.
Existe un acuerdo general en el hecho de que el consumo de analgésicos se reduce en las demencias. Resultaba plausible pensar que ello fuera consecutivo a un descenso de la patología osteoarticular en los pacientes con demencia2; sin embargo, este hecho no ha sido confirmado, de modo que la prevalencia de patología osteoarticular es similar, a igualad de edad y sexo, en pacientes sin demencia o con ella3,4. El menor consumo de analgésicos incluye a todos los grupos de fármacos: paracetamol, AINES (antiinflamatorios no esteroideos) y opiáceos5. De hecho, la reducción de la capacidad cognitiva es la variable independiente que mejor se correlaciona con el menor uso de analgésicos en enfermos ancianos con cáncer y con otras patologías dolorosas6–9.
Si el dolor es infratratado en la demencia, cabe una reflexión encaminada a la búsqueda de causas potenciales de ello10. En primer lugar, existe una idea primigenia, casi atávica, de que el dolor es consustancial a la edad, y de que envejecer trae consigo un plus de sufrimiento que los años y la experiencia biológica enseñan a llevar con el debido estoicismo. Así está recogido en obras cumbre del pensamiento y de la literatura, tanto española11 como universal12; visión que por otra parte coincide con lo resultados de investigaciones cualitativas, encaminadas a dilucidar el punto de vista que ancianos de residencias y cuidadores albergan con respecto al dolor de aquéllos13. Este factor, cultural o antropológico, coexiste con otros como el miedo infundado a la dependencia de opiáceos. Contribuye sin duda a la escasez de tratamiento del dolor de la demencia. Pero es que además, existe un diferente grado de afectación sensorial, sensitiva y sobre todo cognitiva, que dificulta la comunicación en los ancianos. Esto convierte la valoración del dolor en un difícil reto para el neurólogo: lo es primero su existencia, y después su adecuada cuantificación. Por otra parte, los cambios anatómicos de las demencias, específicos para los diferentes tipos, condicionan un distinto grado de lesión en áreas de transmisión o procesamiento del dolor. De esta manera, demencias particulares pueden condicionar respuestas dolorosas diferentes, ante iguales patologías dolorosas.
DesarrolloEn los siguientes apartados expondremos, en primer lugar, la diferente expresividad anatómica y clínica de las demencias más comunes con respecto al dolor; seguiremos con factores como la falta de expectativa y la consecuente inexistencia del efecto placebo en las demencias, que es común a todas ellas, y finalmente, propondremos una guía para la valoración y uso de escalas de dolor en la demencia.
Relación del dolor de la demencia con lesiones específicas de las vías nociceptivasLas sensaciones dolorosas son vehiculadas a partir de nociceptores superficiales y viscerales, a través de axones finos escasamente mielinizados que alcanzan el asta posterior medular. Desde aquí, ascienden por los cordones laterales medulares hasta el cerebro. Es el sistema anatómico doloroso cerebral el que nos interesa particularmente. Y ello por dos razones: por ser el lugar en el que el dolor se convierte en experiencia dolorosa; y por albergar las lesiones estructurales de las demencias, en lugares que con frecuencia son comunes con el asiento de los centros y vías nociceptivas centrales.
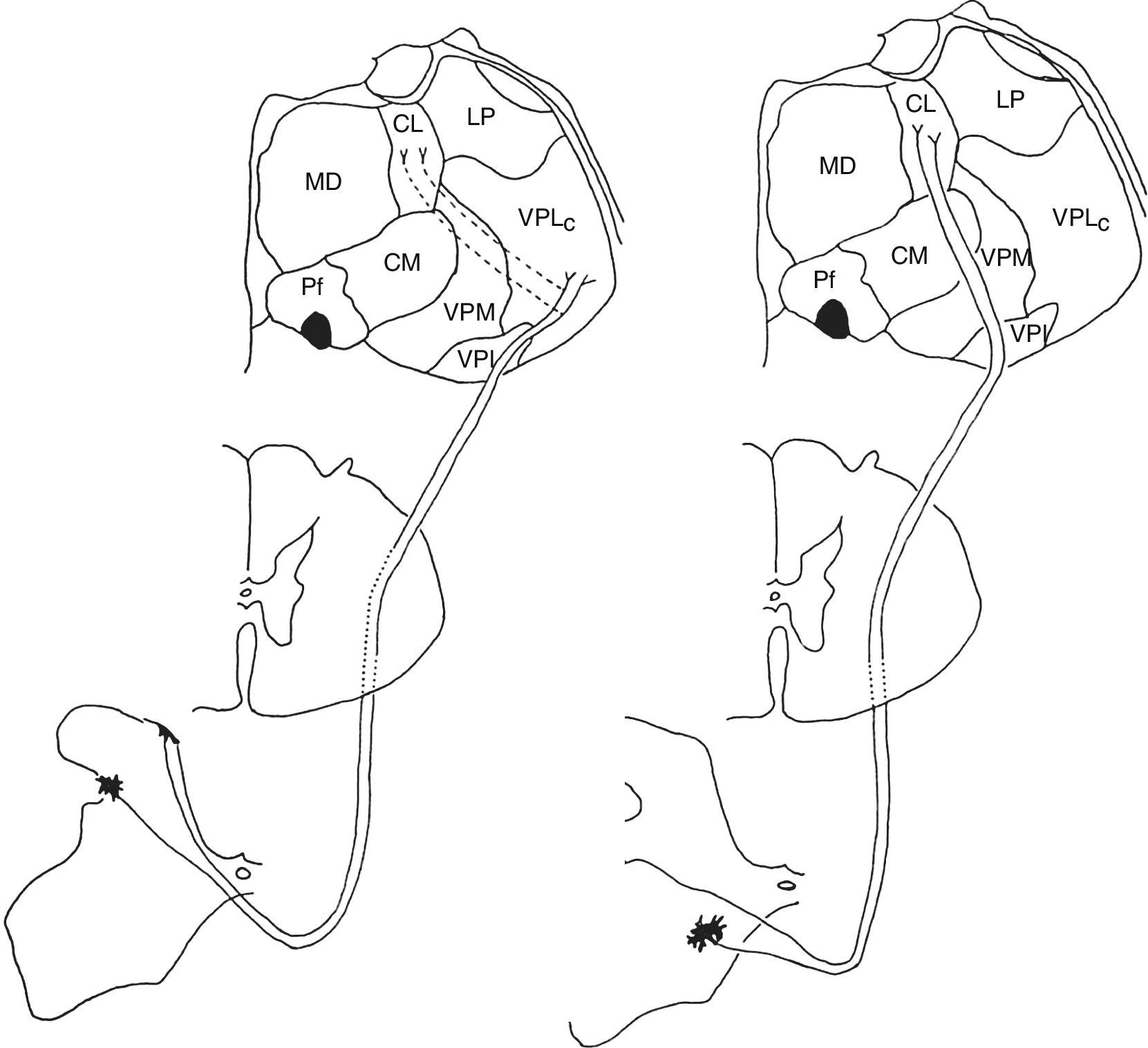
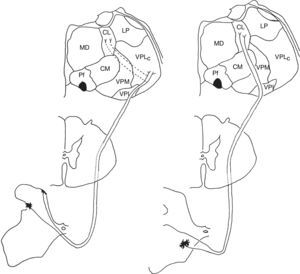
Sistemas nociceptivos medial y lateral (figs. 1 y 2)Por razones prácticas y de claridad, se mencionarán sólo los lugares considerados más relevantes de estos sistemas, en troncoencéfalo, tálamo y cortex. El lector es remitido a excelentes descripciones pormenorizadas de los mismos y del resto de vías dolorosas14.
Representación de los sistemas dolorosos lateral (izquierda) y medial (derecha). El sistema lateral está representado por el haz espinotalámico lateral, que hace relevo sensitivo en el complejo nuclear ventral posterolateral talámico (izquierda). El sistema medial vehicula información sensitiva a través del haz espinotalámico medial, que termina en el sistema nuclear intermediolateral del tálamo, con el núcleo centrolateral talámico representado en la figura (derecha). Las conexiones talámicas entre estos dos sistemas son escasas; representadas a la izquierda (punteado), su lesión es responsable de los síndromes dolorosos talámicos.
Representación de las eferencias del sistema doloroso lateral, que proyecta desde el complejo talámico ventral posterolateral al cortex parietal primario, y del sistema medial. Éste alcanza a diversas áreas corticales y al hipotálamo, de acuerdo a los aspectos más elaborados de la percepción dolorosa que transmite (ver texto).
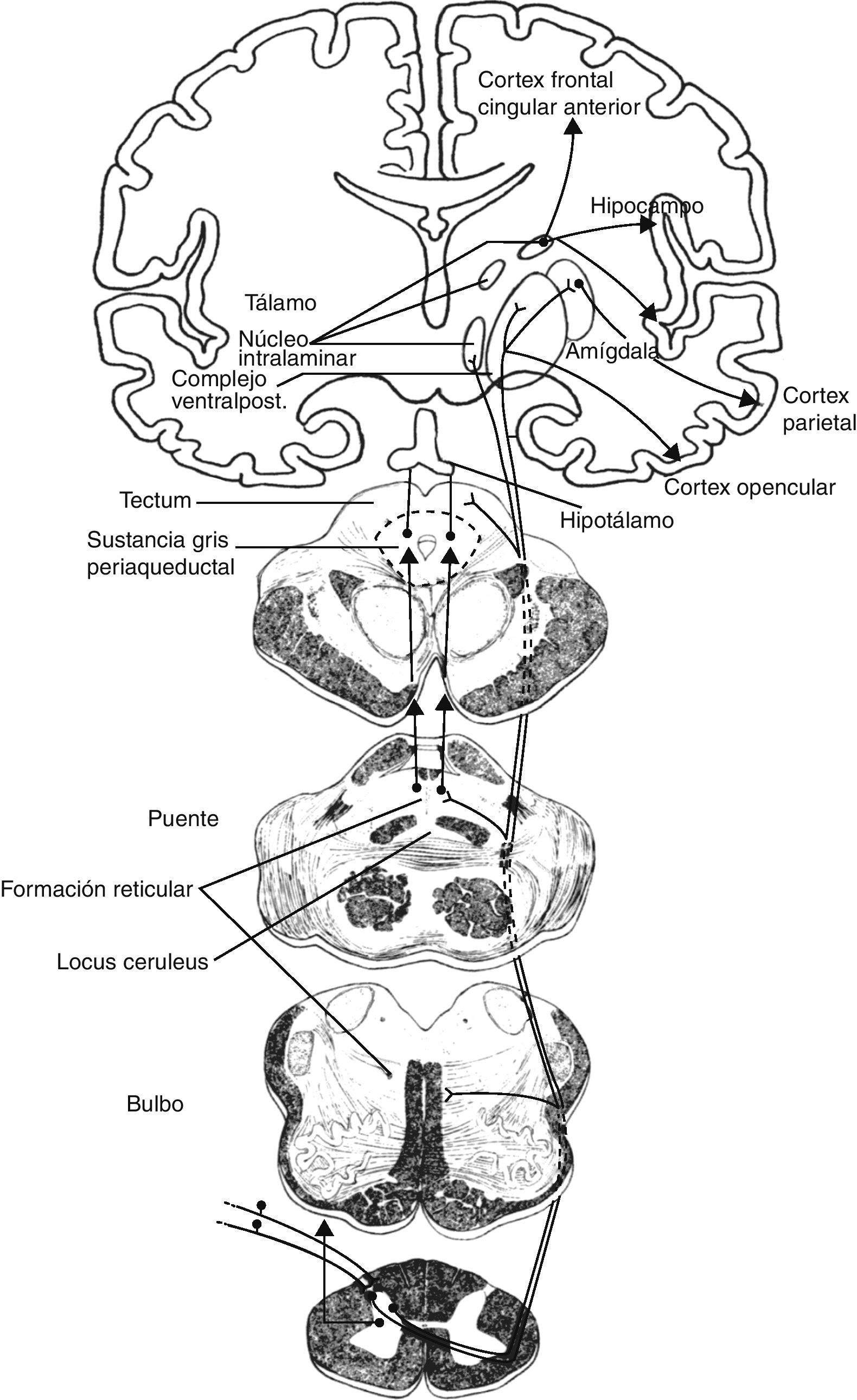
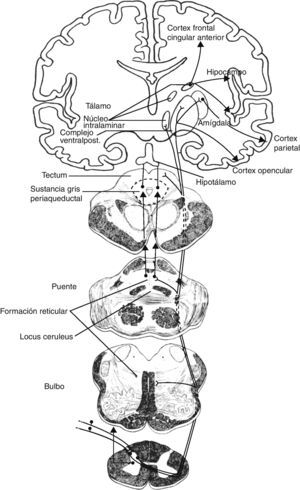
El sistema doloroso medial es el más complejo. Se relaciona con la experiencia dolorosa, es decir, con aspectos emocionales y cognitivos del dolor. Este sistema incluye: los tractos espinotalámicos, que se proyectan directamente sobre los núcleos intralaminares talámicos; el tracto espinoreticular, que proyecta al sistema reticular del puente (núcleo parabrachialis y locus ceruleus), y el sistema espinomesencefálico, que proyecta sobre la sustancia gris periacueductal mesencefálica. Existen a su vez conexiones entre el mesencéfalo y la sustancia reticular pontina, y entre los núcleos intralaminares y los núcleos mediales talámicos. Desde los núcleos talámicos se transmite información a áreas sensitivas parasilvianas (insula, opérculo parietal, cortex secundario somatosensorial S2) y al córtex cingulado anterior (CCA). A su vez, y directamente desde los núcleos parabrachialis y locus ceruleus de la sustancia reticular pontina, la información nociceptiva llega a la amígdala, al hipocampo y al hipotálamo (núcleos paraventricular y tuberomamilares).
El sistema doloroso lateral, menos complejo que el previo, se encarga de aspectos perceptivos más simples, concretamente de la discriminación y cuantificación de la intensidad del dolor. Transmite la información por los haces espinotalámicos, igual que el sistema medial, aunque el sistema lateral lo hace a núcleos talámicos laterales. Desde aquí, la proyección más importante es hacia el cortex primario somatosensorial S1, también hacia S2, opérculo parietal e ínsula.
Vemos pues, que existen estructuras anatómicas compartidas por los sistemas medial y lateral, especialmente en las áreas parasilvianas15. Sin embargo, las conexiones entre ambos sistemas son escasas y circunscritas al tálamo, entre sus núcleos de relevo mediales y los laterales, pertenecientes a los respectivos sistemas dolorosos medial y lateral. Estas conexiones tan restringidas, resultan no obstante de alto interés clínico, puesto que su desconexión da lugar al síndrome central de dolor talámico postinfarto, un síndrome doloroso de desaferentización16.
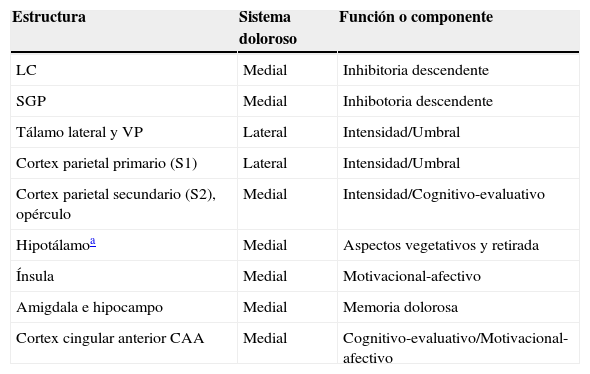
Las múltiples facetas del dolor están representadas en los dos sistemas anatómicos descritos (tabla 1). El medial, que como ya mencionamos es más complejo, se encarga de los aspectos del dolor motivacional-afectivos, de los cognitivo-evaluativos, de la memoria del dolor y de las respuestas autonómicas-neuroendocrinas. El sistema lateral se ocuparía de los aspectos sensitivos-discriminativos del dolor, es decir, de los rasgos primarios del mismo, representados en el cortex S1, filogenéticamente y ontogenéticamente anterior al cortex que interviene en las respuestas emocionales y cognitivas del sistema medial. Dado que son las que tienen más interés en las demencias, pasamos a describir todas estas respuestas, también su asiento anatómico.
Principales estructuras anatómicas y su función en las vías dolorosas cerebrales
| Estructura | Sistema doloroso | Función o componente |
|---|---|---|
| LC | Medial | Inhibitoria descendente |
| SGP | Medial | Inhibotoria descendente |
| Tálamo lateral y VP | Lateral | Intensidad/Umbral |
| Cortex parietal primario (S1) | Lateral | Intensidad/Umbral |
| Cortex parietal secundario (S2), opérculo | Medial | Intensidad/Cognitivo-evaluativo |
| Hipotálamoa | Medial | Aspectos vegetativos y retirada |
| Ínsula | Medial | Motivacional-afectivo |
| Amigdala e hipocampo | Medial | Memoria dolorosa |
| Cortex cingular anterior CAA | Medial | Cognitivo-evaluativo/Motivacional-afectivo |
LC: locus ceruleus; SGP: sustancia gris periacueductal.
Es del que se encarga propiamente el sistema doloroso lateral, a través de las proyecciones que desde los núcleos talámicos laterales se efectúan al cortex parietal S1 y S2, de modo directo o secuencial. A través de este sistema, los estímulos dolorosos también alcanzan la ínsula y el opérculo parietal. De la integridad de este último depende la existencia de un umbral doloroso normal, así como el reconocimiento de cualidades nociceptivas relacionadas con su localización, intensidad y naturaleza17,18. Estos sistemas anatómicos se encuentran habitualmente preservados en la enfermedad de Alzheimer (EA), a diferencia de lo que ocurre con estructuras del sistema medial. De aquí que la percepción del dolor, intensidad y umbral se encuentren respetados en EA15.
Componente motivacional-afectivoEn él están implicadas tres grupos de estructuras: 1- Los núcleos ventrales posteriores talámicos, que proyectan eferencias al opérculo parietal y a la ínsula; 2- El cortex cingular anterior (CCA), hacia el que llegan aferencias de los haces espinotalámicos, del tracto espinoreticular y del espinomesencefálico; también existen conexiones entre ínsula y CCA, que refuerzan los rasgos motivacionales y afectivos del dolor; 3- Hipotálamo y cortex prefrontal, este último con un papel adicional en la anticipación del dolor y en las conductas de evitación del mismo19.
Componente cognitivo-evaluativoLa sustancia reticular pontina, y en concreto el locus ceruleus, se encargan de llevar a cabo una primera aproximación cognitiva al dolor, al orientar la atención hacia el mismo. De este modo, al realizar otras tareas cognitivas o al implementar tareas de distracción, tanto S2 como CCA responden menos a estímulos dolorosos20. Sería precisamente el CCA el elemento central en esta dimensión cognitiva-evaluativa del dolor, que ejecutaría a partir del flujo de información que le llega desde el opérculo parietal y la ínsula21.
Memoria del dolorComo en otros tipos de memoria, las regiones mediales del lóbulo temporal (hipocampo y amígdala) son las encargadas de la memoria dolorosa. Reciben aferencias de ambos sistemas dolorosos (lateral y medial), fundamentalmente desde S2 y desde la ínsula. De modo más directo, la memoria dolorosa puede llegar a la amígdala desde el núcleo parabrachialis de la formación reticular pontina14. Los núcleos talámicos ventrales posteriores tienen también un papel en la memoria dolorosa: su estimulación hace evocar y experimentar sensaciones dolorosas específicas vividas en épocas anteriores de la vida15.
Finalmente, el cortex prefrontal y el CCA valoran las consecuencias del dolor y preparan su neutralización o defensa, a través de la coordinación del componente cognitivo-evaluativo y del estrictamente sensitivo del dolor21.
Respuestas autonómicasEl dolor tiene un componente autonómico notable, que va desde signos externos (palidez, sudoración, piloerección), hasta repuestas cardiovasculares (variaciones de frecuencia cardiaca o tensión arterial), digestivas (vómitos o diarrea) o urinarias (urgencia o incontinencia). Este componente, se encuentra mediado por la sustancia gris periacueductal mesencefálica22, pero sobre todo por el hipotálamo, que tiene un papel central en las conductas aversivas y en las respuestas autonómicas y neuroendocrinas al dolor. Al hipotálamo llegan aferencias de la formación reticular pontina; él mismo establece conexiones con el cortex prefrontal, la amigdala y el hipocampo. De aquél interesan especialmente los núcleos tuberomamilar, que es el único núcleo histaminérgico del cerebro, y el núcleo paraventricular. En éste se producen vasopresina, oxitocina y, colocalizada con ellas, la hormona liberadora de corticotrofina o CRH. Todos ellos son péptidos con acción antinociceptiva, cuya expresión se modifica en el envejecimiento y en la enfermedad de Alzheimer23.
Enfermedad de AlzheimerLas modificaciones de la respuesta dolorosa en la EA van a estar determinadas por los cambios estructurales de sistema medial y del vegetativo autonómico, integrado en el mismo. En cambio, el sistema lateral, tal como hemos apuntado más atrás, se encuentra bastante preservado. Así, no se han descrito lesiones en los núcleos talámicos laterales, y tanto S1 como las conexiones de S1 con S2 están igualmente respetadas, al menos hasta estadíos avanzados de la enfermedad24–25.
En contraste, los cambios histopatológicos de Alzheimer se hallan de manera casi constante en todos los niveles del sistema medial (tabla 2):
- a-
En el tronco: tanto en el puente (afectación muy precoz del LC26,27), como en el mesencéfalo (sustancia gris periacueductal), estructuras ambas con acciones antinociceptivas.
- b-
En el tálamo, afectando a los núcleos mediales e intralaminares27.
- c-
En el cortex, en zonas de memoria del dolor (amigdala e hipocampo) y en el cortex frontal, en el CCA y en el prefrontal28.
- d-
En el hipotálamo, especialmente en las neuronas histaminérgicas de los tubérculos tuberomamilares, que poseen acción analgésica; los núcleos paraventriculares se encuentran respetados de cambios estructurales, de modo que incluso las neuronas productoras de CRF están hiperactivas en la EA y llevan a un aumento de cortisol plasmático29.
Localizaciones de lesiones de vías dolorosas en las principales demencias
| LC | SGP | ILT | Íns | Hip/amig | HipoTMN | CCA | LatTal | Prefr | S1 | S2 | LSB | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Alzheimer | + | + | + | + | ++ | + | ++ | - | - | + | + | |
| Vascular | +(des) | +(des) | +(des) | +(des) | ++ | |||||||
| Frontotemporal | + | + | + | ++ | - | ++ | - | + | ||||
| Parkinson | ++ | - | - |
LC: locus ceruleus; SGP: sustancia gris periacueductal; ILT: núcleos intralaminares del tálamo; Hip/amig: Hipocampo y amígdala; HipTMN: hipotálamo, tubérculos mamilares; CCA: cortex cingular anterior; LatTal: núcleos talámicos laterals; S1: cortex parietal primario o perceptivo; S2: cortex parietal secundario o asociativo; LSB: lesions de sustancia blanca; desc: lesion por desconexión. Las casillas en blanco indican ausencia de estudios o información confusa.
De acuerdo con este patrón histopatológico, el umbral doloroso se encuentra preservado en la EA, como corresponde a la integridad de S1. Este aspecto se ha demostrado con estudios de estimulación eléctrica dolorosa5,15.
Las respuestas autonómicas se encuentran aplanadas ante estímulos de poca intensidad, de forma que se precisan estímulos dolorosos potentes para obtener respuestas equivalentes en pacientes con EA y en controles30. Más recientemente, se ha demostrado que estas respuestas se correlacionan inversamente con el grado de deterioro cognitivo, de manera que a menor puntuación en el test minimental (MMSE), menor frecuencia cardiaca al dolor eléctrico en muñeca31–32. Este fenómeno tiene lugar con preservación de respuestas adecuadas al tacto y al dolor. Ello significaría que, incluso en presencia de respuestas autonómicas alteradas, se mantendrían los umbrales sensitivos de tacto y de dolor en la EA.
Si la lesión de los núcleos tuberomamilares del hipotálamo es responsable del aplanamiento de respuestas autonómicas, los cambios degenerativos de las estructuras corticales y de núcleos de tronco, serían responsables del compromiso del resto de esferas del dolor. Todas ellas se relacionan con la afectación del sistema medial. En concreto, las placas, ovillos y depósitos de amigdala e hipocampo explicarían el descenso en la memoria del dolor. De igual modo, puede preverse que las lesiones de locus ceruleus, S2 y CCA comprometerán los aspectos cognitivo-evaluativos del dolor, o que la atrofia del mismo CCA y del cortex prefrontal disminuirían la respuesta motivacional-afectiva al dolor, de modo que tampoco existiría una adecuada anticipación, ni conducta motora y aversiva ante el dolor. Sin embargo, este descenso de los componentes más elaborados de la respuesta dolorosa puede verse compensado por otros dos factores: en primer lugar, por hiperactividad del eje hipotálamo-hipofisario-suprarrenal, consecutiva a la ya apuntada descarga histaminérgica paraventricular y al aumento consecutivo de CRF; y en segundo lugar, por la existencia de lesiones vasculares de sustancia blanca. Éstas, serían responsables de una desconexión cortico-subcortical y de un incremento de respuestas dolorosas, similar a la hiperpatía que es típica de la demencia vascular (ver más abajo).
Por tanto, existen bases teóricas para pensar en un alteración de la transmisión y procesamiento del dolor, aunque las investigaciones dirigidas a confirmarlas son escasas. Además de las ya citadas, con las que se perfilaron el mantenimiento del umbral y el aumento de la tolerancia al dolor en la EA, existen evidencias de dos tipos: neurofisiológicas y de neuroimagen funcional (fMRI).
Los estudios neurofisiológicos directos se llevaron a cabo con registro de potenciales relacionados y evocados con estímulos dolorosos. La amplitud de éstos no se veía afectada, mientras que la latencia al pico de amplitud estaba diferida en pacientes con EA34. Estos resultados, sugieren que el umbral o intensidad perceptiva del dolor se encuentra mantenido, mientras que la transmisión e integración de la información nociceptiva puede encontrarse enlentecida.
Los estudios con fMRi han resultado aún más reveladores. Contrariamente a lo previsto, la actividad funcional tanto en el sistema doloroso lateral como en el medial se encontraba preservada. El dolor provocado se asociaba a actividad igual en EA moderada (MMSE: 19) y en controles. Se incluían el cortex S1 y S2, la ínsula y el CCA. Pero en este estudio hubo también un aumento de la amplitud y latencia en áreas de procesamiento afectivo y cognitivo del dolor, probablemente relacionado con un incremento de atención ante el dolor35. Sería indicativo de trastornos de integración cognitiva de la información dolorosa percibida. La diferente respuesta del cortex frontal dorsolateral puede explicar esta disociación.
Finalmente, se ha demostrado que la percepción del dolor agudo se encuentra relativamente mantenida. Sería la experiencia del dolor crónico la que se halla especialmente afectada36. En este tipo de cuadros, predominantes en pacientes con demencias avanzadas institucionalizados37, la anticipación y respuestas motoras y de evitación se encontrarían comprometidas21. Ello es consistente con el hallazgo de alteración de activación del cortex frontal dorsolateral en la EA avanzada.
Demencia vascular.
Desde el punto de vista específico de lesiones vasculares y dolor38, son escasos los estudios dirigidos. Sabemos que, a diferencia de la EA y la demencia de la enfermedad de Parkinson, el LC se encuentra respetado39; por otro estudio, conocemos que la desconexión existente entre hipocampo e hipotálamo puede causar hiperactividad del eje hipotálamo-hipófisis-suprarrenal, con aumento consecutivo de CRH40, hallazgo éste común a la EA.
El componente afectivo del dolor es el que se ve más afectado en la demencia vascular. Se atribuye a un incremento del dolor, de la experiencia dolorosa realmente, por desconexión cortico-subcortical; más específicamente, existen desconexiones de núcleos intralaminares del tálamo y S233, y también entre el sistema parietoinsular y el CCA15. La consecuencia de ambas lesiones de sustancia blanca es el dolor por desaferentización. Aparece en los infartos de esa localización a partir del sexto mes del cuadro inicial; y de igual modo, puede verse en la demencia vascular.
Entre los síndromes dolorosos crónicos de los pacientes con infartos cerebrales y con demencia vascular se encuentra la cefalea. Se trata de una entidad escasamente estudiada41. La cefalea puede relacionarse con la causa del infarto (vasculitis, disección arterial), con el tratamiento (antiagregantes plaquetarios, antiinflamatorios), con complicaciones (infecciones sistémicas o de SNC, trastornos metabólicos) o con nuevos infartos, especialmente los más extensos o los de fosa posterior. No obstante, queda un amplio grupo de pacientes que se mantienen con cefalea meses o años después del accidente cerebrovascular. No se ha definido si existe una relación directa con la historia previa de cefaleas primarias, o con factores emocionales asociados a esta patología y a sus secuelas. En un trabajo clínico en el que se investigó este aspecto, se encontró que las cefaleas se correlacionaban con las lesiones de sustancia blanca, pero no con el número, volumen o síntomas directos de los infartos42.
La hiperpatía pudo demostrarse al obtener puntuaciones significativamente más altas en las escalas de dolor pasadas a los enfermos con demencia vascular43.
No se han descrito lesiones en el sistema doloroso lateral, por lo que no hay datos sugestivos de disminución del umbral doloroso, que podría compensar la hiperpatía por desaferentización típica de estos enfermos
Demencia frontotemporal (DFT)En ella, la atrofia frontal y la temporal lateral son mayores que en la EA. En estudios de PET y de flujo regional, se han podido diferenciar los circuitos más afectados en la DFT con respecto a la EA. En aquélla, las mayores reducciones de flujo ocurrían en el cortex prefrontal, en el orbitoprefrontal y en el CCA44. La amigdala y el hipocampo se encuentran bastante preservados. En el lóbulo temporal, las áreas más afectadas en la DFT son las de la región anterior, perisilviana. Ésta, y la frontal, se relacionan con el componente motivacional y afectivo del dolor45. Al encontrarse éste reducido, la consecuencia es una reducción de la expresión del dolor. En este sentido, el cuadro es también similar a la EA, diferentes ambos de la demencia vascular. En la DFT, el dato esencial sería una reducción del componente cognitivo-evaluativo, consecutivo a la lesión frontal.
El LC se encuentra preservado; no se han descrito lesiones en el sistema nociceptivo lateral ni en el hipotálamo46,47.
En el único estudio clínico en el que se comparó la respuesta al dolor en la DFT, EA y demencia vascular, la retirada tras estímulos térmicos (agua caliente) fue mayor y más rápida en la demencia vascular, dato previsible por la hiperpatía. El compromiso cognitivo-evaluativo y afectivo en la DFT explicaría la respuesta más lenta48.
Enfermedad de Parkinson (EP)El dolor es una manifestación común de la EP. Es en general indicativo de inicio de periodos “off” o efecto fin de dosis. Los pacientes con EP tienen también mayor frecuencia e intensidad de dolor de otros orígenes. En ellos se ha descrito un síndrome doloroso central primario, no atribuible a ninguna de las etiologías previas33,49.
El predominio de cuadros dolorosos, se atribuye a lesiones precoces en los núcleos de tronco con acciones antinociceptivas, especialmente LC y regiones subceruleus50.
Expectativas terapéuticas y dolorEl dolor es una experiencia subjetiva muy influenciada por los factores exógenos que lo generan, también por factores endógenos emocionales y cognitivos. Son destacables la ansiedad, la atención, las experiencias previas dolorosas o las expectativas. Estas últimas resultan especialmente importantes, por cuanto determinan la existencia del efecto placebo analgesia. Es éste uno de los factores cognitivos moduladores más potente que se conoce en su acción sobre la percepción del dolor51.
El efecto placebo sucede cuando la administración de una sustancia “inefectiva” produce un efecto, dependiente del convencimiento del sujeto de que la sustancia actúa sobre el síntoma diana. Es especialmente evidente en los trastornos emocionales, en los del movimiento y en el dolor. En la analgesia placebo influyen diversos factores psicológicos: las expectativas, el condicionamiento Pavloviano y la reducción de la ansiedad. Las expectativas se refieren a la respuesta anticipada, emocional y fisiológica, que un individuo espera por un tratamiento; puede ser manipulado con información verbal52. El condicionamiento es un aprendizaje que pone en marcha mecanismos capaces de evocar una respuesta al placebo tras ser emparejado con el tratamiento activo. Un ejemplo de condicionamiento es la respuesta analgésica a placebo en un experimento en el que el dolor de isquemia provocada en un brazo se trató con mórficos; a partir del segundo día, se administró un antibiótico en sustitución del mórfico a aquellos sujetos con respuesta al mórfico. En ellos, se observó respuesta analgésica significativa con el antibiótico53.
Hoy sabemos que el efecto placebo no es un puro fenómeno psicológico dependiente de una acción sobre la atención, la aferencia sensitiva o la percepción del dolor. En el fenómeno intervienen circuitos neurobiológicos bien perfilados54. Su conocimiento deriva de la aplicación de técnicas de neuroimagen funcional. Gracias a ellas, conocemos los grupos celulares implicados en la analgesia placebo. Se trata de estructuras frontales y prefrontales, especialmente el CCA en su porción más rostral, y de las de la sustancia gris periacueductal. Estos grupos, se encuentran implicados en la respuesta a placebo tópico, sistémico, o incluso de acupuntura “blanca” (“Sham acupuncture”). Se trataría de un incremento de la conectividad funcional del CCA con estructuras subcorticales que resultan claves para vehicular información nociceptiva en sentido descendente55.
Aparte del CCA, otras estructuras corticales se activan durante la analgesia placebo. Son áreas normalmente funcionales en experimentos de dolor: tálamo, ínsula, amígdala y cortex parietal. Pues bien, en la respuesta placebo estas zonas muestran un descenso de actividad, de modo que la misma dependería de una inhibición activa del “input” nociceptivo56. Por otra parte, el cortex prefrontal resulta también crucial en la anticipación del efecto placebo; de modo específico, la activación de sus zonas dorsolaterales se correlaciona con la robustez del efecto placebo analgésico. Esta estructura se considera necesaria para generar, mantener e integrar las representaciones internas y las expectativas, entre las que se incluye la respuesta placebo57.
Experimentos pioneros, lograron demostrar hace cuatro décadas que el efecto placebo analgésico puede ser neutralizado con naloxona58. Este hecho, demuestra que al menos una parte del mismo depende de sistemas opioides endógenos. En apoyo de esta hipótesis, trabajos más recientes con PET y radioligandos de opioides han permitido observar una activación de receptores μ-opioides de áreas subcorticales y corticales en la analgesia placebo59. Sin embargo, sabemos que el opioide no es el único sistema de neurotransmisores implicado en el efecto placebo. Lo están también el dopaminérgico, serotoninérgico y cannabinoide, muy probablemente en diferente grado en distintos síndromes dolorosos y en otras respuestas placebo53,54.
Expuestas las estructuras anatómicas de la respuesta placebo dolorosa, vemos que son comunes con áreas específicas de dolor. De igual modo, las regiones afectadas en las demencias son parte de las que median el efecto placebo, por lo que no sorprende el hallazgo de descenso o atenuación del mismo en las demencias. En el único trabajo diseñado al efecto, se encontró precisamente ese resultado: en un grupo de enfermos con EA leve o moderada, le respuesta placebo tópica estaba significativamente reducida. El resultado se correlacionaba directamente con la puntuación en una batería de test frontales, pero no con el grado de deterioro en el test MMSE60. Este hallazgo, resalta el papel del cortex prefrontal en la respuesta placebo analgesia: su lesión o desconexión reduciría la comunicación del mismo con áreas relacionadas con placebo y expectativas, tales como el CCA. De este modo, estaría ausente la inactivación de áreas dolorosas corticales (ínsula, amigdala, S1 y S2) y el efecto opioide de zonas subcorticales que caracterizan la respuesta placebo.
La ausencia de efecto placebo en la EA no ha sido estudiada en otras demencias. Dado que la lesión frontal, por asiento directo o por desconexión cortico-subcortical, es aún mayor en la DFT y en la demencia vascular, puede preverse una ausencia de efecto placebo analgésico también en ellas15. Lamentablemente, no existen hasta la fecha trabajos que lo constaten.
Si la lesión prefrontal trae consigo una reducción del efecto placebo y de las expectativas de analgesia, puede predecirse una disminución de eficacia de los analgésicos. Ésta, es la resultante de un efecto farmacocinético propiamente dicho, al que se suma el efecto de una expectativa; ambos componentes, pueden individualizarse en experimentos de analgesia y placebo61. Por lo tanto, la reducción de la analgesia resulta inseparable de la ausencia del efecto placebo. La consecuencia es que en los pacientes con EA, y muy verosímilmente también en otras demencias que afecten al lóbulo prefrontal, se requerirá una mayor dosis de analgesia para lograr el efecto buscado. Es también predecible que factores ambientales inherentes a la aplicación de analgesia se sumen al efecto placebo farmacológico directo. Dado su pobre interacción en las demencias, la expectativa analgesia se verá igualmente reducida por esta vía.
Valoración del dolor en la demenciaAl ser el dolor una sensación y experiencia compleja, que incluye múltiples dimensiones, su medida objetiva o cuantificación resulta de natural complicada. Será difícil medir la intensidad, calidad, localización, peso emocional o repercusión funcional. Sin embargo, esta medición resulta crítica para valorar la evolución o su respuesta a los tratamientos, así como para la comparación entre diferentes pacientes en estudios o en ensayos clínicos. A estos efectos, se han diseñado escalas de dolor, de diferente complejidad, que evalúan distintos aspectos del mismo62.
Las dificultades de comprensión y los trastornos de comunicación inherentes a la demencia, dificultan de manera especial esa avaluación. La dificultad será mayor en las fases más avanzadas. Las escalas más simples, o visuales, en general unidimensionales, son válidas en los pacientes comunicativos; en los escasamente comunicativos, las escalas requeridas serán las que usan signos más indirectos en la evaluación del dolor, por lo general de índole motora expresiva o vegetativos.
La valoración debe complementarse con la información proporcionada por los cuidadores. En este sentido, sabemos que existe acuerdo entre pacientes y cuidadores, si bien éste alcanza sólo a la presencia de dolor, no a su cuantificación15,33,60.
Evaluación en pacientes comunicativos.En general, en ellos son de gran utilidad las escalas verbales descriptivas, las visuales analógicas y las numéricas. Se cuantifica el dolor mediante puntuaciones a descriptores verbales (elegir entre cinco calificativos desde ausencia de dolor al peor imaginable), numéricos (desde 0 a 10, señalado directamente o en una línea horizontal, al modo de un termómetro visual, en la llamada escala analógica visual o VAS); o formas más elaboradas como la escala de cuadrícula de 21 puntos o BS-21, (que va de 0 a 100, con una cuadrícula oscura y densa cada 5 puntos, superpuesta a la previa, pudiendo llegar a 2163), o a descriptores faciales (dibujos de 7 caras que expresan tipos cuantitativos sucesivos de dolor desde el neutral inicial, llamada escala facial de dolor o FPS64). La última es la más apropiada para pacientes con demencia, si bien en estadios intermedios, con MMSE de 10 a 19, se ha observado una buena correlación entre todas estas escalas. De hecho, las puntuaciones de dolor eran muy similares en todas ellas, por lo que poseen cualidades psicométricas superponibles; la diferencia real era una cuestión de preferencia racial: los caucásicos preferían lasa escalas verbales descriptivas, frente a los afroamericanos, que se inclinaban por la escala facial de dolor65. También se evaluaron en todos los grupos las escalas numéricas, que mostraron igual validez que las otras.
Se trata, por tanto, de escalas unidimensionales, que en realidad valoran la intensidad del dolor. Aún así, para algunos enfermos puede ser difícil entender el significado de las escalas, o transcribir el dolor con papel y lápiz. Por ello, se aconseja evaluar estos aspectos de capacidad cognitiva, al menos con el test del reloj.
El resto de los componentes del dolor a escapan a esas escalas y precisan de otras más complejas en su recogida, que por lo tanto requerirán más tiempo en su elaboración.
Evaluación en pacientes no comunicativosEn las fases de mayor deterioro de la demencia, la atención se centra en signos indirectos que, en conjunto, reflejen del modo más adecuado posible la presencia de dolor. Se lleva a cabo mediante escalas más elaboradas, que cuantifican tres aspectos del dolor: la intensidad y localización, sus componentes afectivos y las respuestas autonómicas. Existen múltiples escalas. No obstante, son dos las más aceptadas y recomendadas en las guías de expertos10,66, por haber demostrado mayor acuerdo interobservadores, validez y consistencia. Se trata de las escalas PACSLAC67 y Doloplus 268. La primera consta de cuatro subescalas, en las que se recogen datos de: 1- Expresividad facial; 2- Posición y movimientos corporales; 3- Rasgos sociales, de personalidad y humor, 4- Otros: signos autonómicos y vegetativos (sueño, apetito, bostezos, etc). La escala Doloplus 2 agrupa tres subtipos de respuestas: somáticas, psicomotoras y psicosociales.
Los signos recogidos en ambas son indirectos y remiten a: 1- Cambios de expresividad facial, con facies en general rígida, distorsión expresiva, cierre palpebral o lo opuesto, parpadeo mantenido; 2- Verbalizaciones o vocalizaciones, en forma de lamentos, gritos, llamadas o expresividad inadecuada de rechazo; 3- Movimientos corporales, en forma ya de defensa, ya de inquietud expresada en movimientos repetidos, vagabundeo o estereotipias complejas; 4- Cambios en los patrones o rutinas de actividad, afectando al sueño, alimentación o hábitos corrientes de desplazamiento en su medio; 5- Modificaciones en las relaciones interpersonales: los pacientes se vuelven irritables, agresivos, no comunicativos, aislados o con conductas obstrucionistas, 6- Cambios en el estado mental, que eventualmente adoptan la forma de síndromes confusionales o de progresividad de la demencia.
Son de particular interés para el neurólogo el primero y el último de los aspectos apuntados, relacionados con la expresividad facial y con cambios del estado mental. La expresividad facial es un rasgo explorado en todas las escalas aptas para pacientes con demencia o no comunicativos. Se dispone de expresiones codificadas, que reflejan con precisión el grado de dolor, al menos desde el punto de vista de validez de escala y de acuerdo interobservadores. Han sido evaluadas en diferentes situaciones clínicas69,70, que van desde la colocación de prótesis articulares al tratamiento de úlceras por decúbito. En la revisión más extensa, se apreció un alto nivel de acuerdo para la presencia o ausencia de dolor, pero no para la cuantificación del mismo71. Es probable que esta limitación sea atribuible al hecho de que la expresividad facial puede verse afectada por patología de base o concurrente en estos enfermos, que condiciona o limita la expresividad facial. La enfermedad de Parkinson u otros parkinsonismos, al igual que la demencia frototemporal de predominio lesional temporal derecho, son ejemplos de situaciones en los que la inexpresividada facial puede no corresponderse con ausencia de dolor5,10,15,64,65.
De igual modo, el dolor, agudo o crónico, es causa de deterioro cognitivo en pacientes con demencia o dificultades de comunicación previas. Es fácil entender que el dolor disminuye la capacidad de atención hacia el entorno, y que los cambios emocionales que lleva asociados pueden también limitar la capacidad cognitiva. De modo que puede haber cuadros dolorosos expresados en forma de progresividad de la demencia. Pueden ser interpretados erróneamente como síndromes confusionales. Sabemos que son reversibles en las formas agudas de dolor, si bien ignoramos el pronóstico en pacientes con dolor crónico. De aquí el interés en un correcto diagnóstico y tratamiento de estos enfermos: el dolor es un aspecto tratable que puede frenar la progresividad y deterioro de los pacientes.
Orientación diagnóstica práctica en el paciente demente con dolorSi el dolor es infratratado en ancianos, y aún más en aquéllos con dificultades de comunicación y con demencia, es debido principalmente a una inadecuada valoración, en primer lugar de su existencia, pero también de su grado y de su repercusión. Conocer este punto resulta capital para implementar una estrategia de valoración y abordaje, en la que descansa el diagnóstico y tratamiento adecuados del síntoma.
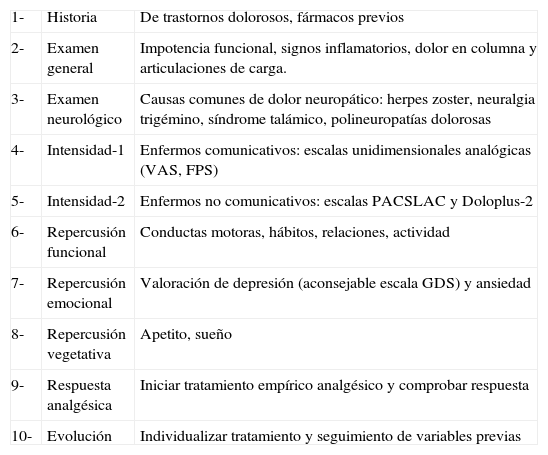
La valoración requiere de una aproximación global (tabla 3), que tenga en cuenta: 1- Una historia y un examen físico dirigidos; 2- Un adecuada cuantificación del dolor; 3- Una evaluación funcional y emocional; 4- Particularidades del dolor neuropático. A estos cuatro puntos nos vamos a referir de manera sucesiva.
Recomendaciones para la evaluación del dolor en al paciente demente
| 1- | Historia | De trastornos dolorosos, fármacos previos |
| 2- | Examen general | Impotencia funcional, signos inflamatorios, dolor en columna y articulaciones de carga. |
| 3- | Examen neurológico | Causas comunes de dolor neuropático: herpes zoster, neuralgia trigémino, síndrome talámico, polineuropatías dolorosas |
| 4- | Intensidad-1 | Enfermos comunicativos: escalas unidimensionales analógicas (VAS, FPS) |
| 5- | Intensidad-2 | Enfermos no comunicativos: escalas PACSLAC y Doloplus-2 |
| 6- | Repercusión funcional | Conductas motoras, hábitos, relaciones, actividad |
| 7- | Repercusión emocional | Valoración de depresión (aconsejable escala GDS) y ansiedad |
| 8- | Repercusión vegetativa | Apetito, sueño |
| 9- | Respuesta analgésica | Iniciar tratamiento empírico analgésico y comprobar respuesta |
| 10- | Evolución | Individualizar tratamiento y seguimiento de variables previas |
La historia debe incluir los antecedentes de patología dolorosa y la toma de fármacos. La primera, condiciona la respuesta al dolor, con un patrón motor, de conducta o autonómico que suele repetirse en el paciente y que puede ser identificado por los familiares del enfermo demente. La historia farmacológica es también importante: tratamientos analgésicos mantenidos pueden condicionar una cronificación de cuadros dolorosos, tales como los de las cefaleas primarias, sin duda con expresividad diferente en el enfermo demente. De igual modo, los tratamientos farmacológicos analgésicos deben adaptarse a la realidad clínica de estos enfermos, que muy comúnmente sufren pluripatología y están polimedicados con otros fármacos, lo que incrementa el riesgo de interacciones y efectos secundarios.
Tal como hemos comentado más atrás, el mismo dolor es causa de empeoramiento de estos pacientes. Un anciano demente con dolor mostrará cambios en su patrón de conducta, que se mostrará retraída, o impulsiva y agresiva; igualmente, se alterará su expresividad emocional, y las respuestas vegetativas y autonómicas: apetito, sueño, control de esfínteres o ritmo intestinal. Lógicamente, se mostrará con descenso de sus habilidades previas, manipulativas, de navegación espacial o de planificación y ejecución. Si no se tiene en cuenta el dolor como origen potencial de estos cuadros, se buscarán otras causas o se pensará en un deterioro primario de la demencia. Como norma general, debe recordarse que las causas fundamentales de dolor agudo son las traumáticas e inflamatorias, y que el origen más común del dolor crónico lo constituyen la patología musculoesquelética y el dolor neuropático.
Se consideran patologías de alarma (“red flags”), a excluir como prioritarias en el anciano demente con dolor, las siguientes:
- •
El herpes zoster, que puede dar cuadros dolorosos previos a la erupción, pero sobre todo una neuralgia postherpética que se cronifique, en ausencia de lesiones cutáneas.
- •
La arteritis de la temporal, que origina cefalea, dolores en miembros o rigidez y debilidad proximal de los mismos.
- •
Las lesiones traumáticas, que pueden pasar desapercibidas y ser causa de dolor crónico: fracturas costales y de miembros, o traumatismos craneales, origen a su vez de hematomas subdurales crónicos.
- •
El dolor óseo nocturno o de reposo, indicativo de origen tumoral, también inflamatorio o infeccioso, incluso sin fiebre, en ancianos con espondilodiscitis que requieren de sospecha previa para una búsqueda dirigida que permita el diagnóstico.
- •
La isquemia aguda de miembros, a la que están predispuestos estos enfermos, fundamentalmente por arterioesclerosis o fibrilación auricular basal, conocida o no.
El examen físico y neurológico debe hacerse buscando esas posibilidades. No debe olvidarse la búsqueda de signos inflamatorios o traumáticos locales, o la impotencia funcional al movimiento de miembros, al lado de un examen neurológico que tenga muy en cuenta zonas de hiperestesia o debilidad muscular, particularmente las de patrón radicular en miembros.
Antes del siguiente paso, segundo citado en nuestra sistematización y relativo a la cuantificación del dolor, debe tenerse en cuenta que está indicada la administración de analgesia si existen dudas sobre la existencia de dolor como causa de deterioro en la demencia. Si llega a administrarse, se observará mejoría del deterioro cognitivo, dada la reversibilidad del mismo, siempre que sea consecutivo a patología dolorosa72.
Por otra parte, debemos intentar cuantificar el dolor, para lo que se dispone de escalas de aplicación de diferente complejidad, diferenciadas para pacientes con capacidad de comunicación o sin ella, ya mencionadas más atrás. En general, las quejas dolorosas directas pueden expresarse hasta estadios avanzados de la demencia, por lo que las escalas más sencillas y directas, que registran bien la intensidad del dolor, deben intentar aplicarse a todos los enfermos dementes: la escalas analógicas verbales o gráficas (termómetro de dolor VAS, o de gestos faciales –FPS-) son muy breves e informativas, para diagnóstico y para seguimiento. En las fases más avanzadas, las escalas recogen información indirecta indicativa de dolor, incluyendo los gestos, funcionalidad, comportamiento y respuestas autonómicas. Debe recordarse que las escalas más breves sacrifican la sensibilidad para la detección del dolor, en aras de una mayor rapidez de aplicación y capacidad para no diagnosticar como dolor a quién no lo sufre. Y a la inversa, a mayor complejidad de escala, mayor capacidad para detectara dementes con dolor, a expensas de más consumo de tiempo y de menor especificidad. Esta norma es de aplicación general para los tests diagnósticos. En la demencia avanzada y en el ámbito estrictamente neurológico, las escalas de dolor más recomendadas (PACSLAC y Doloplus-2) resultan de especial interés en pacientes hospitalizados con patología dolorosa, tales como fracturas de cadera o escaras.
El siguiente aspecto de la valoración es el de la evaluación funcional y emocional. Con la funcionalidad nos referimos a la repercusión del dolor en aspectos como la interacción social o actividades de vida diaria, también en el comportamiento o en el sueño y apetito, aspectos todos susceptibles de deteriorarse ante dolor agudo o crónico. En el mismo contexto debe situarse la repercusión emocional: el dolor se asocia muy frecuentemente a manifestaciones ansiosas o depresivas, a veces a depresión franca, que puede dominar el cuadro o, a la inversa, estar enmascarada. En dolores refractarios precisa de tratamiento específico, lo que puede mejorar directamente la experiencia dolorosa, al mejorar las posibilidades de adaptación y confrontación del dolor. Si el paciente demente mantiene posibilidades de comunicación, es aconsejable el paso de una escala de depresión sencilla y de fácil aplicabilidad, como la GDS (Escala de depresión geriátrica)73.
Finalmente, el dolor neuropático tiene características específicas relativas a su evaluación y examen físico en este grupo de pacientes. Hay que recordar que en los ancianos existen atrofias musculares, sobre todo distales, o reducción de la sensibilidad profunda distal en piernas, que se consideran fisiológicas, igual que el descenso de la apertura o extensión articular. Conocer estos detalles facilita optimizar el examen neurológico. Han de buscarse alteraciones sensitivas directas, en forma de hipoestesia, o al contrario, de hiperalgesia, especialmente como hiperpatía o alodinia. Existen test que permiten la cuantificación de estos aspectos, tales como el QST74. En el escenario clínico práctico75,76, las causas más comunes de dolor neuropático en el anciano son:
- •
Para el dolor neuropático periférico, la neuralgia posherpética, la neuralgia del trigémino y algunas polineuropatías axonales, sobre todo las de origen diabético o las secundarias a tóxicos (quimioterapia, taxoles).
- •
En el dolor neuropático central, los síndromes dolorosos postinfarto, sobre todo talámicos. Se trata de cuadros diferidos en el tiempo, que respetan la sensibilidad profunda y que pueden ocasionar dolor referido proximal, sobre todo en el hombro, adoptando la forma de pseudohombro doloroso77, para el que deben evitarse las infiltraciones.
El dolor es una manifestación muy común en la demencia, con frecuencia no diagnosticado ni tratado. Ello se debe a que las lesiones específicas de las demencias asientan en las mismas áreas encefálicas que las de las vías dolorosas centrales. En concreto, el cortex prefrontal, el cingular anterior, las áreas perisilvianas, el hipocampo y el hipotálamo son zonas responsables de la dimensión cognitivo-evaluativa, emocional, de memoria y autonómica que constituyen la experiencia dolorosa. Los depósitos y acúmulos degenerativos de la EA, de la DFT y de la EP alteran la integración y expresividad de la sensación dolorosa por destruir sus correspondientes asientos anatómicos. Es destacable que este fenómeno sucede manteniéndose intacta la percepción y umbral del dolor, al estar preservada la vía anatómica espinotalámica lateral y sus conexiones.
Por otra parte, la respuesta placebo, dependiente de expectativas y anatómicamente de activación sobre todo del cortex singular anterior, se encuentra también comprometida en las demencias. Es por ello por lo que la acción de los analgésicos, en la que al efecto puramente farmacocinético se suma la expectativa, es siempre menor y pueden requerirse mayores dosis de las teóricas.
En el escenario clínico práctico, se ha de buscar una mayor sensibilidad para diagnosticar el dolor. Las escalas visuales simples son útiles en pacientes comunicativos. En los que no lo son, la observación de signos indirectos y escalas específicas (PACSLAC y Doloplus-2) permiten detectar y cuantificar el dolor. Dado que este síntoma explica por si solo deterioros de situación cognitiva, está justificado ensayar tratamientos analgésicos si se sospecha que sea la causa de progresividad no explicada de demencia. Existen situaciones de alarma como causa de dolor, tanto neuropático (neuralgia postherpética) como no neuropático (arteritis de la temporal, fracturas de cadera o costales, isquemia aguda de extremidades), que deben conocerse e investigarse en búsquedas dirigidas.