Las enfermedades cerebrovasculares están entre las principales causas de mortalidad y discapacidad en los países desarrollados. El ácido acetilsalicílico (AAS) y el clopidogrel son los tratamientos antiagregantes plaquetarios más utilizados para la profilaxis de nuevos eventos tromboembólicos. Sin embargo, se han observado casos en los que el tratamiento antiagregante no inhibe la actividad plaquetaria, un fenómeno llamado resistencia y que posiblemente puede estar modulado a nivel genético.
DesarrolloTras una búsqueda bibliográfica se realizó una revisión sobre el estado actual del tratamiento antiagregante plaquetario. Se tratan los diferentes tipos de resistencia a la terapia antiagregante, de qué manera se mide, la problemática y limitaciones actuales, así como los factores genéticos que se han asociado a esta resistencia. Principalmente se analizan los estudios genéticos realizados en el campo de la resistencia a AAS y clopidogrel mediante Genome Wide Association.
ConclusionesParece existir una asociación entre diferentes factores genéticos y la resistencia a los fármacos antiagregantes medida mediante la actividad plaquetaria; no obstante, no hay una asociación evidente entre estos factores genéticos y el riesgo de nuevos eventos tromboembólicos.
Cerebrovascular diseases are among the leading causes of death and disability in developed countries. Acetylsalicylic acid (ASA) and clopidogrel are the most widely-used antiplatelet drugs for secondary prevention of recurrent thromboembolic events. However, there have been cases in which antiplatelet drugs did not inhibit platelet activity; this phenomenon is called resistance, and it may be modulated at the genetic level.
DevelopmentFollowing a literature search, we reviewed the current state of antiplatelet therapy and covered the different types of resistance to antiplatelet therapy, how it is measured, current problems and limitations, and any genetic factors that have been associated with resistance. We mainly used the Genome Wide Association Studies in the field of ASA and clopidogrel resistance.
ConclusionsWe observed an association between different genetic factors and antiplatelet drug resistance as measured by platelet activity. However, there is no evident association between these genetic factors and risk of new thromboembolic events.
El ictus o enfermedad cerebrovascular, con 6,2 millones de defunciones en 2008, es la segunda causa de mortalidad en el mundo y la primera causa de discapacidad en los países desarrollados, con una media de 200 nuevos casos por cada 100.000 habitantes al año1.
Tras un primer ictus, el riesgo acumulativo de presentar un nuevo evento vascular (recurrencia) es del 11,1% el primer año, el 26,4% durante los siguientes 5 años y 39,2% a los 10 años2. Por subtipos, el riesgo de recurrencia es mayor en los ictus de origen aterotrombótico y cardioembólico, y menor en el lacunar3. Las plaquetas tienen un papel principal en la formación de trombos, pudiendo ser activadas por varios factores, entre ellos, la serotonina, la epinefrina, la adenosina difosfato (ADP) y el tromboxano A2. Los fármacos antitrombóticos y antiagregantes plaquetarios son uno de los tipos de fármacos utilizados en la prevención secundaria del ictus isquémico para tratar de evitar nuevos episodios vasculares4. El tratamiento antiagregante, sobre todo ácido acetil salicílico (AAS) y clopidogrel, es el más recomendado para la prevención secundaria del ictus isquémico. La excepción es el ictus isquémico de tipo cardioembólico tratado con anticoagulantes siempre que este tipo de pacientes no tengan riesgo de presentar hemorragias3.
A pesar de los claros beneficios demostrados por los tratamientos antiagregantes, la reactividad plaquetaria es variable y los pacientes no responden de manera uniforme a esta terapia. Se ha observado que la reducción del riesgo obtenida con estos fármacos no es la óptima. Por ejemplo, la mortalidad de los pacientes se ve reducida únicamente en un 18%, mientras que la discapacidad se reduce en un 25%. De hecho, entre un 10-20%5 de los pacientes tratados con AAS o clopidogrel experimentan nuevos eventos vasculares. Este fenómeno puede ser debido a una resistencia al medicamento por parte del paciente. Esta resistencia se define como una actividad plaquetaria normal a pesar de un correcto tratamiento antiagregante. Diferentes estrategias se han realizado para mejorar los índices de recurrencia vascular con combinaciones de fármacos, sin los resultados esperados6-8.
En esta revisión comentaremos los estudios genéticos que se han realizado en el campo de la resistencia a antiagregantes y la dificultad y la problemática de relacionar la resistencia medida mediante la actividad plaquetaria con la aparición de nuevos eventos vasculares.
DesarrolloRealizamos una búsqueda bibliográfica en PubMed y Google académico con las palabras clave: «stroke», «aspirin», «clopidogrel», «antiplatelet therapy», «resistance», «genetics» y «pharmacogenomics». Se tuvieron en cuenta solo artículos científicos indexados en revistas científicas; entre ellos, se seleccionaron tanto artículos originales como revisiones, publicados en inglés o español.
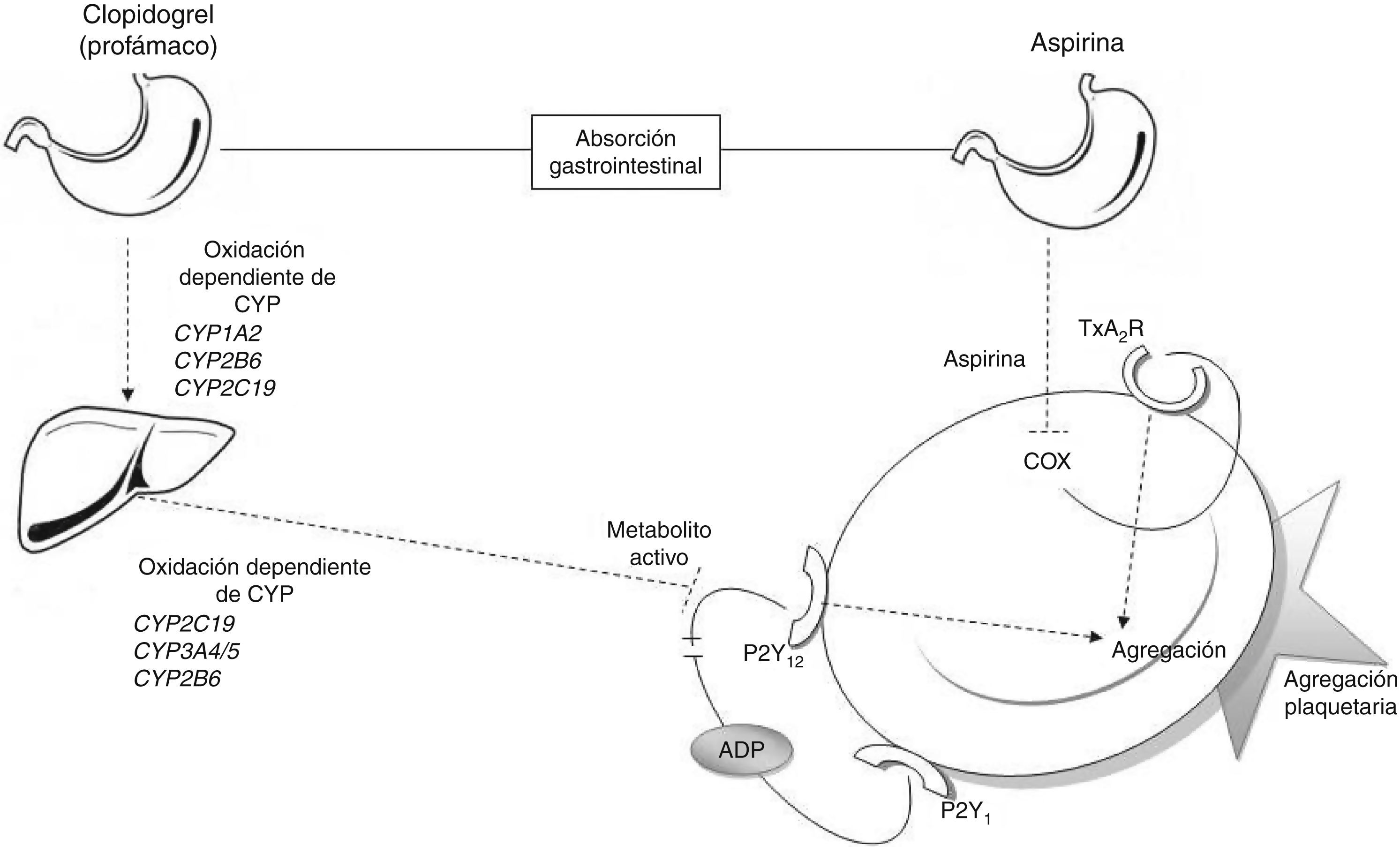
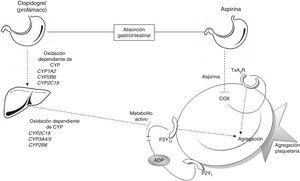
Las vías metabólicas del ácido acetilsalicílico y clopidogrelEl efecto antiagregante del AAS se consigue a través de la inhibición permanente de la enzima ciclooxigenasa (COX)6. La enzima COX tiene 2 isoformas diferentes, COX-1 enzima constitutiva presente en la mayoría las células, y COX-2, que se expresa frente a estímulos inflamatorios. La AAS inhibe de forma irreversible COX-1, bloqueando la conversión del ácido araquidónico a tromboxano A2 (fig. 1); de esta manera, se bloquea el desencadenante principal de la activación plaquetaria6.
Relación entre antiagregantes y agregación plaquetaria. Metabolismo del clopidogrel: el clopidogrel es metabolizado en el hígado mediante 2 etapas de oxidación en las que se ven envueltas diversas encimas del CYP. El metabolito activo inhibe la unión de la adenina disulfato (ADP) al receptor P2Y12 bloqueando la agregación plaquetaria. Metabolismo de la AAS: la AAS es absorbida de forma gastrointestinal, en las plaquetas inhibe a COX y la generación de tromboxano, bloqueando la agregación plaquetaria. ADP: adenosín difosfato; COX: ciclooxigenasa; CYP: citocromo P450; TxA2R: receptor de tromboxano A2.
En cambio, el clopidogrel es un profármaco que necesita ser metabolizado en el hígado para convertirse en un metabolito activo (tiolactona) con actividad antiagregante. Este proceso consta de 2 pasos de oxidación y es mediado por varias enzimas hepáticas del citocromo P450 (CYP) (CYP1A2, CYP2B6, CYP2C19, CYP3A4/5). El efecto antitrombótico del clopidogrel se debe a la unión irreversible de la tiolactona al receptor de ADP (P2Y12) de la superficie plaquetaria7 (fig. 1).
La resistencia a ácido acetilsalicílico y clopidogrelExiste una gran variabilidad en la respuesta al tratamiento antiagregante por parte de los pacientes7,9; esta resistencia puede ser detectada con tests bioquímicos o a nivel clínico debido a la aparición de nuevos eventos vasculares o recurrencias. A pesar de ser conceptos similares, existen diferencias entre ellos. Hablamos de resistencia a los antiagregantes cuando, tras realizar tests bioquímicos funcionales, se comprueba que la agregación plaquetaria no ha sido inhibida por el tratamiento antiagregante. La actividad normal de las plaquetas medida con estos tests funcionales es lo que comúnmente se define como resistencia. Por su parte, se define resistencia clínica o fallo del tratamiento como la ocurrencia de un evento cardiovascular a pesar de una correcta administración y una correcta adherencia al fármaco. No existe una clara asociación entre la resistencia medida por test bioquímico y la aparición de nuevos eventos vasculares o resistencia clínica.
Los test funcionales para el estudio de la resistencia a AAS y clopidogrel se basan en estudios, principalmente cinéticos, de agregación plaquetaria. Existen diversas técnicas agregométricas para determinar la agregación plaquetaria: agregometría óptica, agregometría de impedancia, producción de tromboxano A2, sistema de análisis de función plaquetar (PFA-100), Uletegra RPFA-ASA, sistema de mapeo de plaquetas por tromboelastografía, vasodilatación estimulada por la fosforilación de fosfoproteína o estudio de cambios dependientes de la activación sobre la superficie de las plaquetas9. Desafortunadamente, los resultados obtenidos con estas técnicas no se correlacionan entre ellos, tanto en pacientes tratados con AAS como con clopidogrel9, no existiendo hasta la fecha un consenso sobre cuál es el método bioquímico adecuado para medir la resistencia a antiagregantes.
Dado que después de un ictus aproximadamente un 60% de los pacientes reciben terapia con antiagregantes3,10, es de gran importancia reconocer qué elementos son los causantes de resistencia para actuar en los pacientes resistentes, variando la dosis o realizando un cambio de tratamiento. Por ello, en los últimos años, se han iniciado estudios genéticos con el objetivo de averiguar si existe alguna relación entre el genotipo de los pacientes y la resistencia al tratamiento con antiagregantes.
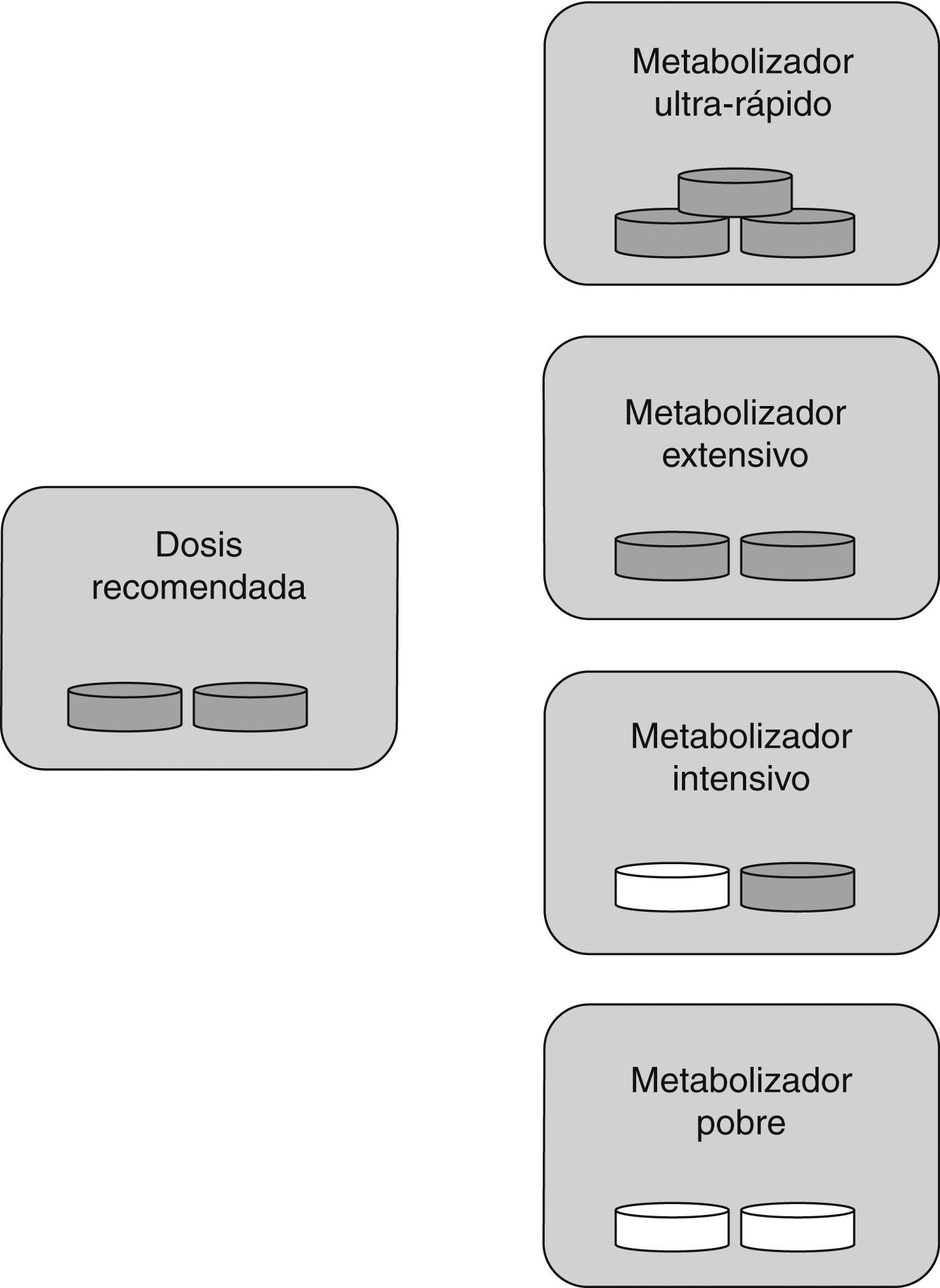
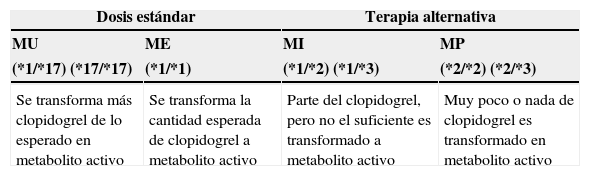
La clasificación de pacientes entre metabolizadores rápidos o lentosTal y como se ha comentado anteriormente, el clopidogrel requiere ser transformado en un metabolito activo mediante las enzimas del CYP, para conseguir el efecto antiplaquetario. Los genes que codifican las enzimas del CYP son polimórficas, con varios alelos que confieren una función alterada11. En función del genotipo CYP2C19, los individuos pueden ser clasificados según su fenotipo, dando lugar a metabolizadores extensivos (ME), intermedios (MI) o pobres (MP) y en el caso del alelo CYP2C19*17 en metabolizadores ultrarrápidos (MU). Ser MU para clopidogrel provoca un incremento en la inhibición plaquetaria y, por tanto, una disminución de la agregación plaquetaria residual (el alelo CYP2C19*17 puede estar asociado a un aumento del riesgo de sangrado). Los ME son aquellos con una inhibición plaquetaria normal y una agregación plaquetaria residual también normal. Para los MI existe una inhibición plaquetaria reducida, un aumento de la agregación plaquetaria residual y posiblemente, un aumento del riesgo de eventos cardiovasculares adversos. Los MP se caracterizan por una inhibición plaquetaria significativamente reducida y, por tanto, posiblemente se deberían asociar con un aumento del riesgo de eventos cardiovasculares adversos12 (tabla 1).
Resultados clínicos indicados según genotipo de CYP2C19
| Dosis estándar | Terapia alternativa | ||
|---|---|---|---|
| MU | ME | MI | MP |
| (*1/*17) (*17/*17) | (*1/*1) | (*1/*2) (*1/*3) | (*2/*2) (*2/*3) |
| Se transforma más clopidogrel de lo esperado en metabolito activo | Se transforma la cantidad esperada de clopidogrel a metabolito activo | Parte del clopidogrel, pero no el suficiente es transformado a metabolito activo | Muy poco o nada de clopidogrel es transformado en metabolito activo |
El gen CYP2C19 es altamente polimórfico, los polimorfismos funcionales más comunes son *2, *3, * y 17, siendo CYP2C19*1 la variante normal. El resultado de la actividad enzimática, según el genotipo, es muy variable, influyendo en la capacidad de un individuo para activar el clopidogrel.
ME: metabolizadores extensivos; MI: metabolizadores intensivos; MP: metabolizadores pobres; MU: metabolizadores ultra-rápidos.
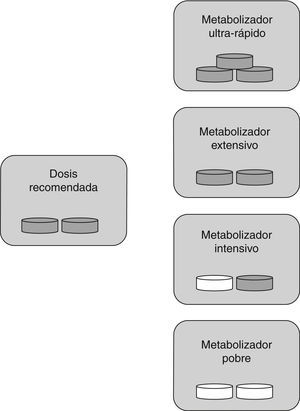
Para la AAS, al tratarse de un fármaco ya activo, la clasificación de los diferentes tipos de metabolizadores es diferente de la que se utiliza para el clopidogrel. En este caso, los MU que tienen una actividad enzimática metabolizadora superior a lo normal, presentan unos niveles plasmáticos de AAS inferiores a lo habitual y, por tanto, la acción de la AAS inhibiendo la agregación plaquetaria es deficiente. Este tipo de pacientes se clasificarían como sujetos con resistencia al tratamiento antiagregante. En los MI y MP la actividad enzimática metabolizadora es inferior a lo esperado, haciendo que el fármaco se acumule en la sangre pudiendo generar toxicidad. Por tanto, solo los ME reciben las dosis adecuadas de medicamento (fig. 2).
Dosis específica de fármaco según tipo de metabolizador para AAS: los metabolizadores ultrarrápidos necesitan más dosis de la habitual (son los sujetos resistentes), los metabolizadores extensivos necesitan la dosis estándar, para los metabolizadores intensivos y pobres es recomendable disminuir la cantidad de fármaco o cambiarlo. Píldora gris: fármaco administrado; píldora blanca: fármaco no administrado.
La farmacogenética es el área de la genética que analiza las variaciones genéticas que pueden modificar la respuesta a un tratamiento farmacológico.
En el área de farmacogenética mediante la aproximación de genes-candidato, se han encontrado polimorfismos relacionados con la resistencia a AAS y clopidogrel. La estrategia de genes candidato se basa en la selección de genes y polimorfismos que, debido a su función, se postula que pueden estar asociados a la patología de estudio. Los polimorfismos son variantes alélicas de una misma población, cada una de las cuales se presenta en más del 1% de la población y que pueden asociarse a características fenotípicas diferentes, como por ejemplo una diferente respuesta a fármacos. La estrategia de estudiar genes candidato es una estrategia sesgada porque se analizan solo un grupo reducido de polimorfismos de unos genes seleccionados; no obstante, ha resultado ser útil para algunas enfermedades y para algunos estudios de farmacogenética. En relación con la resistencia a AAS, diversos estudios han identificado polimorfismos de un solo nucleótido (SNPs) en los genes COX-1, COX-2, GPIa, GPIbα, GPIIIa, GPIV, FXIII, P2Y1, P2Y1213, asociados a la resistencia a AAS. No obstante, ninguno de estos estudios se realizó con tamaños muestrales suficientes o con replicaciones en cohortes independientes para demostrar realmente la asociación de estos genes con la resistencia a AAS.
En el caso de clopidogrel, los primeros estudios que se realizaron mediante la estrategia de gen-candidato encontraron polimorfismos en los genes del CYP, principalmente en la subclase 2C19 (CYP2C19) pero también en CYP2C9, CYP2B6, CYP3A4, CYP3A5 y CYP1A2 asociados a la resistencia a clopidogrel. Otros genes con SNPs que se han relacionado con la resistencia a clopidogrel son el P2RY12, ABCB1 o PON111,14, aunque estos últimos no han sido validados posteriormente.
Genome Wide Association y estudios de resistencia a antiagregantesUna de las herramientas en relación a los estudios genéticos más empleada hoy en día son los Genome Wide Association Studies (GWAS). Los GWAS son habitualmente estudios caso-control a gran escala en los que se analiza un número elevado de polimorfismos, generalmente SNPs (10.000 a 2.000.000 polimorfismos). Con ello se pretende averiguar qué SNPs están asociados a un fenotipo concreto. Estos estudios permiten una aproximación libre de hipótesis previas y no sesgada para el estudio de las enfermedades complejas15.
Gracias a los GWAS se han encontrado genes asociados a diferentes enfermedades complejas que presentaban un componente genético que no se había descubierto hasta ese momento. En el caso del ictus, se han encontrado 2 loci (gen PITX2 y gen ZFHX3) asociados a ictus isquémico de tipo cardioembólico. También se han encontrado SNPs en los genes CDK2MA y CDK2MB del cromosoma 9 (locus 9p21)16 y el gen HDAC9 del cromosoma 7 (locus 7p21.1)17 relacionados con ictus aterotrombótico.
En relación con la resistencia a clopidogrel, se ha realizado un único GWAS en el cual18 se administró clopidogrel durante 7 días a 429 personas sanas de origen amish. La respuesta al tratamiento fue medida por agregometría plaquetaria exvivo. Se observó que la respuesta plaquetaria a clopidogrel tenía un alto componente hereditario (h2 = 0,73; p < 0,001) y se identificaron 13 SNPs en el cromosoma 10 (locus 10q42) que conformaban el cluster CYP2C18, CYP2C9, CYP2C19, CYP2C8, asociados a la disminución de la respuesta a clopidogrel. El polimorfismo rs12777823 fue el que presentó un resultado estadísticamente más significativo (p = 1,5×10–3) en relación con la actividad plaquetaria. El SNP rs12777823 estaba en desequilibrio de ligamento con la variante CYP2C19*2 (r2 = 0,87), uno de los polimorfismos que previamente ya se había encontrado asociado a la resistencia a clopidogrel mediante los estudios con genes-candidato19 (tabla 2). En el estudio de Shuldiner et al.19, la replicación del GWAS se realizó en una nueva cohorte de pacientes. En esta replicación se analizó la variante CYP2C19*C del CYP en desequilibrio de ligamiento con rs12777823, en 227 pacientes sometidos a una intervención coronaria. Los pacientes con la variante de riesgo CYP2C19*C presentaron un mayor número de eventos vasculares durante el primer año después de la intervención coronaria.
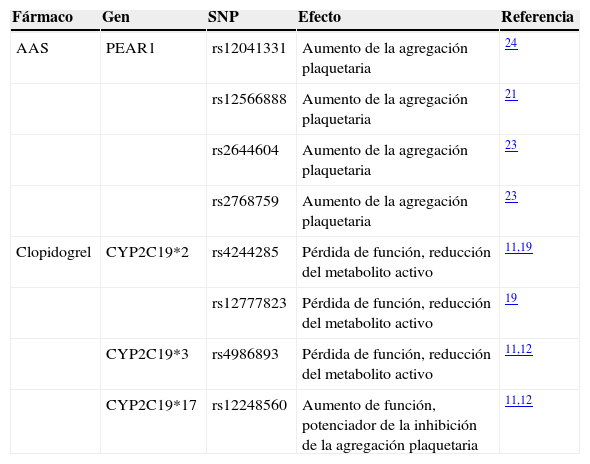
Principales polimorfismos identificados con relación a la agregación plaquetaria
| Fármaco | Gen | SNP | Efecto | Referencia |
|---|---|---|---|---|
| AAS | PEAR1 | rs12041331 | Aumento de la agregación plaquetaria | 24 |
| rs12566888 | Aumento de la agregación plaquetaria | 21 | ||
| rs2644604 | Aumento de la agregación plaquetaria | 23 | ||
| rs2768759 | Aumento de la agregación plaquetaria | 23 | ||
| Clopidogrel | CYP2C19*2 | rs4244285 | Pérdida de función, reducción del metabolito activo | 11,19 |
| rs12777823 | Pérdida de función, reducción del metabolito activo | 19 | ||
| CYP2C19*3 | rs4986893 | Pérdida de función, reducción del metabolito activo | 11,12 | |
| CYP2C19*17 | rs12248560 | Aumento de función, potenciador de la inhibición de la agregación plaquetaria | 11,12 |
Este y otros estudios han provocado que la American Food and Drugs Administration haya recomendado recientemente genotipificar el polimorfismo CYP2C19*17 antes de prescribir clopidogrel20 (tabla 2). Esta recomendación ha generado bastante controversia, puesto que la American Heart Asociation y el American College of Cardiologist defienden que no hay suficiente información para justificar que se hagan ese tipo de estudios de forma rutinaria21. En la última actualización sobre este tema, realizada por el Clinical Pharmacogenetics Implementation Consortium (CPIC), en mayo del 201322, proponen genotipificar el CYP2C19 antes de iniciar el tratamiento antiplaquetario. Esta actuación se recomienda, sobre todo, para pacientes con síndrome coronario agudo sometidos a una intervención coronaria percutánea. Esta recomendación es debida a que el mayor número de acontecimientos recurrentes y potencialmente previsibles se producen al principio del tratamiento, por tanto, mediante la genotipificación de CYP2C19 se adaptaría el tratamiento a las características del paciente evitando nuevas recurrencias.
Respecto a la resistencia a AAS, se ha realizado un único GWAS en 2 cohortes: una formada por 2.753 sujetos pertenecientes al Framingham Heart Study y otra por 1.238 sujetos del Genetic Study of Atherosclerosis Risk tratados con AAS. En este estudio se midió por test bioquímico la resistencia a AAS y se encontraron 7 loci con polimorfismos asociados a la agregación plaquetaria; los resultados con p < 0,05 se replicaron en una cohorte de 840 pacientes del Genetic Study of Atherosclerosis Risk. Entre los genes más interesantes, se encontró PEAR1 (rs12566888, p = 3,4 × 10−12) confirmando resultados previos respecto la asociación de este gen con la resistencia a AAS23 (tabla 2).
PEAR1, o receptor endotelial de la agregación plaquetaria 1, codifica una proteína transmembrana en plaquetas, que es activada al ponerse en contacto con otras plaquetas. En un estudio previo de Herrera-Galeano et al.24 en el que se genotipificaron 10 SNPs del gen PEAR1 en 1.486 individuos sanos, se observó que el polimorfismo rs2768759 se asociaba a una mayor agregación plaquetaria después del tratamiento con AAS (tabla 2).
Más recientemente, Lewis et al.25 realizaron un GWAS en el que también se medía la agregación plaquetaria, en 565 pacientes procedentes del estudio Pharmacogenomics of Anti-Platelet Intervention (PAPI) antes y después del tratamiento con AAS. Los resultados revelaron una fuerte asociación entre SNPs del cromosoma 1q23.1 y la respuesta a AAS. Los hallazgos más significativos fueron genotipificados en 2 nuevas cohortes, una formada por 227 pacientes con intervención coronaria y otra con 1.000 pacientes procedentes del International Verapamil SR/Trandolapril Study (INVEST) subestudio genético (INVEST-GENES). Tras estas replicaciones en cohortes independientes, se observó que el SNP rs12041331 del gen PEAR1 mostraba la mayor asociación (p = 7,66×10–9) con la respuesta a la terapia antiagregante. Estos resultados fueron confirmados por el estudio de Kim et al.26, en el que se realizó la secuenciación exónica de PEAR1 en 104 sujetos con hipo o hiperagregación plaquetaria y se observó que el mismo polimorfismo (rs12041331) tenía la asociación más significativa (p = 4,02×10–4) respecto a la respuesta a la agregación plaquetaria.
La problemática entre la resistencia medida por test bioquímico y la recurrencia vascular o resistencia clínicaA pesar de los esfuerzos dedicados a encontrar los factores genéticos causantes de la resistencia a los fármacos antiagregantes y la recurrencia vascular, no se han obtenido datos del todo esclarecedores. Por el momento, no se ha visto una asociación clara entre la actividad plaquetaria medida por las diferentes técnicas comentadas y la recurrencia vascular27-29 o resistencia clínica. Consecuentemente, los polimorfismos que se han visto asociados con la actividad plaquetaria tampoco presentan una asociación clara con la recurrencia vascular27,29. Por ejemplo, en el subestudio genético del estudio Clopidogrel for High Atherothromen (CHARISMA), en el que se genotipificaron 4.819 pacientes (que habían presentado un ictus o un infarto de miocardio) estables tratados con clopidogrel y se analizó el efecto de los polimorfismos rs11188078 y rs12248560 del alelo CYP2C19*17, finalmente se observó que no afectaban a nuevos eventos isquémicos o de sangrado30.
En un reciente metaanálisis de 32 estudios que incluía el análisis de 42.016 pacientes tratados con clopidogrel con 3.545 eventos cardiovasculares, siendo uno de los estudios más importantes en el campo de la farmacogénetica de la resistencia a clopidogrel, se observó que los alelos de CYP2C19 se asociaron a recurrencia vascular; no obstante, cuando los análisis se restringían a estudios con al menos 200 sujetos con recurrencia vascular la asociación de los polimorfismos de CYP2C19 no era significativa, concluyendo que no existía una clara evidencia entre la asociación de CYP2C19 con nuevos eventos cardiovasculares30.
Existen varias explicaciones para justificar esta falta de asociación que debería encontrarse entre actividad plaquetaria (resistencia) y recurrencia vascular y entre polimorfismos asociados a actividad plaquetaria y recurrencia vascular.
Por un lado, están los problemas de seguimiento a los pacientes incluidos en los estudios. Uno de los problemas más habituales es la falta de adherencia al tratamiento por parte del paciente, pero también se han relatado casos en los que existe un cambio en la medicación antiagregante durante el seguimiento, creando en ambos casos sesgos en el estudio y, por tanto, reduciendo el poder estadístico del estudio. Estos sesgos pueden causar que los SNPs asociados a la resistencia a los fármacos antiagregantes no se asocien a la aparición de nuevos eventos vasculares.
A nivel genético, existen diversas posibilidades que expliquen esta falta de asociación entre los polimorfismos asociados a la resistencia a antiagregantes y su falta de asociación a la recurrencia vascular. Por ejemplo, que aunque la actividad plaquetaria influya en la recurrencia vascular, esta sea una asociación de un grado mucho menor a lo esperado, por tanto, los polimorfismos asociados a la actividad plaquetaria no se asociarán significativamente a la recurrencia vascular.
Para resolver estas dudas se necesitan, primero, estudios con mayores tamaños poblacionales, con un mejor diseño y con un mejor seguimiento y, segundo, estudios realizados directamente en pacientes con resistencia clínica o fallo en el tratamiento, es decir, realizar estudios directamente en pacientes que a pesar del correcto tratamiento antiagregante han presentado una recurrencia vascular.
Por otro lado, nos podemos encontrar con que otros factores genéticos, no analizados hasta el momento, estén relacionados con la resistencia medida mediante la actividad plaquetaria y con la aparición de recurrencia vascular. Puede ser el caso de variaciones raras, factores epigenéticos o variaciones en el número de copias que por problemas como un reducido tamaño muestral o por no utilizar las herramientas adecuadas no hayan sido detectadas.
FuturoLos resultados obtenidos a partir de los estudios realizados hasta el momento no han aportado toda la información esperada para determinar el componente genético asociado a la resistencia a antiagregantes, así pues son necesarios nuevos estudios y nuevas aproximaciones en este campo. En los próximos años probablemente tendremos estudios epigenéticos y de secuenciación de nueva generación en el campo de la farmacogenética de la resistencia a antiagregantes31.
La secuenciación de nueva generación supone una gran mejora, mucho más rápida y económica, respecto a la secuenciación tradicional por Sanger30. Estas técnicas se están empezando a utilizar para confirmar loci encontrados mediante GWAS y para identificar variaciones estructurales en el genoma. También los análisis epigenéticos permitirán estudiar los mecanismos de expresión genética independientes de la secuencia de ADN en pacientes resistentes a los fármacos antiagregantes32.
El desarrollo de herramientas bioinformáticas para analizar las enormes cantidades de información generada por estas técnicas también será crucial para un rápido avance en este campo32. Otro punto crucial para el estudio de la farmacogenética en enfermedades complejas pasa por la creación de consorcios con el fin disponer de mayores tamaños muestrales y conseguir fenotipos mejor definidos. Con ello no solo se aumentará el poder estadístico de los estudios, también se podrán detectar nuevos SNPs no encontrados hasta la fecha. Algunos de los consorcios que están trabajando en este campo son: International Clopidogrel Pharmacogenomics Consortium con el objetivo de incrementar el número de sujetos y realizar estudios genéticos en sujetos con un mejor seguimiento clínico, el CPIC (http://www.pharmgkb.org/page/cpic),el International Stroke Genetics Consortium (http://www.strokegenetics.org/) y el Consorcio Español de Genética del Ictus (GeneStroke) (http://www.genestroke.com/) son otros ejemplos de grandes consorcios que estudian la resistencia al tratamiento antiagregante. En el marco de la cantidad de datos que se genera con estas nuevas técnicas, también toman gran importancia los repositorios online y diferentes bases de datos. Algunas de las más importantes en este área son «pharmGKB» (http://www.pharmgkb.org/), donde se puede encontrar información sobre el impacto de las variaciones genéticas en respuesta a los fármacos, dbSNP (http://www.ncbi.nlm.nih.gov/SNP/), un archivo público sobre las variaciones genéticas en diferentes especies, o dbGaP (http://www.ncbi.nlm.nih.gov/gap), base de datos con información sobre fenotipos y genotipos. Para los estudios GWAS es de gran utilidad Genetic Association Database (http://geneticassociationdb.nih.gov/), donde se pueden encontrar datos de GWAS publicados en diferentes estudios.
ConclusionesAumentar nuestro conocimiento sobre el funcionamiento de los fármacos en la prevención de nuevos eventos vasculares promete tener un impacto global en la promoción de la salud. En el campo de la genética será necesario la utilización de las nuevas técnicas genómicas puestas a nuestro alcance y la organización de estudios dentro de consorcios internacionales para mejorar el fenotipo de los pacientes y el tamaño muestral de los estudios con el objetivo de generar grandes proyectos en este campo que puedan aclarar las dudas existentes hasta el momento. Por el momento, los estudios realizados no han demostrado una asociación definitiva entre los polimorfismos asociados a la resistencia clínica y la recurrencia vascular. Ensayos clínicos prospectivos serían necesarios para demostrar claramente esta asociación y utilizar el genotipificado de estos genes como una herramienta estándar en la práctica clínica. No obstante, en el caso de la resistencia a clopidogrel, en los estudios realizados, aunque no son definitivos, sí que parece existir una relación entre determinados polimorfismos y la actividad plaquetaria. Por tanto, los pacientes susceptibles a tener una resistencia al tratamiento debido a la presencia de polimorfismos de riesgo en la familia del CYP450 podrían ser tratados con otro antiagregante concretamente con un tratamiento con AAS y clopidogrel en el caso del ictus.
FinanciaciónEste estudio fue financiado por una subvención del Instituto Carlos III, del gobierno español, programa Miguel Servet (CP12/03298). IF-C está financiado con el apoyo del programa Miguel Servet (CP12/03298) del Ministerio de Sanidad Español (Instituto de Salud Carlos III).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El laboratorio de Genética y Farmacogenómica del Ictus forma parte del Consorcio Internacional de Genética del Ictus y coordina el Consorcio Español de Genética del Ictus (www.genestroke.com).