Aunque la arteritis de células gigantes o temporal representa un 5-10% de las neuropatías ópticas isquémicas y es la arteritis más frecuente en las personas mayores de 60 años, aún no existen pautas de tratamiento establecidas.
DesarrolloEl tratamiento con glucocorticoides continúa siendo el de elección y debe iniciarse sin demora en aras de prevenir complicaciones neurológicas o sistémicas. Sin embargo, podemos recurrir a tratamiento intravenoso en casos con pérdida de visión u otros síntomas neurológicos. En casos refractarios a glucocorticoides o en los que deseamos reducir la dosis por la aparición de efectos adversos, el metotrexato y los agentes bloqueadores del factor de necrosis tumoral podrían estar indicados de manera individualizada. De otros tratamientos —como azatioprina, dapsona, ciclosporina, ciclofosfamida o imitinib— no hay evidencias suficientes para recomendarlos. En pacientes con factores de riesgo vascular se debe valorar la antiagregación con ácido acetil salicílico. El tratamiento quirúrgico se debe valorar en casos seleccionados con síntomas debidos a estenosis arteriales.
ConclusionesEl tratamiento de elección de la arteritis de la temporal continúan siendo los corticoides; sin embargo, dada la variabilidad clínica de la enfermedad y las características especiales del grupo de paciente, habitualmente mayores y con enfermedades sistémicas, consideramos fundamental el tratamiento individualizado según unas pautas terapéuticas coherentes. Actualmente no sólo disponemos de tratamiento con corticoides orales, sino que en nuestros pacientes podremos elegir el uso de megadosis intravenosas, antiagregar, en casos refractarios recurrir a metotrexato o inhibidores del factor de necrosis tumoral o incluso valorar aproximaciones intervencionistas.
Although giant cell or temporal arteritis represents 5-10% of ischaemic optic neuropathies and is the most common arteritis in people over 60 years old. Currently there is no established treatment with oral glucocorticoids available.
BackgroundGlucocorticoid (GC) is still the treatment of choice but has to be started without delay in order to prevent neurological or systemic complications. However, we can resort to intravenous treatment in cases where there is loss of sight or other neurological symptoms. In cases refractory to GC or in those in whom we wish to decrease the dose due to adverse effects, individualised treatment with methotrexate or TNF blockers could be indicated. There is insufficient evidence to recommend other treatments, such as azathioprine, dapsone, cyclosporine, cyclophosphamide or imitinib. In patients with vascular risk factors, anti-platelet therapy with ASA should be assessed. Surgical treatment should be considered in selected cases with symptoms due to arterial stenosis.
ConclusionsThe corticoids continue to be the treatment of choice in temporal arteritis, however, given the clinical variability of the disease and the special characteristics of this group of patients, usually elderly and with systemic diseases, we believe that individualised treatment with coherent therapeutic guidelines are essential. Currently there is not only treatment with oral glucocorticoids available, although in our patients we can choose to use intravenous mega-doses, anti-platelet treatment, resort to methotrexate or TNF inhibitors in refractory cases, or even consider surgical approaches.
Aunque la arteritis de células gigantes o temporal (AT) representa un 5-10% de las neuropatías ópticas isquémicas y es la arteritis más frecuente en las personas mayores de 60 años, aún no existen pautas de tratamiento establecidas1. Aunque el uso de corticoides y su eficacia es conocido, hay dudas sobre cómo comenzar el tratamiento, cuánto tiempo mantenerlo, qué hacer en los casos refractarios o cuando aparecen efectos secundarios2–4. Se está promoviendo la búsqueda de regímenes de GC menos tóxicos o nuevos tratamientos ahorradores de GC que podrían abrir nuevos campos terapéuticos, pero las evidencias no son claras. En el presente artículo realizamos una revisión de la literatura sobre los distintos tratamientos empleados y proponemos unas pautas terapéuticas para los pacientes con arteritis de la temporal.
Tratamiento médicoGlucocorticoidesA pesar de que el tratamiento con GC ha resultado de elección durante más de medio siglo, actualmente no existe un protocolo estandarizado, consensuado y universalmente aceptado sobre la dosis inicial que emplear, la duración del tratamiento o la pauta de descenso que seguir posteriormente. No se conoce con certeza la conveniencia de utilizar una pauta en días alternos con el fin de minimizar la toxicidad propia de los GC o de cuándo debe considerarse que una AT es resistente al tratamiento con GC5.
Los GC siguen siendo el tratamiento de primera línea por su capacidad para conseguir un rápido alivio de los síntomas, tanto neurológicos como sistémicos, y disminuir la mortalidad aguda de las vasculitis6. Los GC resultan de probada eficacia a la hora de disminuir las complicaciones visuales de la AT7,8. Aunque hay poca evidencia sobre la evolución de las complicaciones visuales en la época previa al uso de esteroides, en los últimos 50 años la frecuencia de ceguera habría descendido desde el 60% hasta un 7-25%9–11. Casi todas las series coinciden en que las complicaciones visuales ocurren habitualmente con anterioridad al inicio del tratamiento con GC, lo que ha llevado a la mayoría de los clínicos a pautarlos sin esperar al resultado de la biopsia. La probabilidad de pérdida visual disminuye a un 1% tras la instauración del tratamiento con GC12.
Respalda la precocidad de inicio del tratamiento con GC ante la sospecha clínica el hecho de que la recuperación de la visión es poco frecuente4–15. La gran mayoría de los pacientes con pérdida visual permanente han sido objeto de un retraso diagnóstico y terapéutico15–17. En pacientes que presenten clínica visual, se recomienda iniciar de inmediato tratamiento con bolos de metilprednisolona (1 g/día vía intravenosa durante 3 días consecutivos), aunque no se ha demostrado más eficaz que el tratamiento vía oral.
Con respecto a la dosis inicial de GC, no existen ensayos controlados al respecto, dado que, por razones obvias, no sería ético realizarlos. La dosis inicial habitual de prednisona es 40-60 mg/día o equivalente18. Aunque algunos autores argumentan que con dosis menores (20 mg/día) o mayores (80 mg/día) se puede obtener resultados al menos con igual o superior éxito terapéutico, no hay estudios que sustenten esta práctica19–21.
La utilización de megadosis iniciales quedaría únicamente justificada en un plan de “inducción de la remisión” para después alcanzar un plan de “mantenimiento de la remisión” con dosis bajas de GC o una menor duración del tratamiento22. El objetivo es conseguir una mayor tasa de remisión persistente tras la suspensión de los GC. Sin embargo, la pérdida de visión tardía (registrada tras 2 o más semanas desde el inicio de los GC) es excepcional ya sea utilizando megadosis o dosis más convencionales23–25.
En cuanto a la pauta de descenso de los GC, la dosis inicial debe mantenerse un mínimo de 2 semanas y un máximo de 4. Los pacientes con AT presentan mejoría sintomática precoz, incluso en 24-48 h tras el inicio del tratamiento, que se acompaña también rápidamente de un descenso de los reactantes de fase aguda26. En casos de que persista la clínica, debería replantearse el diagnóstico de AT aunque exista poca literatura que estudie el descenso de GC de forma prospectiva. En estudios retrospectivos, que no utilizaron un plan estandarizado de reducción, se ha observado que la mayoría de los pacientes precisan tratamiento con GC al menos durante 2 años, y muchos incluso más de 4 años. El índice de recaídas, sobre todo en los primeros 2 años, es muy variable según las series, entre el 26 y el 90%26. Lo ideal es que el descenso de GC se realice adecuándolo a la actividad de la enfermedad, siempre de forma individualizada y basada en parámetros tanto clínicos como analíticos. Se debe tener en cuenta que en ocasiones los reactantes de fase aguda pueden ser normales al inicio de la enfermedad27. En la práctica clínica habitual y en función de la clínica y de los reactantes de fase aguda, se suele reducir los GC un 10-20% cada 2 semanas.
Aunque la pauta de reducción de GC en días alternos se ha intentado en la AT, actualmente no es recomedable porque no se ha podido demostrar una reducción en la incidencia de osteoporosis inducida por GC, y en un buen número de pacientes se produce un empeoramiento de los síntomas el día “off de GC”27–29.
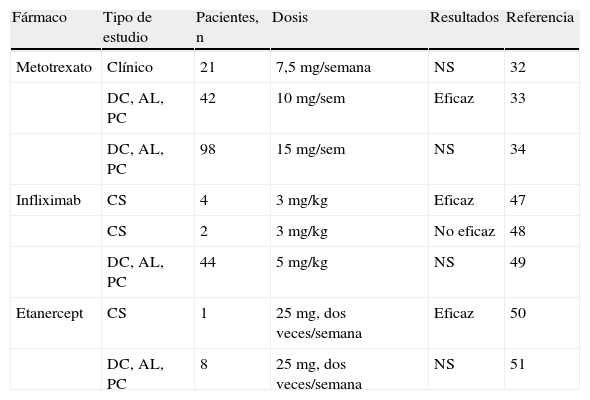
Inmunosupresores ahorradores de esteroides (tabla 1)MetotrexatoLa utilización de metotrexato (MTX) en el tratamiento de la AT sigue siendo controvertido. Su uso se ha basado en que el MTX ha mostrado su potencial efecto terapéutico en otras vasculitis sistémicas como la enfermedad de Wegener30,31 o incluso el Takayasu2,3 que comparte hallazgos tanto histológicos como fisiopatológicos con la AT.
Estudios en el tratamiento con inmunomoduladores de la arteritis de la temporal
| Fármaco | Tipo de estudio | Pacientes, n | Dosis | Resultados | Referencia |
| Metotrexato | Clínico | 21 | 7,5 mg/semana | NS | 32 |
| DC, AL, PC | 42 | 10 mg/sem | Eficaz | 33 | |
| DC, AL, PC | 98 | 15 mg/sem | NS | 34 | |
| Infliximab | CS | 4 | 3 mg/kg | Eficaz | 47 |
| CS | 2 | 3 mg/kg | No eficaz | 48 | |
| DC, AL, PC | 44 | 5 mg/kg | NS | 49 | |
| Etanercept | CS | 1 | 25mg, dos veces/semana | Eficaz | 50 |
| DC, AL, PC | 8 | 25mg, dos veces/semana | NS | 51 |
AL: aleatorizado; CS: casos aislados; DC: doble ciego; NS: no significativo; PC: frente a placebo.
Existen tres estudios no comparables entre sí32–34 que muestran que el MTX disminuye el número de recidivas experimentadas por los pacientes con AT, así como su exposición total a GC35,36. Sin embargo, no avalan la utilización sistemática del MTX como ahorrador de GC en AT o para el control de la actividad de la enfermedad.
Dado que la AT presenta un curso prolongado, con requerimientos de GC que varían enormemente de un sujeto a otro35, los estudios futuros probablemente deberían centrarse en el análisis de subgrupos mayores, sobre todo los que presentan requerimientos de GC más altos como tratamiento crónico de mantenimiento. Los estudios deberían tener una duración mayor, de al menos 3 años, dado que muy pocos pacientes se encuentran sin tratamiento con GC a esas alturas. La definición de remisión de la AT debería establecerse de forma estandarizada, y ese debería ser el objetivo final del tratamiento, aunque se precisara una dosis mínima de GC.
Otros inmunosupresores ahorradores de GCAunque se ha ensayado con distintos fármacos inmunosupresores como posibles ahorradores de GC en la AT, la mayoría de los trabajos son muy pequeños y documentan una considerable toxicidad del fármaco37–39. La dapsona en dosis de 50-100 mg/día ha mostrado una leve eficacia para reducir la dosis de GC en AT37–39. Con azatioprina (AZA), en un ensayo doble ciego aleatorizado con placebo se experimentó toxicidad que requirió su retirada en un tercio de los pacientes, y su efecto ahorrador sólo pudo demostrarse de forma tardía40. La experiencia con ciclosporina y ciclofosfamida es escasa y su uso queda firmemente desaconsejado en este grupo poblacional por su elevado perfil de toxicidad41,42.
Fármacos biológicos (tabla 1)Bloqueo del factor de necrosis tumoralLa plausibilidad biológica de obtener un beneficio terapéutico en AT mediante la terapia bloqueadora del factor de necrosis tumoral (TNF) se basa en la presencia de inflamación granulomatosa en la arteria temporal43,44. Estos hallazgos son superponibles a los observados en otras afecciones en que el bloqueo selectivo del TNF produce resultados óptimos45. Además, en estudios inmunohistoquímicos de arterias inflamadas por AT se ha constatado un aumento en la expresión del TNF43,44. Además se ha observado que la alta producción de TNF en la AT se relaciona con la necesidad de uso más prolongado de GC y un curso recidivante de la vasculitis46.
Los primeros resultados obtenidos con estos agentes biológicos se desprenden de pequeñas series o de casos clínicos aislados. El infliximab (un anticuerpo monoclonal anti-TNF) se ha utilizado en series de pacientes con resultados aceptables47,48. Sin embargo, estudios aleatorizados a doble ciego no han mostrado eficacia superior al placebo en reducir la proporción de pacientes que sufrieron recidivas ni reducir el porcentaje de pacientes en que se pudo disminuir los GC49. El etanercept pudo reducir la dosis de GC a días alternos en un paciente, aunque no hay resultados significativos que defiendan el uso de este fármaco50,51.
Los agentes bloqueadores del TNF podrían estar indicados de manera individualizada en pacientes resistentes al tratamiento con GC, mientras que su eficacia sería menor en las AT no recidivantes, en que el TNF parece tener un papel fisiopatológico menos preponderante46.
Antiagregación con ácido acetilsalicílicoLa morbimortalidad de la AT aumenta considerablente por las complicaciones isquémicas cerebrales51. Además, pueden aparecer incluso cuando el tratamiento con GC se haya iniciado precozmente. La utilización del ácido acetilsalicílico (AAS) ha mostrado una reducción en la mortalidad cardiovascular y en los accidentes cerebrovasculares agudos52–54. El AAS parece tener un efecto antiinflamatorio en los vasos sanguíneos inflamados mediante la inhibición del interferón (IFN) gamma, una importante citocina proinflamatoria de los linfocitos T, claves en la fisiopatología de la AT55. Esta citocina se presenta en concentraciones elevadas en las arterias afectas de AT55,56. Este efecto inhibitorio del AAS no se ha podido reproducir con el uso de indometacina, un antiinflamatorio no esteroideo, de tal forma que la inhibición de la ciclooxigenasa podría descartarse en este modelo experimental.
Los GC suprimen muy eficazmente los síntomas sistémicos de la AT y los reactantes de fase aguda. No obstante, el infiltrado inflamatorio de la pared del vaso persiste casi de forma inalterada a pesar del tratamiento prolongado con GC.
En estudios experimentales se ha mostrado la capacidad del AAS para inhibir la producción de IFNγ (vital en la producción del infiltrado inflamatorio en la pared del vaso), mientras que la dexametasona, un potente GC, actuaría inhibiendo la transcripción del NF–κB y las citocinas derivadas de su expresión, interleucina (IL) 1, 2 y 6, también aumentadas en la AT55. Estos hallazgos implicarían un posible efecto sinérgico en la combinación de ambos agentes terapéuticos.
A pesar de que el evento desencadenante de la pérdida visual en la AT está más relacionado con la hiperplasia intimal que con un evento trombótico, la inhibición de la agregación plaquetaria y la disminución en la producción de IFNγ podrían reducir el riesgo trombótico. Además, en los estudios se ha observado una reducción sustancial de la aparición de eventos isquémicos cerebrales en pacientes con AT que toman AAS51,57.
Aunque son necesarios nuevos estudios prospectivos que valoren el riesgo/beneficio del AAS en pacientes con AT, parece razonable una individualización terapéutica y considerar la antiagregación en pacientes con otros factores de riesgo.
ImatinibEl imatinib actúa inhibiendo las acciones proinflamatorias del factor de crecimiento de las plaquetas (PDGF). En la AT se observa un remodelado vascular con hiperplasia intimal como respuesta a la inflamación. Estos cambios murales pueden producir la oclusión del lumen vascular e isquemia tisular58. Los fenómenos isquémicos ocurren más frecuentemente en los territorios cuya irrigación depende de la carótida o de ramas de la arteria vertebral59. Parece que el PDGF resulta determinante en el desarrollo de hiperplasia intimal en los pacientes con AT60–62. Actualmente no hay estudios que avalen el uso del imitinib en pacientes con AT.
Tratamiento quirúrgicoLa revascularización de las arterias de las extremidades mediante angioplastia, colocación de un stent o cirugía derivativa con bypass raramente es necesaria en la AT debido a la abundante circulación colateral que aparece en esta vasculitis. Las colaterales, en la mayoría de las ocasiones, son suficientes para mantener la viabilidad de los tejidos más distales, a pesar de que algunos pacientes antes del inicio del tratamiento médico presentan claudicación muscular y los pulsos de las arterias largas puedan estar ausentes. Con el tratamiento médico se consigue la supresión del proceso inflamatorio, y con la aparición de circulación colateral la mayoría de los síntomas mejora y permite a los pacientes hacer una vida normal. En un porcentaje pequeño se puede recurrir a técnicas de revascularización, aunque en estos casos es frecuente la reestenosis63–65.
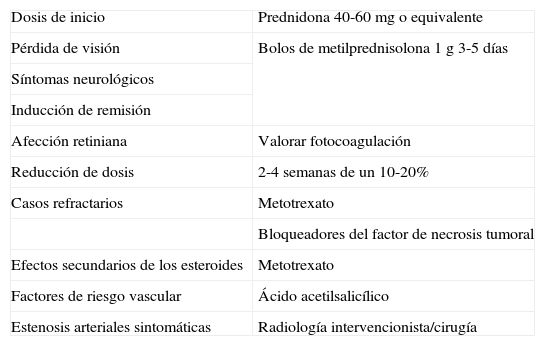
Recomendaciones (tabla 2)La AT es una afección frecuente que puede dejar importantes secuelas al paciente. Por este motivo se debe realizar una pauta terapéutica adecuada y estructurada para reducir al mínimo la posibilidad de complicaciones. Los corticoides continúan siendo el tratamiento de elección. La dosis inicial más razonable es de 40-60 mg/día de prednisona o dosis equivalentes de otros esteroides. Sin embargo, en casos con pérdida de visión u otros síntomas neurológicos, el uso de megadosis de esteroides con bolos intravenosos de metilprednisolona (1 g/día durante 3 días consecutivos) podría ser útil para inducir la remisión.
Recomendaciones propuestas en el tratamiento de la arteritis de la temporal
| Dosis de inicio | Prednidona 40-60mg o equivalente |
| Pérdida de visión | Bolos de metilprednisolona 1 g 3-5 días |
| Síntomas neurológicos | |
| Inducción de remisión | |
| Afección retiniana | Valorar fotocoagulación |
| Reducción de dosis | 2-4 semanas de un 10-20% |
| Casos refractarios | Metotrexato |
| Bloqueadores del factor de necrosis tumoral | |
| Efectos secundarios de los esteroides | Metotrexato |
| Factores de riesgo vascular | Ácido acetilsalicílico |
| Estenosis arteriales sintomáticas | Radiología intervencionista/cirugía |
En cuanto al seguimiento, mantendremos la dosis inicial de 2 a 4 semanas para después reducir la dosis de manera individualizada en función de la clínica y los reactantes de fase aguda. No parece útil realizarla mediante una pauta en días alternos.
En casos refractarios a esteroides o cuando se desee reducir la dosis por la aparición de efectos adversos, el MTX es una opción terapéutica que considerar. Con otros inmunosupresores como azatioprina, dapsona, ciclosporina o ciclofosfamida, no hay evidencias suficientes para recomendar su uso y se debería valorar de manera individualizada. Tampoco hay evidencias que avalen el uso del imitinib en pacientes con AT. Los agentes bloqueadores del TNF podrían estar indicados de manera individualizada en pacientes resistentes al tratamiento con GC. En pacientes con factores de riesgo vascular, valoraremos la antiagregación con AAS. El tratamiento quirúrgico se debe valorar en casos seleccionados con síntomas debidos a estenosis arteriales.
ConclusionesEl tratamiento de elección de la AT continúa siendo los corticoides; sin embargo, dada la variabilidad clínica de la enfermedad y las características especiales del grupo de pacientes, habitualmente mayores y con enfermedades sistémicas, consideramos fundamental el tratamiento individualizado según unas pautas terapéuticas coherentes. Actualmente no sólo disponemos de tratamiento con corticoides orales, sino que en nuestros pacientes podremos elegir el uso de megadosis intravenosas, antiagregar, en casos refractarios recurrir a MTX o inhibidores del TNF o incluso valorar aproximaciones intervencionistas.