La encefalopatía etilmalónica (EE) es una enfermedad excepcional por defecto recesivo del gen ETHE1, de curso progresivo en el lactante, caracterizado por retraso psicomotor, hipotonía y singularmente daño microvascular generalizado. Es constante el retraso pondero-estatural con diarrea y disfagia. El deterioro neurológico se acelera tras una enfermedad infecciosa intercurrente, no superando habitualmente la primera década de vida1,2.
El diagnóstico se sospecha por hallazgos clínicos y analíticos compatibles. Es frecuente encontrar elevación de ácido láctico, acilcarnitinas C4-C5 y tiosulfato en sangre, así como del ácido etilmalónico en orina. La confirmación diagnóstica es habitualmente genética3,4. El tratamiento actualmente es sintomático5.
Presentamos los hallazgos clínicos, bioquímicos, radiológicos y genéticos de un nuevo paciente afecto de EE, diagnosticado durante una descompensación infecciosa y hacemos un repaso actualizado de esta rara entidad y su manejo.
Niño varón de 1,3 años, sin antecedentes familiares ni perinatales de interés, con retraso del desarrollo psicomotor, ligera involución del lenguaje con pérdida de las tres palabras aprendidas, hipotonía y fallo de medro desde los 10 meses. Asociaba fragilidad capilar manifestada en forma de petequias en extremidades.
Ingresa por descompensación aguda en el contexto de fiebre y diarrea, con acidosis metabólica (pH: 7,21, pCO2: 14 mmHg, HCO3: 8,8 mmol/L) hiperlactacidemia (3,8 mmol/L), hiperglucemia (glucosa: 264 mg/dL) y cetonemia (3,4 mmol/L), precisando traslado a Cuidados Intensivos para su estabilización. Ya en planta, su exploración evidencia peso 7,4 kg (< p1, - 3,2 DE), talla 72 cm (< p1, -3,24 DE), perímetro craneal 45,5 cm (p12, -1,18 DE), fenotipo con dolicocefalia, frente prominente, retrognatia, orejas de implantación límite y boca pequeña con labios finos. Mostraba petequias de predominio en antebrazos, pliegue poplíteo y antecubital. Presentaba buena interacción, con escaso lenguaje (dos a tres bisílabos dudosamente referenciales), seguimiento visual adecuado, asimiento bimanual, hipotonía global marcada, sedestación con apoyo, no bipedestación ni deambulación. En prono no consigue cuadrupedia, hiperreflexia generalizada, clonus inagotable y Babinski bilateral.
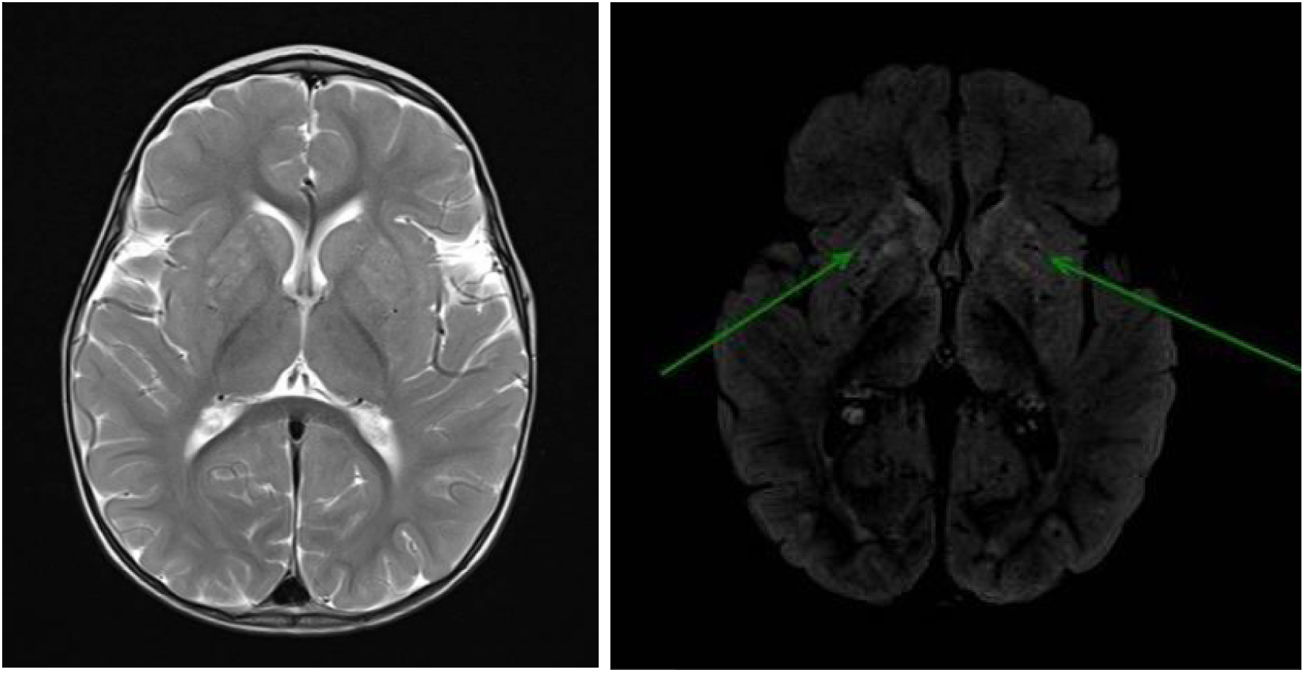
La RM cerebral muestra alteración de señal de putamen y cabeza de caudado de forma simétrica (fig. 1).
Resonancia magnética nuclear cerebral: alteración de señal de putamen y cabeza de caudado de forma bilateral, lesiones hiperintensas en secuencias T2 (izquierda) y FLAIR (derecha: flechas). No se observa afectación de núcleos pálidos ni cápsula interna. No se evidencia pérdida de volumen parenquimatoso supra ni infratentorial.
En el estudio metabólico de aminoácidos, acilcarnitinas en sangre y ácidos orgánicos en orina de 24 h aparece excreción elevada de ácido etilmalónico. El panel genético dirigido reveló la mutación homocigota patogénica del gen ETHE1:c.488G>A(p.Arg163Gln), con ambos padres portadores asintomáticos de la mutación.
Se inició tratamiento con biotina, ubiquinona, vitamina E, riboflavina, tiamina y L-carnitina ante la sospecha de enfermedad mitocondrial, y posteriormente metronidazol y N-acetilcisteína. A los dos meses del ingreso, se evidencia notable mejoría tanto a nivel nutricional como del desarrollo psicomotor. Se mantiene tratamiento con dieta baja en proteínas, ubiquinona, riboflavina, L-carnitina, metronidazol y N-acetilcisteína que ha estabilizado al paciente, si bien mantiene fallo de medro y retraso del desarrollo de predominio en habilidades motoras. Con 2,5 años de vida deambula con ayuda de una mano y dice palabras sueltas sin frases, aunque con buena interacción con su entorno.
La genética de la EE fue descrita por primera vez en Italia en 2004 1. El gen ETHE1 del cromosoma 19 codifica una metalo-β-lactamasa de la vía mitocondrial, necesaria para el catabolismo del hidrógeno-sulfuro (H2S). El defecto produce acumulación del H2S y derivados (tiosulfato) en diferentes líquidos y tejidos e induce daño directo en las membranas celulares, inhibe la citocromo-C-oxidasa (COX) y la acil-COA-deshidrogenasa de cadena corta. Provoca elevación de láctico, etilmalónico y acilcarnitinas C4-C51,5,6. Se han identificado diversas mutaciones, siendo la mayoría de origen mediterráneo o árabe2,6 con variabilidad intrafamiliar4,7,8. Las manifestaciones mucocutáneas características surgen por toxicidad microvascular e incluyen petequias recidivantes, cutis marmorata, sufusión hemorrágica mucosa y/o acrocianosis ortostática de las extremidades distales1,8. También se ha descrito hidronefrosis, criptorquidia y anomalías cardíacas7.
Las alteraciones en la RM cerebral son lesiones irregulares hiperintensas y realzadas a nivel de los ganglios de la base7,9, como en nuestro caso, semejantes al síndrome de Leigh. Otras anomalías descritas incluyen lesiones hiperintensas a nivel tronco-encefálico, atrofia cortical, leucoencefalopatía difusa y malformaciones congénitas como cordón medular anclado y malformación de Chiari2.
Para el diagnóstico se recomienda realizar la secuenciación del gen. En el caso de que no se encuentren variantes patogénicas, o solo se encuentre en un alelo, se recomienda un análisis de deleción/duplicación dirigido al gen3,10.
El tratamiento debe garantizar un soporte nutricional adecuado2. Parece beneficioso el tratamiento con riboflavina, L-carnitina y coenzima Q1011 como en nuestro paciente. También una dieta restringida en aminoácidos sulfurados mejora la clínica y los marcadores bioquímicos5. El uso combinado de metronidazol/N-acetilcisteína ha demostrado controlar la sobrecarga de H2S12,13, para reducir la carga bacteriana productora de sulfuro y captar el H2S, respectivamente. Ocasionalmente requieren terapia de reemplazo renal14.
El trasplante hepático parece una opción terapéutica9 y la terapia génica por vectores adenoasociados, está actualmente en desarrollo15.
Como comentarios finales, cabe decir que el fenotipo asociado con la mutación ETHE1:c.488G>A (p.Arg163Gln) se comporta como una enfermedad mitocondrial con fragilidad capilar asociada y fallo de medro, con buena respuesta al tratamiento de estimulación mitocondrial, antioxidantes y descontaminación intestinal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.