Los anticuerpos IgG-NMO se han demostrado sensibles y específicos para el diagnóstico de neuromielitis óptica (NMO) y han permitido ampliar el espectro clínico a formas limitadas como neuritis óptica (NO) o mielitis longitudinalmente extensas (MLE).
ObjetivoEvaluar la sensibilidad y la especificidad de nuestra técnica y describir las características de los pacientes para los que se solicita dicha determinación.
MétodosLos anticuerpos IgG-NMO se analizaron mediante inmunohistoquímica y se confirmaron sobre células HEK transfectadas con acuaporina 4. La información clínica se obtuvo mediante un cuestionario rellenado por el neurólogo remitente de la muestra.
ResultadosDesde noviembre de 2005 a septiembre de 2008 se analizaron 580 muestras de 518 pacientes. Se obtuvo información de 358 (68%) pacientes. El seguimiento en los 33 casos positivos fue del 100%. De los 43 pacientes diagnosticados de NMO por los criterios de 2006, 28 (65%) eran positivos; la sensibilidad fue del 62,5% si se aplicaban estos criterios eliminando el resultado de IgG-NMO y del 57% aplicando los criterios de 1999, que tampoco incluyen los IgG-NMO. Se detectaron IgG-NMO en 3 (13%) de las MLE recurrentes y 2 (4%) de las NO recurrentes. No se detectaron IgG-NMO en el resto de los pacientes evaluados (96 finalmente diagnosticados de esclerosis múltiple; 80 mielitis; 28 NO no recurrentes; 33 con otros diagnósticos).
ConclusionesEn este estudio no seleccionado y tan amplio, no se han detectado falsos positivos. Los casos positivos se asocian mayoritariamente con NMO y sólo en un pequeño porcentaje con NO o MLE recurrente.
The description of a highly sensitive and specific biomarker for neuromyelitis optica (NMO-IgG/aquaporin-4 antibody) extended the clinical spectrum of NMO to limited forms such as optic neuritis (ON) and longitudinally extensive myelitis (LEM).
ObjectiveTo asses the sensitivity and specificity of our assay, and to describe the clinical characteristics of the patients who were tested for NMO-IgG.
MethodsNMO-IgG was analysed by immunohistochemistry and confirmed by assay on HEK cells transfected with aquaporin-4. The clinical information was obtained from forms filled in by the referring neurologists.
ResultsA total of 580 samples from 518 patients were analysed from November 2005 to September 2008. Clinical information was available from 358 (68%) patients. All 33 (100%) positive cases were followed up. Twenty-eight of the 43 (65%) patients diagnosed with NMO by the revised criteria of 2006 were positive; the sensitivity was 62.5% when applying the same criteria, but discounting the criterion of NMO-IgG status, or 57% when applying the criteria of 1999. NMO-IgG was detected in 3 (13%) of the recurrent LEM and 2 (4%) of the recurrent ON. NMO-IgG was not detected in the remaining patients (96 with a final diagnosis of multiple sclerosis; 80 with myelitis; 28 with non-recurrent ON; and 33 other diagnosis).
ConclusionsNo false positive cases were found in this large and non-selected study. NMO-IgG positive cases were mostly associated with NMO, and only in a low percentage with recurrent ON or LEM.
La neuromielitis óptica (NMO) es una enfermedad inflamatoria desmielinizante, en general grave, que afecta de forma predominante al nervio óptico y la médula espinal1. El descubrimiento de un marcador serológico específico2,3, los anticuerpos IgG-NMO o antiacuaporina 4, ha permitido: a) ampliar el espectro clínico a formas parciales o limitadas de la enfermedad como neuritis óptica (NO) recurrente o mielitis longitudinalmente extensa (MLE)1,2,4–6; b) proponer nuevos criterios diagnósticos en los que se admite la existencia de manifestaciones clínicas o por resonancia magnética (RM) fuera del nervio óptico o la médula7,8, y c) confirmar que se trata de una enfermedad con una etiopatogenia diferente de la de la esclerosis múltiple9–11.
La prevalencia de la enfermedad no se conoce bien, aunque en poblaciones caucásicas se considera una enfermedad rara, con una tasa inferior al 1% de los casos de enfermedades desmielinizantes1. Dependiendo de la técnica utilizada en el análisis de los IgG-NMO y los criterios diagnósticos aplicados, se ha descrito que hasta un 10-46% de los pacientes con NMO son seronegativos y que los falsos positivos pueden llegar hasta el 10%12,13. La disponibilidad de una técnica puede hacer que aumente el número de pacientes en los que se sospecha la enfermedad, lo que puede llevar a que se diagnostiquen más casos, pero también a que se incremente el número de falsos positivos inherentes a la técnica diagnóstica.
En nuestro laboratorio se inició la determinación de los IgG-NMO en noviembre de 2005. El objetivo de este trabajo es evaluar la sensibilidad y la especificidad en nuestro laboratorio y describir las características de los pacientes para los que se solicitó esta determinación.
Pacientes y métodosSe revisó la base de datos de muestras remitidas al Laboratorio de Neuroinmunología del Hospital Clínic de Barcelona para la determinación de IgG-NMO entre noviembre de 2005 y junio de 2008. Los datos clínicos se recogieron mediante una encuesta remitida por los neurólogos solicitantes a través de una plantilla establecida o por entrevista telefónica, en la que, además de variables demográficas, se describían los ítems incluidos en los criterios diagnósticos de NMO de 199914, el número y el tipo de episodios, las enfermedades autoinmunitarias concomitantes, los tratamientos realizados, la puntuación en la escala ampliada de discapacidad de Kurtzke (EDSS)15 en el último seguimiento y el diagnóstico. El diagnóstico definitivo de NMO se estableció aplicando los criterios revisados de 20067; los pacientes con mielitis aguda transversa y RM medular con lesión ≥ 3 cuerpos vertebrales fueron clasificados como MLE; el diagnóstico de esclerosis múltiple (EM) se estableció siguiendo los criterios de McDonald16 y el de NO y otros diagnósticos, con base en el diagnóstico final de los médicos remitentes.
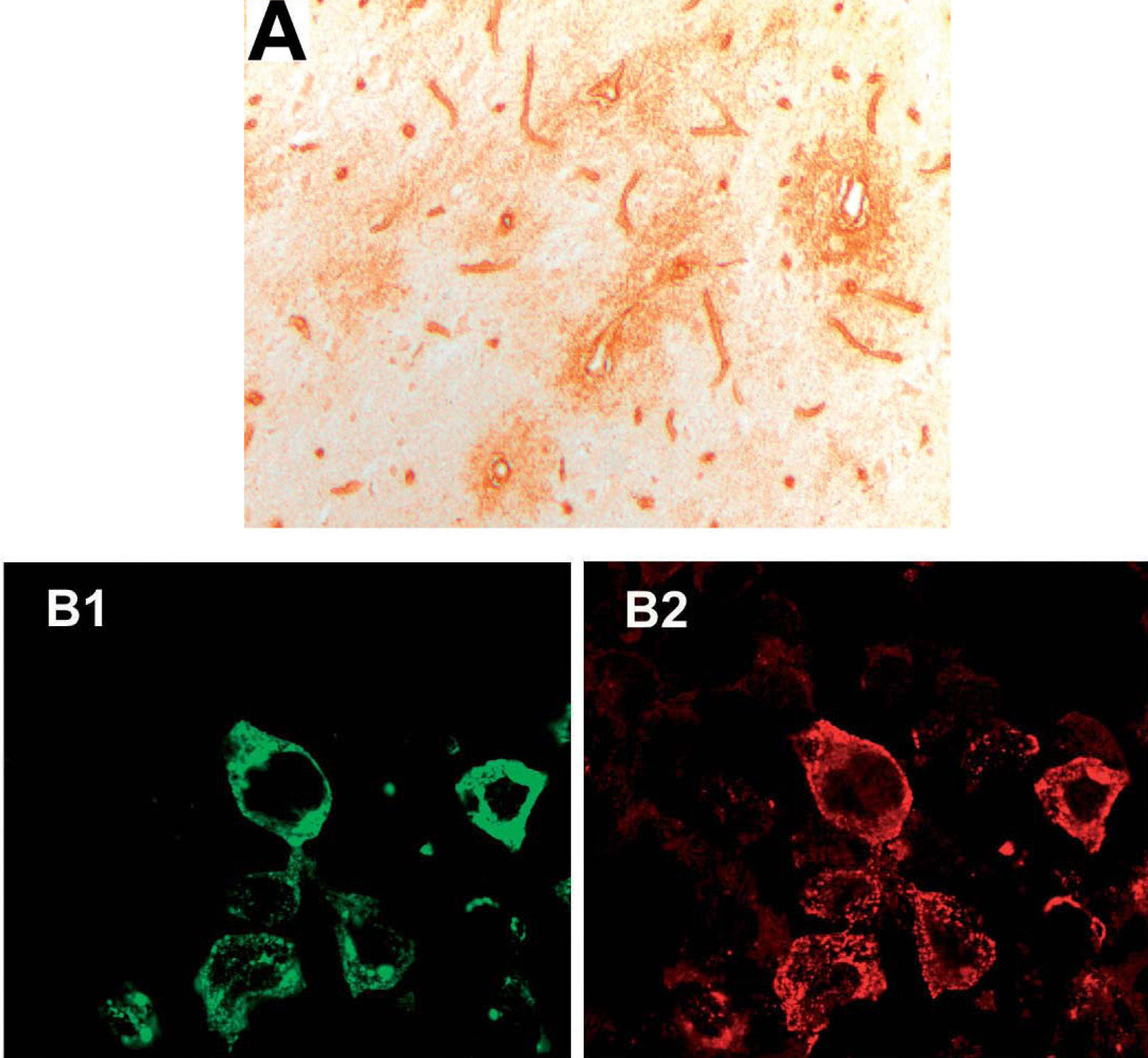
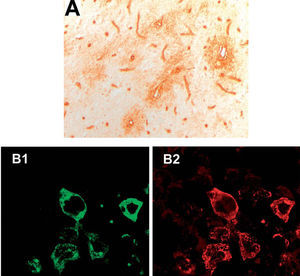
Los IgG-NMO se determinaron mediante inmunohistoquímica utilizando secciones congeladas de hipocampo de rata y una técnica de avidina-biotina peroxidasa (dilución del suero a 1:500), tal como se ha descrito previamente8,17. Todos los casos positivos se confirmaron mediante inmunohistoquímica sobre células HEK transfectadas con acuaporina 4 (AQP4). Brevemente, células HEK293T crecidas a una confluencia del 70% se transfectaron con el gen de la AQP4, clonado en el vector pEGFP-C1 (BD Biosciences Clontech). Para ello se usó Lipofectamine 2000 (Invitrogen) siguiendo las instrucciones del fabricante; concretamente, se combinaron 2μl de Lipofectamine 2000 con 0,8μg de ADN en cada pocillo de placa P24. Tras 40h de transfección, las células se fijaron con el 4% de paraformaldehído en PBS y se incubaron secuencialmente con el suero del paciente y un anticuerpo secundario apropiado (fig. 1).
A: inmunohistoquímica convencional; se puede observar el patrón de inmunorreactividad característica de los IgG-NMO que marcan los microvasos de la sustancia blanca del hipocampo de rata. B: células HEK transfectadas con el gen de la acuaporina 4, clonado en el vector pEGFP-C1 (fluorescencia verde) (B1), y suero de un paciente con IgG-NMO positivo por inmunohistoquímica convencional (anticuerpo secundario fluorescente rojo) (B2).
Las variables cualitativas fueron comparadas mediante el test de la χ2 o el de Fisher, y para las variables cuantitativas se usaron el test de la t de Student o el de la U de Mann-Whitney, según las condiciones de aplicación. Se consideró estadísticamente significativo un valor de p < 0,05 (significación bilateral). El análisis se realizó mediante el paquete estadístico SPSS versión 16.0.
ResultadosEn el periodo descrito se analizaron 580 muestras correspondientes a 518 pacientes. Se obtuvo información de 358 (68%) pacientes. El seguimiento fue del 100% en los 33 casos positivos. Todos los casos positivos por inmunohistoquímica convencional fueron confirmados mediante el estudio con células HEK transfectadas.
Cuarenta y tres pacientes fueron diagnosticados de NMO, 103 de mielitis (59 MLE), 77 de NO, 96 de esclerosis múltiple (EM) y 33 de otros diagnósticos. Se detectó IgG-NMO en 28 (65%) de las NMO, 3 (13%) de las MLE recurrentes y 2 (4%) de las NO recurrentes. Los IgG-NMO fueron negativos en el resto de los pacientes analizados mediante inmunohistoquímica convencional.
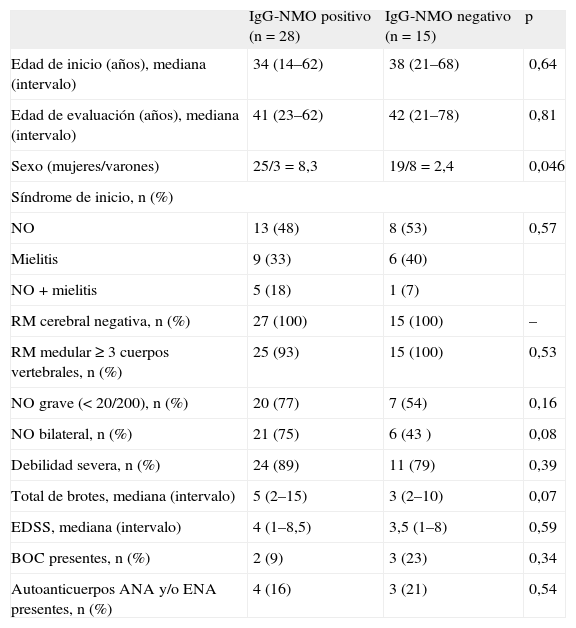
En la tabla 1 se muestran las características de los pacientes con NMO en función del resultado de IgG-NMO. La única diferencia significativa fue el predominio de mujeres en el grupo seropositivo. Si se aplicaban los criterios revisados de 20067 pero eliminando el criterio de IgG-NMO, la sensibilidad de la técnica era del 62,5% (intervalo de confianza [IC] del 95%, 47%-78%), y si se aplicaban los criterios antiguos de 199914, que tampoco incluyen los IgG-NMO, del 57% (IC del 95%, 43%-71%).
Características demográficas y clínicas de los pacientes con neuromielitis óptica en función de los IgG-NMO
| IgG-NMO positivo (n = 28) | IgG-NMO negativo (n = 15) | p | |
| Edad de inicio (años), mediana (intervalo) | 34 (14–62) | 38 (21–68) | 0,64 |
| Edad de evaluación (años), mediana (intervalo) | 41 (23–62) | 42 (21–78) | 0,81 |
| Sexo (mujeres/varones) | 25/3 = 8,3 | 19/8 = 2,4 | 0,046 |
| Síndrome de inicio, n (%) | |||
| NO | 13 (48) | 8 (53) | 0,57 |
| Mielitis | 9 (33) | 6 (40) | |
| NO + mielitis | 5 (18) | 1 (7) | |
| RM cerebral negativa, n (%) | 27 (100) | 15 (100) | – |
| RM medular ≥ 3 cuerpos vertebrales, n (%) | 25 (93) | 15 (100) | 0,53 |
| NO grave (< 20/200), n (%) | 20 (77) | 7 (54) | 0,16 |
| NO bilateral, n (%) | 21 (75) | 6 (43 ) | 0,08 |
| Debilidad severa, n (%) | 24 (89) | 11 (79) | 0,39 |
| Total de brotes, mediana (intervalo) | 5 (2–15) | 3 (2–10) | 0,07 |
| EDSS, mediana (intervalo) | 4 (1–8,5) | 3,5 (1–8) | 0,59 |
| BOC presentes, n (%) | 2 (9) | 3 (23) | 0,34 |
| Autoanticuerpos ANA y/o ENA presentes, n (%) | 4 (16) | 3 (21) | 0,54 |
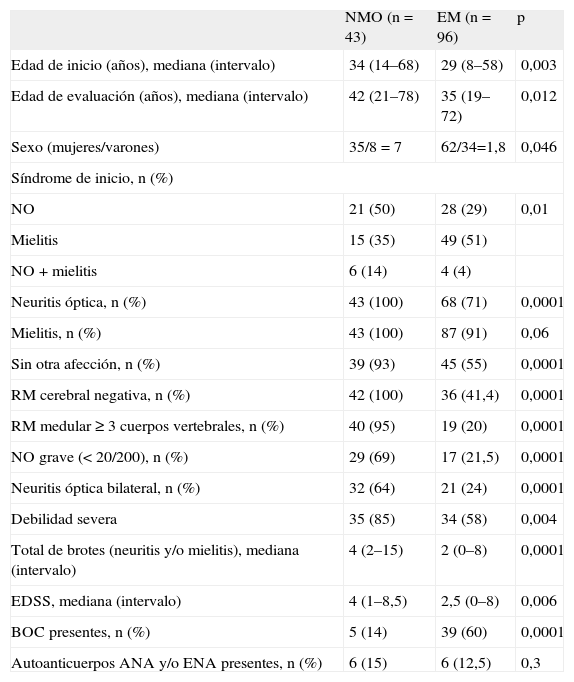
Como cabía esperar, la mayoría de los pacientes para los que se solicitó la determinación de IgG-NMO acabaron siendo diagnosticados de EM. Como grupo, los pacientes con EM eran significativamente diferentes de los de NMO en todas las variables analizadas. Así, la edad de inicio de la enfermedad era menor, las manifestaciones clínicas graves (NO o debilidad severa) eran menos frecuentes, había menos frecuencia de lesiones extensas en la RM medular (≥ 3 cuerpos vertebrales) y una media de brotes inferior, pero era más frecuente la presencia de bandas oligoclonales en el LCR. Por contra, no se encontraron diferencias significativas en la EDSS (tabla 2).
Características demográficas y clínicas de los pacientes diagnosticados de neuromielitis óptica y esclerosis múltiple
| NMO (n = 43) | EM (n = 96) | p | |
| Edad de inicio (años), mediana (intervalo) | 34 (14–68) | 29 (8–58) | 0,003 |
| Edad de evaluación (años), mediana (intervalo) | 42 (21–78) | 35 (19–72) | 0,012 |
| Sexo (mujeres/varones) | 35/8 = 7 | 62/34=1,8 | 0,046 |
| Síndrome de inicio, n (%) | |||
| NO | 21 (50) | 28 (29) | 0,01 |
| Mielitis | 15 (35) | 49 (51) | |
| NO + mielitis | 6 (14) | 4 (4) | |
| Neuritis óptica, n (%) | 43 (100) | 68 (71) | 0,0001 |
| Mielitis, n (%) | 43 (100) | 87 (91) | 0,06 |
| Sin otra afección, n (%) | 39 (93) | 45 (55) | 0,0001 |
| RM cerebral negativa, n (%) | 42 (100) | 36 (41,4) | 0,0001 |
| RM medular ≥ 3 cuerpos vertebrales, n (%) | 40 (95) | 19 (20) | 0,0001 |
| NO grave (< 20/200), n (%) | 29 (69) | 17 (21,5) | 0,0001 |
| Neuritis óptica bilateral, n (%) | 32 (64) | 21 (24) | 0,0001 |
| Debilidad severa | 35 (85) | 34 (58) | 0,004 |
| Total de brotes (neuritis y/o mielitis), mediana (intervalo) | 4 (2–15) | 2 (0–8) | 0,0001 |
| EDSS, mediana (intervalo) | 4 (1–8,5) | 2,5 (0–8) | 0,006 |
| BOC presentes, n (%) | 5 (14) | 39 (60) | 0,0001 |
| Autoanticuerpos ANA y/o ENA presentes, n (%) | 6 (15) | 6 (12,5) | 0,3 |
De las 103 mielitis, 59 (57%) eran MLE, de las que 23 (39%) habían presentado alguna recurrencia. Las características de los pacientes con mielitis en función de si habían presentado recurrencias o no se exponen en la tabla 3. Como se puede observar, no hubo diferencias significativas entre ambos grupos. El resto de las mielitis (44) eran de pacientes con mielitis parciales, de las que 29 (66%) habían presentado recurrencias (datos no mostrados).
Características demográficas y clínicas de los pacientes diagnosticados de mielitis longitudinalmente extensa
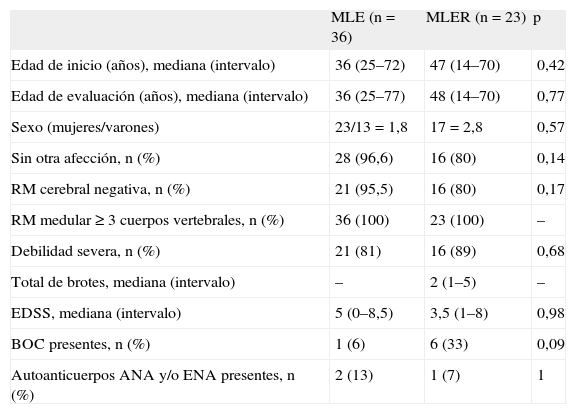
| MLE (n = 36) | MLER (n = 23) | p | |
| Edad de inicio (años), mediana (intervalo) | 36 (25–72) | 47 (14–70) | 0,42 |
| Edad de evaluación (años), mediana (intervalo) | 36 (25–77) | 48 (14–70) | 0,77 |
| Sexo (mujeres/varones) | 23/13 = 1,8 | 17 = 2,8 | 0,57 |
| Sin otra afección, n (%) | 28 (96,6) | 16 (80) | 0,14 |
| RM cerebral negativa, n (%) | 21 (95,5) | 16 (80) | 0,17 |
| RM medular ≥ 3 cuerpos vertebrales, n (%) | 36 (100) | 23 (100) | – |
| Debilidad severa, n (%) | 21 (81) | 16 (89) | 0,68 |
| Total de brotes, mediana (intervalo) | – | 2 (1–5) | – |
| EDSS, mediana (intervalo) | 5 (0–8,5) | 3,5 (1–8) | 0,98 |
| BOC presentes, n (%) | 1 (6) | 6 (33) | 0,09 |
| Autoanticuerpos ANA y/o ENA presentes, n (%) | 2 (13) | 1 (7) | 1 |
De las 77 NO, 49 (64%) eran recurrentes. Las características de los pacientes se exponen en la tabla 4. En comparación con los pacientes con NO monofásica, los pacientes con NO recurrentes eran significativamente más jóvenes al inicio de la enfermedad, presentaban mayor frecuencia de NO bilateral y tendencia a mayor frecuencia de RM cerebral negativa o no diagnóstica de EM.
Características demográficas y clínicas de los pacientes diagnosticados de neuritis óptica
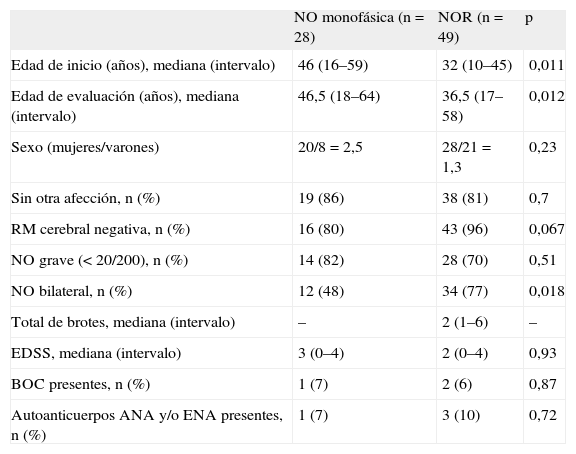
| NO monofásica (n = 28) | NOR (n = 49) | p | |
| Edad de inicio (años), mediana (intervalo) | 46 (16–59) | 32 (10–45) | 0,011 |
| Edad de evaluación (años), mediana (intervalo) | 46,5 (18–64) | 36,5 (17–58) | 0,012 |
| Sexo (mujeres/varones) | 20/8 = 2,5 | 28/21 = 1,3 | 0,23 |
| Sin otra afección, n (%) | 19 (86) | 38 (81) | 0,7 |
| RM cerebral negativa, n (%) | 16 (80) | 43 (96) | 0,067 |
| NO grave (< 20/200), n (%) | 14 (82) | 28 (70) | 0,51 |
| NO bilateral, n (%) | 12 (48) | 34 (77) | 0,018 |
| Total de brotes, mediana (intervalo) | – | 2 (1–6) | – |
| EDSS, mediana (intervalo) | 3 (0–4) | 2 (0–4) | 0,93 |
| BOC presentes, n (%) | 1 (7) | 2 (6) | 0,87 |
| Autoanticuerpos ANA y/o ENA presentes, n (%) | 1 (7) | 3 (10) | 0,72 |
El bajo número de pacientes con IgG-NMO positivos y MLE (3) o NO (2) impidió la comparación estadística con los pacientes seronegativos.
En otros diagnósticos se incluyó a pacientes con encefalomielitis aguda diseminada, encefalitis de Bickerstaff, mielitis necrohemorrágica, tumor medular, siringomielia, mielopatía progresiva, carcinomatosis meníngea, neuropatía óptica tóxica, neuropatía/retinopatía diabética, neuropatía óptica bilateral progresiva, NO de origen isquémico y otros no especificados.
Tres pacientes seropositivos fueron analizados tras recambio plasmático inmediato. En 2 de ellos el análisis fue negativo. Sólo uno de éstos fue analizado de nuevo en relación con un nuevo brote, con resultado positivo. Nueve pacientes seropositivos fueron analizados en más de una ocasión (mediana, 2; intervalo, 2–6), sin que se encontraran cambios en el resultado. El número de pacientes seronegativos que fueron analizados más de una vez fue muy bajo, y en la mayoría de los casos no se dispuso de información clínica. También fue raro disponer de muestras apareadas de suero y líquido cefalorraquídeo (LCR), y sólo en un caso el suero fue positivo mientras que el LCR fue negativo.
DiscusiónÉste es el estudio no seleccionado más amplio descrito en la literatura, en el que se ha analizado la presencia de anticuerpos IgG-NMO en pacientes con sospecha de NMO o de síndromes clínicos relacionados. El resultado más relevante del estudio es la ausencia de falsos positivos con la técnica utilizada. Conocer este dato es importante, puesto que un resultado positivo nos puede dar la seguridad de que se trata de una NMO o una enfermedad de su espectro clínico, y este hecho nos facilita tomar una decisión terapéutica que en muchas ocasiones no está exenta de riesgo.
El estudio confirma que la EM es la enfermedad que con mayor frecuencia plantea un diagnóstico diferencial con la NMO1,2,8. Si bien como grupo ambas enfermedades son significativamente diferentes en parámetros demográficos, clínicos, radiológicos e inmunológicos, es lógico que se plantee este diagnóstico diferencial, dado que cerca de la mitad de los pacientes con EM de esta serie no presentaban manifestaciones fuera del nervio óptico y de la médula, un 40% tenía una RM cerebral normal o no diagnóstica y hasta un 20% mostraba una lesión extensa en la RM medular. Teniendo en cuenta el pronóstico diferente en una y otra enfermedad y que la terapia estándar en la EM es inmunomoduladora y en la NMO es inmunodepresora1, no es de extrañar que se solicite la determinación de los IgG-NMO en pacientes que acaban finalmente siendo diagnosticados de EM.
La frecuencia de detección de IgG-NMO (57-65%) en nuestro estudio según el criterio diagnóstico de NMO utilizado está dentro del intervalo descrito en otros estudios (54-73%) que analizaron muestras de menor tamaño (mediana, 25; intervalo, 11–45)12,13. En un estudio previo, demostramos que nuestra técnica de inmunohistoquímica era igual de sensible que la técnica original de inmunofluorescencia8. En el estudio actual, las muestras de los pacientes con NMO seronegativas fueron reanalizadas a menor dilución (1:100) sin que se detectaran nuevos casos positivos. Estudios recientes han demostrado que la técnica de inmunohistoquímica sobre células HEK transfectadas con AQP4 es más sensible que la técnica convencional18,19. Así, en uno de los estudios el porcentaje de detección en pacientes que cumplían los criterios revisados de NMO de 2006 pasó del 58 al 80%18. En nuestro laboratorio hemos empezado a estandarizar esta técnica, y hemos confirmado el resultado de todas las muestras positivas por inmunohistoquímica convencional mediante aquélla. Nuestro objetivo inmediato será comprobar si con dicha técnica somos capaces de incrementar la sensibilidad sin que se vea afectada la especificidad.
Por otra parte, las características de los pacientes con NMO de esta serie son similares a las de los de otras series publicadas1,7,13. Así, la NMO es entre 7 y 9 veces más prevalente en mujeres que en varones y la media de la edad de inicio está en la década de la treintena, un promedio de unos 5 años superior que en la EM. La RM cerebral al inicio es normal o no diagnóstica de EM, y la RM medular muestra lesiones de más de 3 cuerpos vertebrales en más del 95% de los casos, mientras que la presencia de bandas oligoclonales de IgG en el LCR es infrecuente (14-20%). El único dato que llama la atención respecto a una serie norteamericana es nuestro bajo porcentaje de autoanticuerpos no específicos de órgano, básicamente ANA y/o ENA (el 15 frente al 50%)7. Finalmente, cabe destacar que, al igual que en la serie francesa13 y en nuestro estudio previo, en el que se incluyó a pacientes italianos8, no hemos visto diferencias significativas entre los pacientes en función de la presencia o ausencia de IgG-NMO.
El estudio actual confirma que los IgG-NMO también pueden estar presentes en pacientes con MLE y NO aisladas pero, al igual que en otras publicaciones, sólo asociado a las formas recurrentes. Sin embargo, el porcentaje de detección en nuestro estudio (el 13 y el 4%, respectivamente) ha sido bajo. En series de MLE en las que el número de pacientes evaluados es menor (mediana, 13; intervalo, 6-29) la positividad decrita oscila entre el 38 y el 100%2,4,13,18,20. Sin embargo, llama la atención en estos estudios que el número de pacientes incluidos con NMO al menos duplica al de MLE, al contrario de lo que sucede en el presente trabajo, lo que indica una posible selección de la muestra de análisis. En cualquier caso, la ausencia de datos clínicos en esos estudios impide saber si nuestros pacientes son diferentes o no. En el caso de NO, dos estudios con 24 y 34 pacientes encuentran una positividad del 25 y el 20% respectivamente5,6. En ambos trabajos lo que destaca es que los pacientes seropositivos presentan un mayor número de brotes (media, 4) y mayor frecuencia de episodios graves (100%) que los pacientes de la presente serie (el 2 y el 70%, respectivamente).
Finalmente, debemos reconocer las limitaciones de este estudio, que por su naturaleza pueden haber influido en la interpretación de los resultados. Por ejemplo, sólo se obtuvo seguimiento del 68% de los pacientes, y esto puede influir en la sensibilidad de nuestra técnica para el diagnóstico de NMO. Sin embargo, este hecho no afecta a la especificidad, pues el seguimiento se obtuvo en el 100% de los casos positivos. El estudio se debe considerar transversal, pues en pocos casos se ha hecho un seguimiento evolutivo que pudiera haber cambiado el diagnóstico inicial, y en muchos casos el cuestionario se recibió una vez realizado el análisis, lo que puede haber influido en el diagnóstico final. Tampoco se ha hecho una evaluación centralizada de pruebas como la RM, en la que el número y las características de las lesiones tienen gran valor diagnóstico para las entidades que nos ocupan, o que permita determinar si la calidad técnica de la RM utilizada ha sido adecuada para definir el resultado recogido en la encuesta.
En conclusión, en este estudio amplio y no seleccionado de pacientes con sospecha de NMO o enfermedades relacionadas no se han detectado falsos positivos. Son necesarios más estudios colaborativos diseñados para responder a las preguntas para las que el presente estudio no ha podido dar respuesta. Por ejemplo, si el resultado del análisis está influido por el estado clínico del paciente (en brote o en fase estable)21,22 o si el estudio en paralelo del LCR puede aportar información adicional23.
FinanciaciónEste trabajo se ha realizado en parte gracias a la beca del Fondo de Investigaciones Sanitarias, Madrid, España (AS; PI060070) y de la Red Española de Esclerosis Múltiple (REEM) (F.G., RD07/0060/0012; X.M, RD07/0060/0020; L.R-T, RD07/0060/002).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
PresentacionesEste trabajo fue presentado en la LX Reunión Anual de la SEN.
A Mercé Albá y Eva Caballero por su excelente trabajo en el laboratorio.
Lista de autores del Grupo Español de Neuromielitis Óptica
Hospital de Albacete, Albacete (B. Rallo); Hospital de Alcorcón, Madrid (J. Pardo); Hospital Arnau de Vilanova, Lleida (A. Quilez); Hospital de Basurto, Bilbao (A. Rodriguez-Antigüedad); Hospital de Bellvitge, Barcelona (L. Romero, T. Arbizu); Hospital de Cabueñes, Asturias (S. Rodríguez); Hospital Universitario de Canarias, Tenerife (P. de Juan Hernández); Hospital Central de Asturias, Asturias (C. Lahoz); Hospital Ciudad de Jaén, Jaén (J. Foronda); Hospital Clínica Moncloa, Madrid (M.E. García); Hospital Clínico San Carlos, Madrid (R. Arroyo, M. Bartolomé y V. de las Heras); Hospital Clínico de Valencia, Valencia (F. Coret); Hospital de Cruces, Bilbao (M. Mendibe); Hospital de la Cruz Roja Dos de Mayo, Barcelona (E. Moral); Hospital Donostia, San Sebastián (A. López de Munain y J. Olascoaga); Hospital de Elche, Alicante (D. Sola); Hospital Francesc de Borja, Valencia (L. Lacruz); Hospital de Fuenlabrada, Madrid (I. García Castañón); Hospital General de Elda, Alicante (J. Mallada); Hospital General de Valencia, Valencia (A. Cervelló); Hospital General Universitario de Alicante, Alicante (A. Pérez Sempere); Hospital Germans Trias i Pujol, Barcelona (C. Ramo); Hospital de Getafe, Madrid (A. Rueda); Hospital Gregorio Marañón, Madrid (C. de Andrés); Hospital Josep Trueta, Girona (L. Ramió-Torrenta); Hospital Juan Canalejo, La Coruña (M. Marín-Sánchez); Hospital La Fe, Valencia (B. Casanova y M.J. Magraner); Hospital La Paz, Madrid (L. Gabaldón); Hospital Línea de la Concepción, Cádiz (N. Segura); Hospital Lozano Blesa, Zaragoza (S. Santos); Hospital del Mar, Barcelona (E. Munteis); Hospital Marqués de Valdecilla, Santander (J. Infante); Hospital de Mataró, Barcelona (A. Cano); Hospital Miguel Servet, Zaragoza (R. Alarcia y J.R. Ara); Hospital de Navarra, Navarra (M. Bujanda); Hospital Dr. Negrín, La Palma (J.L. López Fernández); Hospital Parc Taulí, Barcelona (M. Marco y C. Prat); Hospital Príncipe de Asturias, Madrid (C.I. Gómez-Escalonilla y L. Rubio Perez); Hospital Reina Sofía, Córdoba (F. Sánchez López y C. Sánchez Ortiz); Hospital Reina Sofía de Tudela, Navarra (F. Jarauta); Hospital Río Carrión, Palencia (A.L. Guerrero); Hospital Del Río Hortega, Valladolid (M.I. Yugueros y M.A.Tola); Hospital Ruber Internacional, Madrid (A. Jiménez Huete); Hospital Universitario de Salamanca, Salamanca (M. Alañá); Hospital San Jorge, Huesca (M. Bestué); Hospital de Sant Pau i Santa Tecla, Tarragona (J. Batlle); Hospital Severo Ochoa de Leganés, Madrid (M. de Toledo); Hospital Txagorritxu, Vitoria (A.J. Ibáñez); Hospital Vall d’Hebron, Barcelona (A. Horga y X. Montalbán); Hospital de Valme, Sevilla (RF. Bolaños); Hospital Virgen de la Arrixaca, Murcia (J. Meca); Hospital Virgen del Camino, Navarra (E. Maravi); Hospital Virgen de la Luz, Cuenca (A. López Martínez); Hospital Virgen de la Victoria, Málaga (O. Hamad); Hospital Virgen de las Nieves, Granada (C. Arnal García); Hospital Virgen del Rocío, Sevilla (J.L. Casado y A. Uclés); Hospital Xeral de Vigo, Pontevedra (D. Muñoz); Hospital de Zumárraga, Guipúzcoa (F. Moreno Izco).