Evaluar la eficiencia del seguimiento clínico del dolor crónico neuropático (DN) en consultas especializadas (CE) frente a consultas generales (CG) en unidades asistenciales de neurología (UAN) en España.
MétodosEstudio transversal y retrospectivo, de 6 meses, observacional y comparativo, que incluyó a pacientes con DN. Se recogió: situación laboral, nivel educativo, historia clínica, comorbilidad concomitante, capacidad funcional y utilización de recursos sanitarios y no sanitarios. Los costes indirectos incluyeron los equivalentes de días de trabajo perdidos como consecuencia del DN. El coste se computó desde la perspectiva de la sociedad en el año 2008. Como medida de efectividad primaria se registraron la intensidad y la interferencia del dolor en las actividades de la vida diaria.
ResultadosSe incluyó a 234 pacientes (el 53% en CE); el 56,8% eran mujeres, y la media de edad era 59,3±14,7 años. La asignación de pacientes se realizó según criterios asistenciales de forma consecutiva e independiente del diagnóstico y el estado clínico del paciente. El coste indirecto anual de los pacientes en CE fue de 1.299±2.804 euros frente a 1.483±3.452 euros en CG (p=0,660), mientras que los costes directos fueron, respectivamente, 2.911±3.335 euros y 3.563±4.797 euros (p=0,239), con unos costes totales de 4.210±4.654 euros y 5.060±6.250 euros (p=0,249). La puntuación media en la intensidad del dolor fue de 3,8±2,3 en CE y 5,2±2 en CG (p<0,001), mientras que la interferencia del dolor con las actividades diarias fue, respectivamente, de 3,3±2 y 4,7±2,5 (p<0,001).
ConclusionesEl seguimiento clínico del DN en CE es una alternativa dominante cuando se compara con las CG en UAN en España, al asociarse a mejores resultados clínicos con menor intensidad del dolor e interferencia con las actividades diarias mientras se mantiene un coste similar. Estos resultados pueden ayudar en la toma de decisiones sanitarias a la hora de planificar la utilización de los recursos disponibles.
To analyse the cost-consequences of chronic neuropathic pain (NeP) outpatients care comparing management in general clinics (GC) versus specialised pain clinics (SPC) in neurology settings in Spain.
MethodsA 6-month retrospective, cross-sectional, comparative observational study including NeP subjects was designed. Sociodemographics and clinical characteristics of subjects along with pain-related healthcare and non healthcare resources utilization were recorded. Lost-work-days equivalent missed as a consequence of pain were also collected to compute indirect costs. Costs to society were calculated in euros for the year 2008. Severity and interference of pain were used for the main effectiveness evaluation.
ResultsA total of 234 patients (53% in SPC), 56.8% women, and 59.3±14.7 years were included. Patients were allocated according to usual administrative procedures in each participant centre, consecutively and independently of the diagnosis and clinical status of patients. Yearly indirect costs were €1,299±2,804 in SPC compared to €1,483±3,452 in GC (p=0.660), while annual direct costs were, €2,911±3,335 and €3,563±4,797, respectively (p=0.239), with total costs of €4,210±4,654 and €5,060±6,250, respectively (p=0.249). Mean pain severity at the time of evaluation was 3.8±2.3 in subjects in SPC vs. 5.2±2 in GC (p<0.001), while the average interference of pain on daily activities were 3.3±2 and 4.7±2.5, respectively (p<0.001).
ConclusionsIn neurology settings in Spain, the outpatient clinical management of chronic NeP in SPC was a dominant alternative compared with GC healthcare, since it has shown better patients healthcare outcomes with less severity and interference of pain on daily activities, while maintaining a similar level of costs. These results could help health decision makers when planning the use of health care resources.
Las enfermedades y los síndromes que condicionan el dolor crónico afectan a millones de personas en todo el mundo y producen una enorme repercusión en los pacientes y en el conjunto de la sociedad1. Cerca del 50% de la comunidad presenta dolor crónico, y para la mitad de ellos es altamente incapacitante, está mal tratado y conlleva una gran demanda de más y mejores servicios2. En el ámbito de nuestro país, varios estudios sitúan el dolor crónico como la primera causa de limitación de la actividad en países industrializados, con el importante coste socioeconómico que conlleva3,4.
El dolor neuropático (DN) según la Asociación Internacional para el Estudio del Dolor (IASP) se define como el que resulta de una lesión o una disfunción del sistema nervioso central o periférico5. El DN tiene siempre una distribución o una topografía que corresponde a un territorio anatómicamente definido por una vía nerviosa central o periférica, lo que justifica su manejo por parte del neurólogo. Se trata de una enfermedad de diagnóstico y etiología, al igual que su tratamiento, frecuentemente complejos, entre los que se encuentra con más frecuencia la neuralgia del trigémino, la neuralgia posherpética y la polineuropatía diabética dolorosa6,7. En general, la intensidad del dolor está entre moderada y severa y responde mal a los analgésicos habituales, como los antiinflamatorios no esteroideos y los opiáceos8. Los fármacos antiepilépticos constituyen una aproximación terapéutica a considerar en estos pacientes por su acción en los mecanismos de la transmisión neuronal, y son los más utilizados (70,9%) por los neurólogos, junto con los antidepresivos tricíclicos (14,9%), para el tratamiento del DN9. Muy a menudo el DN afecta profundamente al estado de ánimo de los pacientes, y desencadena procesos depresivos o cuadros de ansiedad patológicos que, unidos a una disminución de la calidad del sueño, inciden negativamente sobre su calidad de vida y funcionamiento normal10,11.
El DN es el octavo diagnóstico más frecuente en las consultas de neurología y la demanda asistencial más elevada en las consultas hospitalarias12. La prevalencia en consultas de neurología es del 3,88%; el 6,09% en consultas hospitalarias y el 2,92% en consultas extrahospitalarias9. En numerosos casos, las consultas de neurología están sobresaturadas y los neurólogos consultados sobre un paciente no están especialmente vinculados al DN. Los pacientes con DN requieren un estudio etiológico detallado, la evaluación y cuantificación con escalas de intensidad de dolor de su repercusión en las actividades diarias y en la calidad de vida, así como un tratamiento complejo7. Todo ello supone la necesidad de un mayor tiempo del que se establece habitualmente para una primera visita en el ámbito de la consulta ambulatoria de neurología. La mayor parte de los pacientes atendidos tienen que ser derivados a consultas especializadas, dada la necesidad de una asistencia más compleja13. La propia Sociedad Española de Neurología (SEN) recomienda la realización de trabajos de utilización de los servicios sanitarios con objeto de establecer un ciclo de análisis y mejora14.
Una consulta de neurología general (CG) es aquella en que se atienden los elementos tanto diagnósticos como terapéuticos de la asistencia neurológica. No tiene como objetivo filtrar enfermedades a la atención ambulatoria hospitalaria. Se considera que no puede realizarse una consulta especializada en neurología en menos de 20-30 min para una primera visita y en menos de 15-20 min para las sucesivas14–16. El tiempo recomendable para una primera visita es de 45 min y el exigible es de 25 min. Estos tiempos fueron obtenidos por la SEN16, mediante un consenso entre neurólogos y estudios descriptivos realizados en España17. Los tiempos previstos para las consultas neurológicas en estudios similares en otros países son muy superiores; oscilan entre 40 y 90 min para la primeras visitas18,19. Una consulta de neurología especializada (CE) es aquella que se organiza a propósito de la atención sanitaria a un determinado proceso asistencial, cuyo responsable es un facultativo experto en dicha enfermedad, que utiliza protocolos o vías clínicas basadas en la evidencia científica disponible. Si la atención sanitaria a un proceso asistencial está efectuada por distintos expertos, de forma multidisciplinaria e integrada, de acuerdo con protocolos o vías clínicas basados en la evidencia científica disponible, con carácter de referencia para una determinada población, hablamos de unidad especializada de neurología13. Esta unidad debe mantener activas algunas líneas de investigación clínico-básica o clínica, con proyectos de investigación financiados por agencias externas, y estar acreditada para la docencia e incorporada a programas de formación específica.
Con el objetivo de evaluar la eficiencia y la mejora de la calidad asistencial en las CE de DN de unidades asistenciales de neurología (UAN) frente a CG, se planteó este estudio, donde se evaluaron los costes sanitarios y no sanitarios, así como la efectividad del cuidado médico realizado. Como indicadores de efectividad y calidad asistencial del DN, además de evaluar los costes sanitarios y no sanitarios, se midió el impacto del cuidado médico en la intensidad y la interferencia del DN en la vida diaria. Secundariamente, se analizaron los síntomas concomitantes de ansiedad, depresión, trastornos del sueño y calidad de vida relacionada con la salud. Finalmente, se determinó la satisfacción del paciente con diferentes facetas del cuidado médico recibido.
Material y métodosDiseño y tipo de estudioEstudio transversal y retrospectivo, multicéntrico, observacional y comparativo entre dos modelos de atención médica en UAN. En ningún caso se interfirió en la decisión del investigador sobre el cuidado médico más adecuado para el paciente. Un total de 9 centros terciarios, de 6 comunidades autónomas (Andalucía, Cataluña, Galicia, Madrid, País Vasco y Valencia), con CG y CE participaron en el estudio entre septiembre de 2007 y octubre de 2008. Los pacientes reclutados debían ser de ambos sexos, mayores de 18 años, con diagnóstico de DN según práctica médica habitual, cuya historia clínica (relativa al DN) tuviera un seguimiento mínimo de 6 meses y debían tener suficiente nivel cultural y educativo para cumplimentar cuestionarios de salud formulados en castellano. A todos los pacientes se les informó y se les proporcionó información detallada del estudio, de su naturaleza y objetivos, y de la información requerida por participar en el estudio. A todos los pacientes se les solicitó su consentimiento oral ante testigo para la utilización y posterior análisis de sus datos. El protocolo y el cuaderno de recogida de datos fueron sometidos a revisión y aprobación del Comité Ético de Investigación Clínica del Hospital Clínico San Carlos de Madrid.
La asignación de pacientes a cada tipo de consulta se realizó según criterios asistenciales en cada centro participante, de forma consecutiva e independiente del diagnóstico y estado clínico del paciente. Ninguno de los médicos que evaluaron y recogieron los datos de los pacientes participó en la asignación de los pacientes a uno u otro tipo de consulta. El tamaño de muestra para el estudio se calculó a partir del estudio de Rodríguez et al20, en el que se encontró un coste sanitario mensual sin ajustar por paciente con DN de 422±1.266 euros. Se consideró esta diferencia como relevante entre los dos modelos de asistencia médica para el cálculo del tamaño de muestra necesario para el estudio. Dado el diseño transversal y retrospectivo, no se consideraron pérdidas para el análisis estadístico. El test de la t a dos colas con un nivel de significación del 5% y una potencia del 80% (error beta=0,2) para detectar diferencias estadísticamente significativas y grupos balanceados 1:1 requería de 143 pacientes por modelo asistencial.
Intervenciones sanitarias y tratamientosEl estudio, dada su naturaleza observacional, registró el tipo y la duración de las intervenciones, tanto farmacológicas como no farmacológicas, empleadas. El tipo de tratamiento fue elegido libremente por cada participante según su práctica médica habitual. No se impusieron terapias específicas o regímenes terapéuticos especiales por la participación en este estudio.
Variables de efectividad: resultados en saludLos resultados en salud para valorar la efectividad del cuidado médico en el tratamiento del DN según tipo de consulta se valoró en una única visita, una vez que se constató que el paciente cumplía los criterios de inclusión-exclusión establecidos y se hubieran recogido los datos sociodemográficos. Los resultados en salud de efectividad se determinaron mediante cuestionarios de salud autoadministrados, en sus versiones adaptadas y validadas al castellano.
La intensidad y la interferencia del DN se midieron con el Brief Pain Inventory (BPI). El BPI es un cuestionario autoadministrado y de fácil comprensión. Fue desarrollado por Daule en 1983 y la versión española fue validada por Badia et al21, en 2002. El BPI es un instrumento multidimensional de valoración del dolor que proporciona información sobre la intensidad y su interferencia en las actividades diarias de los pacientes. La versión que se utilizó en este estudio es la abreviada de 11 ítems. Esta versión abreviada consta de dos dimensiones: intensidad del dolor (media de los primeros 4 ítems) e interferencia en las actividades (últimos 7 ítems). Cada uno de los ítems se puntúa de 0 (ningún dolor/no me ha afectado) a 10 (peor dolor imaginable/me ha afectado por completo). Estos 11 ítems proporcionan dos puntuaciones resumen, una para cada dimensión (con intervalo de 0 a 10).
Las posibles alteraciones del sueño se midieron con la escala de sueño del Medical Outocomes Study (MOS). Esta escala consiste en un instrumento de 12 ítems que explora el impacto o la interferencia ocasionados por la enfermedad o un tratamiento o, en general, cualquier estímulo externo sobre los atributos de la arquitectura del sueño que corresponden a 7 subescalas: idoneidad (2 ítems), sueño óptimo (1 ítem), cantidad (1 ítem), despertares bruscos (1 ítem), ronquidos (1 ítem), sueño alterado (4 ítems) y somnolencia (3 ítems)22. Además, produce un índice general de interferencia del sueño (formado por 9 ítems, con intervalo de 0, ninguna interferencia o impacto, a 100, máxima interferencia posible) y la subescala de problemas del sueño (formado por 6 ítems). Cada atributo se puntúa independientemente, también de menor a mayor impacto (a mayor puntuación, impacto más negativo), excepto para los atributos idoneidad y sueño óptimo (menos puntuación significa peor puntuación del atributo) y la cantidad de sueño (número de horas dormidas por día).
La escala hospitalaria de depresión y ansiedad (HADS) fue diseñada con la intención de crear un instrumento de detección de trastornos depresivos y ansiosos en el marco de los servicios hospitalarios no psiquiátricos que cumpliera las siguientes condiciones: no estar contaminado por los síntomas fisiopatológicos que presenta el paciente y diferenciar claramente entre los trastornos de tipo depresivo y los de tipo ansioso23. Tradicionalmente, se viene utilizando la HADS de forma autoaplicada y el marco de referencia es la semana anterior, y de esta manera es como se utilizó en el presente estudio. El paciente ha de contestar a cada ítem utilizando una escala tipo Likert de 4 puntos, que unas veces hace referencia a intensidad del síntoma y otras veces a frecuencia de presentación. La escala oscila entre 0 y 3. La HADS está constituida por 14 ítems que se agrupan en dos subescalas, cada una de ellas con 7 síntomas. Subescala de ansiedad: está centrada en sus manifestaciones psíquicas (tensión, nerviosismo, aprensión, preocupación, inquietud, nervios en el estómago, angustia). Son los ítems impares y el intervalo es de 0 (mejor) a 21 (peor). La subescala de depresión: centrada en anhedonia (disfrute, risa, alegría, torpeza, interés por el aspecto personal, ilusión), son los ítems pares y el intervalo es también de 0 (mejor) a 21 (peor).
La calidad de vida relacionada con la salud se midió con el cuestionario de salud EQ5D. Éste es un instrumento estandarizado y genérico que evalúa la calidad de vida relacionada con la salud24,25. Consta de dos partes, la primera es el perfil de estado de salud, formado por 5 ítems que evalúan 5 dimensiones: movilidad, cuidado personal, actividades cotidianas, dolor/malestar y ansiedad/depresión. Para cada dimensión se definen tres estados, entre los cuales el paciente ha de elegir el que mejor refleje su situación. Esos tres estados describen ausencia de problemas en esa dimensión (1 punto), problemas moderados (2 puntos) y problemas graves (3 puntos). La segunda parte corresponde a la escala analógica visual representada mediante una línea vertical de 20 cm de longitud y graduada de 0 (peor estado de salud imaginable) a 100 (mejor estado de salud imaginable). El paciente ha de marcar en dicha escala el punto que mejor represente su estado de salud general en el día de la entrevista.
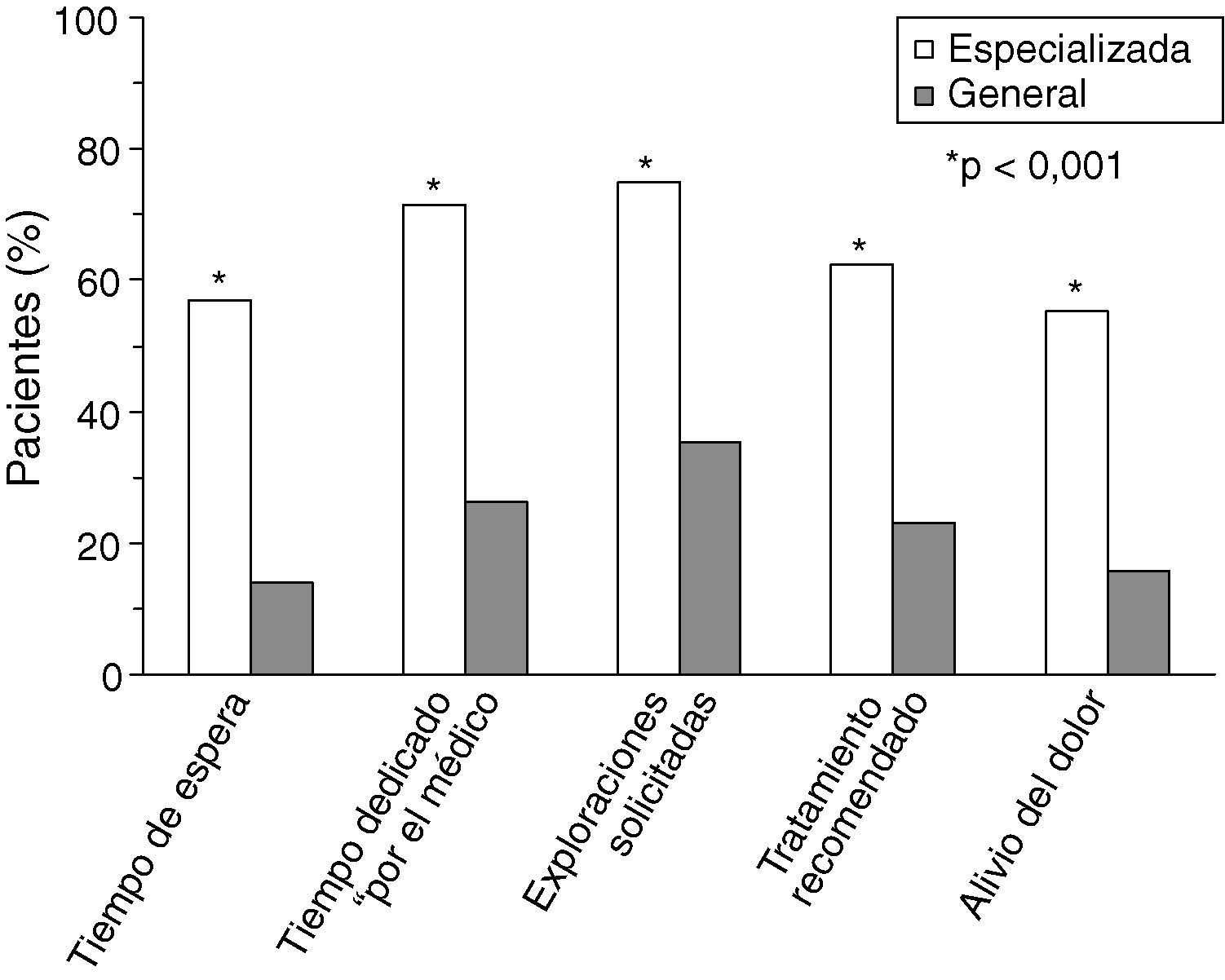
Del mismo modo, mediante un cuestionario, se evaluó la satisfacción del paciente con la asistencia sanitaria recibida en los siguientes apartados: seguimiento médico y satisfacción en general extraídos del cuestionario genérico de satisfacción con el tratamiento con medicinas SATMED-Q26. Éste es un cuestionario autoadministrado que consta de 17 ítems con puntuaciones que van de 0 (nada) a 4 (mucho). Se puede obtener una puntuación general de satisfacción con el tratamiento en una métrica de 0 a 100 (nada a completamente satisfecho), aunque los 17 ítems también pueden agruparse en seis dominios: “efectos indeseables” (ítems 1, 2, 3), “eficacia de la medicación” (ítems 4, 5, 6), “comodidad de la medicación” (ítems 7, 8, 9), “impacto de la medicación en la vida diaria” (ítems 10, 11, 12), “seguimiento médico de la enfermedad” (ítems 13 y 14), que incluye información del médico acerca de la enfermedad y acerca de la manera de tratarla, y “opinión general” (ítems 15, 16, 17), que incluye la intención de continuar el tratamiento, la satisfacción general y si se siente o no a gusto con dicho tratamiento. Todas las puntuaciones se estandarizan de 0 (nada satisfecho) a 100 (completamente satisfecho)26. En el presente estudio únicamente se administraron los ítems correspondientes a las últimas dos dimensiones mencionadas; seguimiento médico y opinión general. Además, se preguntó a los pacientes si estaban o no satisfechos (respuesta binaria) con las siguientes facetas del cuidado médico: tiempo de espera, tiempo dedicado por el médico al paciente, exploraciones solicitadas, tratamiento recomendado y alivio del dolor.
Utilización de recursos sanitarios y productividad laboralA partir de una entrevista realizada por su médico, los pacientes informaron sobre los recursos sanitarios que habían utilizado en los últimos 6 meses: tratamiento farmacológico y no farmacológico, número y tipo de visitas médicas, hospitalizaciones y pruebas complementarias (número y tipo) realizadas a causa de su dolor. Esta información fue recogida mediante entrevista directa con el paciente y a partir de los registros médicos de su historia clínica. A su vez se les preguntó sobre el impacto del dolor en su productividad laboral durante los últimos 12 meses. Se recogió la información relativa al número de días que los pacientes dejan de trabajar o de realizar actividades cotidianas a causa del dolor, el número de días que trabajan o realizan sus actividades cotidianas con dolor (que se computaron con una productividad laboral reducida en un 50%). A partir de estos datos, se calculó el número de equivalentes de días de trabajo perdidos (LWDE) en los últimos 12 meses por causa del dolor, mediante la aplicación de la fórmula: LWDE=W1+W2 (1-P); donde W1 es el número de días con incapacidad de trabajar o emprender actividades normales por el dolor en los últimos 12 meses; W2 es el número de días en el trabajo con dolor en los últimos 12 meses y 1-P es el porcentaje de discapacidad laboral en el trabajo; P es el porcentaje de efectividad en el trabajo que se consideró en 0,5 en este estudio27.
Estimación de los costesSe calculó el coste total anualizado por paciente, que incluye los costes directos sanitarios (tratamiento farmacológico y no farmacológico, visitas médicas, hospitalizaciones y pruebas complementarias) y no sanitarios, y los costes indirectos derivados de los LWDE. El coste de los tratamientos farmacológicos se obtuvo del Catálogo del Colegio Oficial de Farmacéuticos de 200828 y corresponde a los precios de venta al público (PVP-IVA) de los medicamentos genéricos más baratos o de las especialidades farmacéuticas más baratas o sus precios de referencia en caso de no haber genéricos. Los costes de los tratamientos no farmacológicos, visitas médicas, hospitalizaciones y pruebas complementarias se han obtenido de la base de datos de costes sanitarios Oblikue, 2006 (actualizados según los índices de precios de consumo [diciembre de 2007] a costes de 2008) (tabla 1)29. Por último, para determinar el coste de cada LWDE se aplicó el método del capital humano, para lo que se obtuvo el importe salarial total promedio por trabajador y mes (primer trimestre de 2008) dividido entre 30 días, que se obtuvo del Instituto Nacional de Estadística para imputar el coste de 1 LWDE.
Costes unitarios de los recursos sanitarios (tratamientos no farmacológicos, visitas médicas y pruebas complementarias) y de las pérdidas de productividad laboral.
| Recurso | Coste unitario (euros) |
| Tratamiento no farmacológico (por sesión) | |
| Fisioterapia | 10,23 |
| TENS | 23,57 |
| Infiltraciones (articulación, etc.) | 150,29 |
| Electroterapia | 7,56 |
| Bloqueo (epidural, etc.) | 90,20 |
| Iontoforesis | 10,18 |
| Estimulador medular | 7.072,14 |
| Bombas | 8.434,45 |
| Acupuntura | 35 |
| Gimnasia correctiva | 12,78 |
| Masaje linfático | 20,51 |
| Mesoterpia | 17,10 |
| Osteopatía | 50 |
| Reflexoterapia | 35 |
| Visitas médicas | |
| A atención primaria | 20,34 |
| A unidad de dolor | 52,61 |
| Al especialista | 57,93 |
| A urgencias | 114,94 |
| Hospitalización (1 día) | 308,63 |
| Pruebas complementarias | |
| Tomografía computarizada | 149,20 |
| Resonancia | 352,94 |
| Electromiograma | 129,93 |
| Eco-Doppler | 134,72 |
| Termografía | 136,87 |
| Radiografía convencional | 17,73 |
| Analítica general (sangre y bioquímica sanguínea) | 24,11 |
| Gammagrafía ósea | 136,85 |
| Productividad laboral | |
| Coste por día no trabajado | 52,65 |
TENS: neuroestimulación eléctrica transcutánea.
En todo momento se garantizó la veracidad y la rigurosidad en el análisis. La población que se utilizó para el análisis estadístico incluyó a todos los pacientes que cumplieron todos los criterios de selección. Se realizó estadística descriptiva de todas las variables incluyendo medidas de tendencia central y dispersión para las variables cuantitativas, y frecuencias absolutas y relativas para las variables cualitativas, con intervalos de confianza del 95% en ambos casos. Se estudió el tipo de distribución de las variables cuantitativas y se evaluó su ajuste a la distribución de Gauss mediante la prueba de Kolmogorov-Smirnov. Cuando los datos no cumplieron las suposiciones de normalidad, se utilizaron métodos estadísticos no paramétricos. Para la comparación de datos independientes (entre grupos de análisis: consulta especializada de DN y consulta general de neurología) se utilizó la prueba de la t de Student para variables cuantitativas y el test de la χ2 para las variables cualitativas. Para las variables continuas que no siguieron una distribución normal se aplicó la prueba no paramétrica U de Mann-Whitney. Las pruebas estadísticas se realizaron con un nivel de significación del 5% y fueron bilaterales. Se utilizó el paquete estadístico SAS® versión 8.2 para realizar todos los análisis estadísticos.
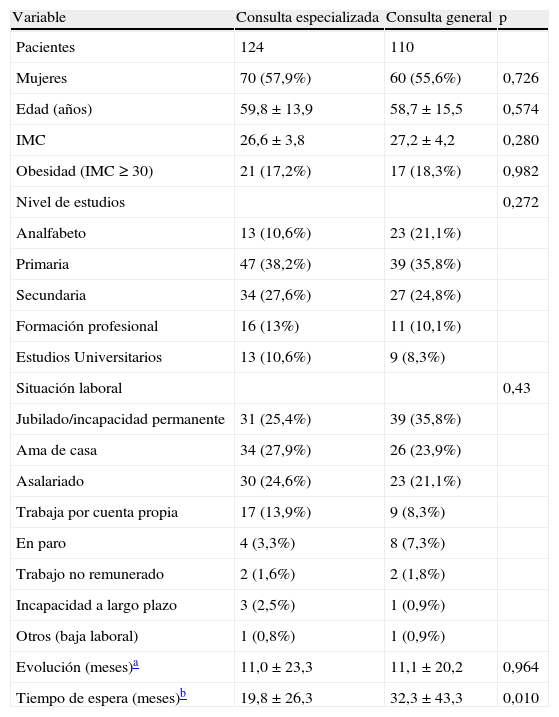
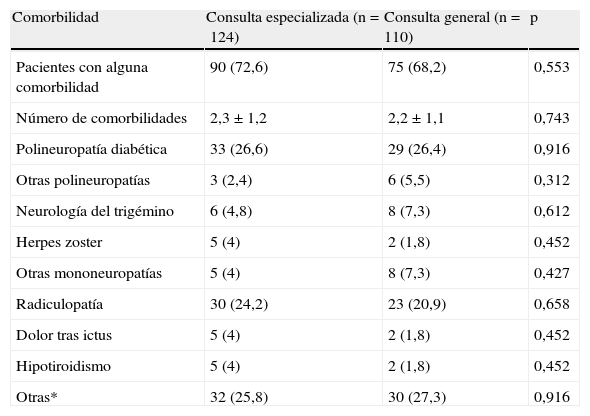
ResultadosSe incluyó un total de 234 pacientes, 124 (53%) en CE (diferencias no significativas), con un 56,8% de mujeres, y una media±desviación estándar de edad de 59,3±14,7 años. Este número de pacientes fue algo inferior al predeterminado en el cálculo inicial del tamaño muestral, por lo que la potencia del estudio quedó limitada al 71%. En la tabla 2 se describen los datos sociodemográficos de los pacientes incluidos en el estudio y algunos aspectos clínicos como evolución, duración de los síntomas y tiempos de espera. Los pacientes atendidos en CE tuvieron un tiempo promedio de espera desde el inicio de los síntomas significativamente menor (19,8 frente a 32,3 meses) (p=0,010) (tabla 2), mientras que no se observaron diferencias significativas en los tiempos de evolución desde el diagnóstico, en el número o tipo de comorbilidades (tabla 3) ni en las demás variables sociodemográficas analizadas.
Datos descriptivos de los pacientes.
| Variable | Consulta especializada | Consulta general | p |
| Pacientes | 124 | 110 | |
| Mujeres | 70 (57,9%) | 60 (55,6%) | 0,726 |
| Edad (años) | 59,8±13,9 | 58,7±15,5 | 0,574 |
| IMC | 26,6±3,8 | 27,2±4,2 | 0,280 |
| Obesidad (IMC ≥ 30) | 21 (17,2%) | 17 (18,3%) | 0,982 |
| Nivel de estudios | 0,272 | ||
| Analfabeto | 13 (10,6%) | 23 (21,1%) | |
| Primaria | 47 (38,2%) | 39 (35,8%) | |
| Secundaria | 34 (27,6%) | 27 (24,8%) | |
| Formación profesional | 16 (13%) | 11 (10,1%) | |
| Estudios Universitarios | 13 (10,6%) | 9 (8,3%) | |
| Situación laboral | 0,43 | ||
| Jubilado/incapacidad permanente | 31 (25,4%) | 39 (35,8%) | |
| Ama de casa | 34 (27,9%) | 26 (23,9%) | |
| Asalariado | 30 (24,6%) | 23 (21,1%) | |
| Trabaja por cuenta propia | 17 (13,9%) | 9 (8,3%) | |
| En paro | 4 (3,3%) | 8 (7,3%) | |
| Trabajo no remunerado | 2 (1,6%) | 2 (1,8%) | |
| Incapacidad a largo plazo | 3 (2,5%) | 1 (0,9%) | |
| Otros (baja laboral) | 1 (0,8%) | 1 (0,9%) | |
| Evolución (meses)a | 11,0±23,3 | 11,1±20,2 | 0,964 |
| Tiempo de espera (meses)b | 19,8±26,3 | 32,3±43,3 | 0,010 |
IMC: índice de masa corporal.
Tiempo desde el diagnóstico hasta el inicio del estudio.
Los datos expresan n (%) o media±desvoación estándar. Los porcentajes que se muestran se han calculado a partir de los sujetos que presentaban el dato. Los tamaños de muestra pueden oscilar en las distintas variables y son inferiores al tamaño de muestra de la población evaluable.
Comorbilidades relacionada con el origen del dolor neuropático en los pacientes seguidos en consultas monográficas y generales de neurología.
| Comorbilidad | Consulta especializada (n=124) | Consulta general (n=110) | p |
| Pacientes con alguna comorbilidad | 90 (72,6) | 75 (68,2) | 0,553 |
| Número de comorbilidades | 2,3±1,2 | 2,2±1,1 | 0,743 |
| Polineuropatía diabética | 33 (26,6) | 29 (26,4) | 0,916 |
| Otras polineuropatías | 3 (2,4) | 6 (5,5) | 0,312 |
| Neurología del trigémino | 6 (4,8) | 8 (7,3) | 0,612 |
| Herpes zoster | 5 (4) | 2 (1,8) | 0,452 |
| Otras mononeuropatías | 5 (4) | 8 (7,3) | 0,427 |
| Radiculopatía | 30 (24,2) | 23 (20,9) | 0,658 |
| Dolor tras ictus | 5 (4) | 2 (1,8) | 0,452 |
| Hipotiroidismo | 5 (4) | 2 (1,8) | 0,452 |
| Otras* | 32 (25,8) | 30 (27,3) | 0,916 |
Los datos expresan n (%) o media±desviación estándar.
*Incluye neoplasia, síndrome doloroso regional complejo, dolor facial, plexopatías, síndrome de atrapamiento periférico.
Los porcentajes que se muestran se han calculado a partir de los sujetos que presentaban el dato. Los tamaños de muestra pueden oscilar en las distintas variables y son inferiores al tamaño de muestra de la población evaluable.
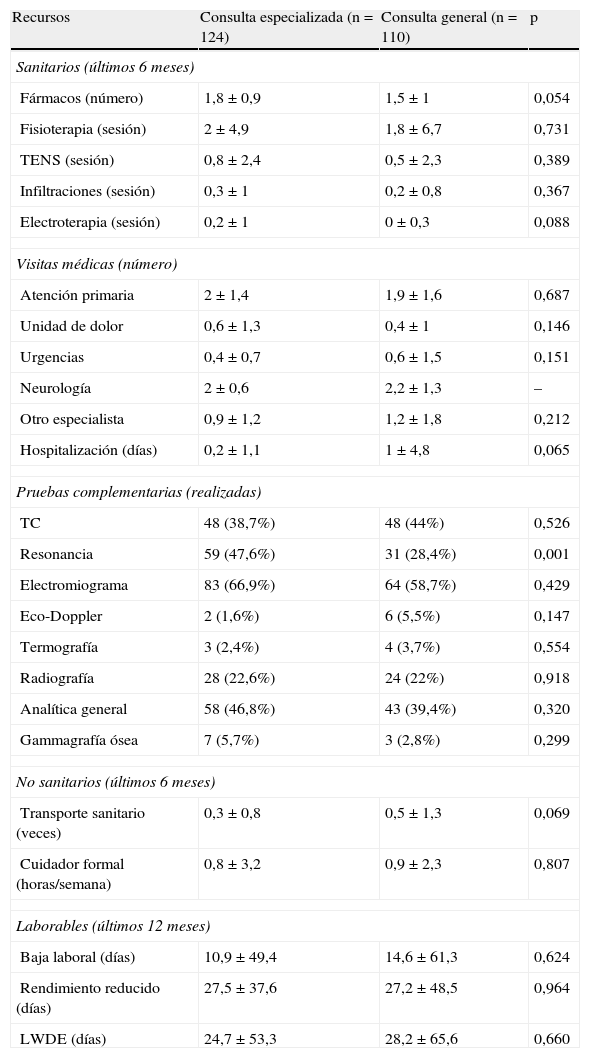
La utilización de recursos sanitarios (visitas médicas, hospitalizaciones, fármacos, etc.) fueron prácticamente similares en los dos modelos asistenciales (tabla 4), con la excepción de que a los pacientes tratados en CE se les prescribió un número significativamente mayor de resonancias como procedimientos complementarios (p<0,001) (tabla 4), y recibieron un promedio casi significativamente mayor de fármacos para el DN (1,8 frente a 1,5; p=0,054) (aunque durante un menor tiempo, datos no mostrados). El 96% de los pacientes en CE y el 93% en CG recibieron algún tratamiento farmacológico para el DN (p=0,280), con una distribución de clases terapéuticas similar en ambos tipos de niveles asistenciales, excepto para el ibuprofeno que fue significativamente más frecuente en CE que en CG (el 9 frente al 1%; p=0,006) y el topiramato que fue más frecuente en CG (el 6 frente al 1%; p=0,037). Los pacientes atendidos en CG estuvieron en promedio 1 día hospitalizados por su DN, que contrasta con los 0,2 días en los seguidos en CE, aunque las diferencias no llegaron a alcanzar la significación estadística (p=0,065) (tabla 4). La utilización de recursos directos no sanitarios fue semejante, con la excepción de un mayor uso del transporte sanitario por parte de los pacientes de CG, que fue casi estadísticamente significativo (p=0,069) (tabla 4).
Utilización de recursos sanitarios y no sanitarios según tipo de consulta.
| Recursos | Consulta especializada (n=124) | Consulta general (n=110) | p |
| Sanitarios (últimos 6 meses) | |||
| Fármacos (número) | 1,8±0,9 | 1,5±1 | 0,054 |
| Fisioterapia (sesión) | 2±4,9 | 1,8±6,7 | 0,731 |
| TENS (sesión) | 0,8±2,4 | 0,5±2,3 | 0,389 |
| Infiltraciones (sesión) | 0,3±1 | 0,2±0,8 | 0,367 |
| Electroterapia (sesión) | 0,2±1 | 0±0,3 | 0,088 |
| Visitas médicas (número) | |||
| Atención primaria | 2±1,4 | 1,9±1,6 | 0,687 |
| Unidad de dolor | 0,6±1,3 | 0,4±1 | 0,146 |
| Urgencias | 0,4±0,7 | 0,6±1,5 | 0,151 |
| Neurología | 2±0,6 | 2,2±1,3 | – |
| Otro especialista | 0,9±1,2 | 1,2±1,8 | 0,212 |
| Hospitalización (días) | 0,2±1,1 | 1±4,8 | 0,065 |
| Pruebas complementarias (realizadas) | |||
| TC | 48 (38,7%) | 48 (44%) | 0,526 |
| Resonancia | 59 (47,6%) | 31 (28,4%) | 0,001 |
| Electromiograma | 83 (66,9%) | 64 (58,7%) | 0,429 |
| Eco-Doppler | 2 (1,6%) | 6 (5,5%) | 0,147 |
| Termografía | 3 (2,4%) | 4 (3,7%) | 0,554 |
| Radiografía | 28 (22,6%) | 24 (22%) | 0,918 |
| Analítica general | 58 (46,8%) | 43 (39,4%) | 0,320 |
| Gammagrafía ósea | 7 (5,7%) | 3 (2,8%) | 0,299 |
| No sanitarios (últimos 6 meses) | |||
| Transporte sanitario (veces) | 0,3±0,8 | 0,5±1,3 | 0,069 |
| Cuidador formal (horas/semana) | 0,8±3,2 | 0,9±2,3 | 0,807 |
| Laborables (últimos 12 meses) | |||
| Baja laboral (días) | 10,9±49,4 | 14,6±61,3 | 0,624 |
| Rendimiento reducido (días) | 27,5±37,6 | 27,2±48,5 | 0,964 |
| LWDE (días) | 24,7±53,3 | 28,2±65,6 | 0,660 |
LWDE: equivalentes de días de trabajo perdidos=días sin trabajar+(días trabajados con rendimiento reducido×0,5); TC: tomografía computarizada; TENS: neuroestimulación eléctrica transcutánea.
Valores expresados como media±desviación estándar o n (%).
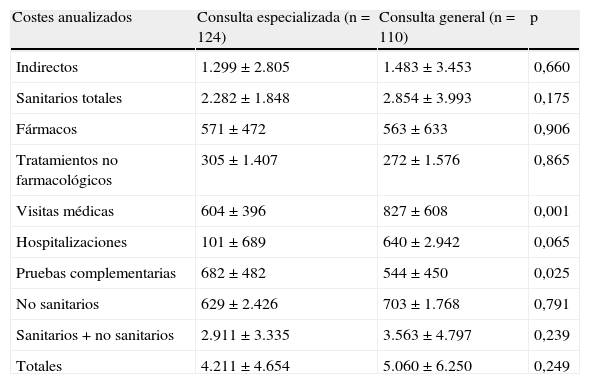
En cuanto a la actividad laboral, el 17,2% de los pacientes atendidos en CE y el 13,8% de los de CG tuvieron que dejar de trabajar algún día debido al dolor y el 59,8% y el 49,5%, respectivamente, habían trabajado con el rendimiento reducido (diferencias no significativas). El número promedio de equivalentes de días de trabajo perdidos por el DN fue de 24,7 y 28,2 días, respectivamente, en CE y CG (p=0,660), que da lugar a un coste indirecto anual (costes por pérdidas de productividad) de 1.299±2.805 euros en CE y de 1.483±3.453 euros en CG (p=0,660) (tabla 5).
Relación de costes del manejo del dolor neuropático en consultas monográficas y generales de neurología.
| Costes anualizados | Consulta especializada (n=124) | Consulta general (n=110) | p |
| Indirectos | 1.299±2.805 | 1.483±3.453 | 0,660 |
| Sanitarios totales | 2.282±1.848 | 2.854±3.993 | 0,175 |
| Fármacos | 571±472 | 563±633 | 0,906 |
| Tratamientos no farmacológicos | 305±1.407 | 272±1.576 | 0,865 |
| Visitas médicas | 604±396 | 827±608 | 0,001 |
| Hospitalizaciones | 101±689 | 640±2.942 | 0,065 |
| Pruebas complementarias | 682±482 | 544±450 | 0,025 |
| No sanitarios | 629±2.426 | 703±1.768 | 0,791 |
| Sanitarios+no sanitarios | 2.911±3.335 | 3.563±4.797 | 0,239 |
| Totales | 4.211±4.654 | 5.060±6.250 | 0,249 |
Valores expresados en euros, como media±desviación estándar.
Se observaron diferencias estadísticamente significativas (p<0,05) entre los grupos analizados en cuanto al coste anual de visitas médicas, mayor en los pacientes atendidos en CG, y el coste anual de las pruebas diagnósticas y complementarias, mayor en CE de dolor (tabla 5). No obstante, tanto los costes directos anuales (la suma de los costes directos sanitarios y no sanitarios) como los costes anuales totales fueron numéricamente más bajos en CE que los de CG, aunque sin llegar a la significación estadística (4.210±4.654 euros y 5.060±6.250 euros, respectivamente; p=0,249) (tabla 5).
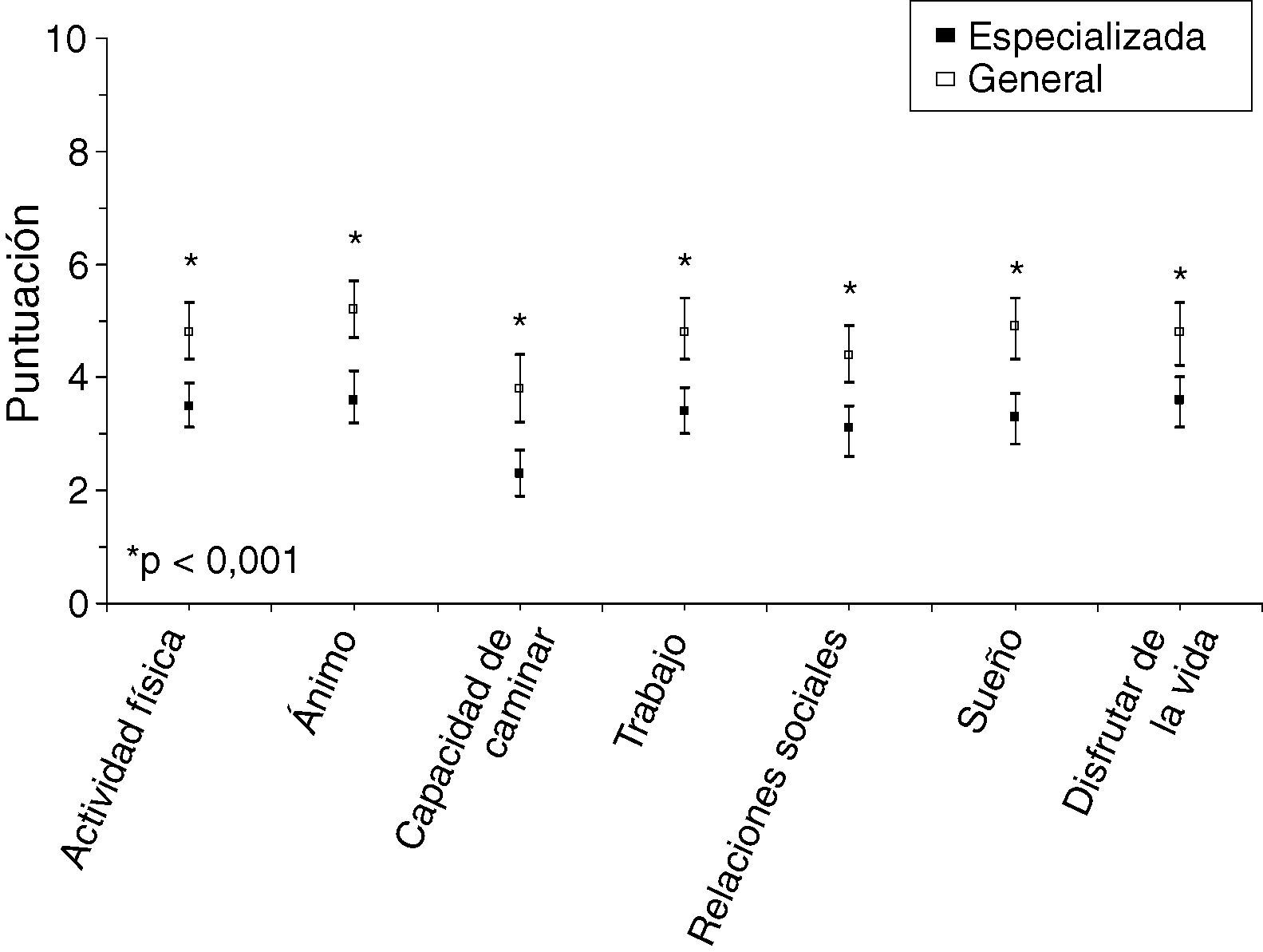
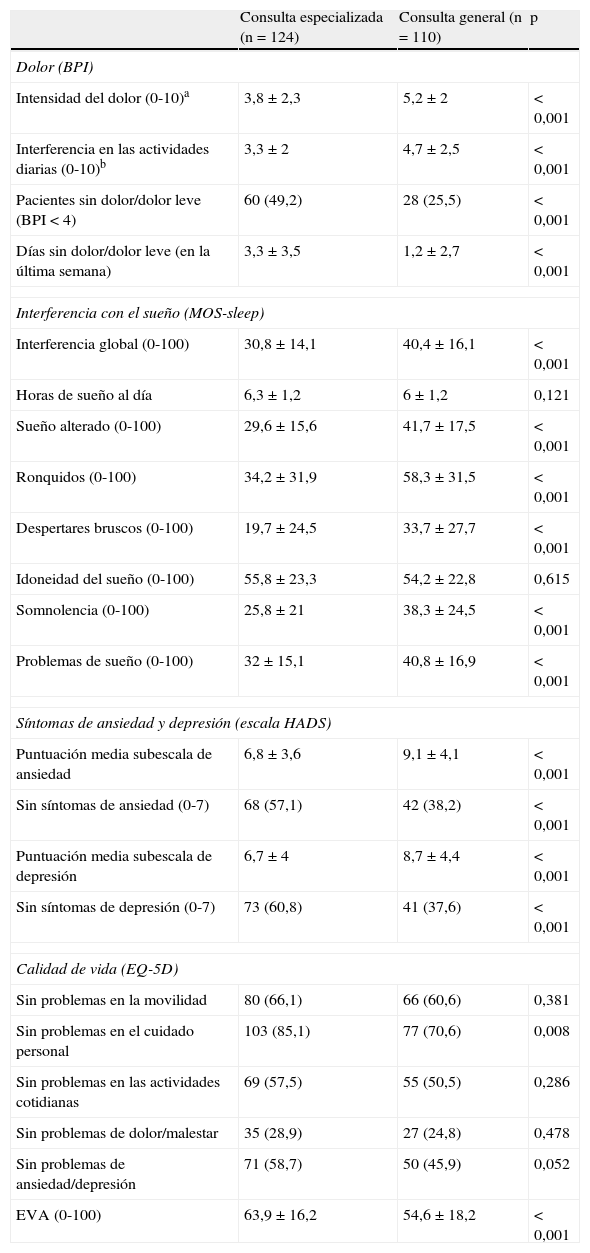
Efectividad y resultados en saludLa puntuación media de la dimensión “intensidad del dolor” de la escala BPI fue 3,8±2,3 en el grupo atendido en CE y 5,2±2 en el de CG (p<0,001), mientras que la interferencia media del dolor en las actividades de la vida diaria fue, en promedio, de 3,3±2 en CE y 4,7±2,5 en CG (p<0,001) (tabla 6). Asimismo, la interferencia por tipo individual de actividad fue significativamente menor en todas las actividades medidas por el BPI en CE que en CG (fig. 1). Se observaron diferencias estadísticamente significativas (p<0,001) entre los dos grupos en cuanto a los dominios del sueño: sueño alterado, ronquidos, despertares bruscos, somnolencia y problemas del sueño. La puntuación media del índice global de interferencia del sueño de la escala MOS fue significativamente menor en el grupo de pacientes atendidos en CE (30,8±14,1 frente a 40,4±16,1; p<0,001) (tabla 6). Estos resultados en salud se asociaron también a puntuaciones medias significativamente menores de los síntomas de ansiedad y depresión en las subescalas de la HADS en el grupo seguido en CE frente al tratado en CG y a un porcentaje significativamente mayor de pacientes sin síntomas de ansiedad o depresión (p<0,01) (tabla 6).
Relación de efectividad del manejo del dolor neuropático en consultas especializadas y generales de neurología.
| Consulta especializada (n=124) | Consulta general (n=110) | p | |
| Dolor (BPI) | |||
| Intensidad del dolor (0-10)a | 3,8±2,3 | 5,2±2 | < 0,001 |
| Interferencia en las actividades diarias (0-10)b | 3,3±2 | 4,7±2,5 | < 0,001 |
| Pacientes sin dolor/dolor leve (BPI<4) | 60 (49,2) | 28 (25,5) | < 0,001 |
| Días sin dolor/dolor leve (en la última semana) | 3,3±3,5 | 1,2±2,7 | < 0,001 |
| Interferencia con el sueño (MOS-sleep) | |||
| Interferencia global (0-100) | 30,8±14,1 | 40,4±16,1 | < 0,001 |
| Horas de sueño al día | 6,3±1,2 | 6±1,2 | 0,121 |
| Sueño alterado (0-100) | 29,6±15,6 | 41,7±17,5 | < 0,001 |
| Ronquidos (0-100) | 34,2±31,9 | 58,3±31,5 | < 0,001 |
| Despertares bruscos (0-100) | 19,7±24,5 | 33,7±27,7 | < 0,001 |
| Idoneidad del sueño (0-100) | 55,8±23,3 | 54,2±22,8 | 0,615 |
| Somnolencia (0-100) | 25,8±21 | 38,3±24,5 | < 0,001 |
| Problemas de sueño (0-100) | 32±15,1 | 40,8±16,9 | < 0,001 |
| Síntomas de ansiedad y depresión (escala HADS) | |||
| Puntuación media subescala de ansiedad | 6,8±3,6 | 9,1±4,1 | < 0,001 |
| Sin síntomas de ansiedad (0-7) | 68 (57,1) | 42 (38,2) | < 0,001 |
| Puntuación media subescala de depresión | 6,7±4 | 8,7±4,4 | < 0,001 |
| Sin síntomas de depresión (0-7) | 73 (60,8) | 41 (37,6) | < 0,001 |
| Calidad de vida (EQ-5D) | |||
| Sin problemas en la movilidad | 80 (66,1) | 66 (60,6) | 0,381 |
| Sin problemas en el cuidado personal | 103 (85,1) | 77 (70,6) | 0,008 |
| Sin problemas en las actividades cotidianas | 69 (57,5) | 55 (50,5) | 0,286 |
| Sin problemas de dolor/malestar | 35 (28,9) | 27 (24,8) | 0,478 |
| Sin problemas de ansiedad/depresión | 71 (58,7) | 50 (45,9) | 0,052 |
| EVA (0-100) | 63,9±16,2 | 54,6±18,2 | < 0,001 |
BPI: cuestionario breve del dolor (a0=sin dolor, 10=peor dolor inimaginable; b0=ninguna interferencia, 10=interferencia completa); EVA: escala visual analógica de salud del cuestionario EQ-5D; HADS: escala hospitalaria de ansiedad y depresión (intervalo, 0-21 para cada subescala de ansiedad y depresión; 0=sin síntomas, 21=síntomas muy intensos); MOS-sleep: escala de alteraciones o de interferencia con el sueño (intervalo, 0-100, general y para cada dimensión; 0=sin interferencia o sin alteraciones, 100=máxima interferencia o alteración).
Valores expresados como media±desviación estándar o n (%). Los porcentajes que se muestran se han calculado a partir de los sujetos que presentaban el dato. Los tamaños de muestra pueden oscilar en las distintas variables y son inferiores al tamaño de muestra de la población evaluable.
Interferencias del dolor en la última semana con diferentes actividades de la vida diaria en pacientes con dolor neuropático atendidos en consulta monográfica o general de neurología. Interferencia, ≥ 5 en cada ítem de la subescala de interferencia del cuestionario breve del dolor.
Los resultados en salud anteriores, significativamente mejores en los pacientes atendidos en CE, se correspondieron con mejores puntuaciones en el cuestionario EQ-5D que mide la calidad de vida relacionada con la salud. En particular, el estado de salud según el termómetro de salud fue de 63,9±16,2 en los atendidos en CE frente a 54,6±18,2 en los seguidos en CG (p<0,001), con diferencias significativas en las dimensiones de ansiedad/depresión y problemas con el cuidado personal (tabla 6).
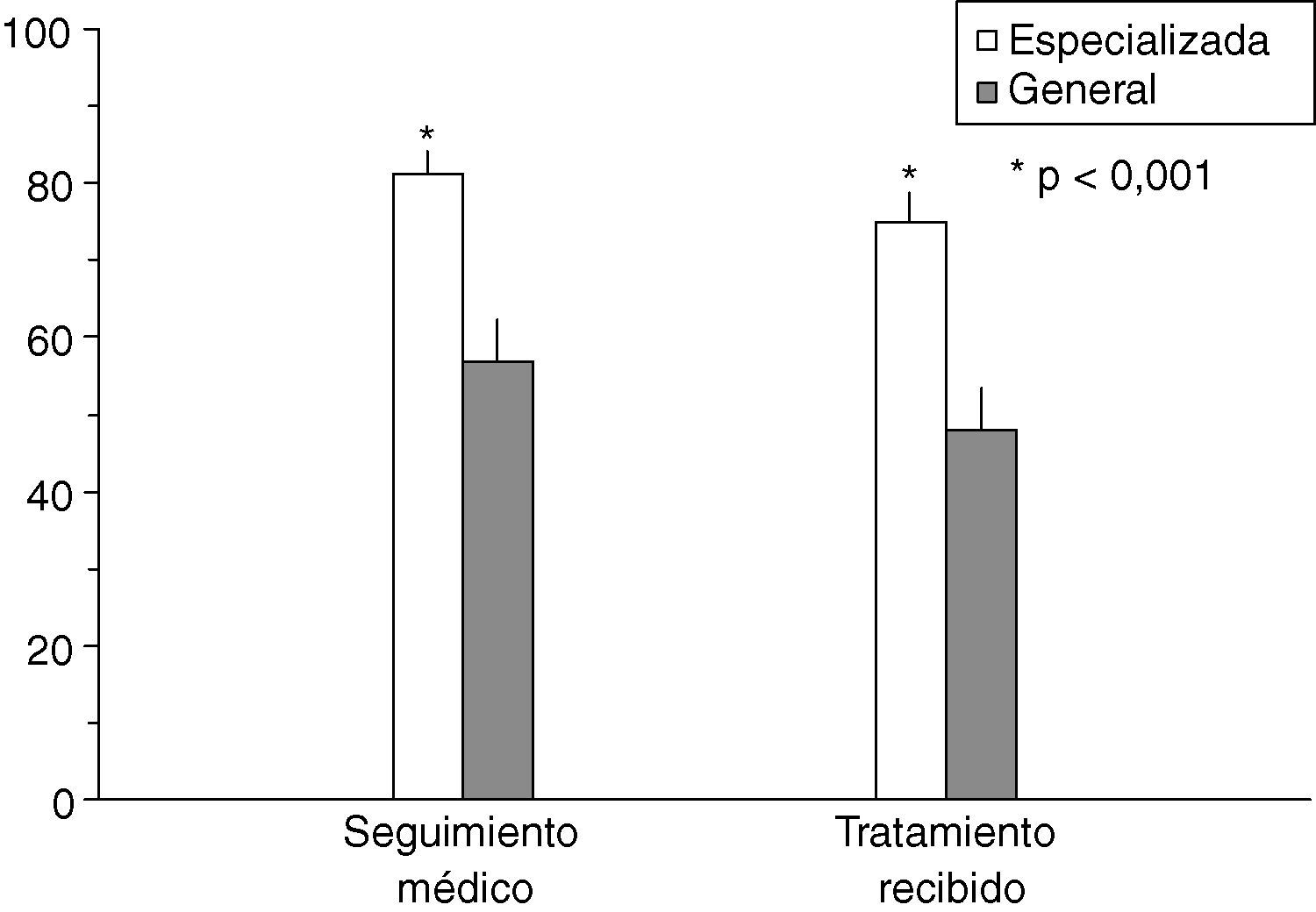
Como corolario, estos mejores resultados en salud se trasladaron al grado de satisfacción de los pacientes con el cuidado médico. Un porcentaje significativamente mayor de pacientes en CE que en CG se mostró satisfecho con el tiempo de espera, el tiempo dedicado a su problema de salud, las exploraciones solicitadas, el tratamiento recomendado o el alivio del dolor. En general, más del 50% de los pacientes en CE declaró estar satisfecho (categorías extremadamente/muy satisfecho) con estas facetas del cuidado médico frente a un 15-35% de los pacientes seguidos en CG (p<0,001) (fig. 2). De forma general, los pacientes atendidos en CE mostraron puntuaciones medias de satisfacción con el seguimiento médico y con el tratamiento recibido significativamente más elevadas que los pacientes atendidos en CG (p<0,001) (fig. 3).
Los resultados de este estudio han mostrado que el seguimiento clínico del DN en CE resultó ser una alternativa dominante cuando se compara con las CG, al asociarse mejores resultados clínicos o en salud (con menor intensidad del dolor e interferencia con las actividades diarias), mientras se mantuvo un coste similar, tanto en el componente sanitario como en la productividad laboral. Esto hizo que los pacientes atendidos en CE estuvieran significativamente más satisfechos con el cuidado médico que los seguidos en CG. Según el estudio, los resultados principales representan, por una parte, los costes de los recursos no sanitarios (transporte, cuidadores, rendimiento bajo en el puesto de trabajo, etc.) y los costes de los recursos sanitarios (medicamentos y otros tratamientos, visitas médicas, pruebas, hospitalizaciones, etc.). El 12,3% de los pacientes atendidos en CE y el 17,4% de los seguidos en CG utilizaron algún transporte sanitario, mientras que el 8,2% de los atendidos en CE y el 14,7% de los de CG contrataron algún cuidador formal (enfermeras, etc.), que en el caso del transporte sanitario llegó a ser casi estadísticamente significativo. Es de señalar que los costes farmacológicos representaron sólo entre un 13 y un 15% de los costes totales y entre un 20 y un 25% de los costes sanitarios; los costes por pérdidas de productividad laboral representaron el componente más importante: alrededor del 30%.
En el estudio se observó que en las CE se prescribe un número significativamente mayor de fármacos para tratar el DN, aunque no se traslada a una media mayor de costes farmacológicos, ya que la duración media de los tratamientos recogida en las historias de los pacientes fue inferior en CE que en CG (datos no mostrados). Además, salvo la excepción de la frecuencia en el uso de ibuprofeno (mayor en CE) y topiramato (mayor en CG), ambos tipos de asistencia neurológica usaron los distintos tratamientos farmacológicos existentes para el DN en una proporción similar por tipo de fármaco. Con escasas excepciones, y aunque se observaron tendencias numéricas hacia una menor utilización o coste, ambos modelos de asistencia sanitaria no mostraron diferencias relevantes en la utilización y los costes de los recursos sanitarios, lo que contrasta con la percepción de un mayor uso de recursos en unidades con dedicación monográfica a una determinada enfermedad médica. Sin embargo, y de forma consistente en todas las variables analizadas, los resultados en salud, medios con escalas autoadministradas, presentaron mejores resultados, estadísticamente significativos, cuando los pacientes son atendidos en CE frente a las CG, tanto en el grado como en la interferencia del dolor, y en todo el corolario de síntomas concomitantes (ansiedad, depresión, sueño), lo que se tradujo, por un lado, en una mejor calidad de vida relacionada con la salud desde la óptica del propio paciente, que lo llevó a declarar, de forma sistemática, estar más satisfecho con diferentes facetas del cuidado médico, y esto, no debe olvidarse, es uno de los objetivos prioritarios en una medicina centrada en el paciente. Derivado de estos resultados, y de la evolución de los costes, el cuidado o atención médica del DN en CE resultó ser una alternativa eficiente sobre el seguimiento de estos pacientes en CG, si asumimos la definición generalmente aceptada de eficiencia30,31.
No hemos podido encontrar estudios semejantes al nuestro, ni en nuestro entorno ni en otros sistemas sanitarios, por lo que creemos que, aunque con limitaciones, nuestro estudio es pionero en el campo de la neurología. Rodríguez et al20 informaron del coste del DN en unidades del dolor en España frente a un nivel asistencial distinto de aquél, pero únicamente recogieron los costes sanitarios y asumieron que el manejo clínico desde la perspectiva del control del dolor sería mejor en la unidad del dolor, ya que los pacientes eran referidos a esas unidades. Un estudio reciente, llevado a cabo en Irlanda y Polonia, revisó las diferentes estrategias analgésicas de manejo del DN, pero sin revisar sus aspectos económicos32. O’Connor recientemente revisa el coste-efectividad de algunas de las intervenciones disponibles basadas en fármacos para el tratamiento del DN de origen diabético o por neuralgia postherpética, pero sin entrar en el nivel de asistencia o cuidado médico33.
Los resultados observados en nuestro estudio no sólo presentan una utilidad desde la perspectiva clínica diaria, a saber, un mejor cuidado de la salud de los pacientes con DN que se traduce en mejoras en la calidad de vida del paciente que, además, está más satisfecho con el cuidado de su salud. Por otra parte, nuestro estudio presenta una utilidad práctica desde el punto de vista de la toma de decisiones sanitarias a la hora de la planificación de la utilización de los recursos sanitarios, al menos en el área de neurología y del tratamiento del DN. Si como algunos autores han reclamado previamente una mayor y mejor asistencia en neurología16–19, los resultados de este estudio ilustran sobre el camino a seguir a la hora de organizar la asistencia sanitaria en dolor en nuestros servicios de neurología. De esta manera, la implantación de nuevas consultas especializadas en el manejo del DN en neurología sería una decisión eficiente por cuanto, sin incurrir en mayores costes y utilización de recursos, se conseguiría una mejor atención de estos pacientes que redundaría en mejoras de su calidad de vida y satisfacción con el cuidado médico.
Nuestro estudio no está, sin embargo, exento de algunas limitaciones. La primera de ellas hace referencia a que participaron únicamente nueve servicios de neurología, lo que puede producir algún problema de representatividad a la hora de generalizar los resultados a otras unidades asistenciales de otras regiones geográficas. Aunque esto es cierto, no observamos diferencias relevantes entre las distintas unidades participantes, lo que nos hace confiar en cierta coherencia nacional a la hora del manejo del DN por el neurólogo clínico. Además, los centros reclutados se ubicaban en las regiones geográficas más pobladas, lo que garantiza su representatividad. Una segunda limitación hace referencia al tamaño final de la muestra reclutada en el estudio, que resultó algo escaso con relación al tamaño predeterminado al inicio del estudio, lo que ha penalizado su potencia estadística que se redujo a un 71%. Aunque esto quiere decir que podría ser no cierta la ausencia de diferencias reales en algunos de los contrastes estadísticos realizados, pensamos que los resultados generales muestran una tendencia que no contradice los hallazgos observados y las conclusiones extraídas, ya que la tendencia observada es que los pacientes atendidos en CE pudieran mostrar incluso menores costes en recursos sanitarios y no sanitarios, lo que terminaría por reforzar aún más la conclusión general de que en neurología la asistencia especializada del DN es más eficiente que la general. Una tercera posible limitación hace referencia al diseño del estudio, que imposibilitó valorar la situación clínica de los pacientes en el momento que son vistos por primera vez por el neurólogo, ya que la visita evaluada se produjo, en ambos casos, alrededor de 11 meses después. No obstante, aunque esto es cierto, los pacientes atendidos en ambos tipos de consultas fueron claramente homogéneos en todas las variables sociodemográficas y clínicas analizadas, incluidas comorbilidades, difiriendo únicamente, como cabía esperar, en el tiempo de demora o espera hasta ser visto por el neurólogo, menor en CE que en CG, lo que es atribuible a un mayor dinamismo de aquel tipo de asistencia médica.
En conclusión, el seguimiento clínico del DN en consulta especializada de neurología fue una alternativa dominante al asociarse a mejores resultados clínicos, con menor intensidad del dolor e interferencia con las actividades diarias, mientras se mantiene un coste similar, lo que puede resultar de interés para los gestores y decisores sanitarios a la hora de planificar la asistencia sanitaria del dolor neuropático en servicios de neurología en España.
PublicaciónLos resultados preliminares de este estudio han sido presentados en los congresos de AES 2009, ISPOR 2009 y SEN 2009.
FinanciaciónEste estudio ha recibido una ayuda económica no condicionada por Pfizer España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores desean agradecer las aportaciones realizadas por Javier Rejas en la realización del presente trabajo.