El síndrome de Guillain-Barré (SGB) es la causa más común de parálisis flácida aguda. En algunos pacientes ocurre falla ventilatoria secundaria a este trastorno, con complicaciones secundarias al soporte ventilatorio y a la movilidad reducida. La mayoría de los casos tienen buen pronóstico; el tratamiento se hace con plasmaferésis o inmunoglobulinas, además del soporte básico.
ObjetivoDescribir las características sociodemográficas, clínicas, de laboratorio y electrofisiológicas de los pacientes con SGB hospitalizados en las Unidades de Cuidado Intensivo (UCI) y Cuidado Especial del Instituto Neurológico de Colombia entre 2006 y 2012.
MetodologíaPresentación de serie de casos.
ResultadosPresentamos a 25 pacientes con SGB; el 68% de los pacientes fueron hombres, con una edad promedio de 54 años. El 60% de los pacientes ingresó entre los días 3 y 7 del inicio del cuadro, el 64% tuvo antecedente de infección respiratoria y el 20% de infección intestinal 20%. La mayoría de los pacientes (84%) presentó disociación albúmino-citológica. El 32% se presentó con polineuropatía inflamatoria desmielinizante aguda, el 28% con polineuropatía axonal motora y sensitiva aguda, el 28% con polineuropatía axonal motora aguda y el 12% con síndrome de Miller-Fisher. Los pacientes de UCI presentaron mayor tiempo de estancia hospitalaria, infecciones y un peor desenlace medido por Rankin modificado al mes.
ConclusionesEsta descripción corresponde a un grupo de pacientes críticos con SGB; su desenlace estuvo determinado por la severidad del cuadro clínico al ingreso. Nuestros hallazgos son comparables con lo publicado en la literatura mundial.
Guillain-Barré syndrome, an acute polyradiculoneuropathy that presents with weakness and areflexia, is the most common cause of acute flaccid paralysis. In certain patients, respiratory failure is secondary to this disorder, eventually causing patients to require mechanical ventilation and experience additional complications due to diminished respiratory support and related mobility limitations. Prognoses for most of these cases are positive; treatment consists of basic support combined with plasmapheresis or administration of immunoglobulins.
ObjectiveThis study sought to describe the socio-demographic, clinical, laboratory and neurophysiological characteristics of patients with Guillain-Barré syndrome who were hospitalised in the Intensive Care Unit of the Neurological Institute of Colombia between 2006 and 2012.
MethodologyThis study presents a case series.
ResultsWe surveyed 25 patients (32% female and 68% male) with Guillain-Barré syndrome and an average age of 54 years. Sixty per cent of these patients were admitted between days 3 and 7 after symptom onset; 64% had a history of respiratory infection and 20% had a history of intestinal infection. In addition, 84% of the patients presented with albuminocytological dissociation. We observed the following clinical subtypes of Guillain-Barré syndrome: inflammatory demyelinating polyneuropathy in 32%, acute motor-sensory axonal neuropathy in 28%, acute motor axonal neuropathy in 28%, and Miller Fisher syndrome in 12%.
ConclusionsIn this descriptive study of a group of critical care patients with GBS, results depended on patients’ clinical severity at time of admission. Our findings are similar to results published in the international literature.
El síndrome de Guillain-Barré (SGB) es una polineuropatía aguda que afecta aproximadamente de 0,4 a 4 por 100.000 habitantes anualmente. Tiene una distribución bimodal, presentándose en mayor proporción en adultos jóvenes y ancianos; sin embargo, la mayoría de las publicaciones han encontrado únicamente un aumento de la frecuencia de esta entidad en adultos mayores de 50 años. En 2 tercios de los pacientes el inicio de los síntomas es precedido por una enfermedad infecciosa1, por lo que se ha planteado un mecanismo de lesión inmune por reacción cruzada entre anticuerpos producidos contra antígenos microbianos y moléculas neuronales2, lo cual genera disfunción en la conducción nerviosa, con las subsecuentes manifestaciones motoras, sensitivas o autonómicas1,3–5.
El diagnóstico de SGB es fundamentalmente clínico. La elevación de las proteínas en el estudio de líquido cefalorraquídeo sin pleocitosis (disociación albúmino-citológica) apoya el diagnóstico de SGB; sin embargo, debe recordarse que este hallazgo puede estar ausente hasta en el 50% de los pacientes en la primera semana de inicio del cuadro, y en el 25% a la tercera semana6, por lo que un LCR normal no excluye el diagnóstico, en especial si se analiza en los primeros días. Los estudios de electrodiagnóstico (velocidades de conducción nerviosa y electromiografía) ayudan a subclasificar el SGB en variantes electrofisiológicas de acuerdo con el patrón de lesión neuronal presente en la polineuropatía desmielinizante inflamatoria aguda (AIDP), la polineuropatía axonal motora aguda (AMAN) y la polineuropatía axonal sensitiva y motora aguda (AMSAN), las cuales se asocian a distintos grados de severidad y pronóstico7. En Estados Unidos y Europa predomina la AIDP8, mientras que en países como China, Japón y México la frecuencia de las variantes axonales asciende al 65% de los casos9.
El síndrome de Miller-Fisher (MF) es una variante clínica poco frecuente del SGB, caracterizado por oftalmoplejía, ataxia y arreflexia, y cuya patogénesis está asociada con la presencia de anticuerpos IgG antigangliósido GQ1b, que están presentes en más del 80% de los casos. Las alteraciones electrofisiológicas son variables y usualmente son leves, excepto la ausencia de reflejo H en el soleus, que al parecer es bastante confiable y constante en los pacientes con esta entidad10.
Cerca del 50% de los pacientes requiere hospitalización en la UCI, principalmente por compromiso ventilatorio (el cual ocurre en el 17 al 30%) y autonómico (20%)11,12. Varios factores clínicos se han relacionado con un mayor riesgo de requerir ventilación mecánica: progresión rápida del cuadro, debilidad de inicio simultáneo en miembros inferiores y superiores, diparesia braquial (3/5 o menos), cefaloparesia, debilidad facial y compromiso bulbar. Por el contrario, la preservación de los reflejos miotendinosos en los miembros superiores se relaciona con un menor riesgo de requerir ventilación mecánica13.
Varios factores se han relacionado con la presentación falla ventilatoria en estos pacientes. En un estudio prospectivo de 154 pacientes14 con este diagnóstico, se encontró que los factores de riesgo independientes para ventilación mecánica fueron la reducción en la capacidad vital forzada y la relación entre el potencial de acción muscular compuesto (CMAP) proximal y distal (pCMAP/dCMAP) del nervio peroneal común. Otro estudio prospectivo de 397 pacientes encontró que los principales factores de falla ventilatoria fueron un menor tiempo transcurrido entre el inicio de la debilidad y el ingreso al hospital (progresión más rápida del déficit), mayor compromiso motor y la presencia de debilidad facial y/o bulbar15.
La hiponatremia secundaria al síndrome de secreción inadecuada de hormona antidiurética (SIADH) es un hallazgo común en los pacientes con SGB y se ha relacionado con mal pronóstico. Un estudio prospectivo de 50 pacientes encontró que 48% de ellos presentaron hiponatremia, la mayoría en el rango de moderado a severo. Los pacientes con SIADH presentaron con mayor frecuencia debilidad bulbar, compromiso ventilatorio, mortalidad, hospitalización prolongada y déficit motor más severo al alta16.
Durante la hospitalización en la UCI, estos pacientes tienen un mayor riesgo de presentar complicaciones como neumonía (54%), sepsis (24%), arritmias cardíacas (22%), íleo y/o perforación intestinal (17%), trombosis venosa profunda, tromboembolismo pulmonar, sangrado digestivo y colitis seudomembranosa, entre otras. Además, tienen un tiempo prolongado de dependencia funcional, y entre los pacientes que requieren ventilación mecánica, la mortalidad asciende al 8,5%, superando el promedio de muerte en todos los pacientes con SGB al año de seguimiento (5 a 6,5%)17.
El pilar del tratamiento farmacológico del SGB se basa en terapias inmunomoduladoras, dentro de las cuales existen 2 opciones: la plasmaféresis18, que busca remover los anticuerpos circulantes y el complemento, y la inmunoglobulina19, la cual interfiere con la activación de linfocitos T y B, modula la expresión de receptores Fc y evita la activación del complemento, entre otros mecanismos de acción propuestos20. El beneficio de estas terapias ya se ha comprobado mediante comparación con placebo; en el momento, no hay evidencia suficiente que apoye la superioridad de alguno de estos tratamientos en términos de eficacia y coste-efectividad. La decisión debe basarse en otras variables, como disponibilidad de la terapia, perfil de seguridad individualizado en cada contexto clínico y experiencia del grupo tratante21.
Materiales y métodosSe realizó un estudio observacional, retrospectivo, entre los años 2006 y 2012, de todos los pacientes con ingreso en la UCI y la UCE con los diagnósticos: «polineuropatía aguda», «SGB» o síndrome de MF».
El ingreso a estas unidades de cuidado crítico supone grados de diferente complejidad: en UCI se ingresa a pacientes con predictores de falla respiratoria, que van a requerir soporte con ventilación mecánica, y/o monitorización invasiva. En la UCE están pacientes con menor compromiso, pero cuyo riesgo de deterioro hemodinámico o respiratorio no permite vigilancia en salas de hospitalización general.
Se evaluaron las siguientes variables: características demográficas, clínicas, de laboratorio y electrofisiológicas, escala de Hughes1, compromiso ventilatorio, tratamiento, complicaciones (disautonomía, infecciones, hiponatremia) y pronóstico a corto plazo (1 y 3 meses) mediante la escala de Rankin modificada.
Los resultados se presentan describiendo las características de este grupo de pacientes y sus diferencias de acuerdo con el nivel de severidad y el manejo en UCI o UCE. Para el procesamiento y análisis de la información se utilizó SPSS versión 21.
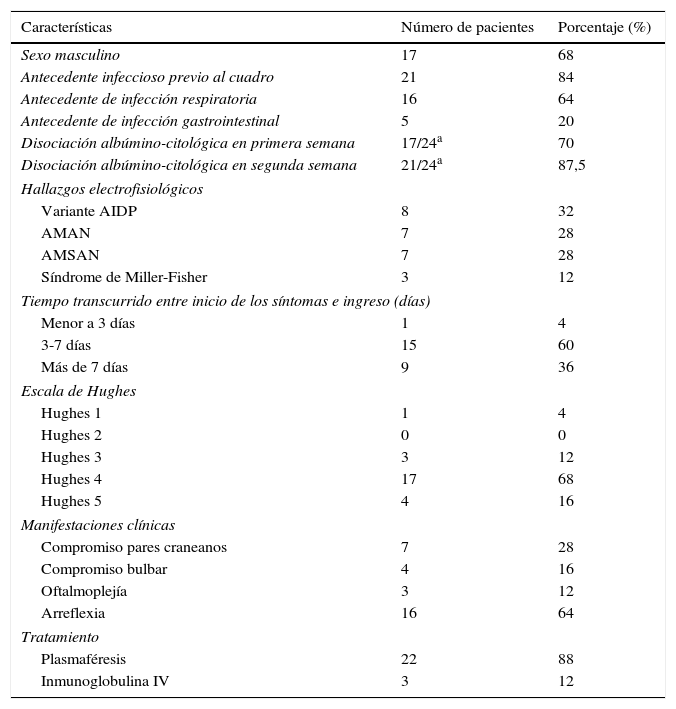
ResultadosSe encontró a 25 pacientes con diagnóstico de SGB en el período comprendido entre enero del 2006 hasta diciembre del 2012. La mayoría de los pacientes fueron hombres (68% vs. 32% mujeres), con un promedio ± desviación estándar de edad de 54 ± 19,7 años. Se encontró que el 84% había presentado un cuadro infeccioso previo al inicio del cuadro neurológico. Se describen las características generales de los pacientes en la tabla 1. En la tabla 2 se diferencian las características de acuerdo con la unidad a la que ingresaron (UCI o UCE).
Características basales de los pacientes
| Características | Número de pacientes | Porcentaje (%) |
|---|---|---|
| Sexo masculino | 17 | 68 |
| Antecedente infeccioso previo al cuadro | 21 | 84 |
| Antecedente de infección respiratoria | 16 | 64 |
| Antecedente de infección gastrointestinal | 5 | 20 |
| Disociación albúmino-citológica en primera semana | 17/24a | 70 |
| Disociación albúmino-citológica en segunda semana | 21/24a | 87,5 |
| Hallazgos electrofisiológicos | ||
| Variante AIDP | 8 | 32 |
| AMAN | 7 | 28 |
| AMSAN | 7 | 28 |
| Síndrome de Miller-Fisher | 3 | 12 |
| Tiempo transcurrido entre inicio de los síntomas e ingreso (días) | ||
| Menor a 3 días | 1 | 4 |
| 3-7 días | 15 | 60 |
| Más de 7 días | 9 | 36 |
| Escala de Hughes | ||
| Hughes 1 | 1 | 4 |
| Hughes 2 | 0 | 0 |
| Hughes 3 | 3 | 12 |
| Hughes 4 | 17 | 68 |
| Hughes 5 | 4 | 16 |
| Manifestaciones clínicas | ||
| Compromiso pares craneanos | 7 | 28 |
| Compromiso bulbar | 4 | 16 |
| Oftalmoplejía | 3 | 12 |
| Arreflexia | 16 | 64 |
| Tratamiento | ||
| Plasmaféresis | 22 | 88 |
| Inmunoglobulina IV | 3 | 12 |
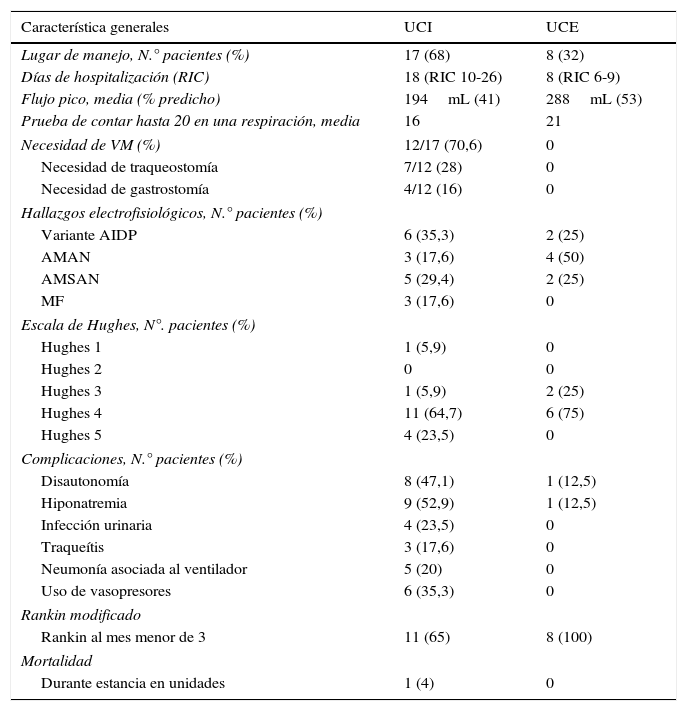
Características respecto al manejo en UCI o UCE
| Característica generales | UCI | UCE |
|---|---|---|
| Lugar de manejo, N.° pacientes (%) | 17 (68) | 8 (32) |
| Días de hospitalización (RIC) | 18 (RIC 10-26) | 8 (RIC 6-9) |
| Flujo pico, media (% predicho) | 194mL (41) | 288mL (53) |
| Prueba de contar hasta 20 en una respiración, media | 16 | 21 |
| Necesidad de VM (%) | 12/17 (70,6) | 0 |
| Necesidad de traqueostomía | 7/12 (28) | 0 |
| Necesidad de gastrostomía | 4/12 (16) | 0 |
| Hallazgos electrofisiológicos, N.° pacientes (%) | ||
| Variante AIDP | 6 (35,3) | 2 (25) |
| AMAN | 3 (17,6) | 4 (50) |
| AMSAN | 5 (29,4) | 2 (25) |
| MF | 3 (17,6) | 0 |
| Escala de Hughes, N°. pacientes (%) | ||
| Hughes 1 | 1 (5,9) | 0 |
| Hughes 2 | 0 | 0 |
| Hughes 3 | 1 (5,9) | 2 (25) |
| Hughes 4 | 11 (64,7) | 6 (75) |
| Hughes 5 | 4 (23,5) | 0 |
| Complicaciones, N.° pacientes (%) | ||
| Disautonomía | 8 (47,1) | 1 (12,5) |
| Hiponatremia | 9 (52,9) | 1 (12,5) |
| Infección urinaria | 4 (23,5) | 0 |
| Traqueítis | 3 (17,6) | 0 |
| Neumonía asociada al ventilador | 5 (20) | 0 |
| Uso de vasopresores | 6 (35,3) | 0 |
| Rankin modificado | ||
| Rankin al mes menor de 3 | 11 (65) | 8 (100) |
| Mortalidad | ||
| Durante estancia en unidades | 1 (4) | 0 |
El 60% de los pacientes consultó entre 3 y 7 días después del inicio de los síntomas. En el ingreso en la UCI se evaluó el grado de disfunción motora con la escala de severidad de Hughes: 17 pacientes ingresaron con grado 4 (68%); 4 pacientes (16%) en el grado 5; en el grado 3 ingresaron 3 pacientes (12%), y un solo paciente (4%) en el grado más bajo de limitación motora, el motivo de ingreso de este paciente a la unidad fue el compromiso de pares bajos.
Se ingresó a la UCI a 17 pacientes (68%) y 8 pacientes a la UCE (32%). El motivo de ingreso a las unidades fue riesgo de falla respiratoria, necesidad de intubación orotraqueal o necesidad de manejo con plasmaféresis (el 60, el 16 y el 20%, respectivamente).
La disociación albúmino-citológica se encontró en 21 pacientes (87,5%) a la segunda semana de evolución; 3 pacientes (12%) no presentaron disociación albúmino-citológica, en un paciente no se realizó estudio de LCR. En 4 pacientes, en quienes se realizó estudio de LCR en la primera semana, no se encontró disociación; sin embargo, en el control de la segunda semana todos estaban disociados. De los 3 pacientes sin disociación, en uno de ellos se realizó el estudio en la primera semana y no tuvo control de LCR; los otros 2 pacientes tuvieron estudio en la segunda semana (día 15, en un paciente con variante MF y en el día 10 en un paciente con variante AMAN).
Respecto a la clasificación según los hallazgos en el estudio electrodiagnóstico, las variantes axonales fueron las más comunes: 7 pacientes (28%) se presentaron con cada uno de los subtipos axonales (AMAN y AMSAN). Ocho pacientes (32%) presentaron la variante AIDP y 3 pacientes presentaron MF (12%). En 2 pacientes con MF los anticuerpos anti-GQ1b fueron positivos.
Del total de los pacientes, 12 pacientes (48%) requirieron ventilación mecánica, los cuales corresponden al 70,6% de los ingresados en la UCI; de estos últimos, 6 pacientes ingresaron intubados a la unidad (35,3%), 3 se intubaron inmediatamente a su llegada, y los otros 3 pacientes requirieron intubación en su primer día de ingreso. El promedio de flujo pico en estos pacientes fue 194mL, que corresponde al 41% del valor predicho y una media de 16 en la prueba de contar hasta 20 en una respiración. La hospitalización promedio en estas unidades fue de 11 días (RIC: 8-20), en la UCI fue de 18 días (RIC: 10-26) y en UCE de 8 días (RIC: 6-9). Este tiempo fue mayor en los pacientes que necesitaron soporte ventilatorio, con un promedio de 19 días (RIC: 13-37).
Se midieron los niveles séricos de sodio al ingreso a las unidades; el 40% de los pacientes presentó hiponatremia (sodio menor de 135 mOsm/L), la media de sodio fue 126,87 ± 7,5 mOsm/L. En la UCE solo un paciente ingresó con hiponatremia (12,5%) y en la UCI 9 pacientes (52,9%); de los pacientes con hiponatremia, el 72,7% requirió ventilación mecánica.
En los pacientes de la UCI se presentaron complicaciones relacionadas con la estancia: 5 pacientes (20%) presentaron neumonía asociada al ventilador; 4 pacientes (23,4%) presentaron infección urinaria (infección del tracto urinario); 3 pacientes (17,6%) presentaron traqueítis, 8 (47,1%) presentaron disautonomía y 6 pacientes (35,6%) requirieron soporte vasopresor. En la UCE solo un paciente presentó disautonomía (12,5%). El tratamiento fue, en su mayoría, con plasmaféresis (22 pacientes); solo 3 pacientes recibieron inmunoglobulina.
Al mes del egreso, el 72% de los pacientes tenían Rankin modificado menor o igual a 3. La proporción de pacientes con Rankin modificado al mes menor o igual a 3 fue mayor en el grupo de UCE comparado con UCI (100% vs. 64%). En el seguimiento a los 3 meses, el Rankin modificado menor o igual a 3 se encontró en todos los pacientes evaluados (17 en total).
Se presentó una muerte en UCI (4%), en una paciente de 77 años con daño axonal severo, quien falleció por neumonía asociada a ventilador.
DiscusiónEste trabajo describe a un subgrupo de pacientes con SGB severo que requirieron hospitalización en las unidades de cuidado neurocrítico (UCI y UCE).
Tenemos conocimiento de un estudio colombiano previo, en el cual se describió una serie de 46 pacientes con SGB, de los cuales el 50% requirió manejo en la UCI. De estos pacientes, el 54% eran mujeres, en el 71,11% se encontró disociación albúmino-citológica, y respecto a los patrones electrofisiológicos, 24 tuvieron AIDP, 14 AMAN y 5 AMSAN. Tres pacientes fallecieron22.
Encontramos una mayor frecuencia de hombres (68%) y un promedio de edad en la sexta década de la vida (52,8 años), lo cual se asemeja a los resultados publicados por Sejvar et al.23 en su metaanálisis realizado con población europea y norteamericana, donde encuentran un promedio de edad mayor en los casos de SGB y mayor frecuencia en hombres que en mujeres.
Encontramos el antecedente de infección respiratoria y gastrointestinal en el 64% y en el 20% de los pacientes, respectivamente. Un estudio realizado en población norteamericana y europea24 encontró resultados similares, ya que hasta el 53% de los pacientes presentó el antecedente de infección respiratoria superior, y entre el 6 y el 26% tuvo previamente síntomas gastrointestinales.
Respecto a la clasificación electrofisiológica, encontramos una mayor frecuencia de las variantes axonales (AMAN y AMSAN), las cuales se presentaron en un 56% de los pacientes, seguida de la AIDP, en el 32% de los pacientes. La variante MF se encontró en un 12% de los casos. Esto concuerda con lo reportado en la literatura mundial, en la cual la variedad axonal se presenta más frecuentemente en países de Suramérica, América Central, Japón y China24.
La presencia de disociación albúmino-citológica se ha descrito superior al 50% en la primera semana del SGB y en más del 75% en la tercera semana1; nosotros encontramos una frecuencia de disociación albúmino-citológica en la primera semana del 70% y en la segunda semana del 87,5%. Nunca será suficiente la insistencia en realizar un estudio de LCR en búsqueda de disociación albúmino-citológica luego de 7 días de inicio del cuadro clínico; este es de gran valor clínico, en especial si no se cuenta con la posibilidad de realización rápida de estudios electrofisiológicos.
En nuestra serie de casos, el tiempo medio de estancia en la UCI fue de 21 días, el 48% de los pacientes requirió ventilación mecánica y, entre ellos, 4 pacientes (20%) presentaron neumonía asociada al ventilador. Estos resultados son similares a lo reportado previamente en la literatura mundial. En el grupo de 114 pacientes descrito por Henderson et al.11, el tiempo en la UCI fue de 30 días, aproximadamente, y el 53% de los pacientes requirió ventilación mecánica. El 82% de los pacientes presentó complicaciones, principalmente neumonía y traqueobronquitis asociadas a ventilación mecánica (50%), y sepsis en el 20%. Otro estudio17 describió un grupo de 76 pacientes con SGB que requirieron hospitalización en cuidado crítico durante 21 días en promedio, y un 78% de ellos necesitó soporte ventilatorio invasivo.
Encontramos que los pacientes con SGB que requirieron intubación fueron aquellos con mayor severidad al ingreso, hiponatremia y aquellos con un flujo pico bajo según el valor predicho, e incapacidad de contar hasta 20 en una respiración. Esto concuerda con estudios prospectivos, en los que se han encontrado como factores de riesgo independientes para ventilación mecánica un mayor compromiso de la capacidad vital forzada14, un menor tiempo entre el inicio de la debilidad y el ingreso al hospital, una mayor severidad al ingreso evaluada por la sumatoria del Medical Research Council2 y la presencia de debilidad facial y/o bulbar15.
Otras complicaciones que se encontraron durante la hospitalización en la UCI fueron disautonomía (47,1%) e hiponatremia (52,9%). En nuestra descripción encontramos una media de sodio en pacientes con hiponatremia de 126,87 ± 7,5 mOsm/L y un 28% de los pacientes con niveles inferiores a 133 mom/L, lo cual se encuentra en el rango de lo descrito en estudios previos, en los que se ha reportado la presencia de hiponatremia (usualmente leve-moderada) entre el 25%11 y el 46% de los pacientes con SGB en la UCI17. De forma similar a lo reportado en estudios previos16, la hiponatremia se comportó como predictor de mal pronóstico, ya que en el grupo de pacientes que presentaron este trastorno el 72,7% requirió ventilación mecánica.
Respecto al tratamiento, se realizó plasmaféresis en 22 pacientes (88%); los 3 pacientes con MF se manejaron con inmunoglobulina. Esta decisión es porque en nuestro centro la plasmaféresis está más disponible, por lo cual se reserva la inmunoglobulina para casos específicos, como la variante MF, donde reportes retrospectivos se asocian a una reducción leve en la duración del cuadro clínico25.
Las tasas de mortalidad varían, de acuerdo con los diferentes estudios, desde el 4% hasta el 12,1%17,26,27; dentro de este rango se encuentran los resultados hallados en nuestro estudio, en el cual se evidenció una mortalidad del 4%. En un estudio prospectivo realizado en una cohorte de 527 pacientes con SGB, se encontró una mortalidad baja (2,5%) tras 6 meses de seguimiento, aunque mencionan que posiblemente esta baja frecuencia de muertes se debió a que la mayoría de los pacientes no presentaron un cuadro clínico lo suficientemente severo para requerir manejo en la UCI. La mayoría de las muertes ocurrieron en la fase de recuperación. Dentro de los factores de riesgo estaban la edad (mayores de 40 años), la severidad de la debilidad al ingreso, la falla ventilatoria, el retraso desde el inicio de la debilidad al ingreso y el tiempo transcurrido desde el inicio de los síntomas hasta el pico máximo de debilidad28. Estos mismos factores también estaban presentes en la paciente que falleció en nuestra descripción.
ConclusiónEl SGB es una causa importante de debilidad aguda y un porcentaje importante de los pacientes afectados puede requerir ventilación mecánica y manejo en la UCI. Existen varios factores que se han relacionado con el curso de la enfermedad y que pueden predecir un mejor o peor desenlace clínico.
Con este trabajo buscamos describir algunos factores clínicos, de laboratorio y electrofisiológicos de una población específica de pacientes con SGB que requirió manejo en las unidades de cuidado crítico neurológico, al igual que mencionar el tratamiento y las principales complicaciones que se presentaron.
Encontramos como factores relacionados con falla ventilatoria y necesidad de intubación una mayor severidad clínica al ingreso, la presencia de hiponatremia, un flujo pico bajo según el valor predicho e incapacidad de contar hasta 20 en una respiración. La mortalidad fue baja (4%) y el 100% de los pacientes evaluados a los 3 meses tuvo un buen desenlace funcional de acuerdo con la escala de Rankin modificado.
FinanciaciónEste trabajo no tuvo ningún tipo de financiación.
Conflicto de interesesNi ninguno de sus autores declara conflicto de interés.
Escala de evaluación funcional, va desde 0 (paciente normal); grado 1 (sintomático pero capaz de correr), grado 2 (incapaz de correr); grado 3 (incapaz de caminar sin ayuda), grado 4 (limitado a la cama), grado 5 (requiere soporte ventilatorio), grado 6 (muerto).