Los pacientes, tras un ictus o un ataque isquémico transitorio, presentan un riesgo muy elevado de sufrir nuevos episodios vasculares. La reducción del nivel de colesterol unido a lipoproteínas de baja densidad (cLDL) reduce la incidencia de nuevos episodios, si bien una proporción importante de pacientes no alcanza los objetivos terapéuticos recomendados con los tratamientos hipolipemiantes actuales. El objetivo de este documento de consenso es actualizar el papel de los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (iPCSK9; alirocumab y evolocumab) en la prevención secundaria de episodios vasculares en pacientes con ictus isquémico previo.
MétodosSe realizó una revisión bibliográfica para identificar las principales evidencias sobre el uso de iPCSK9 en estos pacientes y los objetivos terapéuticos recomendados de cLDL. Los resultados se discutieron en 2reuniones de consenso, que constituyeron la base para la elaboración del documento.
ConclusionesLos iPSCSK9 son eficaces en la reducción del riesgo vascular en prevención secundaria y, específicamente, evolocumab ha demostrado esta reducción en pacientes con ictus isquémico previo. Ambos fármacos han demostrado un buen perfil de seguridad, incluso en pacientes que alcanzaron un nivel de cLDL <20mg/dL. En este sentido, en el subestudio de episodios neurocognitivos con evolocumab no se observó ninguna señal de empeoramiento de la función cognitiva en pacientes con nivel muy bajo de cLDL. Con base en estas evidencias, en el documento se presentan recomendaciones prácticas sobre el uso de iPCSK9 para la prevención secundaria y seguimiento de episodios vasculares en pacientes con ictus isquémico previo.
Patients with history of stroke or transient ischaemic attack present considerable risk of future vascular events. Reducing levels of low-density lipoprotein (LDL) cholesterol decreases the incidence of new vascular events, although in a substantial number of patients, the currently available lipid-lowering therapies fail to achieve the therapeutic goals recommended in clinical guidelines. The aim of this consensus statement is to provide updated information on the role of the proprotein convertase subtilisin/kexin type 9 (PCSK9) inhibitors alirocumab and evolocumab in the secondary prevention of vascular events in patients with history of ischaemic stroke.
MethodsA literature review was performed to identify the main evidence on the use of PCSK9 inhibitors in these patients and the recommended therapeutic targets of LDL cholesterol. The results were discussed in 2 consensus meetings that constituted the basis for the drafting of the document.
ConclusionsPCSK9 inhibitors are effective in reducing vascular risk in secondary prevention; evolocumab specifically has achieved this reduction in patients with history of ischaemic stroke. Moreover, both alirocumab and evolocumab present good safety profiles, even in patients achieving LDL cholesterol levels <20 mg/dL, and no signs of cognitive impairment have been observed in patients treated with evolocumab who achieved very low levels of LDL cholesterol. In the light of this evidence, we provide practical recommendations about the use of PCSK9 inhibitors in secondary prevention of vascular events in patients with history of ischaemic stroke and follow-up of these patients.
Las enfermedades cerebrovasculares son una de las causas más frecuentes de morbilidad, discapacidad y mortalidad en Europa1,2. En España, constituyen la segunda causa de muerte más frecuente3. Además, los pacientes que han presentado un ictus tienen un riesgo elevado de nuevos episodios vasculares, incluyendo ictus recurrente2,4,5. En un metaanálisis de 13 estudios y 9.115 pacientes que sobrevivieron a un primer ictus, se observó un riesgo acumulativo de ictus recurrente del 3, 11, 26 y 39% a 30 días y a 1, 5 y 10 años, respectivamente5. La recurrencia de ictus se asocia además con un peor pronóstico, mayor incidencia de discapacidad y dependencia funcional y elevada mortalidad4,6.
El colesterol unido a lipoproteínas de baja densidad (cLDL) es un factor de riesgo de enfermedad vascular aterosclerótica ampliamente reconocido7,8. Puesto que la enfermedad aterosclerótica es una de las principales causas de ictus isquémico, el control de la dislipemia, sobre todo del nivel elevado de cLDL, es un factor de riesgo modificable clave que abordar en la prevención primaria y secundaria de ictus isquémico1,4,9. Está demostrado que la reducción del nivel de cLDL con los diversos tratamientos hipolipemiantes va ligada a una menor incidencia de episodios vasculares, incluyendo ictus isquémico8,10-12. Respecto a la prevención secundaria, la reducción del cLDL también se asocia a una reducción del riesgo de episodios vasculares en pacientes con historia de ictus previo13-15. Además, la evidencia disponible indica que, a mayor reducción del cLDL, menor es el riesgo de episodios vasculares, incluido el ictus4,10,12,16-18. Recientemente, se han reportado los resultados de un estudio en el que pacientes con ictus o ataque isquémico transitorio (AIT) y evidencia de enfermedad arterioesclerótica, fueron aleatorizados a un objetivo de cLDL <70mg/dL o a un objetivo de entre 90 y 110mg/dL17. El objetivo primario compuesto de episodios vasculares mayores (ictus isquémico, infarto de miocardio, nuevos síntomas que requirieron revascularización urgente coronaria o carotídea, o muerte por causas vasculares) ocurrió significativamente en menos pacientes en el grupo de nivel bajo de cLDL en comparación con el grupo de nivel más alto (8,5 vs. 10,9%; HR 0,78; IC: 0,61-0,98; p=0,04). En este sentido, en un metaanálisis que incluyó 23 estudios aleatorizados de terapias hipolipemiantes, se observó una reducción del 23,5% del riesgo relativo de ictus por cada reducción de 1 mmol/L (39mg/dL) en el nivel de cLDL18. Esta asociación entre nivel de cLDL y riesgo de ictus fue lineal desde niveles elevados de cLDL hasta niveles muy bajos y resultó consistente entre estudios de prevención primaria y secundaria.
A pesar de ello, los datos disponibles sobre el grado de control de la dislipemia en la prevención vascular secundaria de pacientes con ictus previo en Europa y España muestran que un porcentaje sustancial de estos pacientes tienen un control pobre del nivel de cLDL4,19. Datos del módulo específico de ictus del estudio EUROASPIRE III mostraron que, de los 881 pacientes con historia de ictus que fueron entrevistados 550 días después del episodio, solo el 34,4% habían alcanzado el objetivo terapéutico de cLDL, a pesar de que el 56,8% recibían tratamiento con estatinas19. En este mismo sentido, el reciente EUROASPIRE V confirma que en Europa la mayoría de los pacientes en prevención secundaria de episodios vasculares no alcanza los objetivos terapéuticos de cLDL20. En España, varios estudios han demostrado que el grado de control de los factores de riesgo vascular en la prevención secundaria de ictus, incluyendo la dislipemia, es bajo e insuficiente4,21-23. Según la última encuesta de salud realizada en nuestro país sobre factores de riesgo y enfermedad vascular, el 83,0% de los pacientes con enfermedad cerebrovascular tiene un nivel de cLDL inferior a 130mg/dL; mientras que solo el 56,5% muestra un nivel de cLDL <100mg/dL24.
Históricamente, las estatinas han sido el principal pilar del tratamiento hipolipemiantes para la prevención vascular25-27. Sin embargo, en aquellos pacientes que no alcanzan los objetivos terapéuticos a pesar de un tratamiento óptimo con estatinas, o que demuestran intolerancia a estos fármacos, es necesario un tratamiento hipolipemiantes adicional25-28. Los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (iPCSK9) son fármacos hipolipemiantes que alcanzan reducciones significativas del cLDL en pacientes en tratamiento hipolipemiantes estándar, con un buen perfil de seguridad8,28,29. En España se han comercializado 2iPCSK9, los anticuerpos monoclonales evolocumab y alirocumab, ambos con indicación para el tratamiento de la hipercolesterolemia primaria, dislipemia mixta y enfermedad vascular aterosclerótica establecida25,30,31. Los datos del estudio FOURIER demostraron que añadir evolocumab a un tratamiento con estatinas en pacientes con enfermedad vascular aterosclerótica establecida reduce significativamente el riesgo de nuevos episodios vasculares8. Alirocumab también ha demostrado en el ensayo ODYSSEY Outcomes que reduce el riesgo de episodios vasculares isquémicos recurrentes en pacientes con síndrome coronario agudo previo32. Además, un subanálisis del FOURIER en 5.337 pacientes con historia de ictus previo ha confirmado que evolocumab también reduce el riesgo vascular en este subgrupo de pacientes15. En consecuencia, las indicaciones de los iPCSK9 han sido recientemente ampliadas para incluir la reducción del riesgo vascular en adultos con enfermedad vascular establecida27,28.
Los resultados de eficacia y seguridad de los iPCSK98,32, junto con las nuevas evidencias sobre los beneficios y seguridad de un nivel bajo de cLDL7,8,12,28,32,33, han propiciado la revisión de numerosas guías de práctica clínica de reducción de riesgo vascular y control de la dislipemia para posicionar a los iPCSK9 en el arsenal terapéutico y revisar los objetivos terapéuticos en pacientes de alto riesgo o enfermedad vascular establecida1,25,26,34-41. Por tanto, se considera oportuna la elaboración de un documento desde el campo de la neurología, con el objetivo de aportar recomendaciones prácticas sobre el uso iPCSK9 para la prevención secundaria de episodios vasculares en pacientes con ictus isquémico previo, que refleje tanto la evidencia disponible como la opinión y experiencia clínica de los autores.
MetodologíaEl presente documento refleja el trabajo realizado por un grupo de neurólogos expertos durante una sesión participativa celebrada en Madrid el 28 de noviembre de 2018. Previamente, se predefinieron los objetivos del documento, la metodología y la dinámica de trabajo. Durante la reunión, se llevó a cabo un debate ordenado con participación de todos los expertos, en el que se definió la información que incluir en cada uno de los puntos del documento y los perfiles de pacientes prioritarios con ictus isquémico que pueden beneficiarse más del tratamiento con iPCSK9, y se establecieron los objetivos terapéuticos para cada perfil.
Tras la sesión, los autores elaboraron un borrador del documento con el apoyo de un redactor médico profesional. Para identificar la evidencia necesaria para su redacción, se realizó una revisión bibliográfica entre noviembre de 2018 y enero de 2019, con la base de datos MEDLINE y se incluyeron los estudios relevantes publicados en inglés o español. Tras 2rondas de revisión del borrador hechas por los autores, se celebró una segunda reunión participativa (3 de diciembre de 2019, en Madrid) con el objetivo de discutir e incorporar las nuevas evidencias relevantes aparecidas durante la elaboración del documento, así como para aprobar de manera definitiva el consenso del grupo con relación a los perfiles de pacientes y los objetivos terapéuticos. Tras la reunión, se incorporaron los cambios en una última versión del documento, que se envió a todos los autores para su aprobación final.
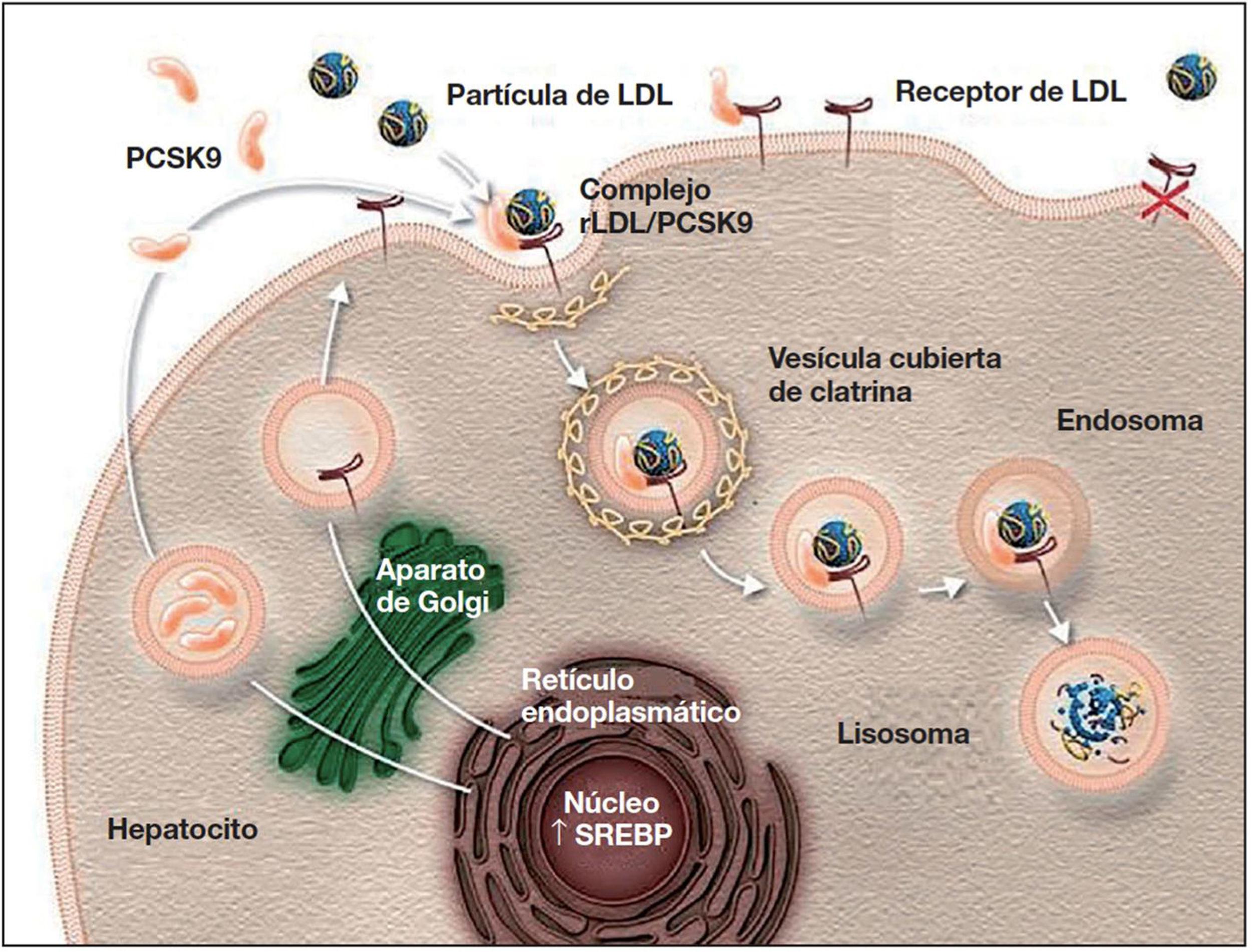
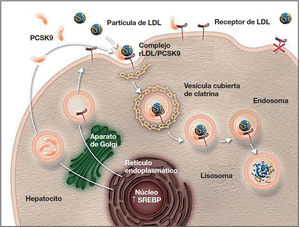
Mecanismo de acción e indicaciones de los iPCSK9La PCSK9 es una proteína sintetizada principalmente en el hígado27 que participa en la regulación del metabolismo del cLDL25,27. En condiciones normales, los receptores de cLDL en la superficie de los hepatocitos captan el cLDL circulante y se internan hacia el citoplasma mediante endocitosis. En el endosoma, el cLDL se separa del receptor y, mientras que el cLDL es degradado, el receptor es reciclado a la superficie celular25,27,42,43. Cuando la PCSK9 se une al receptor de cLDL, el complejo proteína-receptor sufre el mismo proceso de endocitosis; sin embargo, la PCSK9 no permite que el receptor se recicle en la superficie del hepatocito, lo que disminuye la captación del cLDL circulante26,27,42,43 (fig. 1). Además, la PCSK9 parece aumentar la degradación intracelular de los receptores de cLDL, incluso antes de que estos lleguen a ser secretados27. La inhibición de la PCSK9 mediante anticuerpos monoclonales bloquea la acción de esta proteína, al evitar su unión al receptor de cLDL, y permite que estos receptores se reciclen, con la consiguiente reducción del cLDL circulante27,42. Los iPCSK9 tienen un efecto rápido y potente sobre el nivel de cLDL, con una supresión máxima de la PCSK9 circulante que se observa a las 4-8 h tras la administración del anticuerpo, y con reducciones del nivel de cLDL de ∼60% en pacientes con hipercolesterolemia8,27. En comparación con placebo y el tratamiento hipolipemiantes convencional, los iPCSK9 también se han asociado con un aumento del colesterol unido a lipoproteínas de alta densidad (cHDL) y una reducción del colesterol total, triglicéridos y de lipoproteína (a)42,44,45. Asimismo, se ha señalado que los iPCSK9 tienen un efecto sinérgico al de las estatinas, ya que estas, además de aumentar la expresión de los receptores de cLDL, aumentan la expresión de PCSK9 en los hepatocitos43,46,47.
Papel de PCSK9 en la degradación de los receptores de cLDL79.
Autorizado por Amgen Inc.
Las indicaciones aprobadas para evolocumab y alirocumab30,31 aparecen resumidas en la tabla 1. Ambos iPCSK9 se administran por vía subcutánea30,31.
Indicaciones de los iPCSK9 aprobadas por la Agencia Europea del Medicamento y financiadas por el Sistema Nacional de Salud
| Evolocumab | Alirocumab | |
|---|---|---|
| Indicaciones aprobadas por la EMA30,31 | 1. Hipercolesterolemia y dislipemia mixtaAdultos con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipemia mixta, como complemento a la dieta:- En combinación con una estatina o con una estatina y otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar el nivel objetivo de cLDL con la dosis máxima tolerada de estatina- Solo o en combinación con otros tratamientos hipolipemiantes en pacientes intolerantes a las estatinas o en los que las estatinas están contraindicadas2. Hipercolesterolemia familiar homocigóticaAdultos y adolescentes a partir de 12 años con hipercolesterolemia familiar homocigótica en combinación con otros tratamientos hipolipemiantes3. Enfermedad vascular aterosclerótica establecidaAdultos con enfermedad vascular aterosclerótica establecida (infarto de miocardio, ictus o enfermedad arterial periférica) para reducir el riesgo vascular disminuyendo el nivel de cLDL, como tratamiento adyuvante a la corrección de otros factores de riesgo:- En combinación con la dosis máxima tolerada de estatina con o sin otros tratamientos hipolipemiantes- Solo o en combinación con otros tratamientos hipolipemiantes en pacientes intolerantes a las estatinas o en los que las estatinas están contraindicadas | 1. Adultos con hipercolesterolemia primaria (familiar heterocigótica y no familiar) o dislipemia mixta, como tratamiento complementario a la dieta:- En combinación con una estatina o una estatina con otros tratamientos hipolipemiantes en pacientes que no consiguen alcanzar sus objetivos de cLDL con la dosis máxima tolerada de una estatina- En monoterapia o en combinación con otros tratamientos hipolipemiantes en pacientes con intolerancia a las estatinas, o en los que se contraindique el uso de una estatina2. Enfermedad vascular aterosclerótica establecidaAdultos con enfermedad vascular aterosclerótica establecida para reducir el riesgo vascular, disminuyendo el nivel de cLDL, como tratamiento adyuvante a la corrección de otros factores de riesgo:- En combinación con la dosis máxima tolerada de una estatina con o sin otros tratamientos hipolipemiantes- Solo o en combinación con otros tratamientos hipolipemiantes en pacientes que son intolerantes a estatinas o a los que se les ha contraindicado una estatina |
cLDL: colesterol unido a lipoproteínas de baja densidad; EMA: Agencia Europea del Medicamento; iPCSK9: inhibidores de la proproteína convertasa subtilisina/kexina tipo 9; SNS: Sistema Nacional de Salud.
El efecto de los iPCSK9 sobre la reducción del riesgo vascular se ha evaluado en 2grandes ensayos clínicos aleatorizados, FOURIER (evolocumab) y ODYSSEY Outcomes (alirocumab), cuyas principales características y resultados se resumen en la tabla 28,29,32,41. Estos 2ensayos evaluaron la eficacia y seguridad de iPCSK9 en pacientes con enfermedad vascular y nivel elevado de cLDL o colesterol no HDL a pesar de un tratamiento con estatinas de intensidad alta o moderada. Evolocumab y alirocumab redujeron el nivel de cLDL basal frente a placebo en aproximadamente un 60%. En ambos ensayos se alcanzó el objetivo primario de eficacia, con reducciones significativas del 15% del riesgo de episodios vasculares vs. placebo, incluyendo muerte de origen vascular, infarto de miocardio, ictus, revascularización coronaria u hospitalización por angina inestable en el caso del estudio FOURIER, y muerte por enfermedad coronaria, infarto de miocardio no mortal, ictus isquémico mortal o no mortal u hospitalización por angina inestable en el estudio ODYSSEY Outcomes8,32.
Principales características y resultados de eficacia de los ensayos clínicos aleatorizados FOURIER y ODYSSEY OUTCOMES
| FOURIER (evolocumab)8 | ODYSSEY OUTCOMES (alirocumab)32 | |
|---|---|---|
| Diseño del estudio | Ensayo aleatorizado, multicéntrico, doble ciego, controlado con placeboAleatorización 1:1Evolocumab (140mg cada 2 semanas o 420mg una vez al mes) o placebo, ambos por vía subcutánea | Ensayo aleatorizado, multicéntrico, doble ciego, controlado con placeboAleatorización 1:1Alirocumab (75mg cada 2 semanas) o placebo, ambos por vía subcutáneaLa dosis de alirocumab fue ajustada para alcanzar un nivel de cLDL de 25-50 mg/dL |
| Principales criterios de inclusión | 40-85 años, enfermedad vascular aterosclerótica establecida (infarto de miocardio, ictus no hemorrágico, enfermedad arterial periférica), cLDL ≥ 70 mg/dL o colesterol no HDL ≥ 100 mg/dL en tratamiento optimizado con estatinasa | ≥40 años, hospitalización por síndrome coronario agudo (infarto de miocardio o angina inestable), cLDL ≥70 mg/dL o colesterol no?HDL ≥100 mg/dL o apolipoproteína B ≥80 mg/dL, en tratamiento con estatinas de alta intensidadb |
| Objetivos principalesdel estudio | Primario: variable compuesta de episodios vasculares (muerte vascular, infarto de miocardio, ictus, revascularización coronaria u hospitalización por angina inestable)Secundario: variable compuesta de MACE (muerte vascular, infarto de miocardio o ictus) | Primario: variable compuesta de episodios vasculares (muerte por enfermedad coronaria, infarto de miocardio no mortal, ictus isquémico mortal o no mortal u hospitalización por angina inestable) |
| Principales resultados de eficacia | N=27.564; evolocumab, n=13.1784; placebo, n=13.780Historia previa de:- Infarto de miocardio: 81,1%- Ictus no hemorrágico: 19,4%- Enfermedad arterial periférica: 13,2%Seguimiento (mediana): 2,2 añosA las 48 semanasEvolocumab:- Redujo el nivel de cLDL en un 59% en comparación con placebo (p <0,001; mediana basal cLDL, 92 mg/dL; mediana cLDL a la semana 48, 30 mg/dL) a las 48 semanas de tratamiento- Redujo el riesgo del objetivo primario en un 15% (hazard ratio: 0,85; p <0,001)- Redujo el riesgo del objetivo secundario en un 20% (hazard ratio: 0,80; p <0,001) | N=18.924; alirocumab, n=9.462; placebo, n=9.462Historia previa de:- Infarto de miocardio: 83,0%- Angina inestable: 16,8%- Ictus: 3,2%- Enfermedad arterial periférica: 4,0%Seguimiento (mediana): 2,8 añosAlirocumab:- Redujo los niveles de cLDL en un 61% respecto a placebo a los 12 meses de tratamiento- Redujo el riesgo del objetivo primario en un 15% (hazard ratio, 0,85; p <0,001) |
cLDL: colesterol unido a lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad; MACE: episodios cardiovasculares mayores.
En el ODYSSEY Outcomes, todos los pacientes incluidos debían tener historia de hospitalización por síndrome coronario agudo en el año anterior y en el FOURIER se estableció como criterio de inclusión la presencia de enfermedad vascular aterosclerótica establecida, incluyendo infarto de miocardio, ictus no hemorrágico o enfermedad arterial periférica8,32. En el estudio ODYSSEY Outcomes, el 3,2% de los pacientes en cada grupo tenía historia de ictus, si bien no se realizaron análisis específicos en este subgrupo de 611 pacientes32. Por otro lado, en el estudio FOURIER, el 19,4% (n=5.337) de los pacientes tenían historia de ictus no hemorrágico previo, lo que ha permitido evaluar el efecto del tratamiento con evolocumab sobre el riesgo vascular en este subgrupo8,15. Los niveles basales de cLDL y cHDL de estos pacientes con historia de ictus en el ensayo FOURIER fueron de 97,5 y 47,8mg/dL, respectivamente. Evolocumab alcanzó en este subgrupo una reducción significativa del cLDL del 56% vs. placebo (similar a lo observado en la población global), con una reducción absoluta de 53mg/dL, hasta obtener una mediana de cLDL de 29mg/dL (vs. 89mg/dL en el grupo placebo, p<0,001), sin datos de problemas de seguridad15. Asimismo, el objetivo primario de eficacia en la reducción de nuevos episodios vasculares también se alcanzó en este subgrupo de pacientes con ictus, con una reducción significativa del 15% del riesgo de sufrir un nuevo episodio, incluyendo muerte de origen vascular, infarto de miocardio, ictus, revascularización coronaria u hospitalización por angina inestable (p=0,047). Por tanto, el tratamiento con evolocumab parece tener un efecto beneficioso y una seguridad similar en pacientes con ictus previo y en pacientes con historia de otras enfermedades vasculares15. Tal y como se ha comentado, los resultados del estudio FOURIER han dado lugar a una nueva indicación de evolocumab para la reducción del riesgo vascular en adultos con enfermedad aterosclerótica establecida, incluyendo pacientes con ictus previo31.
Puesto que el riesgo de ictus recurrente persiste a medio y largo plazo en aquellos pacientes que ya han presentado un primer ictus5, es importante que los tratamientos hipolipemiantes utilizados en prevención secundaria sean eficaces en el futuro. En este sentido, tanto alirocumab como evolocumab han demostrado reducciones de cLDL sostenidas en el tiempo en los ensayos clínicos8,32, aunque aún es necesario recabar datos a más largo plazo con estos fármacos. Evolocumab ha demostrado una reducción sostenida del cLDL del 58% respecto al nivel basal tras 5 años de tratamiento, sin nuevas señales de seguridad48.
La adherencia es otro aspecto clave en cualquier tratamiento utilizado en prevención secundaria, ya que la falta de adherencia al tratamiento preventivo se asocia a peores resultados clínicos49,50. La adherencia a los iPCSK9 en los ensayos clínicos ha sido elevada49,51,52, con una adherencia a evolocumab del 79% tras 44 meses de tratamiento, superior a los datos de adherencia de otros tratamientos hipolipemiantes, incluyendo las estatinas52. Aunque la información en vida real es limitada, los datos disponibles hasta ahora indican una adherencia satisfactoria a los iPCSK950.
La seguridad del nivel bajo de cLDLExiste una relación directa entre el nivel de cLDL y el riesgo de episodios vasculares41,53. Los datos publicados con relación al tratamiento con estatinas11, ezetimiba+estatinas12 e iPCSK97,8,32,52 han confirmado que, cuanto más bajo es el nivel de cLDL, menor es el riesgo de sufrir episodios vasculares, en lo que se ha denominado el concepto de «cuanto más bajo, mejor» o la «hipótesis de cLDL cero»28,33,53. Esta teoría ha tomado especial fuerza tras la disponibilidad de los iPCSK9 y los resultados de los estudios FOURIER y ODYSSEY, en los que se han alcanzado niveles de cLDL aún más bajos a los obtenidos con estatinas o estatinas+ezetimiba, con un beneficio añadido al reducir aún más el riesgo de sufrir nuevos episodios7,8,32,53,54.
La principal preocupación de los médicos a la hora de manejar a pacientes que alcanzan un nivel bajo o muy bajo de cLDL es la seguridad asociada a estos niveles. Los estudios iniciales con estatinas señalaron una posible relación entre nivel bajo de cLDL y un aumento del riesgo de hemorragia cerebral13. Un único estudio prospectivo encontró un mayor riesgo de hemorragia cerebral en aquellos pacientes con nivel de cLDL <70mg/dL en comparación con pacientes con un cLDL entre 70-99mg/dL55. Sin embargo, las limitaciones metodológicas del estudio dificultan la extrapolación de los resultados a otras poblaciones, ya que este se realizó en una cohorte de pacientes con factores de riesgo vascular procedentes de una población concreta en China (el riesgo de hemorragia cerebral es mayor en poblaciones orientales que en caucásicas)56, y no se incluyeron datos como el nivel de control de la hipertensión arterial o pruebas de neuroimagen que permitieran clasificar esta población en cuanto a riesgo hemorrágico55.
Por el contrario, varios estudios, así como las guías 2019 para el manejo de la dislipemia de la Sociedad Europea de Cardiología/Sociedad Europea de Arteriosclerosis (ESC/EAS), ponen en duda la asociación entre un nivel bajo de cLDL y un aumento del riesgo de hemorragia cerebral9,11,17,18,28,57. El estudio IMPROVE-IT no demostró ninguna relación significativa entre el riesgo de hemorragia cerebral y el uso de la terapia hipolipemiantes más intensa con ezetimiba+estatina12. En el mencionado estudio de pacientes con ictus o AIT aleatorizados a un objetivo de cLDL <70mg/dL o de entre 90 y 110mg/dL, no se hallaron diferencias entre ambos grupos con relación a la incidencia de hemorragia intracraneal17. Tampoco en el reciente metaanálisis de estudios aleatorizados de terapias hipolipemiantes (>222.000 pacientes) se ha observado asociación entre nivel bajo de cLDL y un mayor riesgo de ictus hemorrágico18. En este sentido, en los estudios con iPCSK9 recientemente publicados no se ha demostrado un incremento del riesgo de hemorragia cerebral, ni siquiera en pacientes que alcanzaron un nivel muy bajo de cLDL7,8,28,32,54. En el ensayo FOURIER, no se observaron nuevos problemas de seguridad en el 25% de los pacientes tratados con evolocumab que alcanzaron un nivel de cLDL <20mg/dL31 ni tampoco en el 10% de los pacientes que llegaron a cLDL <10mg/dL7,58. De forma similar, análisis agrupados de los ensayos de alirocumab notificaron que un 37 y un 9% de los pacientes alcanzaron un nivel de cLDL <25 y <15mg/dL, respectivamente, sin mostrar nuevos problemas de seguridad41,59. A pesar de que es necesario seguir vigilando la seguridad de estos fármacos36, el perfil de seguridad a largo plazo de los iPCSK9 no muestra nuevos hallazgos, con un seguimiento de hasta 5 años en el caso de evolocumab32,60.
Existe cierta evidencia que ha asociado el uso de estatinas al desarrollo de déficits neurocognitivos, aunque estos resultados no han sido consistentes y, recientemente, se ha indicado que no existe tal asociación61. Al principio, se postuló también una posible relación entre el uso de iPCSK9 y efectos adversos cognitivos41,62, pero los ensayos FOURIER y ODYSSEY Outcomes, que incluyeron un mayor número de pacientes, así como los datos de metaanálisis, no han demostrado ninguna relación al respecto7,32,41,58,62-64. Los resultados del estudio EBBINGHAUS, un subestudio del FOURIER que evaluó específicamente el rendimiento cognitivo en 1.204 pacientes, demostraron que no existe ninguna relación entre el tratamiento con evolocumab y la función cognitiva, incluso en aquellos pacientes con nivel de cLDL más bajo7,62.
Algunos datos publicados señalan que las estatinas aumentan el riesgo de desarrollar diabetes, en especial en pacientes con prediabetes65. Sin embargo, ni el estudio IMPROVE-IT con ezetimiba12,28 ni los ensayos clínicos con iPCSK928,32,58,59,65 han demostrado una asociación entre el uso de estas medicaciones y el nivel bajo de cLDL y el desarrollo de diabetes. Un nivel de cLDL <25mg/dL no se asoció con un riesgo de desarrollar diabetes en pacientes tratados con alirocumab59. En un subestudio del ensayo FOURIER, evolocumab no aumentó el riesgo de diabetes de nueva aparición ni alteró el nivel de glucemia, incluso en pacientes con prediabetes, además de mostrar una eficacia y seguridad consistente tanto en pacientes con diabetes como en pacientes no diabéticos65. Tampoco se ha observado riesgo de diabetes de nueva aparición en aquellos pacientes que alcanzaron un nivel muy bajo de cLDL <20mg/dL7,52.
Por último, ni el ensayo IMPROVE-IT ni los ensayos con iPCSK9 han mostrado que estos fármacos tengan efectos secundarios relevantes ni a nivel muscular ni a nivel hepatobiliar7,8,12,32,58. En este sentido, no es necesario ningún ajuste de dosis con los iPCSK9 en pacientes con insuficiencia hepática leve (evolocumab) o leve a moderada (alirocumab), ni tampoco en pacientes con insuficiencia renal leve a moderada30,31.
Recomendaciones sobre la seguridad de los niveles bajos de cLDL| No se considera que existan niveles excesivamente bajos de cLDL.No se considera que existan hallazgos de seguridad relevantes asociados a un nivel bajo de cLDL.No se recomienda modificar la pauta hipolipemiantes en pacientes que alcancen el nivel objetivo de cLDL indicado, excepto si aparecen efectos secundarios.Una vez se ha iniciado tratamiento con iPCSK9, el tratamiento hipolipemiantes no debe modificarse y su eficacia debe ser evaluada en la siguiente determinación del nivel de cLDL. |
Con base en la evidencia disponible, las guías de práctica clínica1,37-39,57,66 y la experiencia clínica de los autores de este documento, a continuación se recogen los perfiles de pacientes con ictus isquémico que podrían obtener un mayor beneficio del tratamiento con iPCSK9 en prevención secundaria, así como los objetivos terapéuticos (cLDL) para dichos perfiles.
Recomendaciones sobre el uso de iPCSK9 en prevención secundaria en pacientes con historia previa de ictus isquémico| La administración de iPCSK9 para reducir el riesgo de episodios vasculares estará indicada en todos los pacientes con ictus isquémico de cualquier etiología (según clasificación TOAST)67 con nivel de cLDL>100 mg/dL, en tratamiento con dosis máximas toleradas de estatinas, en pacientes intolerantes a las estatinas y en pacientes en los que las estatinas están contraindicadas (con base en las directrices del informe de posicionamiento terapéutico)68,69. |
En línea con las recomendaciones generales de las guías europeas de dislipemia57, se recomienda la adición de un iPCSK9 si tras 4-6 semanas (periodo adaptable según práctica clínica) de tratamiento con dosis máximas toleradas de estatinas no se alcanza el nivel objetivo de cLDL.
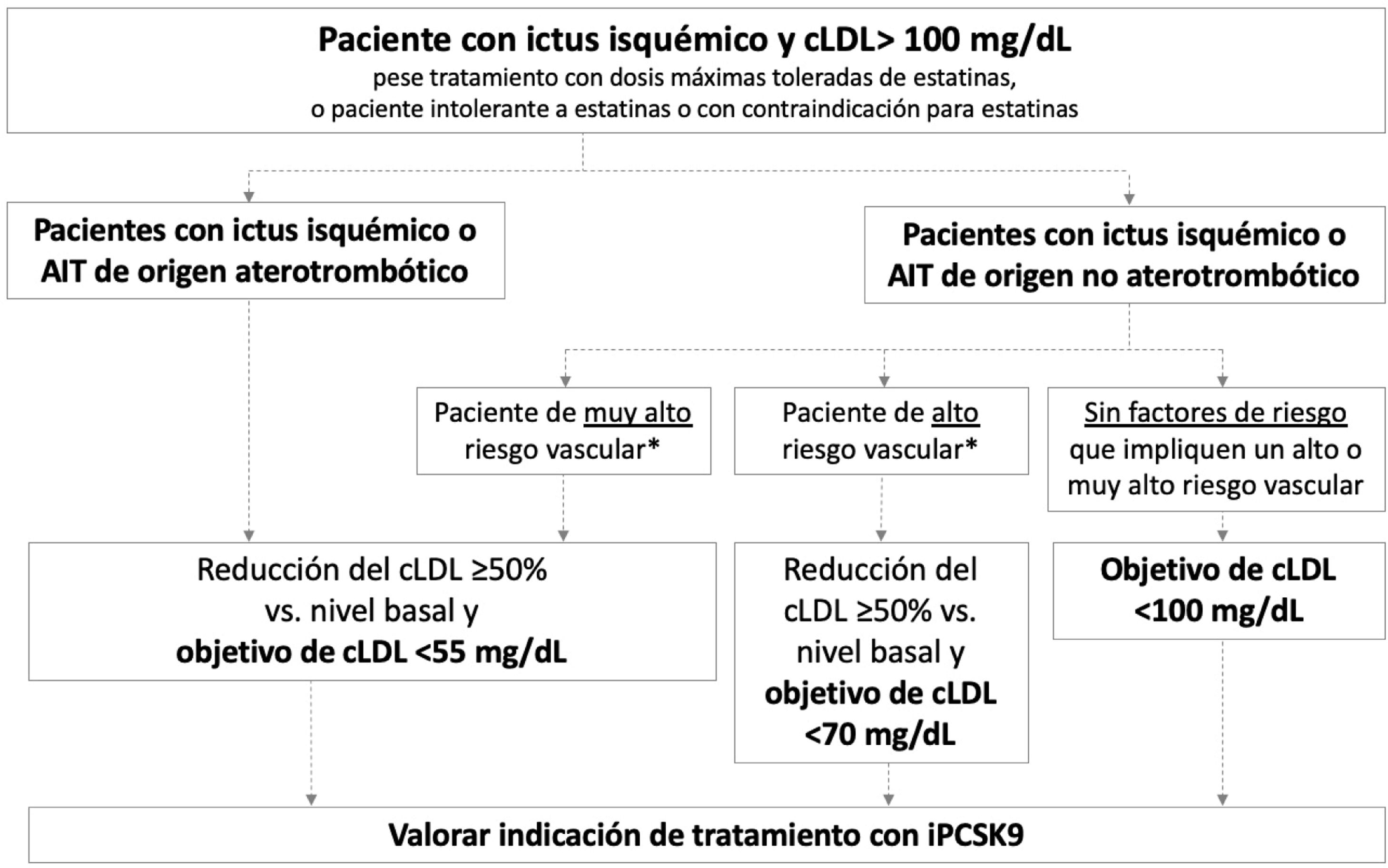
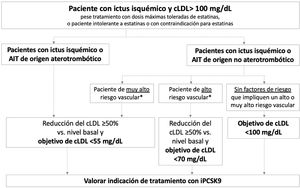
La figura 2 presenta los objetivos terapéuticos de cLDL recomendados en diferentes perfiles de pacientes con historia de ictus isquémico o AIT, en función de su origen (aterotrombótico o no aterotrombótico) y la presencia de factores que impliquen un riesgo vascular alto o muy alto. En ictus isquémicos de etiología infrecuente sin relación con disfunción endotelial o ateromatosis, como por ejemplo los asociados a mixoma cardiaco, disección arterial o fuente embólica de riesgo incierto, no es necesario realizar un control lipídico intensivo.
Pacientes con ictus isquémico o ataque isquémico transitorio de origen aterotrombóticoEste grupo engloba a los pacientes diagnosticados con ictus isquémico o AIT de origen aterotrombótico que continúan teniendo cLDL>100mg/dL a pesar de un tratamiento hipolipemiantes óptimo, así como a aquellos que cumplen estas características y que son intolerantes a las estatinas o en los que las estatinas están contraindicadas. Estos pacientes presentan un riesgo muy elevado de nuevos episodios aterotrombóticos, incluyendo ictus recurrente38. Las guías del Colegio Americano de Cardiología (ACC) establecen un objetivo de cLDL <70mg/dL para pacientes con enfermedad vascular aterotrombótica establecida39. Por su parte, la Asociación Americana de Endocrinólogos Clínicos (AACE) establece un objetivo terapéutico más ambicioso, cLDL <55mg/dL, para pacientes con riesgo vascular extremo, grupo en el que se incluyen los siguientes pacientes: 1) enfermedad vascular aterotrombótica establecida progresiva a pesar de haber alcanzado un nivel de cLDL <70mg/dL; 2) enfermedad vascular establecida y diabetes mellitus, enfermedad renal crónica de grado 3/4 o hipercolesterolemia familiar heterocigótica y 3) pacientes con historia de enfermedad vascular aterotrombótica prematura (<55 años en hombres, <65 años en mujeres)37. En las guías de manejo de dislipemia de la ESC/EAS 2019, se clasifica el riesgo vascular en 4 categorías (muy alto, alto, moderado y bajo) en función de la presencia de ciertas entidades clínicas y factores de riesgo (tabla 3)57. En este sentido, los pacientes con ictus isquémico o AIT de origen aterotrombótico se incluyen en la categoría de riesgo vascular muy alto, recomendándose para estos pacientes en prevención secundaria reducir el cLDL ≥ 50% desde el nivel basal y un objetivo terapéutico de cLDL <55mg/dL57. Todas las guías mencionadas recomiendan añadir iPCSK9 al tratamiento hipolipemiantes oral si el tratamiento con estatinas (±ezetimiba) no permite alcanzar el objetivo deseado o si existe intolerancia o contraindicación a las estatinas37,39,57. El plan europeo de acción para ictus 2018-2030 también recomienda el uso de tratamiento hipolipemiantes adicional, incluidos los iPCSK9, en pacientes con ictus previo que no tengan buen control lipídico con el tratamiento hipolipemiantes estándar1.
categorías de riesgo vascular de la Sociedad Europea de Cardiología/Sociedad Europea de Arteriosclerosis (ESC/EAS)
| Categorías de riesgo | |
|---|---|
| Muy alto | ECV documentada: IAM, SCA, angina, ictus o AIT, enfermedad arterial periférica, revascularización coronaria o arterialDM con LOD (p.ej. proteinuria), DM con 3 o más FRCV graves asociados (tabaquismo, dislipemia e hipertensión), o DM tipo 1 de más de 20 años de duraciónERC estadio IV (TFGe <30 mL/min/1,73 m2)SCORE calculado ≥10%Hipercolesterolemia familiar con ECV o un FRCV grave asociado |
| Alto | Un FRCV grave muy elevado; esto es, dislipemia marcada (colesterol total>300 mg/dL, cLDL>190 mg/dL) o hipertensión grave (180/110 mmHg)DM con un FRCV grave o de más de 10 años de duraciónERC estadio III (TFGe 30-59 mL/min/1,73 m2)SCORE calculado ≥5% y <10%Hipercolesterolemia familiar sin ECV o sin FRCV |
| Moderado | SCORE calculado ≥1% y <5% |
| Bajo | SCORE <1% |
AIT: ataque isquémico transitorio; cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; FRCV: factor de riesgo cardiovascular; IAM: infarto agudo de miocardio; LOD: lesión de órgano diana; SCA: síndrome coronario agudo; SCORE: Systematic Coronary Risk Estimation.
Adaptado de Mach et al.57.
Con base en la evidencia descrita, los autores de este documento recomiendan para estos pacientes alcanzar una reducción del cLDL ≥ 50% desde el nivel basal y un objetivo terapéutico de cLDL <55mg/dL.
Pacientes con ictus isquémico o accidente isquémico transitorio de origen no aterotrombótico y con un perfil de muy alto riesgo vascularSe incluye a los pacientes diagnosticados con ictus isquémico o AIT de origen no aterotrombótico que presentan al menos un factor que implique un muy alto riesgo vascular y que continúan teniendo cLDL>100mg/dL a pesar de un tratamiento hipolipemiantes óptimo, o que son intolerantes o muestran contraindicación a las estatinas.
En la tabla 3 se presentan los factores que determinan que el paciente se considere como de muy alto riesgo vascular, según las guías de la ESC/EAS57. A pesar pues de no tener un ictus de etiología aterotrombótica67, los pacientes incluidos en este grupo tienen un riesgo muy elevado de nuevo episodio vascular y, en consecuencia, se recomienda para ellos los mismos objetivos terapéuticos que para los pacientes con ictus isquémico o AIT de origen aterotrombótico57.
Los autores de este documento recomiendan para estos pacientes alcanzar una reducción del cLDL ≥ 50% desde el nivel basal y un objetivo terapéutico de cLDL <55mg/dL.
Recomendaciones sobre los objetivos terapéuticos para este grupo de pacientesSi este objetivo no se alcanza con dosis máximas toleradas de estatinas, se recomienda añadir medicaciones hipolipemiantes adicionales, incluyendo iPCSK9. Alirocumab y evolocumab se han asociado a reducciones del riesgo vascular en diferentes subgrupos de pacientes con ≥1 de los factores de muy alto riesgo vascular indicados, así como en pacientes con cardiopatía isquémica8,32. La eficacia de evolocumab para reducir el riesgo vascular también se ha demostrado en pacientes con múltiples infartos de miocardio previos o enfermedad coronaria multivaso70. Asimismo, evolocumab ha demostrado favorecer la regresión de la placa de ateroma tras 78 semanas de tratamiento en pacientes con enfermedad coronaria, incluso en pacientes que partían de un nivel basal de cLDL <70mg/dL71. Adicionalmente, evolocumab ha demostrado una reducción del riesgo de episodios vasculares mayores y episodios mayores asociados a las extremidades en un subgrupo de pacientes del ensayo FOURIER con enfermedad arterial periférica sintomática, en los que se observó un beneficio progresivo hasta un nivel de cLDL <10mg/dL72. Como ya se ha indicado, evolocumab también ha disminuido el riesgo vascular en pacientes con historia de ictus isquémico previo15. La diabetes es uno de los factores de riesgo vascular más comunes y tanto evolocumab como alirocumab han demostrado su eficacia y seguridad en la reducción del riesgo vascular en este grupo de pacientes65,73.
Pacientes con ictus isquémico o accidente isquémico transistorio de origen no aterotrombótico y con un perfil de alto riesgo vascularSe trata de pacientes con ictus isquémico o AIT de origen no aterotrombótico y con al menos un factor que implique un alto riesgo vascular, que continúan con un nivel de cLDL>100mg/dL a pesar de un tratamiento hipolipemiantes con estatinas óptimo o que son intolerantes o muestran contraindicación a las estatinas.
La tabla 3 presenta los factores de riesgo que permiten categorizar a estos pacientes como de alto riesgo vascular. Para esta categoría, las guías de la ESC/EAS recomiendan reducir el cLDL al menos a la mitad con respecto al nivel inicial, así como alcanzar un nivel <70mg/dL.
Los autores de este documento recomiendan para estos pacientes una reducción del cLDL ≥ 50% desde el nivel basal y un objetivo terapéutico de cLDL <70mg/dL.
Recomendaciones sobre los objetivos terapéuticos para este grupo de pacientesPacientes con ictus isquémico o accidente isquémico transitorio de origen no aterotrombótico que no presenten un perfil de alto o muy alto riesgo vascularEn este grupo se englobarían el resto de los pacientes con historia de ictus isquémico o AIT de origen no aterotrombótico que no tienen ninguno de los factores presentes en la tabla 3 que impliquen un alto o muy alto riesgo vascular (y que, por tanto, no entran dentro de los grupos descritos en los apartados anteriores).
El objetivo terapéutico recomendado por los autores es de cLDL <100mg/dL.
Recomendaciones sobre los objetivos terapéuticos para este grupo de pacientesLa administración de iPCSK9 para reducir el riesgo vascular está indicada en aquellos pacientes que encajan en este perfil con nivel de cLDL>100mg/dL en tratamiento con dosis máximas toleradas de estatinas y en pacientes intolerantes o con contraindicación a las estatinas.
Prevención secundaria de episodios vasculares en pacientes con ictus isquémico: el papel del especialista en el control lipídicoEl marco de acción europeo para la prevención de ictus 2018-2030 incluye la prevención secundaria como uno de los pilares del plan1. Se reconoce que dicha prevención es aplicable a prácticamente todos los pacientes que han sufrido un ictus o AIT y que puede llegar a reducir la recurrencia de ictus en hasta un 80%. La prevención secundaria engloba la reducción del riesgo de sufrir nuevos ictus, AIT u otras enfermedades vasculares, así como la reducción de complicaciones, como el deterioro cognitivo y la demencia, la ansiedad o trastornos anímicos, la fatiga o una mala calidad de vida1. A pesar de ello, la prevención secundaria representa, en general, un área de mejora en el manejo de los pacientes con ictus1, lo que también sucede en nuestro país4,21-23.
Recomendaciones sobre el papel del especialista en la prevención secundaria en pacientes con ictus| Sería recomendable que las unidades de ictus tuvieran una mayor implicación en el seguimiento inicial de la prevención secundaria de los pacientes con historia de ictus o AIT hasta que se alcance el objetivo terapéutico de cLDL.Es necesario seguir concienciando a los neurólogos de la importancia y consecuencias de un nivel elevado de cLDL y de un buen control lipídico en estos pacientes.Es importante que los especialistas trabajen con la administración de cada centro hospitalario, así como con equipos multidisciplinares y médicos de atención primaria, para incorporar progresivamente el uso de los iPCSK9 en los protocolos de prevención secundaria en pacientes con ictus isquémico previo y riesgo vascular elevado. |
Adicionalmente, la tabla 4 presenta una lista de aquellos puntos que se recomienda abordar en la prevención secundaria de pacientes con historia de ictus isquémico o AIT previo1,4,9.
Checklist de prevención secundaria en pacientes con ictus isquémico o accidente isquémico transitorio previo
| Medidas en prevención secundaria para controlar los factores de riesgo modificables:Dieta: promover la ingesta de una dieta saludable rica en fruta y verduraConsumo de alcohol: moderar el consumo de alcoholTabaquismo: recomendar el cese del tabaquismoConsumo de drogas: cesar el consumo de estas sustanciasObesidad: recomendar un plan de control de peso y aumentar el ejercicio físicoSedentarismo: recomendar aumentar el ejercicio físicoHipertensión: abordar de acuerdo a las recomendaciones de las guías de práctica clínicaDislipemia: tratar de acuerdo a las recomendaciones de las guías de práctica clínicaSe recomienda usar cLDL como el principal objetivo terapéuticoSe recomienda que el especialista continúe el seguimiento del paciente hasta que se alcance el objetivo terapéutico de cLDLRealizar analíticas de control cada 8 (±4) semanas66 hasta que se alcance el objetivo terapéuticoParámetros mínimos en el perfil lipídico: colesterol total, cLDL, cHDL, triglicéridos, lipoproteína(a)Fibrilación auricular: abordar de acuerdo a las recomendaciones de las guías de práctica clínica sobre el uso de anticoagulantesDiabetes mellitus: abordar de acuerdo a las recomendaciones de las guías de práctica clínicaDiagnóstico y manejo específico de otras enfermedades concomitantes: enfermedad renal, enfermedad cardiaca, enfermedad arterial periférica, etc. |
AIT: ataque isquémico transitorio; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad.
Teniendo en cuenta las indicaciones aprobadas de evolocumab y alirocumab, se estima que hasta un 80% de los pacientes con enfermedad vascular aterosclerótica serían candidatos a recibir iPCSK9 en prevención secundaria en Europa35. Hasta la fecha, se han publicado 2estudios de coste-efectividad sobre el uso de evolocumab en el contexto de nuestro Sistema Nacional de Salud74,75, con resultados dispares.
Villa et al.74 utilizaron un modelo Markov para evaluar el coste-efectividad de evolocumab+estatinas vs. estatinas, suponiendo un tratamiento de por vida en 2grupos de pacientes con cLDL>100mg/dL y con hipercolesterolemia familiar con o sin episodio vascular previo o con historia previa de episodio vascular (prevención secundaria). Se observó que, aunque el coste de evolocumab era superior, las mayores reducciones de cLDL y riesgo vascular de por vida asociadas a evolocumab tenían una gran influencia sobre la razón de coste-efectividad incremental, y se concluyó que evolocumab podía ser una opción coste-efectiva para los pacientes de estos 2grupos que continúan teniendo un elevado riesgo vascular a pesar de recibir la máxima dosis tolerada de estatinas74.
En el segundo estudio se utilizaron un árbol de decisión y una simulación a 10 años mediante un modelo Markov para realizar un análisis de impacto presupuestario desde la perspectiva del sistema sanitario público español75, a partir de los datos del FOURIER. La conclusión fue que evolocumab se asocia a una menor frecuencia de episodios vasculares, pero resulta ineficiente desde un punto de vista farmacoeconómico75. Sin embargo, hay que destacar que las conclusiones de este estudio han sido cuestionadas debido a la metodología seguida y a algunas de las suposiciones utilizadas en él76. En consecuencia, parece necesario seguir investigando los aspectos farmacoeconómicos del uso de iPCSK9 en la práctica clínica y contextualizarlos en función de los resultados clínicos, incluyendo el riesgo vascular absoluto y el nivel absoluto de cLDL, factores determinantes del número de pacientes que es necesario tratar para prevenir un episodio vascular36. Además, es importante considerar el impacto de estos tratamientos de por vida36. Asimismo, en el ámbito de la prevención secundaria, sería importante contextualizar el coste de los iPCSK9 en comparación con el coste asociado con los ictus recurrentes, que habitualmente provocan mayor discapacidad, dependencia funcional y morbimortalidad, y, por ello, mayores costes sanitarios y sociales, en comparación con un primer ictus77.
El estudio CONOCES ha investigado el coste real por paciente y año asociado a los pacientes con ictus que son tratados en una unidad de ictus en España78: es de 27.711€, con más de 2/3 del coste correspondientes a costes directos no relacionados con el sistema sanitario, relativos al cuidado informal de estos pacientes78.
Siguientes pasosEs importante promover la realización de nuevos estudios que investiguen el uso de iPCSK9 en prevención vascular secundaria en pacientes con ictus en España, que evalúen su efecto en los diferentes subtipos de ictus isquémico, así como la eficacia y seguridad a largo plazo y el impacto sobre la discapacidad y la mortalidad vascular.
Hasta la fecha, el uso de iPCSK9 en prevención vascular secundaria de ictus se ha limitado a la fase crónica; sin embargo, estos fármacos reducen el nivel de cLDL de forma muy rápida (1-2 semanas tras la primera dosis de fármaco)8,32, por lo que sería interesante evaluar específicamente su uso en la fase aguda de ictus isquémico en los pacientes de alto riesgo seleccionados.
ConclusionesEn el presente documento de consenso de neurólogos expertos se revisa de forma práctica la evidencia disponible sobre el uso de iPCSK9 en la prevención secundaria de episodios vasculares en pacientes con ictus isquémico previo, con el propósito de orientar al neurólogo acerca de aquellos perfiles de pacientes que pueden beneficiarse más del tratamiento con iPCKS9, así como los objetivos terapéuticos de cLDL. Las recomendaciones recogidas proceden de las opiniones y experiencia de los expertos y, aunque estas se basan en la evidencia disponible, es necesario resaltar que solo una pequeña parte de esta proviene de estudios clínicos específicamente diseñados en pacientes con historia de ictus (principal limitación del documento). Por ello, los expertos consideran imprescindible abordar ensayos clínicos en los que se incluyan pacientes con ictus de etiologías claramente definidas, que proporcionen evidencia científica sobre los subtipos de ictus que podrán beneficiarse de estos fármacos en mayor medida. A modo de resumen, la tabla 5 presenta los mensajes clave del artículo.
Conclusiones clave del documento de consenso sobre el uso de iPCSK9 en prevención secundaria en pacientes con ictus isquémicoo accidente isquémico transitorio
| La prevención secundaria es fundamental en cualquier paciente con ictus o AITCon base en las recomendaciones recogidas en diferentes guías clínicas (ESC/EAS AACE), los autores de este documento recomiendan un objetivo terapéutico (cLDL) de <55 mg/dL para los pacientes con ictus isquémico o AIT de origen aterotrombótico, así como para los pacientes con ictus isquémico o AIT de origen no aterotrombótico pero que presentan un muy alto riesgo vascular. Para los pacientes con ictus isquémico o AIT de origen no aterotrombótico con alto riesgo vascular, se recomienda un objetivo de cLDL <70 mg/dL. En pacientes con ictus isquémico o AIT de origen no aterotrombótico sin factores de muy alto o alto riesgo vascular, se recomienda un objetivo de cLDL <100 mg/dL.Ambos iPCSK9, evolocumab y alirocumab, disminuyeron en sus respectivos estudios (FOURIER y ODISSEY OUTCOMES) el nivel de cLDL en hasta un 60% aproximadamente en pacientes con régimen basal de estatinas de intensidad alta o moderada.Los iPCSK9 han demostrado una reducción significativa del riesgo de episodios vasculares en pacientes con enfermedad vascular y niveles elevados de cLDL o colesterol no-HDL a pesar de un tratamiento con estatinas de intensidad alta o moderada.Los iPCSK9 están indicados en prevención secundaria para reducir el riesgo vascular en pacientes con enfermedad aterosclerótica establecida.Con la evidencia disponible hasta la fecha, no se considera que exista un nivel excesivamente bajo de cLDL, ni que existan hallazgos de seguridad relevantes asociados a nivel bajo de cLDL, por lo que no se recomienda modificar la pauta hipolipemiantes en pacientes que alcancen el nivel objetivo de cLDL, excepto si aparecen efectos secundarios.La administración de iPCSK9 para reducir el riesgo de episodios vasculares es recomendable en todos los pacientes con ictus isquémico de cualquier etiología con nivel de cLDL>100 mg/dL, en tratamiento con dosis máximas toleradas de estatinas, en pacientes intolerantes a las estatinas y en pacientes en los que las estatinas están contraindicadas (según las directrices del IPT).Los iPCSK9 han demostrado un perfil de seguridad favorable, incluso en pacientes con nivel bajo de cLDL y en pacientes con diabetes mellitus. No se han asociado a un mayor riesgo de problemas musculares, hepatobiliares, hemorragia cerebral o afectación cognitiva.Sería recomendable que el neurólogo realizara el seguimiento del control lipídico en pacientes con ictus en prevención secundaria hasta que se alcance el objetivo terapéutico de cLDL.Es imprescindible la realización de ensayos clínicos en los que se incluyan pacientes con ictus de etiologías claramente definidas, que proporcionen evidencia científica sobre los subtipos de ictus que podrán beneficiarse de estos fármacos en mayor medida. |
AIT: ataque isquémico transitorio; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; iPCSK9: inhibidores de la proproteína convertasa subtilisina/kexina tipo 9; IPT: informe de posicionamiento terapéutico.
Este proyecto ha contado con el apoyo logístico de Amgen SA. Las opiniones, interpretaciones y conclusiones expresadas en este artículo corresponden exclusivamente a sus autores.
Conflicto de interesesAGN ha recibido honorarios en concepto de asesoría científica o conferencias de AGA Medical Corporation, Almirall, Astra Zeneca, Bayer, Boehringer Ingelheim, Bristol-Myers-Squibb, Daiichi Sankyo, Esteve, Ferrer, MSD, Novartis, Pfizer, Sanofi-Aventis, Servier, Solvay y Uriach. JM,MC, JFA y FP han recibido honorarios como consultores de Amgen. TS ha recibido honorarios de Amgen, AstraZeneca, Boehringer-Ingelheim y Bayer en concepto de asesoría científica y conferencias médicas. EP ha recibido honorarios de laboratorios Esteve, Rovi, MSD y Amgen en concepto de asesoría científica y conferencias. PC ha recibido honorarios de Amgen, Boheringer Ingelheim, Daichii-Saycho y laboratorios Ferrer. JT ha recibido honorarios de Amgen, Allergan y Zambón Pharma en concepto de asesoría científica y conferencias. MC ha recibido honorarios de Amgen, Boehringer-Ingelheim, Daichii Sankyo y Allergan en concepto de asesoría científica y conferencias médicas.
Los autores agradecen el apoyo recibido por parte de Amgen SA para la realización de este proyecto y a Ogilvy Health y Paula Martín Vaquero, PhD, por el apoyo metodológico y la asistencia editorial y de redacción médica para la elaboración de este documento de consenso.