La interleucina 1β (IL-1β) aumenta la muerte neuronal necrótica debido al estado epiléptico (EE) en el área CA1 del hipocampo de ratas en desarrollo; sin embargo, se desconoce si ejerce un efecto similar en el giro dentado (GD) hipocampal. El objetivo de esta investigación fue analizar el efecto de IL-1β en la muerte neuronal inducida por el EE en el GD de ratas Wistar de 14 días de edad.
MétodosEl EE se indujo con el modelo de litio-pilocarpina. Seis horas después del inicio del EE, la IL-1β se inyectó intracerebroventricularmente (0, 0,3, 3, 30 o 300ng/μl); grupos adicionales se inyectaron con el antagonista natural del receptor tipoi (IL-1RI) de IL-1β (IL-1Ra, 30ng/μl) en ausencia o presencia de IL-1β (3ng/μl). La muerte neuronal se evaluó en la capa granular del GD 24h después del EE mediante la tinción de hematoxilina-eosina. Las células muertas se caracterizaron por presentar citosol eosinofílico y núcleos condensados y fragmentados.
ResultadosSe observó un incremento en el número de células eosinofílicas en el GD ipsilateral a la inyección de 3 y 300ng/μl de IL-1β en comparación con el grupo vehículo; en el GD contralateral se observó un efecto similar únicamente con 3ng/μl de IL-1β. La coadministración de IL-1β con el IL-1Ra no evitó el aumento en el número de células eosinofílicas.
ConclusiónLa IL-1β aumenta la muerte neuronal con morfología apoptótica provocada por el EE en el GD del hipocampo, mecanismo independiente de la activación del receptor IL-1RI.
Interleukin-1β (IL-1β) increases necrotic neuronal cell death in the CA1 area after induced status epilepticus (SE) in developing rats. However, it remains uncertain whether IL-1β has a similar effect on the hippocampal dentate gyrus (DG). In this study, we analysed the effects of IL-1β on 14-day-old Wistar rats experiencing DG neuronal death induced by SE.
MethodsSE was induced with lithium-pilocarpine. Six hours after SE onset, a group of pups was injected with IL-1β (at 0, 0.3, 3, 30, or 300ng/μL) in the right ventricle; another group was injected with IL-1β receptor (IL-1R1) antagonist (IL-1Ra, at 30ng/μL) of IL-1RI antagonist (IL-1Ra) alone, and additional group with 30ng/μL of IL-1Ra plus 3ng/μL of IL-1β. Twenty-four hours after SE onset, neuronal cell death in the dentate gyrus of the dorsal hippocampus was assessed using haematoxylin-eosin staining. Dead cells showed eosinophilic cytoplasm and condensed and fragmented nuclei.
ResultsWe observed an increased number of eosinophilic cells in the hippocampal DG ipsilateral to the site of injection of 3ng/μL and 300ng/μL of IL-1β in comparison with the vehicle group. A similar effect was observed in the hippocampal DG contralateral to the site of injection of 3ng/μL of IL-1β. Administration of both of IL-1β and IL-1Ra failed to prevent an increase in the number of eosinophilic cells.
ConclusionOur data suggest that IL-1β increases apoptotic neuronal cell death caused by SE in the hippocampal GD, which is a mechanism independent of IL-1RI activation.
La Organización Mundial de la Salud considera que en la actualidad aproximadamente 50 millones de personas de todo el mundo padecen epilepsia, con una proporción estimada que oscila entre 4 y 10 por cada 1.000 individuos1. La Liga Internacional Contra la Epilepsia (International League Against Epilepsy [ILAE]) y el Buró Internacional para la Epilepsia (International Bureau for Epilepsy [IBE]) definen la epilepsia como un trastorno del cerebro caracterizado por una predisposición duradera a generar crisis epilépticas y por las consecuencias neurobiológicas, cognitivas, psicológicas y sociales de esta condición2. El status epilepticus o estado epiléptico (EE) es una condición que resulta ya sea de una falla en los mecanismos responsables de la terminación de las crisis o de la iniciación de mecanismos que conducen a crisis anormalmente prolongadas. El EE tiene consecuencias a largo plazo, incluyendo muerte neuronal, daño neuronal y alteración de las redes neuronales, dependiendo del tipo y de la duración de las crisis3. Estudios epidemiológicos han mostrado que el EE se presenta con alta incidencia en niños pequeños4-6, haciendo a esta población importantemente vulnerable a este tipo de actividad epiléptica y a sus consecuencias.
A nivel experimental, el EE se puede estudiar utilizando modelos animales. Un modelo ampliamente empleado en ratas en desarrollo es el modelo de litio-pilocarpina, ya que reproduce las manifestaciones motoras y causa daño neuronal en diversas regiones cerebrales7-10, siendo el hipocampo (capas piramidal de CA1 y granular del giro dentado) una de las más susceptibles7,10,11. La formación hipocampal tiene un papel relevante en la cognición y la memoria, y se caracteriza por poseer un circuito trisináptico excitador que inicia en la corteza entorrinal a través de la vía perforante y cuyas proyecciones contactan con las células granulares del giro dentado; estas células a su vez envían sus axones hacia las neuronas piramidales de CA3 que proyectan a CA1 mediante la vía colateral de Schaffer12.
Por otro lado, la evidencia actual indica que la neuroinflamación tiene un papel preponderante en la fisiopatología de la epilepsia y el EE13,14. En particular la interleucina 1β (IL-1β) es una citocina proinflamatoria cuyas concentraciones plasmáticas se encuentran elevadas en personas con epilepsia, además de que se han identificado células inmunorreactivas a esta citocina en el tejido cerebral obtenido por resección quirúrgica15-18. En ratas en desarrollo también se ha identificado un aumento en la concentración y la expresión génica de la IL-1β pocas horas después de iniciado el EE19-22. Datos experimentales también han mostrado que la IL-1β posee un efecto pro-epiléptico23-25, y recientemente se comprobó que esta citocina disminuye las corrientes evocadas por el ácido γ-amino butírico (GABA), el principal neurotransmisor inhibidor del cerebro, en especímenes obtenidos de pacientes con epilepsia del lóbulo temporal26. En un estudio realizado por Medel-Matus et al.27 se observó que la aplicación exógena de la IL-1β aumentó la muerte neuronal necrótica debido al EE en el área CA1 del hipocampo, efecto mediado por su receptor tipo1 (IL-1R1). Sin embargo, no se conoce si ejerce el mismo efecto en otras regiones hipocampales, tal como el giro dentado. El objetivo del presente estudio fue evaluar el efecto de la administración intracerebral de diferentes concentraciones de IL-1β en la muerte neuronal observada en el giro dentado después del EE y la participación del receptor IL-1RI en tal efecto, a través de la aplicación de su antagonista natural (IL-1Ra).
Materiales y métodosSujetos experimentalesSe emplearon ratas de la cepa Wistar de ambos sexos y de 14días de edad posnatal (P14) al momento de inducir las convulsiones (peso corporal: 25-30g), las cuales fueron criadas en el bioterio del Centro de Investigaciones Cerebrales de la Universidad Veracruzana. Se emplearon ratas hembras y machos, considerando que a esta edad y bajo nuestras condiciones experimentales no se han detectado diferencias en los resultados asociadas con el dimorfismo sexual. Los padres de las ratas utilizadas en los experimentos se obtuvieron de la compañía Rismart México. Los animales (un macho adulto y 2 hembras adultas) fueron alojados durante el periodo de cruza (5días) en cajas de acrílico transparente (20×30×50cm). Después del periodo de apareamiento y durante la lactancia, las hembras adultas que resultaron preñadas se alojaron individualmente en cajas de acrílico transparente (15×24×37cm). El día de nacimiento fue considerado como el día posnatal cero (P0). Se estandarizó el número de crías a 8 animales por camada para evitar diferencias en el peso de los animales. Los animales se mantuvieron con sus madres en condiciones de temperatura y humedad ambientales, con ciclos luz-oscuridad normales de 12h (8:00 a 20:00h) y con libre acceso a agua y alimento. Todos los experimentos se realizaron bajo los lineamientos éticos nacionales e internacionales de acuerdo a las regulaciones vigentes en la NOM-062-ZOO-1999 para el uso y cuidado de animales de investigación, así como en la guía de cuidado y uso de animales de laboratorio del National Research Council en su versión 2011.
Inducción del estado epiléptico con litio-pilocarpinaLas ratas se inyectaron con cloruro de litio (3mEq/kg, i.p.) en el día 13 de edad, y 20h después, en el día posnatal 14, se indujo el EE por la administración de clorhidrato de pilocarpina (100mg/kg, s.c.). La manifestación conductual del EE fue monitorizada según la escala de Haas et al.28, y solo los animales que lo desarrollaron se incluyeron en el estudio.
Cirugía estereotáxicaSeis horas después de la administración del clorhidrato de pilocarpina, las ratas se anestesiaron con isoflurano (1,5-2%). Posteriormente se colocaron en un marco estereotáxico adaptado para ratas neonatas, se expuso el cráneo y con un taladro (broca de 2,4mm) se realizó un trépano en las siguientes coordenadas: −4,0mm posterior a bregma y −1,6mm lateral a la línea media, dirigidas al ventrículo lateral derecho. Los tratamientos se administraron unilateralmente utilizando una aguja calibre 25G (0,5mm) ×16mm (Nipro), que se introdujo 3,5mm por debajo del nivel del cráneo para microinyectar las sustancias correspondientes utilizando una bomba de microinfusión a un flujo de 0,2μl/min (Pump 11 Elite, Harvard Apparatus). Después de la inyección, el trépano se cubrió con cera ósea quirúrgica (Ethicon Ltd.) y se suturó la piel. Las ratas fueron rehidratadas con solución salina glucosada (Solución DX-5 PISA glucosa 5% 1ml, s.c.) y la herida fue cubierta con una solución saturada de ácido pícrico para evitar el canibalismo maternal27. En todo momento se controló la temperatura de las ratas con un sistema de regulación de temperatura (FHC, modelo 41-90-8D) y fue monitorizada mediante un termómetro rectal del mismo sistema. El procedimiento se realizó en su totalidad en condiciones asépticas y el material quirúrgico fue esterilizado en seco (Stoelting, Germinator 500) antes de realizar cada cirugía. Una vez que las ratas se recuperaron por completo fueron colocadas de nuevo con sus madres. Al final de los experimentos se identificó la localización del sitio de inyección mediante histología utilizando la tinción de hematoxilina-eosina.
Aplicación de la IL-1β y el antagonista del receptor IL-1RIPara estudiar el efecto de la IL-1β en la muerte neuronal inducida por el EE en la rata en desarrollo se realizó una curva concentración-respuesta de la IL-1β. Para tal fin, 6h después de la administración del clorhidrato de pilocarpina se inyectó vía intracerebroventricular (i.c.v.) la IL-1β (rat recombinant, R&D Systems, EE.UU., #501-RL-010/CF) en 4 diferentes concentraciones (0,3, 3, 30 y 300ng en 1μl de solución salina libre de pirógenos como vehículo) (Medel-Matus et al.27). Cada animal recibió solamente una de las 4 concentraciones de la interleucina. El grupo control se inyectó únicamente con el vehículo. Con la finalidad de evaluar la participación del antagonista del receptor IL-1R1 de la IL-1β en la muerte neuronal observada, se generaron grupos adicionales a los cuales se les aplicó 30ng del IL-1Ra solo (rat recombinant, R&D Systems, EE.UU., #1545-RA-025/CF) o en combinación con 3ng de IL-1β.
Preparación del tejido para histologíaVeinticuatro horas después del inicio del EE, las ratas se anestesiaron con una sobredosis i.p. de pentobarbital sódico y se perfundieron transcardiacamente con solución salina (NaCl 0,9%) y paraformaldehído al 4% preparado en una solución amortiguadora de fosfatos 0,1M (pH 7,4). Los cerebros fueron mantenidos in situ por una noche a 4°C y posteriormente se extrajeron y post-fijaron durante 2h en la misma solución. Todos los cerebros se deshidrataron en soluciones crecientes de etanol (70, 80, 95 y 100%), en xileno y se incluyeron en bloques de parafina. Posteriormente se obtuvieron cortes coronales de 10μm a nivel del hipocampo dorsal para realizar la tinción de hematoxilina-eosina para identificar células muertas en el giro dentado. También se obtuvieron cortes cerebrales a nivel de los ventrículos laterales para identificar el sitio de inyección.
Tinción de hematoxilina-eosinaEl daño neuronal en el giro dentado del hipocampo se evaluó con la versión modificada de la tinción hematoxilina-eosina mediante microscopia óptica7. Las células muertas se identificaron por presentar encogimiento, eosinofilia (citoplasma color rosa) y núcleos azul/púrpura (teñidos por la hematoxilina) con fragmentación de la cromatina (cariorrexis, morfología apoptótica) o altamente picnóticos sin fragmentación (morfología necrótica)10.
Las secciones cerebrales fueron desparafinizadas con xileno e hidratadas con soluciones de etanol a concentraciones decrecientes (100, 95 y 70%). A continuación las laminillas fueron colocadas en hematoxilina de Harris (Sigma) durante 10min. Transcurrido este tiempo, los cortes se lavaron con agua corriente para después ser colocados en etanol ácido al 70%. Después de una serie de lavados con agua destilada e incubaciones subsecuentes en una solución de hidróxido de amonio 0,3%, se realizó una contratinción de los cortes cerebrales con una solución alcohólica y ácida de eosina (0,01%; Sigma) durante 1min. Por último, las secciones se deshidrataron con etanol y xileno y se montaron con un medio no acuoso (Permount, Fisher Scientific) para su posterior análisis con un microscopio óptico de la marca Leica. El recuento de las células muertas se realizó en la capa de células granulares del giro dentado del hipocampo dorsal ipsilateral y contralateral al sitio de la administración de los tratamientos; se contaron 4 secciones por individuo y se obtuvo el promedio de las células acidofílicas. Esta misma tinción se empleó para verificar la trayectoria de la aguja utilizada en la inyección i.c.v. de las sustancias.
Análisis estadísticoLos resultados fueron analizados mediante el programa Sigma Stat versión 3.5 utilizando un análisis de varianza de una vía para grupos independientes y una prueba post hoc de Tukey para identificar diferencias entre los tratamientos. Los resultados se representan como la media±el error estándar de la media (EEM). Las gráficas se diseñaron con el programa computacional GraphPad Prism versión 5.0.
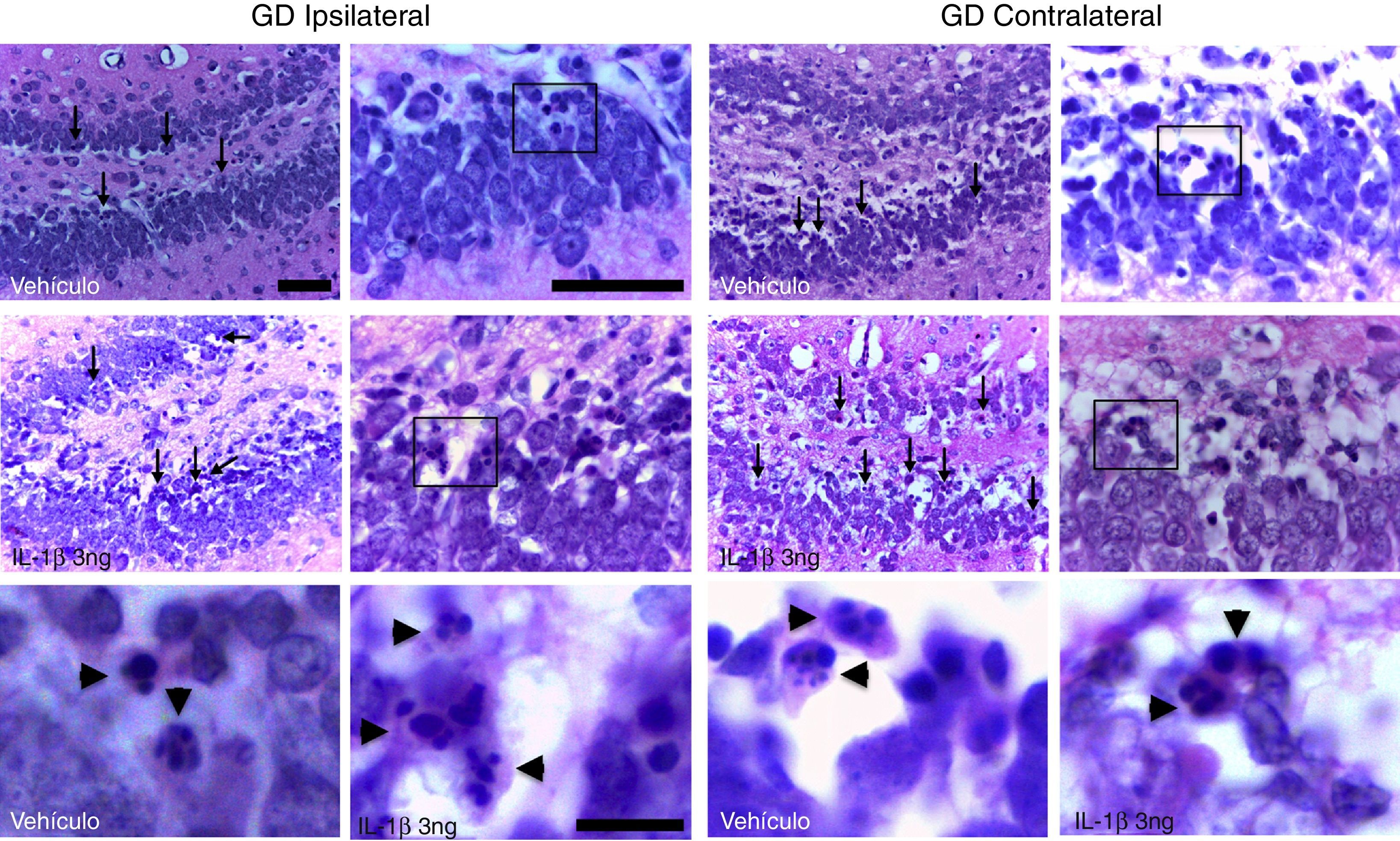
ResultadosTodas las ratas del estudio presentaron crisis generalizadas y EE. El análisis histológico permitió identificar en el giro dentado del hipocampo la presencia de células eosinofílicas con núcleos altamente condensados y fragmentados. Dichas células se localizaron principalmente en la capa granular interna (fig. 1).
Fotomicrografías que muestran el giro dentado de un animal tratado con vehículo y otro con la IL-1β a la concentración de 3ng, en la región ipsilateral (panel izquierdo) y contralateral (panel derecho) al sitio de inyección. Las flechas señalan algunas de las células que presentan citosol eosinofílico y fragmentación de la cromatina. El recuadro indica el área que se amplificó en las imágenes en alto aumento. Nótese que las células eosinofílicas presentan fragmentación nuclear sugerente de muerte celular por apoptosis (cabezas de flechas). Barras de calibración: 50μm (baja y media amplificación) y 10μm (alta magnificación).
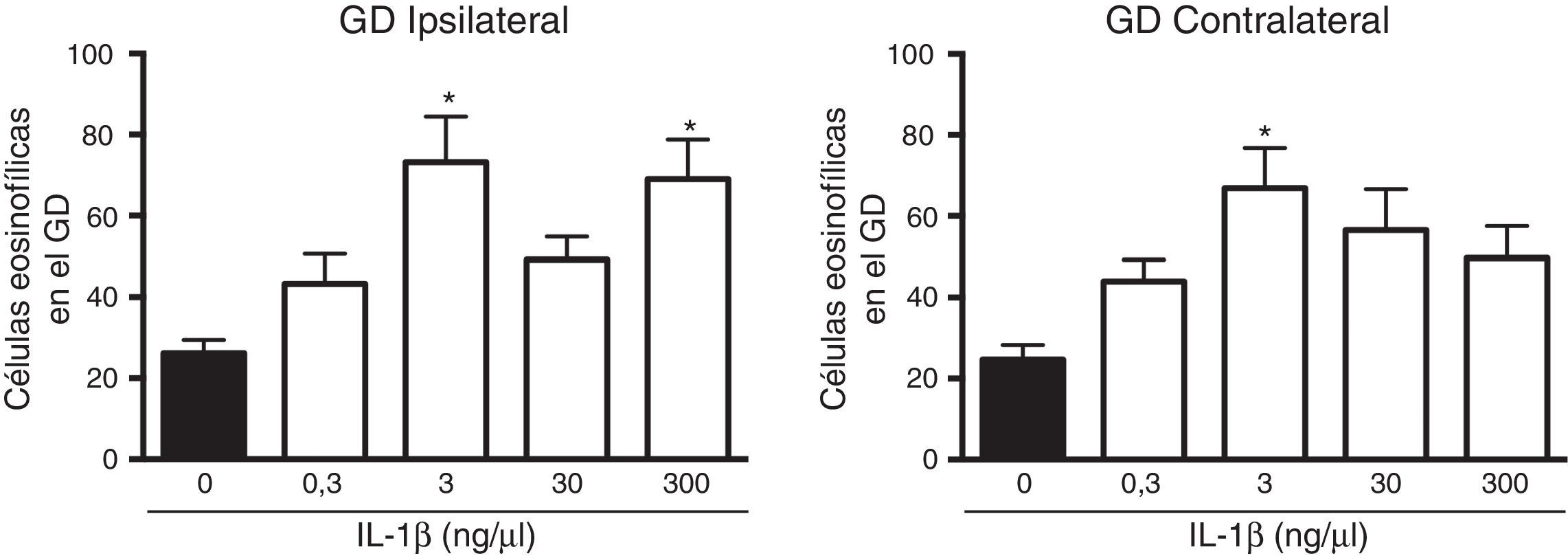
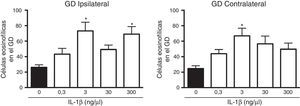
El análisis de varianza mostró diferencias significativas entre los grupos experimentales en el número de células muertas en el giro dentado ipsilateral a la aplicación de la citocina (F(4,25)=5,8, p=0,002). Los resultados mostraron que la administración de 3 (73,2±11,3) y 300 (69±9,8)ng/μl de IL-1β aumentó de forma estadísticamente significativa (p=0,003 y 0,007, respectivamente) el número de células muertas después del EE en el giro dentado ipsilateral al sitio de la administración, en comparación con el grupo vehículo (26,2±3,2). Las concentraciones de 0,3 y 30ng/μl de la citocina no modificaron la muerte neuronal en el giro dentado ipsilateral después del EE (fig. 2). El análisis estadístico también mostró diferencias significativas entre los grupos experimentales en el número de células muertas en hipocampo contralateral al lugar de la administración (F(4,25)=4,078, p=0,011]; sin embargo, únicamente la concentración de 3ng/μl aumentó (66,9±9,91; p=0,006) el número de células muertas después del EE en comparación con el vehículo (24,7±3,6) (fig. 2).
Curva concentración-respuesta del efecto de la IL-1β en la muerte neuronal en el giro dentado (GD) del hipocampo inducida por el estado epiléptico en la región ipsilateral (panel izquierdo) y contralateral (panel derecho) al sitio de inyección. Las barras representan la media±EEM del número de células eosinofílicas para el grupo vehículo y las diferentes concentraciones de la IL-1β inyectadas (n=6 por grupo experimental). *p<0,05 vs el grupo vehículo.
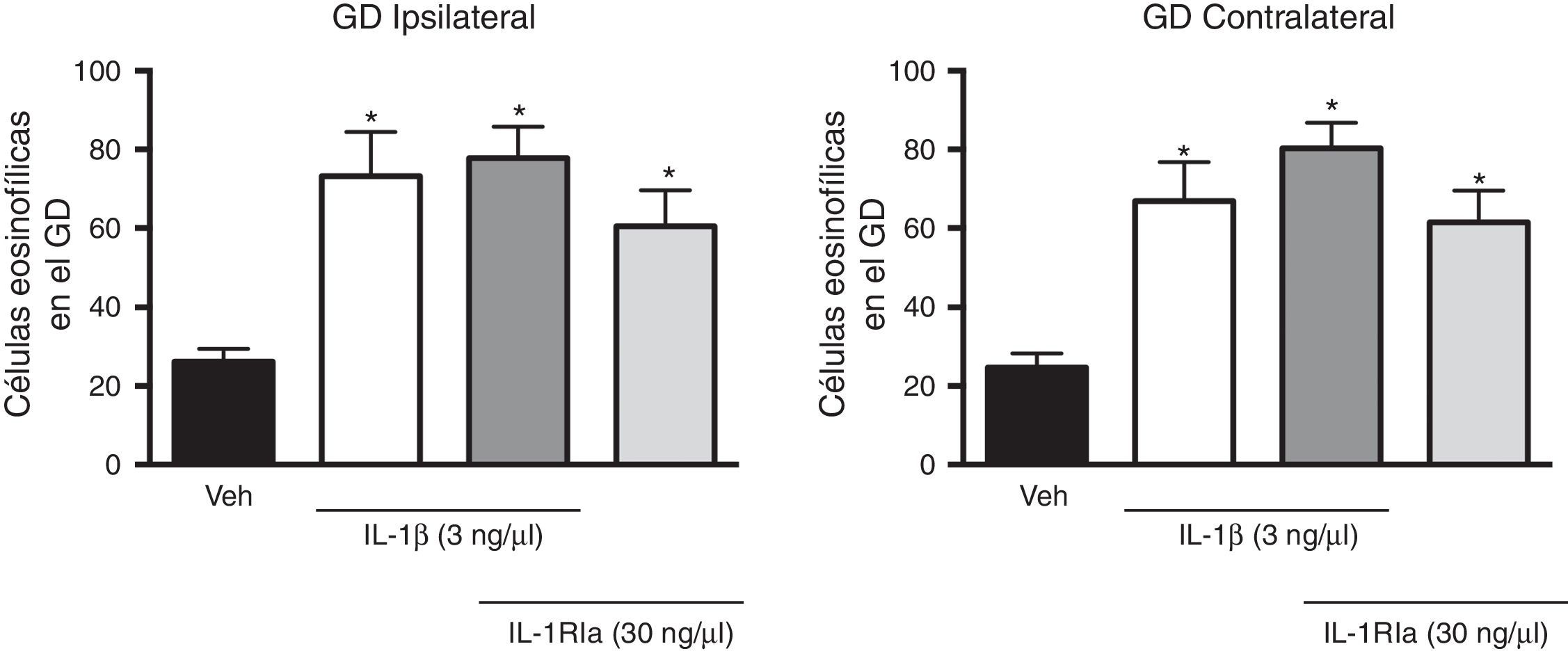
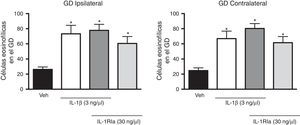
Al evaluar el efecto del antagonista de la IL-1β sobre el aumento que produjo esta en el número de células eosinofílicas, el análisis de varianza identificó diferencias entre los diferentes grupos experimentales tanto en el giro dentado ipsilateral (F(3,20)=7,62, p=0,001) como en el contralateral (F(3,20)=10,352, p=0,001) al sitio de administración de los tratamientos. Sin embargo, el IL-1Ra aplicado en combinación con la IL-1β no evitó el aumento producido por la citosina sola (p=0,585), e incluso la combinación de la IL-1β+IL-1Ra también produjo un aumento en el número de células eosinofílicas en el giro dentado ipsilateral (77,8±7,9; p=0,002) y contralateral (80,3±6,5; p<0.001) en comparación con el grupo vehículo. El IL-1Ra solo también promovió un aumento en el número de células eosinofílicas en el hemisferio ipsi (60,5±9,2, p=0,044) y contralateral (61,5±8,1, p=0,011) con respecto al grupo tratado con vehículo (fig. 3).
Efecto del antagonista natural de la IL-1β (IL-1Ra) inyectado solo o en combinación con la IL-1β en el número de célula eosinofílicas detectadas en el giro dentado (GD) del hipocampo después del EE. En el panel izquierdo se representan los datos del hipocampo ipsilateral al sitio de inyección de las citocinas y en el panel de la derecha, lo correspondiente al hipocampo contralateral. Las barras representan la media±EEM del número de células eosinofílicas para el grupo vehículo (veh), el grupo de 3ng de IL-1β, el grupo IL-1β+IL-1Ra (3 y 30ng, respectivamente) y IL-1Ra (30ng) (n=6 por grupo experimental). *p<0,05 vs el grupo vehículo.
Los resultados de este estudio muestran que la administración i.c.v. de IL-1β incrementó la muerte neuronal con morfología apoptótica en el giro dentado del hipocampo después del EE, efecto que no está mediado a través del receptor IL-1R1, pues su antagonista natural no evita este efecto.
Numerosos reportes han mostrado que el EE producido con el modelo de litio-pilocarpina produce muerte neuronal en el hipocampo en desarrollo7-11. En ratas de 14 días de edad, el EE produce muerte necrótica en el área CA1, mientras que en la capa granular interna del giro dentado existe muerte neuronal con morfología apoptótica10. En este contexto nuestros hallazgos concuerdan con estudios previos al demostrar muerte celular con morfología apoptótica en la región granular del giro dentado del hipocampo después del EE, ya sea en ausencia o en presencia de IL-1β. Medel-Matus et al.27 investigaron el efecto de la administración i.c.v. de IL-1β en la muerte neuronal hipocampal después del EE en ratas P14. Estos autores mostraron que la concentración de 3ng/μl de IL-1β aumentó la muerte neuronal en el área CA1 del hipocampo de ambos hemisferios después del EE. Los resultados de este estudio demostraron que la aplicación i.c.v. de IL-1β también aumenta la muerte celular en otra región hipocampal, el giro dentado. Sin embargo, la respuesta varió entre los hipocampos ipsi y contralateral al sitio de inyección. En este sentido, 3 y 300ng/μl de IL-1β incrementaron la muerte neuronal en el giro dentado ipsilateral al sitio de aplicación, mientras que este efecto se observó en el hipocampo contralateral únicamente con 3ng/μl de la citocina. Un posible efecto de dilución podría explicar las diferencias observadas entre hemisferios, considerando que después de la aplicación de IL-1β la cantidad de citocina que finalmente haya alcanzado el hemisferio contralateral a través del sistema ventricular haya sido insuficiente para favorecer la muerte celular.
En el intento por caracterizar el mecanismo por el cual la IL-1β aumentó la muerte neuronal después del EE, se co-administró con el antagonista natural de su receptor tipoi; sin embargo, el antagonista no evitó tal efecto, por lo que se asume que no depende de la activación de su receptor tipo1. El reporte previo de Medel-Matus et al.27 mostró que la IL-1β aumentó la muerte neuronal necrótica en el área CA1 a través de la activación de IL-1RI27. Los resultados de este estudio ponen de manifiesto que si bien la IL-1β aumenta la muerte neuronal hipocampal después del EE, el mecanismo comprometido puede variar dependiendo de la región cerebral implicada. Es posible que la IL-1β aumente la muerte neuronal en el giro dentado a través de un mecanismo indirecto, ya sea al inducir la síntesis y liberación de otras citocinas29,30 o bien al promover cambios en el flujo sanguíneo cerebral31,32, factores que podrían adyuvar al aumento de la muerte celular. En un reporte publicado recientemente se demostró que concentraciones ≥25ng/ml de IL-1β (concentraciones fisiopatológicas) disminuyen hasta en un 30% la neurotransmisión mediada por el receptor GABAA en el tejido de pacientes con epilepsia del lóbulo temporal, lo que sugiere que esta citocina reduce la neurotransmisión inhibitoria26. También se ha mostrado que la IL-1β atenúa la actividad de los transportadores gliales a glutamato y promueve su endocitosis en la médula espinal33. Ambos efectos de la citocina —la disminución de la transmisión GABAérgica o el aumento de la glutamatérgica— podrían favorecer la muerte neuronal asociada al EE observada en nuestro estudio.
El giro dentado es la principal vía de entrada de información al hipocampo a través de la vía perforante; las células de la capaii y iii de la corteza entorrinal envían sus axones al giro dentado y las neuronas granulares proyectan sus axones hacia las dendritas de las neuronas piramidales de CA312. El giro dentado del hipocampo es una de las regiones neurogénicas mejor caracterizadas. En la capa subgranular se localizan precursores neuronales que dan lugar a células granulares que se integran en los circuitos hipocámpicos mostrando propiedades fisiológicas similares a las neuronas granulares maduras34, las cuales migran a la capa de células granulares y proyectan axones al hilus y al área CA335,36. Se ha demostrado que durante el desarrollo de la epilepsia en animales, las nuevas células muestran anomalías estructurales, entre ellas el desarrollo de dendritas y fibras musgosas aberrantes37. En las células granulares esto ocasiona sinapsis excitatorias con las células vecinas, lo que puede generar un foco epileptogénico38. El desarrollo de circuitos aberrantes por las células granulares es característico de la epilepsia del lóbulo temporal, tanto en animales como en humanos, y la presencia de estos circuitos contribuye a la hiperexcitabilidad del giro dentado39-41. En un estudio previo se observó que las células del giro dentado que morían debido al EE en ratas en desarrollo expresaban marcadores de neuronas inmaduras10. El hecho de que la IL-1β aumente la muerte neuronal en la capa granular sugiere que un número mayor de las neuronas inmaduras pudieran estar muriendo debido al EE. Este hecho afectaría el funcionamiento hipocampal al disminuir el número de células viables para generar los circuitos normales del hipocampo. Sin embargo, podría también favorecer la neurogénesis como un mecanismo compensatorio para recuperar las células perdidas. En este último caso no es posible descartar que las neuronas recién generadas podrían establecer circuitos aberrantes y favorecer la excitabilidad hipocampal y, consecuentemente, la generación de crisis epilépticas o convulsiones. Resulta interesante que la inhibición selectiva de la enzima convertidora de interleucina (con el inhibidor selectivo VX-76) retrasa el desarrollo del kindling en ratas, efecto asociado con el bloqueo en la producción de IL-1β por los astrocitos en el cerebro de la rata25. Estos resultados sugieren que la IL-1β puede favorecer el proceso ictogénico o epileptogénico, el cual podría asociarse, en el caso del EE, con cambios en la funcionalidad del giro dentado debido a un proceso de daño o muerte neuronal.
La presente investigación demostró que la administración i.c.v. de la IL-1β aumenta la muerte neuronal con morfología apoptótica provocada por el EE en la capa granular del giro dentado del hipocampo de ratas de 14 días de edad. Estos resultados apoyan la importancia de identificar una terapia antiinflamatoria en el sistema nervioso central dirigida a disminuir la IL-1β como miras a evitar la muerte neuronal hipocampal debida al EE.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses relacionado con el artículo.
Al Consejo Nacional de Ciencia y Tecnología de México por el donativo de Investigación Básica otorgado a MLLM (CB-2008-106402) y por la beca de ayudante de investigación otorgada a ATP en conjunto con la Universidad Veracruzana (número de personal 44250).