La proteína priónica celular patógena (PrPsc) necesita de la presencia de la fisiológica (PrPc) para su propagación y replicación. Se estudia comparativamente la expresión y localización de PrPc en el sistema nervioso central (SNC) de rata, ratón, gato, vaca y humano, mediante técnicas inmunohistoquímicas y de Western blot, con el objetivo de un mejor conocimiento de las prionopatías y de la enfermedad de Alzheimer (EA).
Material y métodosSe emplearon encéfalos humanos y de gato, rata y vaca, para estudios por técnicas inmunohistoquímicas; se analizaron las cortezas frontal, temporal y occipital, así como hipocampo y tálamo. Se utilizaron técnicas de Western blot para encéfalos de ratón, gato, vaca y humano.
ResultadosExiste una disminución rostrocaudal de la cuantía de PrPc en el SNC de dichas especies. PrPc se sitúa en la membrana y en el citoplasma de las neuronas. Se observan neuronas inhibitorias en el córtex del gato. El patrón general del Western blot es análogo en las especies estudiadas, con predominio de la banda diglucosilada sobre las bandas monoglucosilada y no glucosilada.
DiscusiónLos datos indican que en las prionopatías, PrPsc puede transmitirse y replicarse de forma retrógrada en y a partir de las zonas más PrP positivas. La mayor cuantía de PrPc en algunas zonas del encéfalo humano podría estar en relación con los hallazgos anatomopatológicos de la EA.
ConclusionesLos datos apoyan un transporte retrógrado de la PrPsc en el SNC. La PrPc debe de tener relación con la fisiopatología de la EA.
The scrapie prion protein (PrPsc) requieres the cellular prion protein (PrPc) for its propagation and replication. In this work we studied the expression and localization of the PrPc in the central nervous system (SNC) of the rat, mouse, cat, cow and human, using immunohistochemestry and Western blot techniques to understand more about prionopathies and Alzheimer's disease (EA).
Matherial and methodsFor the immunohistochemetry study we used human, cat, rat and cow samples to analyse frontal, temporal and occipital cortex, as well as the hippocampus and the thalamus. For the Western blot analysis we used mouse, cat, cow and human brain samples.
ResultsWe observed a decrease in the amount of PrPc in the SNC in a rostrocaudal shift in the species mentioned above. We observed inhibitory cells in the cat cortex. The Western blot analysis showed a similar pattern of expression in the different species studied with a preponderance of the diglycosylated band, in relation to the other bands observed in the analysis.
DiscussionThese data suggest that in prionopathies PrPsc could be transmitted and could be replicated in and from the areas with most expression of PrPc. Similarly, a higher amount of this protein (PrPc) in some brain areas could explain some histopathological aspects of EA.
ConclusionsOur findings support the hypothesis of a retrograde transport of PrPsc in the SNC. PrPc could be related to the pathophysiology of EA.
La proteína priónica celular (PrPc) es una glucoproteína de membrana que se encuentra de forma constitutiva en diferentes órganos de la mayor parte de las especies animales estudiadas. Es especialmente abundante en el sistema nervioso central (SNC)1.
Existe una isoforma diferente de esta proteína: la proteína priónica scrapie (PrPsc o prión, anagrama de PROteinaceous INfectious particle). Los priones son los agentes causantes de las encefalopatías espongiformes transmisibles (EET), para cuyo establecimiento y posterior evolución es necesaria la presencia de PrPc junto a PrPsc; precisamente, se ha visto que ratones knock-out para PrP no desarrollan la enfermedad al ser inoculados con PrPsc2. Ambas isoformas de PrP están codificadas por el mismo gen, y presentan la misma secuencia aminoacídica, aunque con diferencias en cuanto a su estructura secundaria. PrPc puede ser digerida por la proteinasa K, mientras que PrPsc tan sólo lo es parcialmente.
PrPsc sólo aparece en las prionopatías, y alcanza en el encéfalo concentraciones de 10 a 20 veces más que la PrPc. En ocasiones, aparecen acúmulos de PrPsc en forma de placas en las EET.
La forma más habitual de las EET en humanos es la enfermedad de Creutzfeldt-Jakob (CJD). El insomnio familiar grave o fatal (FFI) muestra similitudes con la CJD. Pero lo característico del FFI son las alteraciones anatomopatológicas iniciales de la banda intermedia del núcleo dorsomedial del tálamo (MD) y del núcleo anteroventral del complejo de los núcleos anteriores del tálamo (A)3–5. Curiosamente, las zonas talámicas mencionadas presentan una conectividad diversa con respecto a las demás porciones de MD y A, así como con respecto a núcleos talámicos vecinos a MD y A, tanto en el gato como en la rata6,7. Al cabo de un tiempo, en FFI, en los casos de mayor duración, se afectan otras estructuras, entre ellas, las capas profundas de la corteza cerebral3,8. La zona cortical más afectada son la corteza cingular y la frontal, y la que menos, la occipital8,9.
Nosotros hemos propuesto la existencia de una propagación retrógrada de la PrPsc desde MD y A hacia varias áreas del SNC en el FFI6,10. Igualmente, en otras prionopatías, la propagación debe ser retrógrada (por ejemplo, en la encefalopatía espongiforme bovina11). Por otra parte, en el SNC de la rata hemos observado la colocalización de PrPc con varios neurotransmisores7, lo que induce a pensar en una multiplicidad de mecanismos patogénicos, tanto en el FFI como en las EET en general.
Y se da otra circunstancia especial: hemos observado un particular comportamiento de la PrPc en encéfalos con enfermedad de Alzheimer (EA)12.
El objetivo del trabajo es dilucidar si PrPc, tanto en las prionopatía como en la EA, ha de tener un papel especial en relación con la fisiopatología de ambos grupos de entidades clínicas.
Material y métodosSe han utilizado encéfalos de humano, así como de gato, rata, ratón y vaca.
Los encéfalos de gato, rata, vaca y humano se estudiaron por técnicas inmunohistoquímicas, analizando de modo especial las cortezas frontal, temporal y occipital, el hipocampo y el tálamo.
El tejido se fijó por inmersión, para conseguir una buena protección antigénica. Se incluyó en parafina y se cortó en secciones de 4μm. Los anticuerpos de mejores resultados fueron los policlonales Anti-Prion Protein 91511, de Assay Dessigns Inc., y ARP-01-8634, de American Research Products.
Se procedió también a técnicas de Western blot, con tejido fresco, no fijado, en que al efecto se diseccionaron las zonas de interés; las muestras fueron rápidamente congeladas con hielo seco y almacenadas a −80°C, hasta la cuantificación del contenido total de proteínas en cada una de las zonas de estudio. Posteriormente, las proteínas se separaron en geles de acrilamida al 12% y se transfirieron a membrana de nitrocelulosa, con una incubación en que se utilizó el anticuerpo para PrP mAb 6H4, de Prionics. Una vez conseguidas las condiciones adecuadas, se procedió a la medición correspondiente por densitomería. Se utilizaron encéfalos de gato, ratón, vaca y humano.
Para los experimentos se utilizó un cerebro humano, procedente de un fallecido de 28 años de edad, considerado sano por el BCH de Navarra, al que se le practicó la extracción a las 6 horas de su fallecimiento tras un accidente.
El trabajo fue realizado de acuerdo con la Declaración de Helsinki de 1975, y aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de Navarra.
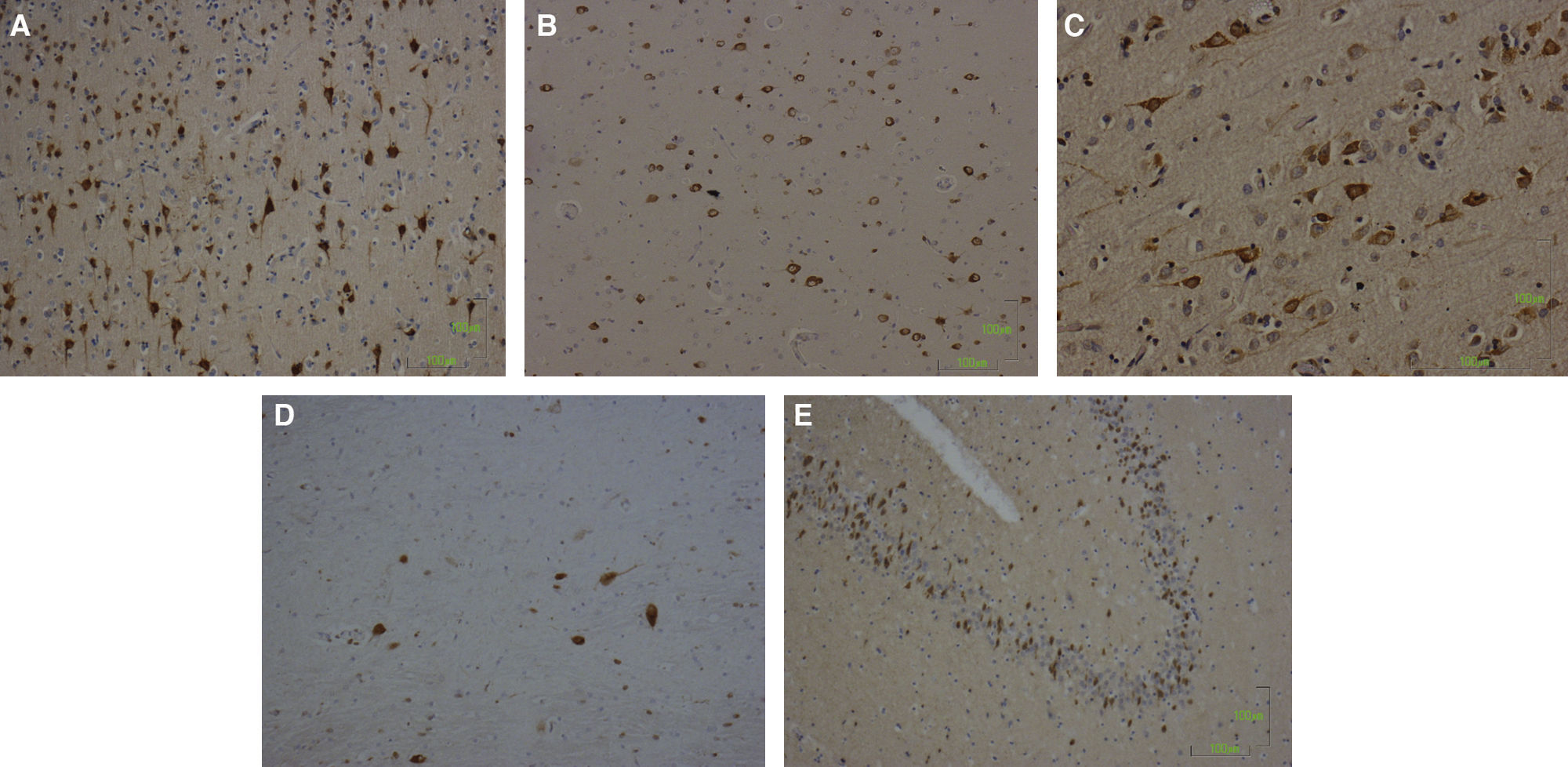
ResultadosInmunohistoquímica (rata, gato, vaca y humano)En las especies estudiadas, incluido el humano, la cuantía de PrPc disminuye en sentido caudal dentro del SNC (por ejemplo, comparar tálamo y corteza cerebral en las figs. 1–4).
Se observa claramente que la PrPc se sitúa en la membrana de las células (fig. 4, corteza temporal de humano) y también en el citoplasma (en este caso, en forma de acúmulos, oliva inferior de vaca) (fig. 3).
Hay que destacar que, en la corteza cerebral de todas las especies, la marcación es más abundante en las capas profundas que en las superficiales, y que hay células gabaérgicas distribuidas a lo largo del SNC (por ejemplo, en la corteza occipital del gato) (fig. 2), tema que ya fue estudiado en su día por Moleres et al7,13 en la rata.
Western blotSe ha estudiado de forma comparada el Western blot para cortezas frontal temporal y occipital, así como para el tálamo en gato, vaca y humano (fig. 5).
Western blots comparativos para gato, vaca y humano, de corteza frontal y tálamo (A) y de cortezas temporal y occipital (B). C: el análisis es en el hipocampo de ratón, gato, vaca y humano. Obsérvese el patrón similar en las tres especies, con una mayor intensidad para la banda diglucosilada con respecto a las otras dos bandas.
La cuantía de PrPc es mayor en la vaca que en las otras especies, excepto por lo que respecta a la corteza temporal, en que la cuantía es mayor para el humano. En todos los casos, la intensidad es mayor para la banda diglucosilada que para las otras bandas correspondientes a la proteína (monoglucosilada y no glucosilada) (fig. 5A y B).
La figura 5C muestra el análisis comparado para ratón, gato, vaca y humano en cuanto al hipocampo. Sigue siendo más abundante la cuantía de PrPc en vaca, le sigue el humano y la menor cuantía es para el gato y el ratón. En todos los casos, la intensidad para la banda diglucosilada es mayor que para las otras bandas.
DiscusiónEl presente es una continuidad de trabajos nuestros anteriores6,7,11–13.
En cuanto a los datos de inmunohistoquímica, como en trabajos anteriores, seguimos observando una gran ubicuidad en el SNC, pero con más abundancia de proteína en sus zonas más rostrales, lo que podría significar que en las prionopatías la PrPsc se replicaría más intensamente en y a partir de tales zonas. El hecho de que en las especies estudiadas la cuantía de PrPc sea especialmente abundante en zonas que proyectan al tálamo (como son las capas profundas de la corteza cerebral, figs. 1–4) indica que la transmisión de los priones en las EET (por ejemplo, en la encefalopatía espongiforme felina, la encefalopatía espongiforme bovina, el insomnio familiar grave humano) ha de seguir una vía retrógrada dentro del encéfalo14,15. Por otra parte, la corteza occipital proyecta menos al tálamo, y de las consideradas, vemos en nuestro estudio que ésta es la corteza que menor marcación para PrPc contiene, lo que apoya también la hipótesis del transporte retrógrado de los priones.
Observamos que PrPc se sitúa tanto en la membrana celular (fig. 1) como en el interior del citoplasma de las neuronas (fig. 3).
Por otra parte, al igual que ocurre en la rata7,13, hay células gabaérgicas en la corteza cerebral (fig. 2, corteza occipital del gato), lo que explica (por extrapolación legítima) una vez más el hecho de que en el insomnio familiar grave haya signos y síntomas de tipo excitatorio, debido a la destrucción de células inhibitorias.
En cuanto a los datos obtenidos a partir del Western blot de algunas zonas de corteza cerebral, parece lógico que en el humano sea más abundante la cuantía de PrP en corteza temporal que en las otras especies estudiadas. Y en cuanto al hipocampo, parece curioso que la cuantía sea mayor en la vaca que en las otras especies. El Western blot da noticia también de una cuantía menor de PrP en corteza occipital que en las demás cortezas consideradas, sobre todo en el humano, lo que está en consonancia con los hallazgos de la inmunohistoquímica.
Estos datos concuerdan además con los hallazgos de Rezai et al16, que observan que, tanto en casos sanos como en los de EA, la expresión de la PrPc es mayor en la corteza frontal que en la occipital. Podría significar, además, que la mayor abundancia de PrPc en determinadas zonas corticales esté en relación con las lesiones anatomopatológicas de la EA; tales lesiones son mayores en hipocampo, corteza temporal y corteza frontal que en otras zonas corticales del SNC. Esto no significaría obligadamente que la PrPc esté directamente implicada en el proceso de la EA, como dicen algunos autores17; es simplemente un dato que observamos. Nosotros, en cambio, pensamos que PrPc tendría un papel protector en relación con la EA12, en concordancia con trabajos recientes de otros autores18-20.
En todos los casos, la banda diglucosilada es más intensa que las bandas monoglucosilada y no glucosilada. Esta situación se altera en los casos de EA, en que la cuantía de PrP disminuye y se da una cierta intensificación de la banda no glucosilada12.
FinanciaciónAyuda PIUNA 2006-2008 y Ayuda BMH4-CT96-856 (EU).
Nuestro agradecimiento a la Dra. Cristina Caballero (Banco de Cerebros, Anatomía Patológica, Hospital de Navarra, Pamplona, España), que proporcionó las muestras de humanos.