La variabilidad glucémica (VG) hace referencia a las oscilaciones en los niveles de glucosa en sangre y podría influir en el pronóstico del ictus. Objetivo: Analizar el efecto de la VG en la evolución del infarto cerebral agudo (IC).
MétodosAnálisis exploratorio del estudio GLIAS-II (multicéntrico, prospectivo y observacional). Se midieron los niveles de glucemia capilar cada cuatro horas durante las primeras 48 horas y la VG se definió como la desviación estándar de los valores medios. Variables principales: mortalidad y muerte o dependencia a los tres meses. Variables secundarias: porcentaje de complicaciones intrahospitalarias y de recurrencia de ictus, e influencia de la vía de administración de insulina sobre la VG.
ResultadosSe incluyeron 213 pacientes. Los pacientes que fallecieron (N = 16;7,8%) presentaron mayores valores de VG (30,9 mg/dL vs. 23,3 mg/dL; p = 0,05). En el análisis de regresión logística ajustado por edad y comorbilidad, tanto la VG (OR = 1,03; IC del 95%: 1,003-1,06: p = 0,03) como la gravedad del IC (OR = 1,12; IC del 95%: 1,04-1,2; p = 0,004) se asociaron de forma independiente con la mortalidad a los tres meses. No se encontró asociación entre la VG y las demás variables de estudio. Los pacientes que recibieron tratamiento con insulina subcutánea mostraron una mayor VG que los tratados con insulina intravenosa (38,9 mg/dL vs. 21,3 mg/dL; p < 0,001).
ConclusionesValores elevados de VG durante las primeras 48 horas tras el IC se asociaron de forma independiente con la mortalidad. La administración subcutánea de insulina podría condicionar una mayor VG que la vía intravenosa.
Glycaemic variability (GV) refers to variations in blood glucose levels, and may affect stroke outcomes. This study aims to assess the effect of GV on acute ischaemic stroke progression.
MethodsWe performed an exploratory analysis of the multicentre, prospective, observational GLIAS-II study. Capillary glucose levels were measured every 4 hours during the first 48 hours after stroke, and GV was defined as the standard deviation of the mean glucose values. The primary outcomes were mortality and death or dependency at 3 months. Secondary outcomes were in-hospital complications, stroke recurrence, and the impact of the route of insulin administration on GV.
ResultsA total of 213 patients were included. Higher GV values were observed in patients who died (n = 16; 7.8%; 30.9 mg/dL vs 23.3 mg/dL; p = 0.05). In a logistic regression analysis adjusted for age and comorbidity, both GV (OR = 1.03; 95% CI, 1.003-1.06; p = 0.03) and stroke severity (OR = 1.12; 95% CI, 1.04-1.2; p = 0.004) were independently associated with mortality at 3 months. No association was found between GV and the other outcomes. Patients receiving subcutaneous insulin showed higher GV than those treated with intravenous insulin (38.95 mg/dL vs 21.34 mg/dL; p < 0.001).
ConclusionsHigh GV values during the first 48 hours after ischaemic stroke were independently associated with mortality. Subcutaneous insulin may be associated with higher VG levels than intravenous administration.
El concepto de variabilidad glucémica (VG) hace referencia a las oscilaciones temporales en los niveles de glucosa en sangre. El desarrollo de los dispositivos de monitorización continua de la glucosa (MCG), ha permitido profundizar en el conocimiento de la dinámica de la glucemia en los pacientes con Diabetes Mellitus (DM)1. Un metaanálisis reciente ha mostrado la asociación entre los valores elevados de VG y el daño microvascular en los pacientes con DM, aunque los datos de su implicación en el daño macrovascular son inconsistentes hasta el momento2.
En los últimos años, se ha estudiado la influencia de la VG en el pronóstico de los pacientes con DM en diferentes entornos clínicos, y si sus efectos son independientes de la hiperglucemia o de los valores de la hemoglobina glicosilada y se ha demostrado que valores elevados de VG se han asociado con una mayor mortalidad en los pacientes atendidos en unidades de cuidados intensivos, así como con una mayor duración de la estancia hospitalaria en los pacientes no críticos3,4, independientemente del tipo de enfermedad. Por otra parte, algunos autores han propuesto que, además de la hiperglucemia postictus (PSH), la VG podría actuar como factor predictor pronóstico tras un infarto cerebral (IC), asociándose a un aumento de la mortalidad vascular después del IC y a deterioro neurológico precoz (DNP)5,6. Un estudio retrospectivo también señala que en los pacientes con un IC tratados con trombolisis intravenosa, la VG pueda estar relacionada con la mortalidad7.
Existe gran cuerpo de evidencia de que la hiperglucemia es un factor de mal pronóstico en el IC, incluso en los pacientes tratados con trombolisis intravenosa (TIV) y trombectomía mecánica8-14. Sin embargo, los ensayos clínicos dirigidos a la reducción intensiva de los niveles de glucosa no han logrado demostrar su beneficio en los pacientes con IC15, lo que sugiere que otros parámetros, más allá de la propia hiperglucemia postictus, podrían estar involucrados en el mal pronóstico de estos pacientes y que tradicionalmente se ha atribuido a la hiperglucemia.
Nuestro objetivo fue analizar la influencia de la VG en el pronóstico del IC agudo en pacientes ingresados en unidades de ictus (UI). También analizamos la posible influencia de la vía de administración de insulina sobre la VG.
MétodosSe realiza un análisis exploratorio del estudio Glycemia in Acute Stroke (GLIAS) II. Los detalles completos del diseño han sido previamente publicados14. Brevemente, el estudio GLIAS II es un estudio de cohorte multicéntrico, prospectivo, observacional y académico realizado con la participación de nueve Servicios de Neurología. Se incluyeron pacientes de entre 18 y 85 años con IC agudo de menos de 24 horas de evolución. Se recogieron, entre otros, los siguientes datos: características demográficas; antecedentes médicos (incluyendo diagnóstico previo de DM y síndrome metabólico); comorbilidad previa según el Índice de Comorbilidad de Charlson16,17; y características del IC. La gravedad se midió mediante la escala NIHSS (National Institute of Health Stroke Scale) al ingreso y al día siete o al alta hospitalaria (lo que ocurriera primero).
Se midieron los niveles de glucosa capilar cada cuatro horas durante las primeras 48 horas. Definimos la hiperglucemia postictus como los valores superiores a 155 mg/dL18. Para medir la VG, se calculó la glucemia media durante las primeras 48 horas y la desviación estándar (DE) de la media para cada paciente19. La HbA1c se midió en todos los pacientes en el momento del ingreso, como reflejo del control glucémico de los últimos tres meses20. Los pacientes con hiperglucemia postictus fueron tratados y alimentados de acuerdo con los protocolos de cada hospital. Se registraron además todos los tratamientos correctores de hiperglucemia que fueron prescritos a criterio del médico, sin que la participación en el estudio GLIAS-II condicionara la dosis o vía de administración de la insulina.
Las variables principales de análisis fueron la mortalidad y la muerte o dependencia a los tres meses (puntuación en la escala Rankin modificada (ERm) de 3-6). Las variables secundarias fueron las complicaciones intrahospitalarias (hemorragia cerebral sintomática, edema cerebral, deterioro neurológico precoz (DNP), neumonía e infección urinaria), así como la recurrencia de ictus a los tres meses. El DNP se definió como el aumento de cuatro o más puntos en la puntuación del NIHSS entre la evaluación basal y la correspondiente al día siete o alta (lo que ocurriera primero). Finalmente, también analizamos la influencia de la vía de administración de insulina correctora de hiperglucemia postictus en los valores de VG considerando los siguientes grupos: insulina subcutánea, insulina intravenosa o no tratamiento corrector.
Análisis estadísticoEl análisis estadístico fue realizado por la Unidad de Bioestadística y apoyo a la investigación del Instituto de Investigación IdiPAZ, utilizando SPSS 12.0 para Windows (SPSS Inc., Chicago, IL). Las variables categóricas se describieron como porcentajes, y las proporciones entre los grupos se compararon utilizando la prueba de ji-cuadrado o la prueba exacta de Fisher para las variables dicotómicas. Las variables continuas se expresaron como la media y la desviación estándar (DE) o la mediana y rango intercuartil (RIQ). La relación entre la variabilidad glucémica y las variables demográficas y subtipo de ictus se analizó mediante la prueba T de Student y para la relación con edad una regresión lineal.
El análisis se realizó de forma exploratoria sin presunciones. En primer lugar, se consideró la VG como una variable continua y se utilizó la prueba T de Student o la U de Mann-Whitney, según fuera apropiado. Para la comparación entre grupos según la prescripción de insulina y su vía de administración se utilizó la prueba de ANOVA de un factor con la corrección post-hoc de Bonferroni.
El efecto de los niveles de la VG sobre el pronóstico del IC se analizó en varios pasos. En primer lugar, se realizó un análisis de regresión logística por pasos hacia adelante en el que se incluyeron aquellas variables que alcanzaron una diferencia con p < 0,1 en el análisis de comparación de medias, ajustando por la edad, la puntuación inicial del NIHSS y el índice de Comorbilidad de Charlson. Los resultados se expresaron como odds-ratios (OR) con intervalos de confianza (IC) del 95%.
En segundo lugar, se realizó un análisis de la curva característica operativa del receptor (COR) para determinar el valor predictivo del área bajo la curva, así como un punto de corte para la VG que diferenciara mejor entre los resultados favorables y desfavorables. Se consideró el punto en el que la suma de la especificidad y la sensibilidad era más alta y dando el mismo peso a los falsos positivos y a los falsos negativos. Finalmente, calculamos las curvas COR para predecir la sensibilidad de los modelos que estaban estadísticamente asociados con los objetivos primarios. Todas las pruebas fueron de dos colas, y se asumió la significación estadística si p < 0,05.
Aspectos éticosSe obtuvo el consentimiento informado de todos los pacientes o de sus familiares en caso de incapacidad del paciente. Este estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Universitario La Paz (PI -855) y clasificado como estudio observacional por la Agencia Española de Medicamentos y Productos Sanitarios.
ResultadosSe incluyeron 213 pacientes en el estudio GLIAS-II. Las características basales y los datos de laboratorio se muestran en la tabla 1. Casi la mitad de los pacientes presentaron hiperglucemia postictus, siendo los valores medios de VG de 23,83 mg/dL. Se observaron mayores valores de VG en los pacientes con diagnóstico previo de DM (36,3 vs 18,4 mg/dL; p < 0,001) y de síndrome metabólico (31,9 vs 22,1 mg/dL; p < 0,001). No hubo diferencias en los valores de VG en relación con la edad, sexo, diagnóstico previo de HTA, dislipidemia, o subtipo etiológico de ictus.
Datos demográficos y relacionados con el infarto cerebral
| Cohorte GLIAS-II N = 213 | |
|---|---|
| Edad (años), media (DE) | 71,24 (10,83) |
| Sexo masculino (%) | 128 (60,1) |
| Hipertensión arterial, N (%) | 151 (70,9) |
| Dislipidemia, N (%) | 97 (45,5) |
| Síndrome metabólico, N (%) | 18 (34) |
| Índice de comorbilidad de Charlson, mediana (RIQ) | 2 (1-3) |
| DM, N (%) | 64 (30) |
| NIHSS basal, media (RIQ) | 5 (3-11) |
| TIV, N (%) | 82 (38) |
| Subtipo etiológico de ictus, N (%) | |
| Enfermedad de gran vaso con estenosis > 50% | 24 (11,3) |
| Enfermedad de gran vaso con estenosis < 50% | 16 (7,5) |
| Cardioembólico | 74 (34,7) |
| Enfermedad de pequeño vaso | 54 (25,4) |
| Inhabitual | 6 (2,8) |
| Criptogénico | 39 (18,3) |
| Presión arterial sistólica al ingreso, media (DE) | 156,94 (27,99) |
| Presión arterial diastólica al ingreso, media (DE) | 83,75 (15,67) |
| Temperatura corporal al ingreso, media (DE) | 36,09 (0,53) |
| Saturación de oxígeno al ingreso, media (DE) | 96,49 (2,21) |
| Glucemia capilar al ingreso (mg/dL), media (DE) | 134 (54,07) |
| HbA1c (%, mmol/mol) al ingreso; media (DE) | 6,16, 43 (1,23) |
| Episodios de glucemia postictus > 155 mg/dL en las primeras 48 horas, N (%) | 97 (45,5) |
| Variabilidad Glucémica (mg/dL), media (DE) | 23,83 (15,11) |
DE: Desviación estándar; NIHSS: National Institute Health Stroke Scale; TIV: trombolisis intravenosa.
Un total de 69 pacientes recibieron tratamiento de insulina durante las primeras 48 h, seis de ellos fueron tratados sólo con insulina intravenosa y 63 con insulina subcutánea utilizando diferentes estrategias de tratamiento (insulina en bolo según glucemia capilar en 30 pacientes, insulina basal en dos casos, insulina en bolo ajustada a la glucemia capilar seguida de insulina iv en ocho pacientes, insulina en bolo ajustada a la glucemia capilar seguida de insulina subcutánea basal en 14 casos, insulina intravenosa inicial seguida de insulina basal en un paciente, e insulina intravenosa inicial seguida de insulina pandrial e insulina subcutánea basal en ocho).
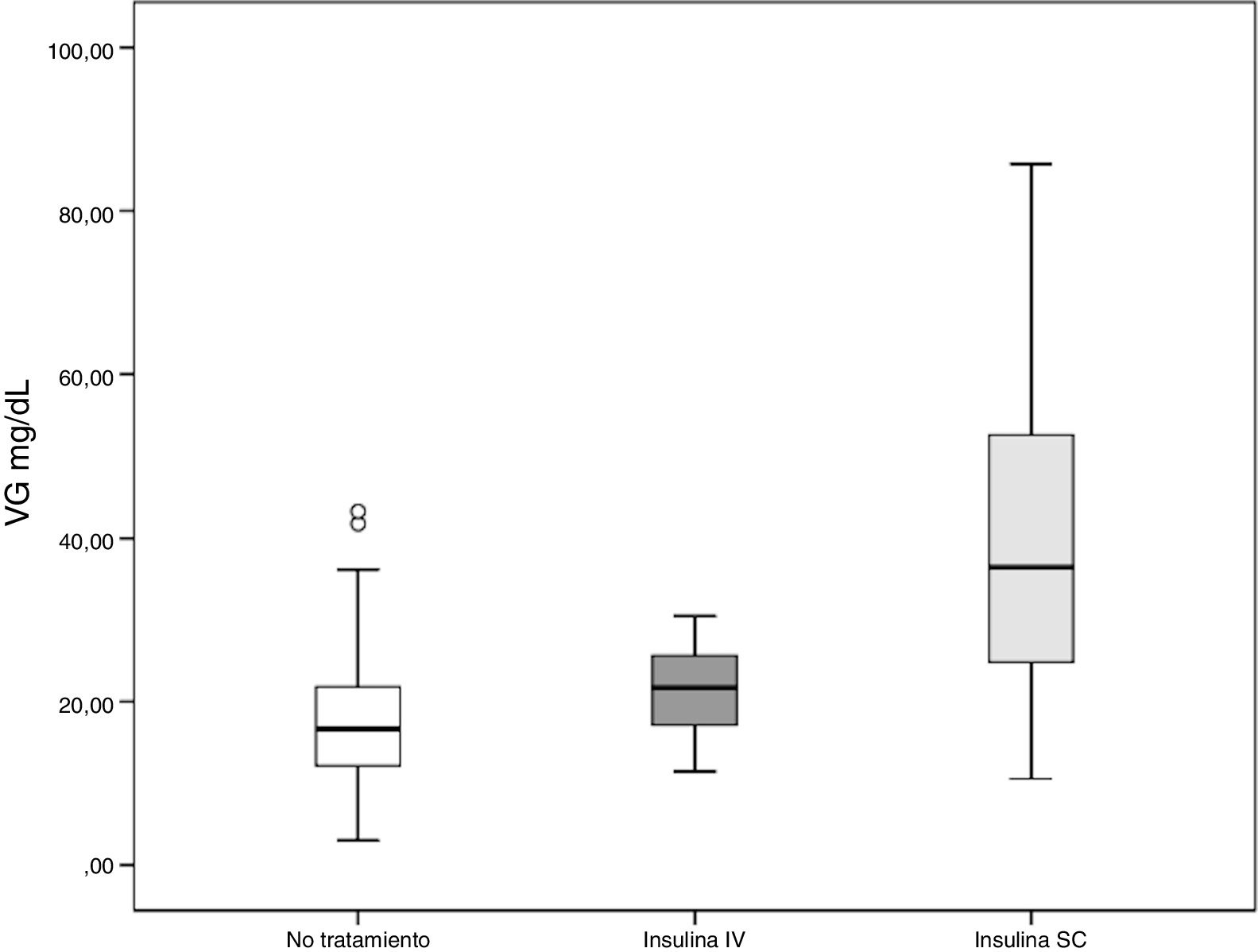
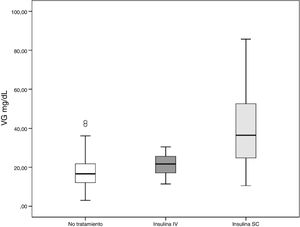
Los pacientes tratados sólo con insulina intravenosa mostraron niveles más bajos de VG que el grupo tratado con insulina subcutánea; con valores de VG en este grupo casi 20 mg/dL más altos (p < 0,001). Además, los valores de VG en el grupo de insulina intravenosa fueron muy similares a los niveles de VG en los pacientes sin tratamiento de hiperglucemia. Los resultados se muestran en la tabla 2 y en la figura 1.
Influencia de la vía de administración de insulina en la variabilidad glucémica
| Administración de insulina | Variabilidad glucémica (mg/dL) | p |
|---|---|---|
| Sin tratamiento N = 144 | 17,32 | Referencia |
| Insulina intravenosa N = 6 | 21,34 | 1,00 |
| Insulina subcutánea N = 63 | 38,95 | < 0,001 |
Test de ANOVA y post-hoc de Bonferroni
Se completó el seguimiento a los tres meses en 203 pacientes (95,3%). Los datos de mortalidad, muerte o dependencia y complicaciones de la hospitalización se muestran en la tabla 3. Un total de 16 pacientes fallecieron, lo que representa el 7,8% de la cohorte: 6 (37,5%) por complicaciones directamente relacionadas con el ictus (edema cerebral o infarto maligno), 4 (25%) por causa no vascular, 3 (18%) por causa vascular no relacionada con el ictus y 3 (18%) por causas desconocidas. No se encontraron diferencias en la frecuencia de fallecidos con relación a la etiología del infarto cerebral (p = 0,7).
Análisis de las variables principales y secundarias
| Variables principales (N = 203) | Variabilidad glucémica media (DE), mg/dL | 95% IC | p |
|---|---|---|---|
| Mortalidad a 3 meses | |||
| Presente N = 16 | 30,9 (16,1) | ||
| Ausente N = 187 | 23,3 (15,9) | -15,4-0,16 | 0,05 |
| ERm 3-6 a 3 meses | |||
| Presente N = 57 | 23,2 (14,9) | ||
| Ausente N = 146 | 25,5 (16,1) | -2,4-6,9 | 0,34 |
| Recurrencia de ictus a los 3 meses | |||
| Presente N = 8 | 24,0 (8,1) | ||
| Ausente N = 195 | 23,9 (15,5) | -11,0-10,7 | 0,97 |
| Variables secundarias: Complicaciones intrahospitalarias (N = 213) | |||
| Infección de tracto urinario | |||
| Presente N = 5 | 19,2 (9,8) | ||
| Ausente N = 208 | 23,9 (15,2) | -8,7-18,2 | 0,49 |
| Neumonía | |||
| Presente N = 8 | 24,2 (16,6) | ||
| Ausente N = 205 | 23,8 (15,0) | -11,1-10,3 | 0,94 |
| Edema cerebral | |||
| Presente N = 10 | 25,0 (18,1) | ||
| Ausente N = 203 | 23,7 (14,9) | -10,9-8,3 | 0,78 |
| Transformación hemorrágica sintomática | |||
| Presente N = 2 | 19,7 (20,4) | ||
| Ausente N = 211 | 23,8 (15,1) | -17,0-25,3 | 0,7 |
| Deterioro neurológico precoz | |||
| Presente N = 21 | 26,7 (15,0) | ||
| Ausente N = 192 | 23,5 (15,1) | -10,1-3,5 | 0,35 |
En el análisis no ajustado, observamos una tendencia a mayor VG en los pacientes fallecidos a los tres meses (30,9 vs 23,3 mg/dL; p = 0,05), sin diferencias en las variables muerte o dependencia y complicaciones hospitalarias.
En el análisis de regresión logística ajustado por la edad y la comorbilidad, tanto la gravedad del IC (OR = 1,12; IC 95%: 1,04-1,2; p = 0,004) como la VG (OR = 1,03; IC 95%: 1,003-1,06; p = 0,03) se asociaron de forma independiente con la mortalidad.
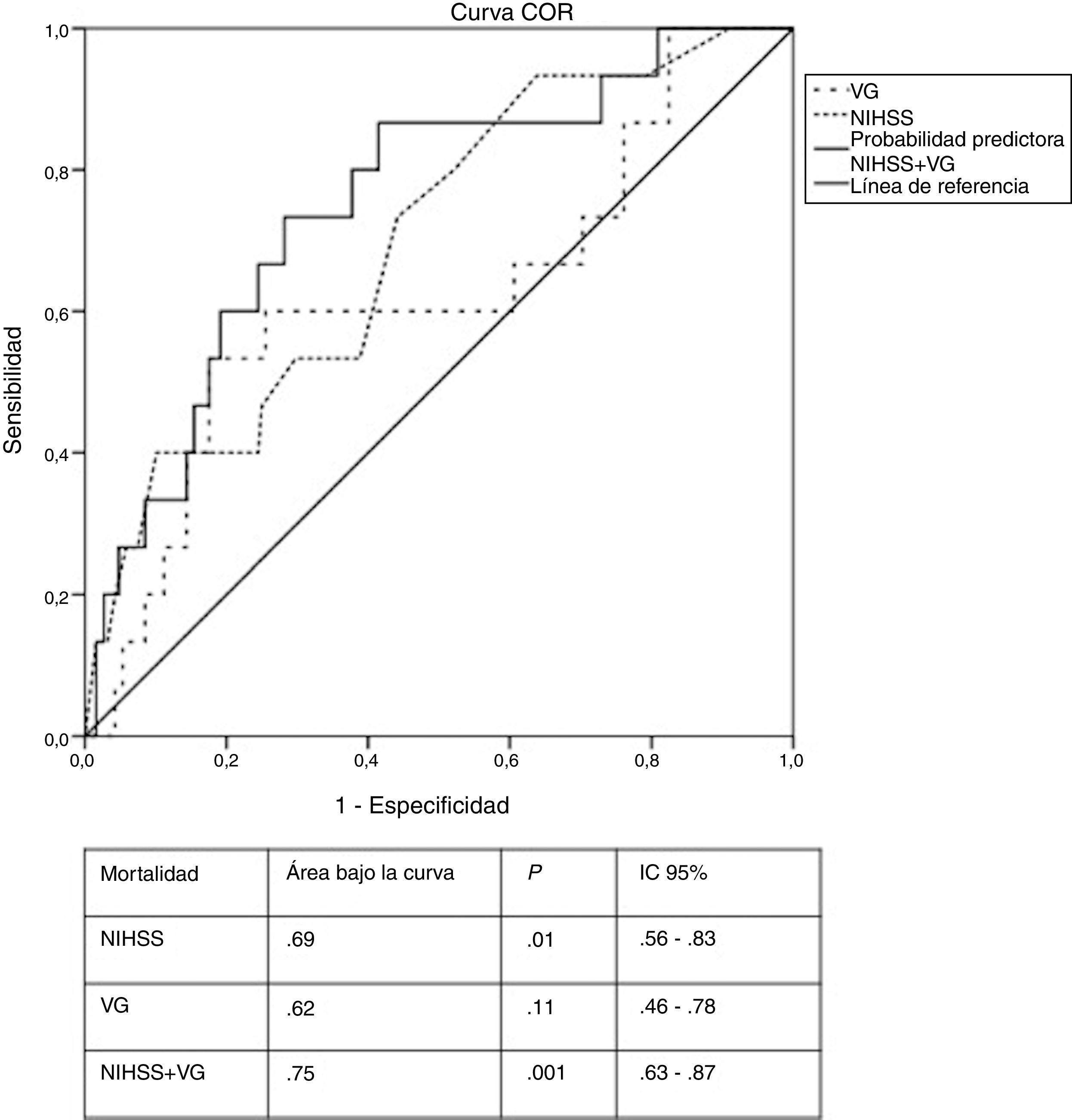
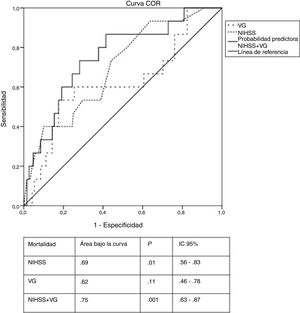
En la curva COR para la VG, el punto de corte que se identificó asociado la mortalidad fue 32,5 mg/dL, casi 10 mg/dL más alto que el valor medio de la cohorte del estudio. Se observó además que los pacientes tratados con insulina subcutánea presentaron niveles de VG por encima de este valor. La curva COR para el modelo de regresión logística se muestra en la figura 2. La combinación de la gravedad del ictus y la VG mostró una probabilidad del 75% de predecir la mortalidad, mientras que la gravedad del ictus y la VG analizadas de forma aislada tuvieron una probabilidad del 69% y 62% respectivamente. Los valores elevados de VG aumentaron en un 6% la probabilidad de mortalidad a los tres meses.
DiscusiónEn la cohorte GLIAS II, los pacientes que fallecieron tras el IC presentaban mayores valores de VG en las primeras 48 horas que los supervivientes y, tras ajustar por edad y comorbilidad, la VG y la gravedad del IC se asociaron de forma independiente con la mortalidad.
Hasta el momento pocos estudios han abordado la repercusión de la VG en el pronóstico del IC, con resultados controvertidos. Un estudio reciente centrado en la identificación del umbral glucémico que predice mal pronóstico del ictus tras el tratamiento con TIV no encontró una relación con la VG7. Sin embargo, Hui et al. mostraron que los pacientes con mayor VG tenían una mayor frecuencia de DNP6. Otros estudios realizados en pacientes con DM tipo 2 encontraron una relación entre los valores elevados de VG y mayor mortalidad vascular en pacientes con IC5. En este análisis exploratorio de la cohorte GLIAS-II incluimos pacientes con y sin diagnóstico previo de DM, pacientes tratados con TIV y, tras el ajuste por edad y comorbilidad, la VG junto con la gravedad inicial del ictus se mostraron como predictores independientes de mortalidad, con un punto de corte de 32,5 mg/dL en la curva COR, hallazgos similares a los reportados en estudios previos que evaluaron la influencia de la VG en otras enfermedades3,21. Otra de las variables que podría influir en la mortalidad es el subtipo etiológico del IC22,23. Sin embargo, no hemos observado diferencias en los valores de VG en la fase aguda del ictus ni en la mortalidad al comparar los diferentes subtipos etiológicos, los que sugiere que la influencia de la VG es independiente de la etiología del IC. No obstante, futuros estudios específicamente centrados en este análisis podrán obtener conclusiones definitivas sobre el papel pronóstico de la VG en los diferentes subtipos etiológicos de IC.
Hasta la fecha, no existe un patrón oro para la medición de la VG para fines de investigación o clínicos; de tal forma que cada grupo de investigación utiliza un parámetro diferente. Algunos de los más utilizados son la desviación estándar de la media, el rango, y la amplitud media de la excursión glucémica (MAGE, del inglés mean amplitude of glycemic excursions)24. En el estudio GLIAS -II, la medición del VG se basó en la desviación estándar de los niveles de glucosa, al igual que otros estudios en pacientes con ictus6. Para la correcta interpretación de la desviación estándar como valor de la VG, se consideran necesarias de ocho a diez mediciones de glucemia19. En el estudio GLIAS-II se realizaron las mediciones cada cuatro horas, con ocho valores en cada paciente para calcular el promedio y la desviación estándar. Sin embargo, en la mayoría de los estudios que utilizaron la desviación estándar como parámetro de VG, el número de determinaciones para calcularla fue menor, con sólo dos a seis determinaciones en cada paciente3,7, y solo un estudio utilizó más de 10 determinaciones6. Estas diferencias en el índice de VG utilizado podrían explicar las diferencias en los resultados de los diferentes estudios. Actualmente, el desarrollo de la MCG ha abierto una oportunidad para explorar mejor el efecto pronóstico de la VG en IC, así como los factores que influyen en las oscilaciones de los niveles de glucosa en los primeros días después del ictus. Hasta donde sabemos, son pocos los estudios que utilizan la MCG en pacientes con IC8,25-27 y sólo uno de ellos ha encontrado una relación entre la VG y el crecimiento del IC26.
En este análisis exploratorio, también observamos que las diferentes vías de administración de insulina utilizada para corregir la hiperglucemia postictus tuvieron un impacto en la VG. Así, la administración intravenosa mostró valores más bajos de VG, mientras que el tratamiento con basado en insulina subcutánea mostró niveles de VG superiores a 32,5 mg/dL, que es el punto de corte que hemos identificado como umbral asociado a mayor riesgo de mortalidad. Durante la isquemia cerebral aguda, existe una mayor demanda metabólica con aumento en la necesidad de sustratos de glucemia. Esta mayor demanda de glucosa, en condiciones de hipoxia, conduce a un aumento del metabolismo anaeróbico, produciendo niveles más altos de lactato y piruvato. Solo puede mantenerse el suministro adecuado de glucosa al cerebro cuando la concentración de glucosa sistémica se mantiene en un especial equilibrio. Por un lado, se ha demostrado que la hiperglucemia aumenta el estrés oxidativo, activa las citoquinas inflamatorias y aumenta la acumulación de ácido láctico en el espacio intracelular, causando una disfunción mitocondrial que agrava el fallo energético. Y por el otro lado, la hipoglucemia puede inducir neuroglucopenia y crisis metabólicas cerebrales debido a la capacidad limitada del cerebro para compensar la hipoglucemia, por lo que la falta de glucosa en el tejido cerebral hipóxico podría inducir disfunción mitocondrial debido a la generación de radicales libres de oxígeno, alteración en los gradientes iónicos transmembrana, y activación de apoptosis28. Por tanto, las oscilaciones de la glucemia, con momentos de hiperglucemia y otros de hipoglucemia, secundaria a la corrección farmacológica de la primera, podrían empeorar el pronóstico, y son estas oscilaciones las que subyacen al concepto de VG.
La Asociación Americana de Diabetes recomienda tratar la hiperglucemia en pacientes hospitalizados con insulina intravenosa para mantener los valores de glucosa en sangre dentro de un rango de 140-180 mg/dL (7,7-10 mmol/L) en pacientes en estado crítico20. Sin embargo, la evidencia en la que se basan estas recomendaciones de objetivos de glucemia en pacientes con ictus agudo es débil, debido a que ninguno de los ensayos clínicos realizados hasta el momento ha conseguido demostrar que la corrección agresiva de la hiperglucemia sea superior al enfoque estándar en pacientes con IC15. El último ensayo clínico que ha investigado este tema, el estudio SHINE también ha fallado en demostrar que el control intensivo de la glucemia sea superior al tratamiento convencional en los pacientes con IC29. Sin embargo, hay poco consenso en los ensayos clínicos publicados con respecto a lo que se considera el tratamiento estándar para la corrección de la hiperglucemia postictus, y ninguno de ellos tuvo en cuenta la oscilación de los valores de glucemia, es decir la VG. Considerando la estrecha ventana de la glucemia necesaria para mantener el metabolismo en el tejido cerebral hipóxico, el efecto deletéreo tanto de la hiperglicemia como de la hipoglucemia en los pacientes con ictus podría explicar los resultados negativos de aquellos ensayos que trataban de implementar una terapia muy intensiva de reducción de la glucosa en sangre30. Desafortunadamente, ninguno de estos ensayos clínicos ha analizado la VG de los grupos de estudio.
Los principales hallazgos de este estudio exploratorio son: 1) que la VG se asocia de forma independiente a un mayor riesgo de mortalidad en pacientes con IC agudo, 2) que la combinación de la VG y la gravedad del ictus muestran una mejor capacidad para predecir el peor pronóstico en el IC que la gravedad de forma aislada, y 3) que la administración de insulina subcutánea se asocia a cifras más altas de VG que la insulina intravenosa, lo que, de confirmarse en estudios prospectivos, podría tener un impacto en los protocolos de tratamiento de la hiperglucemia postictus, con la incorporación de la valoración de la VG como marcador de las oscilaciones de la glucemia, tal como han señalado algunos autores28,30,31.
Nuestro estudio tiene algunas limitaciones. En primer lugar, el número de pacientes con un mal pronóstico es pequeño, lo que podría limitar la capacidad de interpretar los datos, especialmente en lo que respecta a los resultados del análisis de la vía de administración de la insulina, por lo que es necesario desarrollar nuevos estudios prospectivos que analicen específicamente este aspecto, como lo hará el próximo estudio GLIAS-III (N C T 04001049), que ha iniciado el reclutamiento de pacientes en el primer semestre del año 2020. En tercer lugar, la desviación estándar de la media de los valores glucémicos, aun siendo un parámetro comúnmente utilizado en otros estudios sobre el tema, podría no ser la mejor medida de VG y deberían explorarse otros parámetros como MAGE, el coeficiente de variación (CV), y otros que reflejan diferentes aspectos de la VG19. Finalmente, el punto de corte de VG identificado en las curvas COR como predictor de mortalidad no alcanzó la significación estadística por sí solo, pero se encontró una asociación significativa con la mortalidad cuando se ajustó con la puntuación en la escala NIHSS. Este análisis exploratorio del estudio GLIAS-II puede considerarse como generador de hipótesis, y los futuros estudios prospectivos con MCG en el IC agudo deberían validar el umbral de la VG asociado a la mortalidad. Las principales fortalezas del estudio GLIAS-II son el enfoque prospectivo y multicéntrico y que está explícitamente diseñado para estudiar la influencia de los parámetros glucémicos en el pronóstico del ictus.
En conclusión, este análisis exploratorio sugiere que los valores elevados de VG durante las primeras 48 horas tras el IC aumentan de forma significativa el riesgo de mortalidad, tras ajustar por la edad, comorbilidad y gravedad inicial, y que el uso de insulina subcutánea parece estar asociado con una VG significativamente más alta en comparación con la insulina intravenosa. Se necesitan estudios para caracterizar mejor la influencia de la VG en el pronóstico del ictus, ya que podría tener implicaciones clínicas para el tratamiento de la hiperglucemia postictus, previniendo los valores extremos y proporcionando el fundamento para la mejor elección de tratamiento.
FinanciaciónFinanciado por el Instituto de Salud Carlos III (ISCIII) y el FEDER (PI 09/01781). Promovido por el Proyecto Ictus del Grupo de Estudio de Enfermedades Cerebrovasculares de la Sociedad Española de Neurología, y las Redes de Investigación temática RETICS INVICTUS e INVICTUS Plus (RD12/0014/0006, RD16/0019/0005).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Investigadores colaboradores del estudio GLIAS II. Borja E. Sanz-Cuesta, Servicio de Neurología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. Patricia Martínez-Sánchez, Servicio de Neurología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. María Gutiérrez-Fernández, Laboratorio de Investigación en Neurología y Enfermedad Cerebrovascular del Servicio de Neurología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. Berta Rodríguez-Frutos, Laboratorio de Investigación en Neurología y Enfermedad Cerebrovascular del Servicio de Neurología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. Jaime Ramos-Cejudo, Laboratorio de Investigación en Neurología y Enfermedad Cerebrovascular del Servicio de Neurología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. Laura Otero-Ortega, Laboratorio de Investigación en Neurología y Enfermedad Cerebrovascular del Servicio de Neurología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. Daniel Prefasi, Servicio de Neurología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. María Ángeles Mangas-Guijarro, Servicio de Neurología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. Luis Felipe Pallardo, Servicio de Endocrinología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. Remedios Frutos, Servicio de Radiología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. Andres Fernández-Prieto, Servicio de Radiología. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. Rosario Madero, Servicio de Bioestadística. Hospital Universitario La Paz, IdiPAZ, Instituto de investigación biomédica. Madrid, España. Juan Manuel García-Sánchez, Servicio de Neurología. Hospital de Basurto, Bilbao, España. Nuria Aymerich, Servicio de Neurología. Hospital General de Navarra, Pamplona, España. Miguel Blanco†, Servicio de Neurología. Hospital Clínico Universitario, Santiago de Compostela, A Coruña, España. Noemí Díez-González, Servicio de Neurología. Hospital de Donostia, Gipuzkoa, España. Ana de Arce, Servicio de Neurología. Hospital de Donostia, Gipuzkoa, España. Félix González, Servicio de Neurología. Hospital de Donostia, Gipuzkoa, España. Joan Martí-Fábregas, Servicio de Neurología. Hospital de la Santa Creu I Sant Pau, Barcelona, España. Mireya Fernández-Fournier, Servicio de Neurología. Hospital Universitario Ramón y Cajal, Madrid, España. Fernando Díaz-Otero, Servicio de Neurología. Hospital Universitario Gregorio Marañón, Madrid, España. Juan Álvarez-Linera, Unidad de Neurorradiología. Hospital Ruber Internacional, Madrid, España.