En las cefaleas parece existir una influencia multifactorial, tanto de mecanismos genéticos como ambientales, siendo interesante el estudio de la posible participación de mecanismos epigenéticos en su desarrollo, cronificación y potencial papel como diana terapéutica.
MétodosHemos llevado a cabo una revisión bibliográfica, principalmente a través de la base de datos Medline/PubMed, de la implicación de los distintos mecanismos epigenéticos en las cefaleas. Para ello hemos utilizado los términos de búsqueda en inglés: headache, migraine, epigenetics, DNA methylation, histones, non-coding RNA y miRNA.
ResultadosSe obtuvieron un total de 15 publicaciones en idioma inglés relacionadas con los términos anteriores.
ConclusionesExisten indicios de la relación entre la epigenética y las cefaleas, siendo imprescindible, debido al reducido número de estudios, continuar con la investigación de las modificaciones epigenéticas en las cefaleas. Esto podría ayudar a comprender la fisiopatología de las cefaleas e incluso identificar biomarcadores y nuevas dianas terapéuticas más eficaces.
Multiple factors, including both genetic and environmental mechanisms, appear to play a role in the aetiology of headache. An interesting area of study is the possible involvement of epigenetic mechanisms in headache development and the transformation to chronic headache, and the potential role of these factors as a therapeutic target.
MethodsWe performed a literature review of the involvement of different epigenetic mechanisms in headache, mainly using the Medline/PubMed database. To this end, we used the following English search terms: headache, migraine, epigenetics, DNA methylation, histones, non-coding RNA, and miRNA.
ResultsA total of 15 English-language publications related to the above terms were obtained.
ConclusionThere is limited but consistent evidence of the relationship between epigenetics and headache; it is therefore essential to continue research of epigenetic changes in headache. This may help to understand the pathophysiology of headache and even to identify candidate biomarkers and new, more effective, therapeutic targets.
La epigenética abarca los mecanismos de regulación de la expresión génica sin modificación del código genético. Estos mecanismos son esenciales en los procesos de diferenciación celular y tisular durante el desarrollo embrionario, y también en las respuestas duraderas a las señales ambientales en los organismos adultos. Las principales modificaciones epigenéticas son la metilación del ADN, el efecto silenciador de los ARN no codificantes y las modificaciones postraduccionales de las histonas. La metilación del ADN en vertebrados consiste en la adición de un grupo metilo al carbono 5 de la citosina por efecto de ADN metiltransferasas, modificando la función del ADN cuando se encuentra en regiones promotoras, y generalmente tiene una función represora de la transcripción génica. Las modificaciones de las colas N-terminales de las histonas, como la metilación o acetilación de histonas, constituyen un código que determina la configuración de la cromatina y su estado tendente a la trascripción (eucromatina) o silenciador de la expresión génica (heterocromatina). Por último, los ARN no codificantes son moléculas de ARN de tamaño variable con diversas funciones que no codifican para proteínas, entre los que se incluyen los micro-ARN (miARN). Su función reguladora de la expresión génica está siendo dilucidada en los últimos años. Los miARN son complementarios a uno o más ARN mensajeros (ARNm) y regulan postranscripcionalmente la expresión génica, generalmente disminuyendo la traducción del ARNm a proteína.
Relevancia en la práctica clínica de los mecanismos epigenéticos en la migrañaEn los últimos años se ha hecho más evidente el papel de los mecanismos epigenéticos en un amplio abanico de enfermedades multifactoriales y también parece existir una implicación de estos mecanismos en las cefaleas. Las cefaleas representan uno de los trastornos más comunes del sistema nervioso a nivel mundial, generando una gran incapacidad. Su etiología parece tener un origen multifactorial, mediante la participación de diversos mecanismos genéticos y ambientales. Puesto que la epigenética constituye el ámbito de interacción entre los factores genéticos y los ambientales, parece legítimo suponer la participación de los diferentes mecanismos epigenéticos en su fisiopatología e incluso cronificación. Por ejemplo, en la migraña los factores ambientales pueden desencadenar directamente o disminuir el umbral de un ataque de migraña y probablemente contribuyan en la misma medida que el componente genético a desarrollar la migraña1. En cualquier caso, los mecanismos epigenéticos pueden mediar el efecto que los factores externos ejercen en la expresión génica a la hora de determinar un fenotipo. Por otro lado, los tratamientos sintomáticos y profilácticos actuales de las cefaleas no son completamente eficaces, como es el caso de la migraña donde resultan efectivos en menos de la mitad de los pacientes2. La identificación de factores predisponentes, incluidos los factores epigenéticos, es por lo tanto crucial para poder disponer de dianas moleculares específicas para diseñar nuevos y más eficaces tratamientos para las cefaleas y, entre ellas, para la migraña. Además, la respuesta a analgésicos y triptanes puede cambiar a lo largo del tiempo y en función de la frecuencia de su uso. Esto no puede ser explicado por simples alteraciones en el código genético, e indica la probable aparición de cambios epigenéticos en las moléculas diana. En este trabajo, realizamos una revisión bibliográfica sobre la relación de los diferentes mecanismos epignéticos y la cefalea en julio de 2017. Para ello utilizamos como fuente principal la base de datos Medline/PubMed y los términos de búsqueda en inglés: headache, migraine, epigenetics, DNA methylation, histones, non-coding RNA y miRNA. Se obtuvieron un total de 15 publicaciones en idioma inglés.
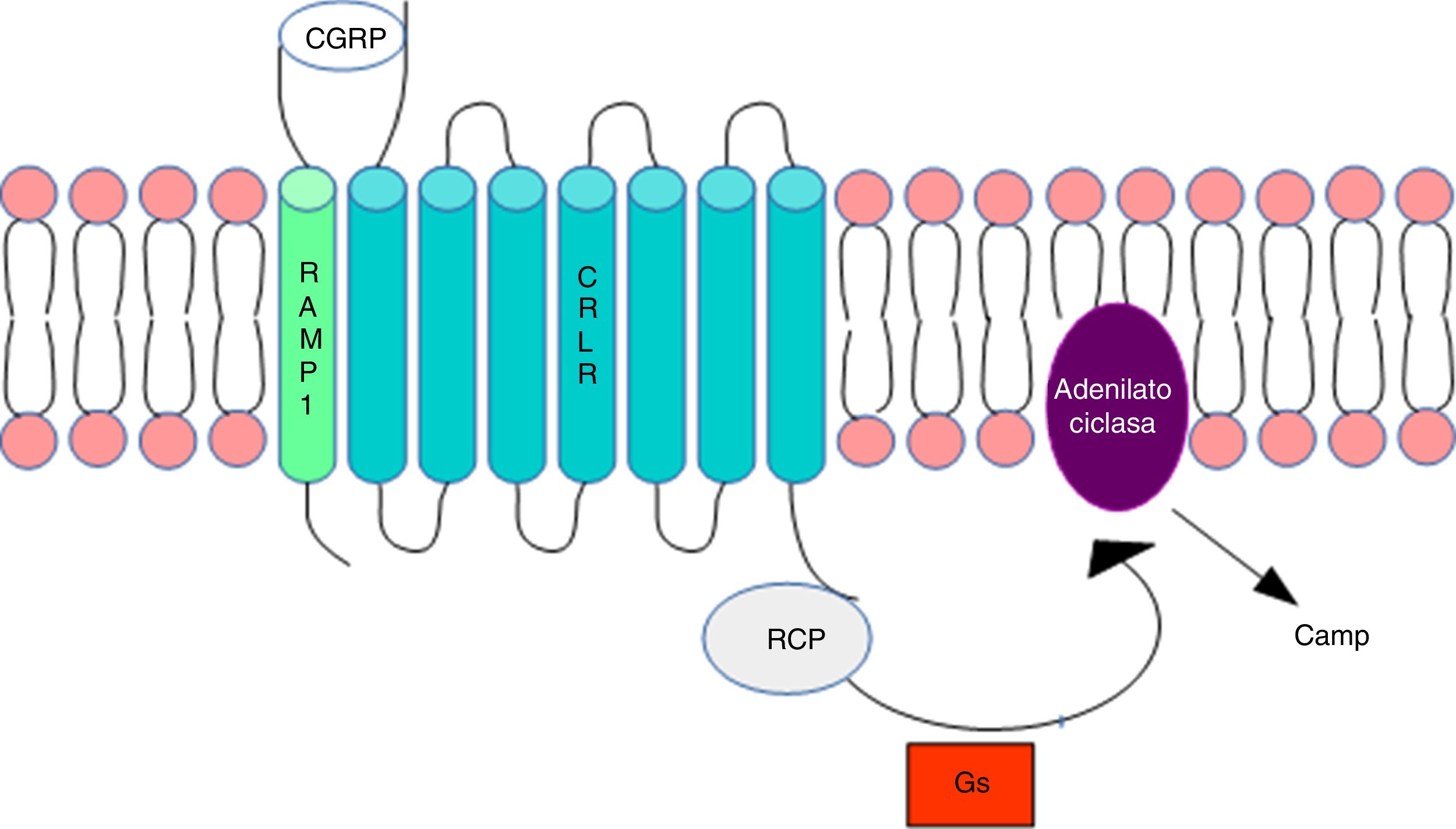
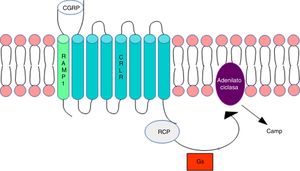
Metilación del ADN en las cefaleasLa vía del gen de la calcitoninaEl gen CALCA codifica para el péptido relacionado con el gen de la calcitonina (CGRP) y, mediante un mecanismo de splicing alternativo, para la calcitonina. La expresión del gen CALCA se limita normalmente a células endocrinas y neuronales y no se expresa en la glía. Por otro lado, el gen Ramp1, que junto con el receptor de tipo 1 del péptido relacionado con el gen de la calcitonina (CRLR) conforman el receptor del CGRP, participa en la regulación de la acción de CGRP (fig. 1).
Receptor del CGRP. La figura muestra la conformación del CGRP en la membrana citoplasmática. Modificada de Ramos-Romero y Sobrino-Mejía51.
CGRP: péptido relacionado con el gen de la calcitonina; CRLR: receptor de tipo 1 del péptido relacionado con el gen de la calcitonina; G: proteína G; RCP: proteína del componente receptor.
La elevación del CGRP se ha relacionado con el inicio y la patología de la migraña. La importancia de CGRP en la fisiopatología de la migraña se ha demostrado mediante la inducción de cefaleas tipo migraña con la inyección de CGRP en pacientes migrañosos, pero no en los controles sanos3, y mediante la demostración de la eficacia analgésica de la migraña con un antagonista del receptor CGRP4–6. Esto podría indicar de un modo indirecto que la regulación de los genes CALCA y RAMP1 estaría implicada en la susceptibilidad a la migraña.
Basándose en lo descrito previamente, un estudio realizado por Wan et al. intentó averiguar si el patrón de metilación en la región promotora del gen RAMP1 en los leucocitos periféricos se asocia a migraña7. Con este objetivo, obtuvieron 51 muestras de ADN de sangre (26 pacientes con migraña y 25 controles sanos), que fueron tratadas con bisulfito y posteriormente se midieron los niveles de metilación del ADN en la región promotora de RAMP1. Globalmente no hubo diferencias significativas en la metilación de 13 sitios CpG –en la región promotora del gen, en concreto en las posiciones entre-300 a 205 respecto al inicio de la transcripción– entre pacientes con migraña y controles, aunque sí que se encontró una leve tendencia al aumento de la metilación de forma global en los pacientes con migraña. No obstante, lo destacable del estudio es que un análisis estratificado posterior mostró que el nivel de metilación de los dinucleótidos CpG en posición +25, +27 y +31 respecto al inicio de la transcripción se asoció significativamente a una historia familiar de migraña y la metilación en las CpG en posición +89, +94 y +96 se relacionó con la migraña en mujeres. Curiosamente, cuando el nivel de metilación de esta última región disminuía por debajo del 3,50% el riesgo de padecer migraña se incrementaba significativamente en las mujeres, aunque no así en los varones. Por ello, los autores plantean que la metilación de esa región podría considerarse como un biomarcador epigenético para predecir el riesgo de migrañas en la población femenina. A pesar de las limitaciones del estudio debido al restringido número de muestras y realización del estudio en leucocitos, este trabajo aporta las primeras evidencias de que la metilación del ADN en la región promotora del gen RAMP1 pueda desempeñar un papel en la migraña.
Por otro lado, apoyándose en la creciente evidencia de la implicación de la glía en el dolor, Park et al. investigaron si los mecanismos epigenéticos son los responsables de la expresión específica celular del gen CALCA. Para ello utilizaron líneas celulares comerciales de rata y humanas y también cultivos primarios de glía de ganglios trigeminales de rata y midieron la metilación del ADN y la acetilación de las histonas en una isla CpG cercana a una región potenciadora (del inglés, enhancer) que está activa en las neuronas pero inactiva en la glía. Encontraron que la metilación del ADN y la acetilación de las histonas H3 de la isla CpG se correlaciona con la expresión del gen CALCA, estando hipometilada en células que expresan el gen e hipermetilada e hipoacetilada en células que no lo expresan, como son las células de la glía. Esto indica que el patrón específico celular de la metilación y acetilación de histonas podrían explicar tanto el silenciamiento del gen Calca de rata como el gen CALCA humano en los diferentes tipos celulares. Asimismo, en este estudio midieron la consecuencia funcional de alterar el estado de la cromatina mediante mediciones cuantitativas del ARNm de la calcitonina y de CGRP tras la utilización de un inhibidor de la metilación, la 5-aza-2’-desoxicitidina, y un inhibidor de la deacetilasa de histonas, la tricostatina A. El tratamiento del ADN con 5-aza-2’-desoxicitidina indujo la expresión del gen CALCA tanto en células humanas como de rata y cultivos de glía, mientras que el tratamiento con tricostatina A de forma aislada no tuvo efecto. Sorprendentemente el tratamiento combinado de tricostatina A y 5-aza-2’-desoxicitidina mostró un efecto sinérgico muy potente en la inducción del gen CALCA en la glía. Esto indica la necesidad de desmetilación del ADN para que se manifieste el efecto de la acetilación de histonas, siendo la metilación de esta región la llave determinante para la expresión específica celular de este gen. En conclusión, este estudio demuestra que la modulación epigenética es suficiente para la inducción de la expresión del gen CALCA en la glía. Debido a que este gen se activa sistémicamente en situaciones de inflamación en tejidos en los que normalmente no se expresa, siendo el producto predominante la procalcitonina (precursor de la calcitonina) y que la inflamación neurogénica se ha implicado en la migraña, la procalcitonina podría ser una biomarcador a explorar en la migraña8.
Debido a la difícil accesibilidad al tejido neurológico humano, los estudios previamente descritos se realizaron en leucocitos humanos, líneas celulares o tejido neurológico de rata. Sin embargo, la duda que se plantea es si el patrón de metilación del ADN en los leucocitos sanguíneos se correlaciona con el del tejido neurológico. Labruijere et al. realizaron un estudio en ratas para comparar la metilación en diferentes genes involucrados en la migraña y probablemente regulados epigenéticamente, entre los que se incluyeron los genes Calca, Ramp1, Crcp y Calcrl, en leucocitos y distintos tejidos relevantes en la fisiopatología de la migraña (duramadre, ganglio trigeminal y núcleo trigeminal caudal). En el caso de los genes examinados en los estudios previamente descritos, gen CALCA y gen RAMP1, se observó una concordancia en el patrón de metilación en todos los tejidos, aunque no fue así en otros genes. Por ello, parece que los resultados obtenidos en los estudios previos sobre en los genes CALCA y RAMP1 serían extrapolables al tejido neurológico. Además, los autores objetivaron un alto grado de concordancia entre la metilación del ADN en leucocitos de rata y humanos, indicando que es posible estudiar la metilación del ADN en tejidos de rata cuando un tejido o muestra es difícil de obtener en humanos9.
Cronificación de la cefaleaLos mecanismos biológicos implicados en la transición de la cefalea episódica a la crónica todavía son desconocidos. Sin embargo, debido a la capacidad de los cambios en la metilación de ADN para modificar el estado de un sistema biológico, resulta de especial interés el estudio de su implicación en la cronificación de la cefalea.
La participación de los mecanismos de metilación del ADN en la cronificación del dolor de cabeza se basa en que la actividad neuronal síncrona, que también se produce en la depresión cortical propagada (DCP) de la migraña con aura, conduce a cambios en la metilación de ADN cerebral de genes relacionados con la plasticidad neuronal10.
Un estudio realizado por Winsvold et al. apoya la asociación de cambios en la metilación de genes que regulan la plasticidad sináptica con la cronificación de la cefalea. Para ello, se realizó un estudio emparejando a 36 pacientes femeninas que pasaron de cefalea episódica a crónica, entre la valoración inicial y el seguimiento 11 años después, con 35 controles con cefalea episódica. Posteriormente se cuantificó la metilación del ADN en 485.000 sitios CpG y se compararon en 2 etapas los cambios de de la metilación entre casos y controles mediante un análisis de regresión lineal. Combinando los resultados de ambas etapas se identificaron 20 sitios CpG que podrían señalar genes implicados en la cronificación de las cefaleas, aunque ninguno alcanzó el umbral de significación estadística en un metaanálisis de efecto fijos (1,15×10-7). Los sitios CpG con mayor asociación se localizaron en relación con SH2D5 y NPTX2, siendo ambos genes reguladores de la plasticidad sináptica. Por otro lado, al considerar la lista de 200 sitios CpG con mayor asociación se observó la existencia de un enriquecimiento en genes relacionados con la unión a iones calcio. Bien es cierto que, dado que se trata de un estudio transversal, no permite concluir si los cambios en la metilación de estos genes son causa o consecuencia de las frecuentes cefaleas11.
Modificación de histonas en cefaleasLa metilación de histonas es un proceso de adición de uno, 2 o 3 grupos metilo a ciertos aminoácidos en las colas de las histonas. Cada nivel de modificación puede tener diferentes efectos biológicos dependiendo de los residuos afectados y el contexto. La regulación de las histonas y, por lo tanto, la remodelación de la estructura de la cromatina desempeñan un papel crítico en el control de la transcripción genética y la facilitación de cambios a largo plazos de la plasticidad neuronal. Además de la sugerida implicación de la acetilación de histonas H3 en la expresión del gen CALCA8, descrito previamente, se han descrito otras modificaciones de la acetilación de histonas relacionadas con las cefaleas.
Modificación de histona en la depresión cortical propagadaComo es bien conocido, en la migraña se plantea la teoría de la DCP como uno de los mecanismos fisiopatológicos para la activación del sistema trigémino-vascular. La DCP es una onda de despolarización neuronal y glial que se propaga lentamente a lo largo de la corteza cerebral, seguida de una supresión sostenida de la actividad neuronal espontánea. Durante la DCP se producen cambios corticales y activación de metaloproteinasas que rompen la barrera hematoencefálica y permiten que los mediadores químicos activen los terminales trigeminales que rodean los vasos meníngeos12. La DCP también parece estar involucrada en el control epigenético de la expresión génica mediante la inducción de modificaciones en las histonas. La trimetilación de la lisina 4 en la histona H3 (H3K4) ocurre en todos los genes activos, mientras que la trimetilación de H3K9 ocurre en la heterocromatina compacta que es transcripcionalmente inerte.
En el trabajo realizado por Passaro et al. se estudió si la DCP causa modificaciones epigenéticas en la cromatina de la rata. Para ello se comparó el nivel de metilación de H3K4 y H3K9 en el hemisferio cerebral en el que se desencadena una DCP respecto al hemisferio contralateral a las 24h después de la inducción de la DCP. Las modificaciones epigenéticas de la cromatina fueron evidentes en las ratas 24h después de la inducción de DCP con una disminución significativa de la dimetilación y monometilación de H3K4 y un aumento de la dimetilación de H3K913. Posteriormente Rana et al. estudiaron en rata estos mismos cambios en 2 genes neuroprotectores, iNOS y HIF1ɑ, y sus resultados corroboraron la hipótesis de que la regulación epigenética de la expresión génica puede ser afectada por la DCP14.
Polimorfismos en genes «epigenéticos» relacionados con el abuso de medicación en cefaleaEl abuso de medicación en las cefaleas podría compartir mecanismos patogénicos con otros tipos de drogadicción y tener una participación de factores genéticos en la predisposición al abuso de medicación15–17. En este sentido, la inhibición de la histona deacetilasa 3 parece tener un papel en los procesos de memoria implicados en el cese de búsqueda de drogas en modelos animales18. La histona deacetilasa 3 es una proteína expresada en casi todos los tejidos, incluido el cerebro, responsable de la desacetilación de residuos de lisina de las histonas centrales. Pisanu et al. fueron los primeros en investigar el papel de los polimorfismos de la histona deacetilasa 3 en el uso excesivo de medicación. A pesar de ser una muestra limitada, este estudio mostró una asociación significativa del alelo G del polimorfimo rs2530223 con un mayor consumo de medicación, aunque no con la frecuencia ni la intensidad de los episodios de cefalea19.
Implicación de la cascada de señalización JNK en la regulación epigenéticaEl cerebro de las personas con migraña es especialmente hiperexcitable y reacciona de forma anómala ante estímulos externos e internos que pueden actuar como desencadenantes de las crisis. Las fibras nerviosas del nervio trigémino en las cavidades nasales y orales son sensibles a diversos estímulos ambientales, como los irritantes químicos y toxinas. c-Jun es un factor de transcripción inducible, cuya fosforilación por la cinasa JNK es importante porque condiciona en gran medida su potencial para activar la transcripción de genes. Esta fosforilación representa el final de una cascada de señales en respuesta a lesiones nerviosas, infecciones e inflamación del sistema nervioso20–23. Wu et al. evaluaron in vitro el papel de la cascada JNK/c-Jun en la regulación de la acetilación de histonas H3 en neuronas trigeminales de rata tras estímulos neurotóxicos (gas mostaza) y los niveles de acetilación de las histonas en respuesta a estos estímulos. Este estudio fue el primero en proporcionar pruebas sólidas de la implicación de la cinasa JNK en la modulación epigenética de histonas en neuronas trigeminales periféricas como respuesta a la estimulación química ambiental24.
Modificación de ARN no codificantesLos ARN no codificantes son moléculas de ARN que no son traducidas a proteínas y que tienen una gran variedad de funciones reguladoras de la expresión génica. Existen muchos tipos de ARN no codificantes y, entre ellos, destacan los miARN por haber sido extensamente estudiados en los últimos años. Los miARN reducen los niveles de los ARNm y desempeñan un papel importante en el procesamiento postranscripcional de los genes mediante la formación de complejos de silenciamiento inducidos por ARN. Los miARN también parecen estar implicados en la señalización del dolor, como se ha mostrado en estudios donde se encontró una desregulación de los miARN en pacientes con síndrome de dolor regional complejo, dolor de osteoartritis y fibromialgia25–27. En base a estos hallazgos, también se ha postulado la alteración del miARN en la migraña, a pesar de haberse realizado solo unos pocos estudios preliminares.
Andersen et al. examinaron posibles cambios de miARN en sangre de pacientes en el curso de episodios de migraña respecto a controles sanos y también valoraron si se producían alteraciones crónicas de miARN en sangre ante esta situación. Observaron niveles elevados en sangre de miARN-34a-5p y miARN-382-5p durante los ataques de migraña y también alteraciones durante los periodos libres de dolor. Es interesante señalar que miARN-34a-5p se ha asociado a inflamación y respuesta de estrés endotelial vascular, y miARN-382-5p se encuentra principalmente en neuronas y líquido cefalorraquídeo, presentándose en pequeñas cantidades en sangre. Se ha sugerido que la barrera hematoencefálica pudiera presentar una alteración de su integridad durante los ataques de migraña, lo que hace pensar que el incremento de miARN-382-5p podría proceder de estructuras del sistema nervioso central o líquido cefalorraquídeo. Los autores concluyen que la migraña condiciona cambios en la expresión de miARN en sangre no solo durante los ataques, sino también en periodos libres de dolor, indicando que los miARN desempeñan un papel importante en la fisiopatología de la migraña. Basándonos en los resultados, la cuantificación de miARN en sangre podría ser un prometedor biomarcador de la migraña con aplicación potencial en la estratificación, diagnóstico y monitorización del tratamiento28.
Por otro lado, Tafuri et al. evaluaron la expresión de miARN circulantes en pacientes femeninas con migraña sin aura durante los periodos sin dolor comparándolos con controles sanos. Encontraron un perfil específico de miARN circulantes asociado a migraña, siendo estadísticamente significativo respecto a controles sanos: sobreexpresión de miARN-27b e infraexpresión en miARN-181a, miARN-let-7b y miARN-22. Además, en esta población, la especificidad y sensibilidad del patrón de miARN para el diagnóstico de migraña fue comparable al gold standard de criterios clínicos, indicando que la evaluación concomitante de estos 4 miARN podría representar una poderosa herramienta diagnostica en la migraña sin aura29.
Las alteraciones neuroinmunológicas en el sistema nervioso central y periférico desempeñan un papel esencial en la fisiopatología del dolor crónico30-36 y los ARN no codificantes37 y, en especial, los miARN regulan tanto los procesos inmunes como neurológicos. Nuevas evidencias indican que los sistemas de control endógenos del dolor, incluyendo el sistema GABAérgico y opioide están regulados por miARN, como miARN-134 o miARN-181a38,39. Además, se han asociado miARN específicos con el dolor patológico y la desregulación en la expresión de los canales de neuronas sensitivas en modelos de ratones38,40,41. De forma análoga, el conocimiento de la desregulación de miARN neuronales podría aplicarse no solo al dolor neuropático, sino también muy probablemente a otros síndromes dolorosos, entre ellos las cefaleas y en particular las migrañas hereditarias y otras formas de migraña.
Las señales dopaminérgicas y glutaminérgicas de la amígdala, hipocampo y córtex prefrontal al núcleo accumbens participan en los circuitos de control de impulsos y el núcleo accumbens en aspectos emocionales del procesamiento del dolor. Se ha encontrado relación entre el dolor crónico con la disfunción emocional y, por otro lado, se han asociado las respuestas maladaptativas del núcleo accumbens en el dolor neuropático con la desregulación de miARN en esta región42. Esto indica que las condiciones de dolor pueden alterar la expresión de determinados miARN en receptores nociceptivos primarios y en áreas cerebrales asociadas con componentes emocionales en la percepción del dolor42-50.
En conclusión, la investigación del perfil de miARN es interesante porque constituye una fuente de potenciales biomarcadores para predecir el inicio, carga y evolución de la migraña. Los miARN podrían también representar dianas para futuras terapias que podrían cambiar radicalmente el manejo de la migraña.
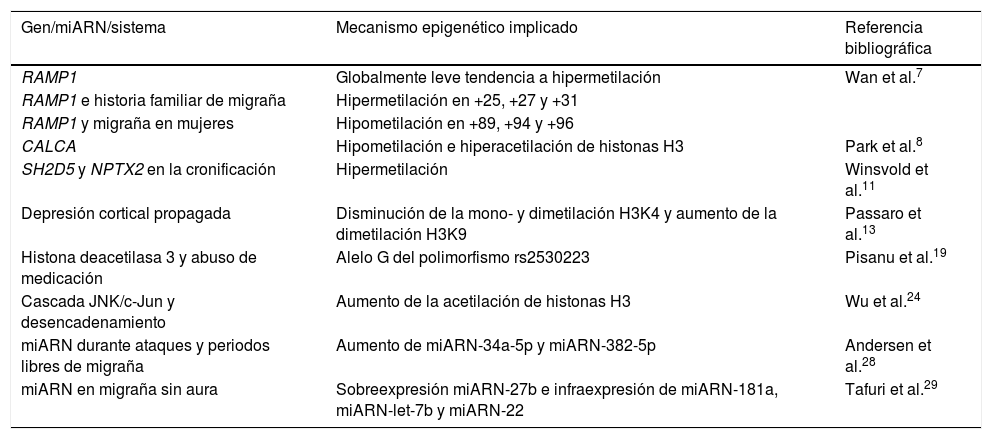
A continuación adjuntamos una tabla (tabla 1) resumen de los genes, miARN y mecanismos obtenidos en la revisión que presentan modificaciones epigenéticas en las cefaleas.
Genes y mecanismos epigenéticamente modificados en la cefalea
| Gen/miARN/sistema | Mecanismo epigenético implicado | Referencia bibliográfica |
|---|---|---|
| RAMP1 | Globalmente leve tendencia a hipermetilación | Wan et al.7 |
| RAMP1 e historia familiar de migraña | Hipermetilación en +25, +27 y +31 | |
| RAMP1 y migraña en mujeres | Hipometilación en +89, +94 y +96 | |
| CALCA | Hipometilación e hiperacetilación de histonas H3 | Park et al.8 |
| SH2D5 y NPTX2 en la cronificación | Hipermetilación | Winsvold et al.11 |
| Depresión cortical propagada | Disminución de la mono- y dimetilación H3K4 y aumento de la dimetilación H3K9 | Passaro et al.13 |
| Histona deacetilasa 3 y abuso de medicación | Alelo G del polimorfismo rs2530223 | Pisanu et al.19 |
| Cascada JNK/c-Jun y desencadenamiento | Aumento de la acetilación de histonas H3 | Wu et al.24 |
| miARN durante ataques y periodos libres de migraña | Aumento de miARN-34a-5p y miARN-382-5p | Andersen et al.28 |
| miARN en migraña sin aura | Sobreexpresión miARN-27b e infraexpresión de miARN-181a, miARN-let-7b y miARN-22 | Tafuri et al.29 |
La cefalea y, en concreto la migraña, es una condición con una importante repercusión sanitaria y social. Debido a que, por el momento, desconocemos el mecanismo etiopatogénico completo de las cefaleas y a la ausencia de tratamiento sintomático suficientemente efectivo, la investigación en este tema resulta imprescindible. Puesto que se postulan mecanismos tanto externos como genéticos en el desarrollo de la cefalea, la epigenética resulta de gran interés al representar la intersección entre ambos tipos de factores.
A pesar de que el número de estudios realizados sobre cefaleas y epigenética es todavía reducido, los resultados muestran indicios y las primeras evidencias de la relación entre la epigenética y las cefaleas. En consecuencia, resulta necesario continuar con la investigación en este campo para identificar mecanismos epigenéticos que afecten a la fisiopatología de la migraña, su papel como potenciales biomarcadores y moléculas que puedan modular la estructura de la cromatina con relación a vías de la migraña, pudiendo ser utilizadas como potenciales dianas terapéuticas en el tratamiento de la migraña.
FinanciaciónNo se ha recibido financiación por ningún organismo público, entidad privada u otros.
Conflicto de interesesDeclaramos la ausencia de conflictos de intereses.
El trabajo no ha sido publicado en la Reunión Anual de la SEN ni en otras reuniones o congresos.