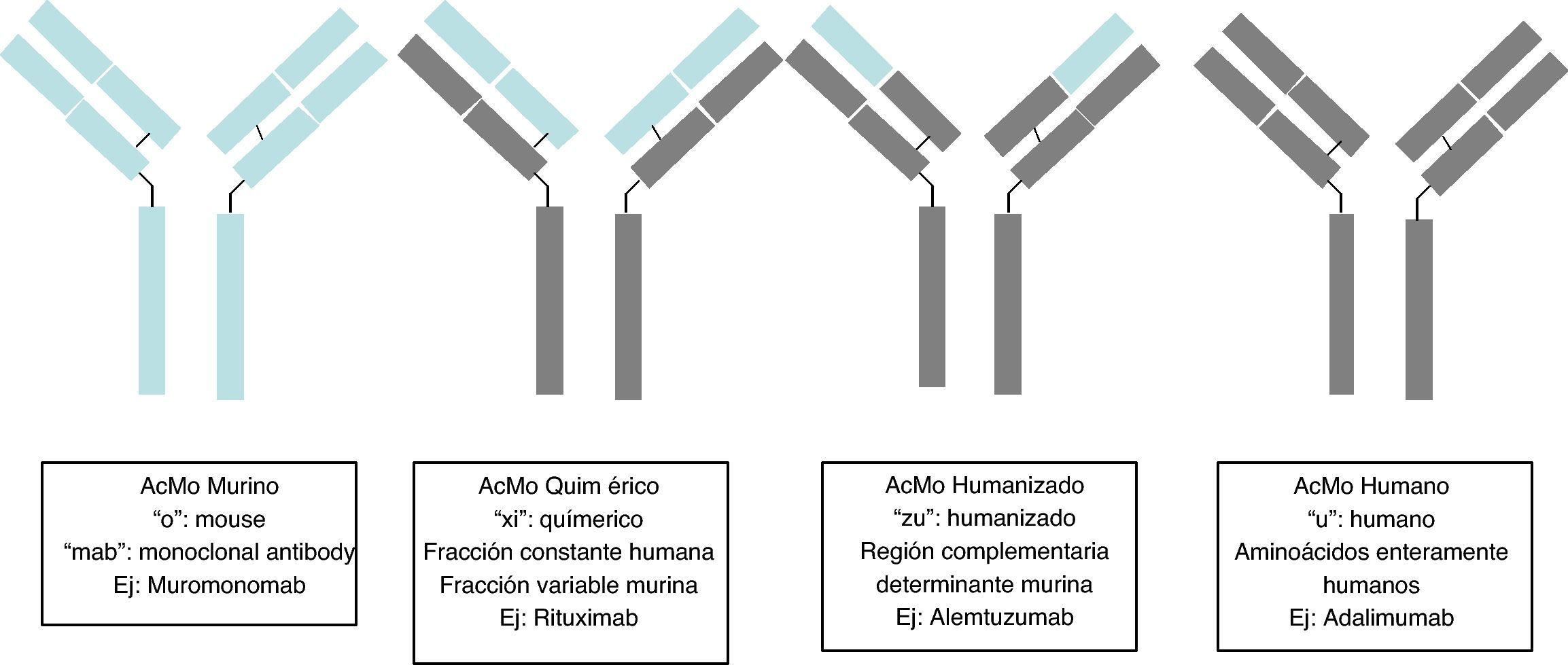
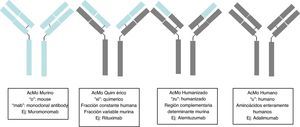
Los anticuerpos monoclonales son inmunoglobulinas diseñadas específicamente para actuar frente a dianas concretas, de forma que su administración interrumpa un proceso patogénico concreto, estimule una acción celular determinada o desvíe un mecanismo celular hacia una vía de interés. Su producción se basa en el establecimiento de linfocitos B inmortales modificados para producir una inmunoglobulina específica; según el nivel de pureza de la inmunoglobulina, ésta puede ser: completamente murina (terminación en «o», ejemplo muromonomab); quimérica, donde toda la inmunoglobulina es humana, salvo la región variable que es murina (terminación en «xi», ejemplo el rituximab); humanizada, donde toda la inmunoglobulina es humana salvo la región complementaria variable que sigue siendo murina (terminación en «zu», ejemplo el natalizumab); y completamente humana (terminación en «u», ejemplo adalimumab). Los efectos secundarios serán pues de dos tipos: los derivados de la acción del anticuerpo como infecciones oportunista por inmunosupresión y los derivados de la administración de una proteína como es la aparición de una reacción anafiláctica. Las fuentes utilizadas para el presente artículo ha sido artículos publicados en PubMed, tras realizar una búsqueda «Monoclonal antibodies and Secindary effects», y las páginas web de la Agencia Europea del Medicamento (EMEA) y la Administración para la Alimentación y Fármacos (FDA).
DesarrolloSe describen los efectos secundarios derivados de los mecanismos de acción: infecciones oportunistas, infecciones comunes, desarrollo de tumores y desarrollo de fenómenos autoinmunes. Así como los efectos secundarios derivados de la administración de proteínas: reacción anafiláctica, síndrome de liberación de citocinas y desarrollo de anticuerpos neutralizantes. Finalmente, se desarrolla el manejo de los anticuerpos monoclonales en la práctica clínica y el manejo de situaciones especiales: administración de vacunas, embarazo y edad pediátrica. Con una referencia al síndrome de reconstitución inmune.
ConclusionesLos anticuerpos monoclonales son fármacos altamente eficaces en las condiciones de indicación específica pero con un perfil de efectos secundarios graves aunque poco incidentes, lo que requiere de una estrecha vigilancia de los pacientes que están con estos regímenes terapéuticos.
Monoclonal antibodies are immunoglobulins specially designed to act against specific targets, in such a way that their administration stops a specific pathogenic process, stimulates a particular cellular action, or changes a cell mechanism to another pathway of interest. Their production is based on the establishment of modified immortal B lymphocytes to produce a specific immunoglobulin. Depending on the level of purity, this immunoglobulin may be murine complement (ending in “o”, for example muromonab); chimeric, in which all the immunoglobulin is human, except in the variable region which is murine (ending in “xi”, for example, rituximab); humanised, in which all the immunoglobulin is human, except in the variable complement region which remains murine (ending in “zu”, for example, natalizumab); and human complement (ending in “u”, for example, adalimumab). Therefore, there will be two types of secondary effects: those arising from the action of the antibody, such as opportunistic infections due to immunosuppression, and those arising from the administration of a protein, such as anaphylactic reactions. The sources used for the present articles were articles published in PubMed, located by searching for “Monoclonal antibodies and Secondary effects”, and the web pages of the European Medicines Agency (EMEA) and the US Food and Drus Administration (FDA).
DevelopmentThe secondary effects arising from the mechanisms of action were opportunistic infections, common infections, development of tumours and autoimmune phenomena, and those arising from the administration of proteins: anaphylactic reaction, cytokine release syndrome, and the development of neutralising antibodies. Finally, the management of monoclonal antibodies in clinical practice and in special situations is discussed, including administering vaccines, pregnancy and paediatric use. Reference will be made to immune recovery syndrome.
ConclusionsMonoclonal antibodies are highly effective drugs when specifically indicated, but they also may incur serious secondary effects, which although incidence is low, require close monitoring of the patients receiving these treatments.
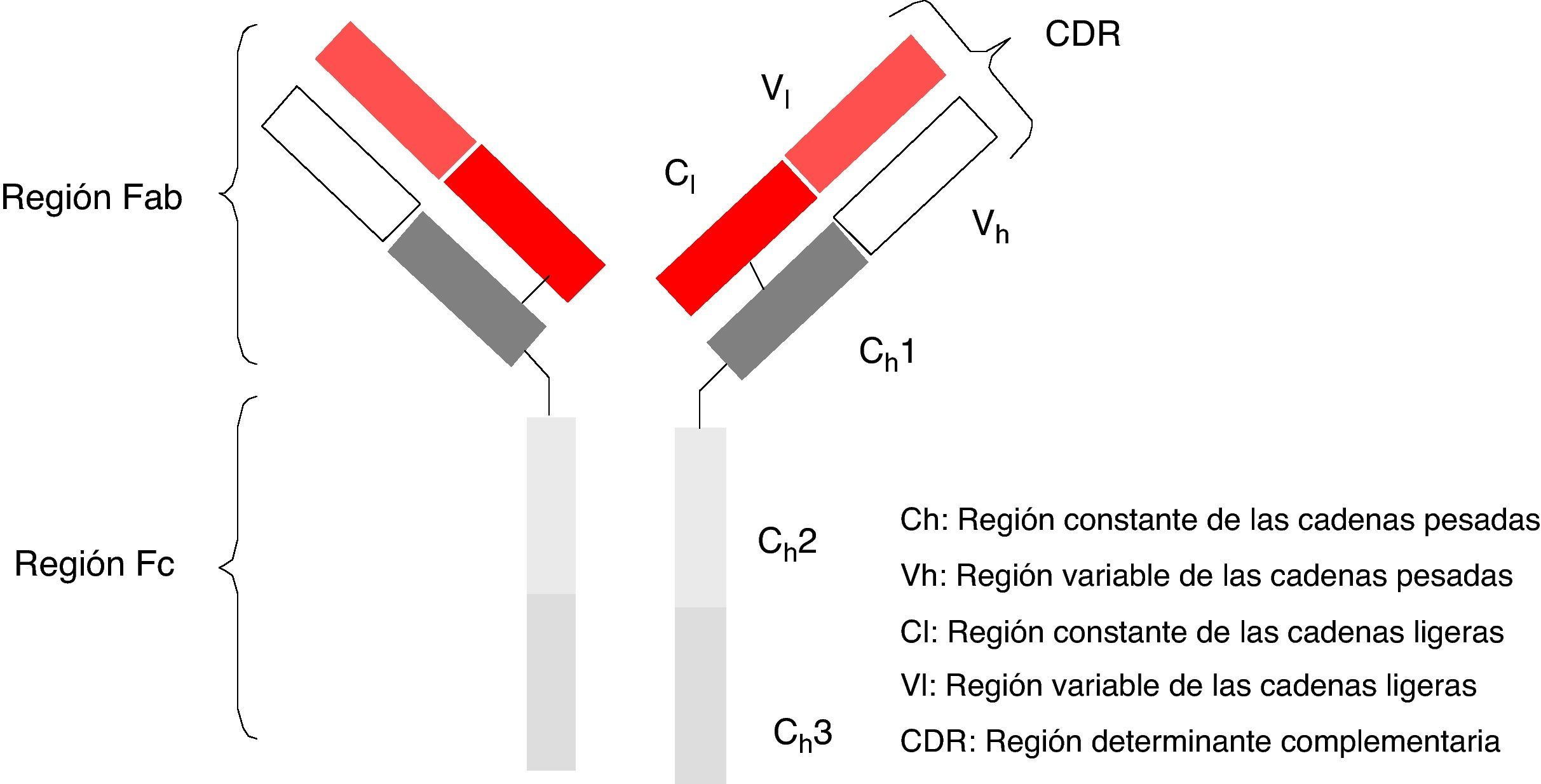
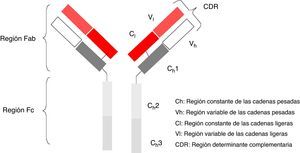
Los anticuerpos monoclonales (AcMo) son un grupo de fármacos de «diseño» y se fundamentan en la capacidad tecnológica que tenemos en la actualidad para producir anticuerpos dirigidos contras antígenos específicos. Los AcMo son pues, inmunoglobulinas (fig. 1) modificadas en el sentido de que éstas puedan ejercer un efecto determinado y controlado sobre las células y sus funciones1 (fig. 2).
La producción de AcMo fue establecida por Georges Köhler y César Milstein en 19752, mediante la generación de una línea celular estable, secretora de un isotipo determinado de inmunoglobulina contra un antígeno específico, fruto de la fusión de dos células diferentes por medios físicos y químicos (polietilenglicol-centrifugación). El objetivo es producir un hibridoma3,4, esto es, una inmunoglobulina producida en una célula inmortal que se obtiene de la unión de un linfocito B previamente inmunizado contra el antígeno de interés y una célula tumoral de mieloma no secretora de anticuerpos con déficit del enzima hipoxantina-guanina-fosforribosil transferasa (HGPRT), lo que la convierte en inmortal.
Desde la incorporación del primer AcMo para tratar el rechazo primario de trasplantes, se observó que generaba una grave reacción de hipersensibilidad5, por lo que se han desarrollado técnicas para minimizar este efecto. En 1985 se generaron los primeros AcMo humanos, mediante tecnología de ADN recombinante, en los cuales los genes que codifican la región variable de las Ig del ratón se unen con genes que codifican la región constante humana, para luego insertarse en la célula del mieloma, donde se producirán nuevas moléculas de Ac con una parte humana y una de ratón (fracción Fab), son los AcMo quiméricos, que son menos inmunogénicos que los AcMo de ratón, pero su poder para producir Ac es menor. En 1986 se incorporó la técnica de humanización de anticuerpos con el objetivo de minimizar los componentes del anticuerpo de ratón, generadores de la respuesta inmune. La producción de AcMo humanizados se realiza a través de la ingeniería de proteínas6, de forma que durante este proceso se transfiere los CDR provenientes de la Ig del ratón a la región variable de las cadenas pesadas o variable de la Ig humana. Aunque la humanización de AcMo ha minimizado la respuesta anti-anti-AcMo, todavía se comunican hasta un 9% de respuestas anafilácticas7.
Así pues, podemos sintetizar que los efectos secundarios esperables en el caso del tratamiento con AcMo, son fundamentalmente de dos tipos: los derivados por la acción específica de los mismos (generación de inmunosupresión) y los derivados de tratarse de proteínas lo que pueden condicionar diferentes grados de hipersensibilidad (tabla 1).
Efectos secundarios generales de los AcMo
| 1. Reacción a la infusión: |
| a) Síndrome de liberación de citocinas/reacción aguda a la infusión |
| b) Reacción alérgica/hipersensibilidad |
| 2. Efectos secundarios por la alteración del sistema inmune: |
| a) Infecciones comunes |
| b) Infecciones oportunistas |
| c) Desarrollo de tumores |
| d) Desarrollo de respuestas inmunológicas paradójicas: |
| - Purpura trombótica idiopática |
| - Tiroiditis autoinmune |
| - Síndrome esclerosis múltiple «like» |
| 3. Desarrollo de Ac neutralizantes frente a AcMo (AcN) |
| 4. Otros efectos secundarios |
Los AcMo son un grupo terapéutico que cada día amplía sus indicaciones. Las características propias de los pacientes susceptibles de ser tratados, unido al efecto y composición de estos fármacos, hace que nos enfrentemos a una amplia variedad de efectos secundarios que abarcan desde las reacciones anafilácticas al desarrollo de tumores. Por lo que antes de iniciar el tratamiento se deberá tener en cuenta los siguientes factores: inmunosupresión previa recibida; historia previa de infecciones con especial atención a las infecciones de la familia herpes virus (zoster o simple), así como al estado inmunológico respecto al virus de la hepatitis B y C; historia de tumores, y posibles alteraciones inmunológicas previas como tiroiditis. De forma general se recomienda realizar un test de Mantoux, serología para el virus B y C, un estudio de las poblaciones linfocitarias (CD4 y CD8), así como una analítica completa.
En cuanto a la aparición de efectos secundarios, estos los podemos clasificar en: reacciones que ocurren durante la infusión o inmediatamente después; infecciones, tanto adquiridas en la comunidad como oportunitas; reactivación o desarrollo de fenómenos autoinmunes, incluyendo la producción de anticuerpos neutralizantes, y aparición de neoplasias.
Finalmente durante el tratamiento con AcMo y tras su retirada, nos enfrentamos fundamentalmente a dos problemas: la vacunación durante el tratamiento y la posible reactivación del proceso tratado.
Reacciones a la infusión de AcMoBien durante o inmediatamente después de la administración de un AcMo, se pueden desarrollar dos tipos de reacciones a la infusión (RI): el síndrome de liberación masiva de citocinas y una reacción de hipersensibilidad.
Síndrome de liberación masiva de citocinas (reacción aguda a la infusión) –SLC/RAI−El SLC es un cuadro sistémico caracterizado por la aparición de artralgias con mialgias, fiebre, cefalea, afectación respiratoria, hipo o hipertensión, náuseas, vómitos, rash cutáneo con descamación y prurito, sudoración y taquicardia. Se trata de un cuadro dinámico que se desarrolla en 3 fases (tabla 2), el manejo del SLC depende del grado de toxicidad que se alcance (tabla 3)8–11.
Fases del desarrollo de un SCL/RAI
| Fase 1: (60-90 minutos tras la infusión): |
| - Mialgias lumbares |
| - Síntomas gastrointestinales |
| - Rigidez, eritema |
| - Vasodilatación periférica |
| Fase 2: (4 horas): |
| - Hipotensión, taquicardia |
| - Fiebre |
| - Linfopenia, monocitopenia |
| Fase 3: (16-20 horas): |
| - Fallo multiorgánico y CID |
Criterios de toxicidad y manejo del SLC/RAI
| Grado 1: reacción moderada (interrumpir la infusión) |
| Grado 2: respuesta inmediata tras interrumpir el AcMo: |
| - Antihistamínicos |
| - AINE |
| - Fluidos |
| Grado 3: sintomatología prolongada o recurrente: |
| - Indicación de hospitalización por posibles complicaciones |
| - Afectación renal/pulmonar |
| Grado 4: grave (riesgo de muerte): |
| - Indicación de ventilación asistida UCI |
| Grado 5: muerte |
La frecuencia de presentación del SLC/RAI varía en función del AcMo, así se ha descrito en menos del 0,2% en casos de bevacizumab y hasta el 10% cuando se infunde rituximab. El origen de este síndrome se encuentra en la movilización de células efectoras hacia el lugar de actuación del AcMo con su diana y la consiguiente libración de citocinas: IL-6 y TNF-α12.
Reacción de hipersensibilidadLa RH es un cuadro sistémico caracterizado por disnea, broncoespasmo, fiebre, hipo o hipertensión arterial, edema/angioedema y manifestaciones dermatologícas que van desde el rash cutáneo a la reacción urticarial grave. La RH es una reacción de tipo 1 (mediada por IgE), por lo que debe haber habido una exposición previa al antígeno, de ahí que ocurra con mayor frecuencia en la segunda o tercera infusión, si bien hay casos descritos de aparición más tardía. EL mecanismo de producción es por una liberación de histamina, leucotrienos y prostaglandinas, así como citocinas, fundamentalmente TNF-α13,14. Al igual que para el SLC/RAI, se han descrito unos grados de toxicidad en función de la clínica, dependiendo de los cuales se deberá actuar de diferente forma (tabla 4)15,16.
Criterios de toxicidad y manejo de una RH
| Grado 1: |
| - Enrojecimiento transitorio o rash |
| - Fiebre por fármaco < 38° |
| - Actuación: enlentecer la velocidad de infusión |
| Grado 2: |
| - Rash, enrojecimento, urticaria |
| - Fiebre > 37,5° |
| - Disnea |
| Grado 3 |
| - Broncoespasmo sintomático con o sin urticaria |
| - Indicada medicación iv |
| - Edema/angioedema |
| - Hipotensión |
| Grado 4: anafilaxia |
| Grado 5: muerte |
| Actuación a partir del grado 2 (incluido), en función de la clínica: |
| - Suspender la infusión |
| - Epinefrina |
| - Corticoides intravenosos |
| - Antihistamínicos |
| - Broncodilatadores |
| - Oxigeno, vasopresores, UCI |
Los AnMo son un grupo de fármacos muy específicos en cuanto a sus dianas terapéuticas, pero aún así dan lugar a una alteración de la inmunidad que tiene como resultado un estado de inmunosupresión lo que da lugar al aumento de las infecciones comunes y a la aparición de infecciones oportunistas. A la vez la alteración funcional de la inmunidad tiene consecuencias sobre el sistema normal de vigilancia inmune sobre células malignas por lo que existe, al menos teóricamente un aumento en la posibilidad del desarrollo de tumores. Finalmente, el cambio en la inmunidad da lugar a respuestas paradójicas con la aparición de manifestaciones autoinmunes inesperadas.
Infecciones adquiridas en la comunidad y nuevas infeccionesEl mecanismo general de respuesta frente a microorganismos depende de la activación de la inmunidad humoral frente a organismos encapsulados: Streptococos, Neisseria meningitidis, haemophilus, u hongos; o de la activación de la inmunidad celular que actúa frente a: bacterias, virus, protozoos y hongos17,18.
Los riesgos asociados al uso de AcMo se pueden resumir en: aumento de la incidencia de neumonías adquiridas en la comunidad; infecciones por virus del tracto respiratorios superior: adenovirus, virus respiratorio sincitial; y por el desarrollo de infecciones relacionadas con bacterias encapsuladas. El desarrollo de sepsis urinaria, sobre todo en pacientes tratados con rituximab ha dado lugar a casos de exitus por dicha complicación.
Un problema a parte lo constituye la posibilidad de reactivación de una tuberculosis latente, lo que se ha visto con anti-TNF alfa para la artritis reumatoide19,20, o de una hepatitis por virus B.
Infecciones oportunistasEntre las diferentes infecciones oportunistas que se han comunicado durante el tratamiento con AcMo, dos son las que desde un punto de vista neurológico nos interesan: las infecciones del grupo virus herpes y la infección por virus JC.
Infecciones por virus de la familia herpesLa infección por el virus de la varicela-zoster se puede presentar durante el tratamiento con NTZ (1-2%), bien en forma de varicela-zoster, lo que obliga a un tratamiento específico pero no supone criterio de retirada de medicación. Existen también casos referidos de infección generalizada por varicela-zoster, situación potencialmente mortal así como un caso de encefalitis herpética que fue mortal. Se ha observado un caso de encefalitis por VHH-6 y reactivaciones de dicho virus en casos tratados con NTZ, así como durante el tratamiento con alemtuzumab y rituximab21–23.
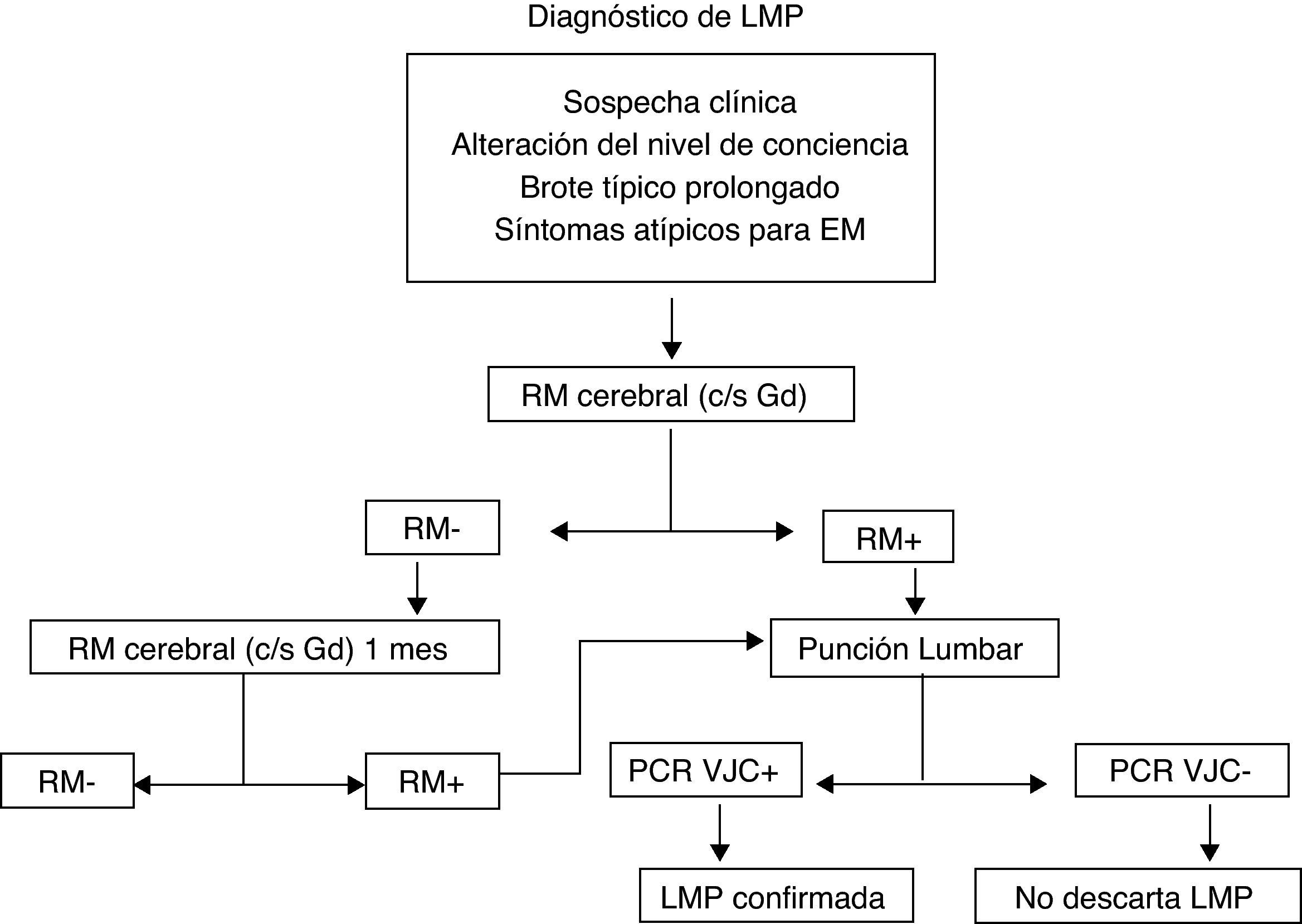
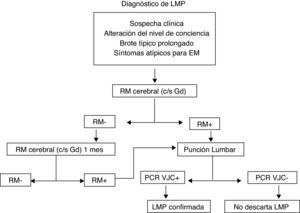
Leucoencefalopatía multifocal progresiva (LMP)La LMP es una infección con una mortalidad alta (60%) y una producción de discapacidad prácticamente en el 100% de los pacientes. Se produce por el virus JC, que es un virus ubicuo. Más del 60% de las personas presentan anticuerpos frente a dicho virus, por lo que no existen pruebas diagnósticas que nos permitan definir un patrón de riesgo en función de un contacto previo24–27. El porqué del aumento de frecuencia con este virus concreto en pacientes tratados con AcMo, en concreto con NTZ, se desconoce, por lo que en la actualidad únicamente podemos mantener un elevado nivel de sospecha y un control estrecho de los pacientes en tratamiento, no solo con NTZ, sino con cualquier AcMo, dado que se han descrito casos con rituximab28, infliximab, e incluso con inmunosupresores inespecíficos como el mycofenolato mofetil. Ante la sospecha de una LMP se recomienda realizar una RM y estudios de LCR, pero aún sin confirmación sobre LCR, se debe, en caso de tratamiento con NTZ suspender la administración de NTZ, realizar una plasmaféresis y administrar tratamiento antiviral específico29. No existe a día de hoy una terapia consensuada pudiendo tratarse con: mefloquina, cytarabina, cidofovin, la mirtazapina se puede utilizar como tratamiento adyuvante (fig. 3). La frecuencia de LMP en pacientes en tratamiento con natalizumab parece que aumente a medida que aumenta el tiempo de exposición al fármaco, de forma que actualmente se considera una incidencia de 1,55 casos por mil pacientes tratados más de 24 meses (desviación estándar 1,06 a 2,19).
Otras infecciones oportunistasDurante el tratamiento con NTZ en pacientes con enfermedad de Chron que habían recibido tratamiento inmunosupresor previos (azatioprina) se apreció el desarrollo de toxoplasmosis, infección por citomegalovirus, candiadiasis, aspergilosis, neumonía por Pneumocistis carinii y peritonitis tuberculosa. Igualmente se han descrito casos de colitis (mortal) por Clostridium difficile en casos de tratamiento con rituximab (tabla 5).
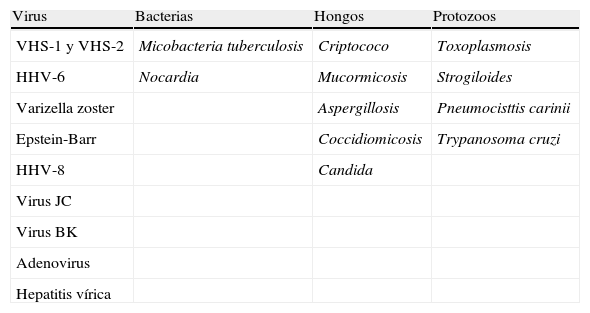
Infecciones oportunistas más frecuentes con el uso de AcMo
| Virus | Bacterias | Hongos | Protozoos |
| VHS-1 y VHS-2 | Micobacteria tuberculosis | Criptococo | Toxoplasmosis |
| HHV-6 | Nocardia | Mucormicosis | Strogiloides |
| Varizella zoster | Aspergillosis | Pneumocisttis carinii | |
| Epstein-Barr | Coccidiomicosis | Trypanosoma cruzi | |
| HHV-8 | Candida | ||
| Virus JC | |||
| Virus BK | |||
| Adenovirus | |||
| Hepatitis vírica |
HHV: herpes virus humano; HSV: virus herpes simple.
La posibilidad de desarrollar neoplasias en el contexto del tratamiento con AcMo es un tema controvertido, existen datos que apuntan hacia la posibilidad que realmente haya un aumento del riesgo para el desarrollo de ciertas neoplasias. Inicialmente se comunicó una mayor incidencia de tumores sólidos en pacientes tratados con infliximab, pero un metanálisis no mostró diferencias con la población general o con pacientes tratados con metotrexato. Respecto al desarrollo de neoplasias en los pacientes tratados con natalizumab, en el ensayo pivotal en monoterapia, se comunicó una incidencia de neoplasias de 0,79 frente al 0,39% del grupo placebo, y ya en el período de comercialización se han referido dos casos de melanomas durante el tratamiento30, con lo que la recomendación actual es no administrar dicho fármaco en casos de antecedentes familiares o personales de melanomas, o ante nevus oculares o efélides atípicas. De forma general se ha visto en pacientes tratados con natalizumab tanto para la esclerosis múltiple como para la enfermedad de Crohn, neoplasias de órganos sólidos que han afectado a: vejiga, colón y pulmón.
Finalmente está en desarrollo la interleucina 12/23 (ustekinumab), que es efectiva en psoriasis, enfermedad de Crohn y en esclerosis múltiple, pero que puede tener un potencial tumoral, dado que IL-12 promueve la infiltración por células T citotóxicas, a lo que se une que IL-23 induce un proceso inflamatorio promovido por tumores31-33. No se han referido casos en el ensayo de alemtuzumab o daclizumab, así como tampoco con el uso del rituximab.
Desarrollo de anticuerpos neutralizantes (AcN)Los AcMo son proteínas y como tales se comportan como antígenos, lo que da lugar a que el organismo pueda desencadenar una respuesta inmunológica frene a dichos antígenos con la generación de anticuerpos frente a los AcMo que se administran.
Se han descrito dos tipos de Ac: los anticuerpos ligandos «binding», que en general no tienen acción sobre el efectos farmacológico del fármaco y los Ac neutralizantes, los cuales sí pueden actuar disminuyendo e incluso anulando el efecto farmacológico34,35.
Se han descrito Ac ligando hasta en un 26% de pacientes tratados con alemtuzumab a los 12 y 24 meses, sin que por ello se haya visto mermada la eficacia del fármaco. En caso del tratamiento con rituximab se desarrollan Ac conocidos como HACA, acrónimo de «Human Antichimeric Antibodies»; que aparecen en un 24% y al igual que en el caso del alemtuzumab no tienen un efecto sobre la eficacia del fármaco. Un caso distinto es el desarrollo de Ac neutralizantes en caso del tratamiento con natalizumab, que se presentan en un 6% de pacientes y que guardan relación con el desarrollo tanto de efectos secundarios, reacción de hipersensibilidad, como de pérdida del efecto terapéutico. En el ensayo AFFIRM 57 pacientes (9%) desarrollaron Ac en algún momento durante el estudio, pero sólo 37 de ellos presentaron dos determinaciones positivas separadas por 42 días (6%), fueron estos pacientes los que mostraron una aumento de las reacciones a la infusión y una pérdida de eficacia del fármaco36,37.
Desarrollo de respuestas inmunológicas paradójicasLos AcMo tienen la capacidad de desarrollar diferentes respuestas autoinmunes a través de su acción inmunomoduladora. El AcMo que se ha implicado de forma más frecuente con estos procesos, de interés en neurología es el alemtuzumab, que produjo hasta un 3% de plaquetopenia en pacientes tratados con EM, y hasta un 22% de tiroiditis. También de interés en neurología es la posibilidad que aparezcan procesos desmielinizantes del SNC e (EM-like), en pacientes tratados con AcMo, estos procesos se han relacionado sobre todo con el uso de AcMo específicos frente al TNF-α38.
Púrpura trombocitopénica autoinmuneEl alemtuzumab, es una AcMo humanizado contra el receptor CD52 que produce una depleción de linfocitos CD4, CD8, «Natural killer» y monocitos, mientras que sobre los linfocitos B produce una depleción transitoria39,40. Produce una púrpura trombocitopénica que puede ser mortal. De los 6 pacientes comunicados con PTI, 4 habían recibido 24mg y dos 12mg. Un caso revirtió espontáneamente, dos casos fueron tratados con éxito con corticoides y dos más necesitaron rituximab. Un caso persistió con trombocitopenia a pesar del tratamiento, en este caso el paciente había sido tratado con interferón beta-1a23,41.
La trombocitopenia inducida por AcMo también se ha referido en pacientes tratados con infliximab (anti-TNF- α), efalizumab y rituximab.
Tiroiditis autoinmuneEn el 22% de pacientes tratados con alemtuzumab se presentó clínica de alteración del tiroides, las cuales se relacionaron en un 96% con el desarrollo de anticuerpos antitiroideos. Tres pacientes (1,4%) desarrollaron alteraciones tiroideas graves y 32 hipertiroidismo, 25 de los cuales quedaron con un hepertiroidismo crónico y 6 pacientes quedaron con hipotiroidismo persistente. Cuatro pacientes requirieron ablación del tiroides con iodo radioactivo y 24 fueron tratados con antitiroideos de forma permanente23,41. El hecho de que en los pacientes con alemtuzumab habían recibido previamente tratamiento con interferón beta puede haber contribuido a la alta prevalencia de esta complicación.
Síndrome esclerosis múltiple «like»Los anti-TNF-α, se han relacionado con el desarrollo de anticuerpos anti-nucleares y Ac anti-DNA de doble cadena. En este contexto puede aparecer una síndrome «lupus-like» y dentro de las manifestaciones del mismo o bien de forma aislada se puede producir un síndrome de desmielinización secundaria del SNC con la formación de placas desmielinizantes del tipo EM42,43. EL tratamiento es con corticoides, y hay que tener presente que éste cuadro puede aparecer en un contexto más amplio de vasculitis y nefritis. Igualmente hay que considerar que el proceso autoinmune desencadenado por estos Ac, puede seguir aún después de haber suspendido el tratamiento con AcMo44.
Manejo de situaciones especiales durante el uso de los AcMoLa farmacocinética de los AcMo es compleja y el efecto farmacológico duradero tras varios ciclos de administración, por ejemplo el rituximab que se administra inicialmente en dos ciclos separados por 15 días, mantiene su efecto durante 6 meses, o el alemtuzumab que mantiene su efecto durante un año, tras cinco días de infusiones diarias. Nos plantea problemas de manejo de situaciones cotidianas tales como el efecto sobre las vacunas o el embarazo. De la misma forma nos encontraremos con problemas derivados de la retirada de los mismos (síndrome de reconstitución inmune [SRI]) o como enfrentarnos a situaciones que requieran el restablecimiento de la inmunidad por la aparición de un efecto secundario derivado de la inmunosupresión prolongada.
Vacunación y AcMoEn relación con la vacunación hemos de tener en cuenta que tanto el alemtuzumab como el rituximab van a producir una pérdida de la inmunidad adquirida por vacunas que desarrollan anticuerpos. De forma general las vacunas con gérmenes vivos están formalmente contraindicadas al igual que en el trasplante de médula ósea. Son seguras las vacunas con gérmenes atenuados e igualmente son seguras las vacunas con el bacilo de Calmette Guerin; la vacuna de la polio y de la fiebre tifoidea.
Embarazo y AcMoEn cuanto al embarazo, en un documento de consenso reciente se recomienda retirar inmediatamente cualquier tratamiento con AcMo ante un embarazo. La experiencia es muy limitada, no obstante la Sociedad Americana de Reumatología indica que los inhibidores del TNF pueden continuarse durante el embarazo si el riesgo para la paciente es muy alto. Mientras que tanto el rituxumab como el abatacept deben ser retirados, dado que se desconoce el riesgo de fetopatía. No existen estudios con otros AcMo como el alemtuzumab o el daclizumab. Mientras que con natalizumab únicamente existen trabajos publicados con experiencias en animales. Por lo que la prudencia aconseja el uso de anticonceptivos durante el tratamiento con AcMo y su retirada ante un embarazo no previsto45.
AcMo en edad pediátricaEn pacientes en edad pediátrica se ha utilizado el natalizumab en tres pacientes con EM con una respuesta similar a los adultos46,47. Mientras que existe experiencia amplia del uso del rituximab en la edad pediátrica, con resultados superponibles a los adultos. Para el resto de AcMo en desarrollo en neurología (alemtuzumab, daclizumab) no existe experiencia durante la edad pediátrica.
Otros efectos secundariosA parte de los efectos secundarios analizados, toda una pléyade de efectos pueden aparecer desde la anemia hemolítica inducida por alemtuzumab. O el síndrome de reacción grave frente a fármacos (DRESS) con hipereosinofilia en casos de pacientes tratados con daclizumab48.
Síndrome de reconstitución inmuneFinalmente nos encontramos con una situación particular que bien puede aparecer de forma espontánea o que podamos querer generarla. Se trata del síndrome de reconstitución inmune49. La actualidad de este proceso en neurología surgió por dos hechos: el empeoramiento neurológico que aparecía en pacientes son SIDA tratados de forma adecuada con múltiple antiretrovirales de forma Intensiva (HAART), que por un lado dominaban la replicación del virus del SIDA, pero a la vez producían una respuesta inmunológica descontrolada mediada por linfocitos CD450. La propia definición de SRI incorpora la necesidad de demostrar un componente inflamatorio que ocurre como consecuencia de una reconstitución inmune no explicada por toxicidad a fármacos, o la aparición de una infección oportunista49.
Si atendemos a la definición de SRI, nos podemos encontrar en tres situaciones que hay que valorar: la aparición de un SRI como resultado de una retirada de un AcMo; la aparición de un SRI como respuesta a una seroconversión a una infección viral; y la aparición de un SRI como respuesta a una hipersecreción de IL-2, que sería el mecanismo que opera en caso del tratamiento con daclizumab51.
En estudios de caso-control se apreció que aquellos pacientes que desarrollaban un SR en casos de seroconversión al virus JC, la posibilidad de supervivencia era mayor51. Ante la aparición de casos de LMP en pacientes tratados con natalizumab se ha indicado el tratamiento con plasmaféresis que tiene como objeto eliminar el fármaco en sangre, pero a la vez desencadena un SRI que puede ayudar a controlar la infección por VJC.
El mecanismo por el cual se produce un SRI es poco conocido, se ha señalado que la IL-2 tendría un papel primordial en el desarrollo de éste síndrome, de forma que el aumento de la IL-2 daría lugar a un aumento de las subpoblaciones de linfocitos CD4 y CD851. De hecho existen varios casos de LMP en pacientes con SIDA o tras trasplante de médula ósea que han sido tratados con éxito con IL-252.
Las características clínicas de un SRI son la presencia de un cuadro focal en el contexto de la aparición de nuevas lesiones hiperintensas que captan gadolinio en los estudios de RM. Obviamente el diagnóstico diferencial entre un SRI y una reactivación de la EM puede ser imposible. No obstante ante un cuadro inflamatorio del SNC que aparece durante o tras la retirada de un AcMo se debe realizar el diagnóstico diferencial entre un SRI ante una seroconversión al VJC y una recidiva de la enfermedad de base. El tratamiento será con metil-prednisolona intravenosa a dosis de 1g al mes durante 6 meses53.
ConclusionesLos AcMo son un grupo de fármacos muy eficaces, pero no exentos de efectos secundarios que pueden ser muy graves (tabla 6). Desde un punto de vista práctico se debe seleccionar de forma adecuada a los pacientes, estos tratamientos deben ser aplicados en hospital de día por personal entrenado y contar con una infraestructura que permita atender una parada cardiorrespiratoria. En caso del natalizumab se recomienda una vigilancia hasta una hora después de haberse administrado el tratamiento. Es conveniente que cada unidad o consulta disponga de protocolos de inicio y seguimiento adecuados para cada AcMo que se utilice.
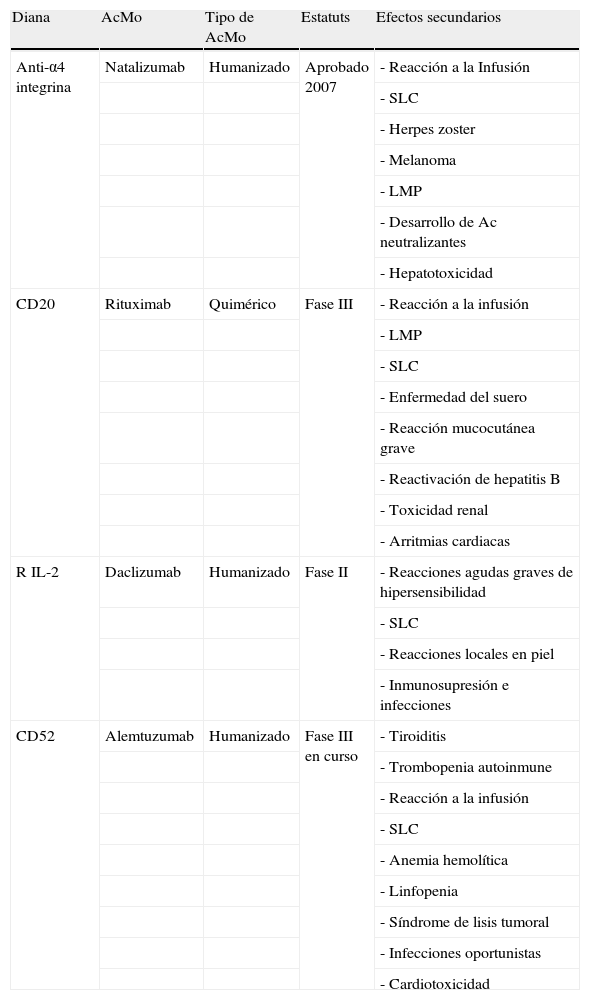
Resumen de los efectos secundarios más frecuentes con AcMo que han finalizado la fase II de ensayos clínicos en neurología
| Diana | AcMo | Tipo de AcMo | Estatuts | Efectos secundarios |
| Anti-α4 integrina | Natalizumab | Humanizado | Aprobado 2007 | - Reacción a la Infusión |
| - SLC | ||||
| - Herpes zoster | ||||
| - Melanoma | ||||
| - LMP | ||||
| - Desarrollo de Ac neutralizantes | ||||
| - Hepatotoxicidad | ||||
| CD20 | Rituximab | Quimérico | Fase III | - Reacción a la infusión |
| - LMP | ||||
| - SLC | ||||
| - Enfermedad del suero | ||||
| - Reacción mucocutánea grave | ||||
| - Reactivación de hepatitis B | ||||
| - Toxicidad renal | ||||
| - Arritmias cardiacas | ||||
| R IL-2 | Daclizumab | Humanizado | Fase II | - Reacciones agudas graves de hipersensibilidad |
| - SLC | ||||
| - Reacciones locales en piel | ||||
| - Inmunosupresión e infecciones | ||||
| CD52 | Alemtuzumab | Humanizado | Fase III en curso | - Tiroiditis |
| - Trombopenia autoinmune | ||||
| - Reacción a la infusión | ||||
| - SLC | ||||
| - Anemia hemolítica | ||||
| - Linfopenia | ||||
| - Síndrome de lisis tumoral | ||||
| - Infecciones oportunistas | ||||
| - Cardiotoxicidad |
LMP: leucoencefalopatía multifocal progresiva; SLC: síndrome de liberación de citocinas.
Finalmente, aunque las reacciones adversas graves existen: 10% de reacciones a la infusión con rituximab; 22% de reacciones autoinmunes con alemtuzumab; o riesgo de desarrollo de leucoencefalopatía multifocal progresiva (1,5 por mil) con natalizumab. Con las medidas de de gestión de riesgos que se han puesto en marcha, tanto en la Unión Europea como en Estados Unidos, hace que sean medicamentos con un perfil de seguridad muy alto unido a la eficacia probada de los mismos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.