La mayoría de los pacientes con esclerosis múltiple (EM) debutan con un síndrome clínico aislado (SCA). Es importante diferenciar este SCA de otras patologías neurológicas agudas o subagudas y estimar el riesgo de desarrollar una esclerosis múltiple clínicamente definida (EMCD), pues un segundo ataque clínico en un corto período de tiempo se asocia con peor pronóstico a largo plazo.
DesarrolloSe realizó una revisión bibliográfica con el objetivo de contrastar diferentes variables, tales como la resonancia magnética (RM) y distintos marcadores biofluídicos como las bandas oligoclonales IgG (BOC), bandas oligoclonales IgM (BOCM), bandas oligoclonales IgM lípido específicas (BOCM-LE), índice de cadenas ligeras libres Kappa (κ index) mediante la determinación de las cadenas ligeras libres kappa en líquido cefalorraquídeo (LCR), neurofilamentos de cadenas ligeras en LCR (NfLL) y suero (NfLS) y la proteína chitinasa 3-like 1 (CHI3L1) en LCR (CHI3L1L) y suero (CHI3L1S), con el objetivo de mejorar la precisión diagnóstica y predecir los riesgos de un segundo ataque clínico tras un SCA.
ConclusiónUnas BOC positivas junto con la identificación de lesiones por RM, reducirán el tiempo de diagnóstico y nos indicarán que la mayoría de los pacientes con SCA evolucionarán a EM. Un κ index > 10,6 y una concentración de NfLL > 1.150 ng/L, nos muestran que los SCA tienen más probabilidades de convertirse en EM durante el primer año (40/50%). El 90% de los pacientes con SCA y niveles de CHI3L1S > 33 ng/mL, y el 100% con presencia BOCM-LE se transforman en EM durante el primer año.
In most cases, multiple sclerosis (MS) initially presents as clinically isolated syndrome (CIS). Differentiating CIS from other acute or subacute neurological diseases and estimating the risk of progression to clinically definite MS is essential since presenting a second episode in a short time is associated with poorer long-term prognosis.
DevelopmentWe conducted a literature review to evaluate the usefulness of different variables in improving diagnostic accuracy and predicting progression from CIS to MS, including magnetic resonance imaging (MRI) and such biofluid markers as oligoclonal IgG and IgM bands, lipid-specific oligoclonal IgM bands in the CSF, CSF kappa free light-chain (KFLC) index, neurofilament light chain (NfL) in the CSF and serum, and chitinase 3–like protein 1 (CHI3L1) in the CSF and serum.
ConclusionsCodetection of oligoclonal IgG bands and MRI lesions reduces diagnostic delays and suggests a high risk of CIS progression to MS. A KFLC index > 10.6 and CSF NfL concentrations > 1150 ng/L indicate that CIS is more likely to progress to MS within one year (40-50%); 90% of patients with CIS and serum CHI3L1 levels > 33 ng/mL and 100% of those with lipid-specific oligoclonal IgM bands present MS within one year of CIS onset.
El síndrome clínico aislado (SCA) es el estado clínico que procede con inflamación y desmielinización en el sistema nervioso central (SNC), sugerente de esclerosis múltiple (EM) en ausencia de otros diagnósticos alternativos1,2. La EM comienza como un SCA en aproximadamente el 85% de los pacientes, y se convierte en esclerosis múltiple clínicamente definida (EMCD) cuando estos desarrollan un segundo ataque. Los estudios prospectivos demuestran que entre el 60 y el 70% de los pacientes con SCA desarrollan EMCD en 20 años3. Actualmente, no existe una prueba patognomónica o característica clínica capaz de diagnosticar la EM por sí sola. El diagnóstico se basa en la integración de la historia, el examen físico, resonancia magnética (RM) y los hallazgos de laboratorio (marcadores biofluídicos), junto con el juicio clínico para excluir diagnósticos alternativos4.
La identificación de los riesgos de conversión de SCA a EMCD, son de gran importancia, ya que la conversión en un corto período de tiempo se asocia con un peor pronóstico y un alto grado de discapacidad. De esta forma, los pacientes con mayor riesgo podrían beneficiarse de tratamientos altamente eficaces (pero con riesgo más elevado), y a aquellos con bajo riesgo les serían prescritos otros más seguros, pero de menor eficacia5–7. Por tanto, es importante identificar biomarcadores tanto en líquido cefalorraquídeo (LCR) como en sangre, que puedan ayudarnos a predecir esta conversión.
En este artículo de revisión, hemos analizado junto con la RM, los biomarcadores fluídicos que puedan cumplir este objetivo (bandas oligoclonales IgG [BOC], bandas oligoclonales IgM [BOCM], bandas oligoclonales IgM lípido específicas [BOCM-LE], índice de cadenas ligeras libres Kappa [κ index], neurofilamentos de cadenas ligeras en LCR [NfLL] y suero [NfLS] y la proteína chitinasa 3-like 1 [CHI3L1] en LCR [CHI3L1L] y suero [CHI3L1S]), con el objetivo de intentar evaluar su precisión diagnóstica e identificar cuál de ellos puede predecir con más eficiencia los riesgos de un segundo ataque clínico tras un SCA.
Diagnóstico de SCASegún las especificaciones de McDonald, el diagnóstico de EM se puede realizar en un paciente con SCA si la primera RM cumple con los criterios de diseminación en el espacio (DIS) y diseminación en el tiempo (DIT), o con BOC presentes, que pueden sustituir a un evento clínico o DIT en la RM8.
La RM se usa ampliamente para respaldar este diagnóstico clínico9, al igual que la síntesis intratecal de IgG (SITG) en los pacientes que presentan un SCA sugestivo de EM. La RM es la herramienta más utilizada para evaluar a estos sujetos10,11. Es útil para investigar DIS y DIT, contribuyendo así a un diagnóstico precoz de EM12. Según diferentes estudios, entre un 50 a 80% de los pacientes con un SCA presentan lesiones de aspecto desmielinizante en la RM craneal inicial13–15, no obstante, se puede encontrar hasta en el 91% al menos una lesión de sustancia blanca en imágenes potenciadas en T216.
Cuando la RM se valora basándose en tres de los cuatro criterios de Barkhof modificados por Tintoré (RM-BT), tiene una alta especificidad (70 a 88%) y moderada sensibilidad (49 a 82%)17–20, pero cuando se evalúa con base en los criterios de McDonald, para la demostración de DIS9, fundamentados en Swanton et al., mejora la sensibilidad (72%) sin perder especificidad21–23.
La SITG determinada por la detección de BOC constituye una herramienta importante para el diagnóstico de EM24. En un SCA, las BOC están presentes entre 61,02 a 70%, y la RM, cuando se valora según los criterios de RM-BT entre 53,5 a 64%25,26. Las BOC, tienen más precisión general que la RM-BT (sensibilidad 78 vs. 70%, especificidad 65 vs. 48%, valor predictivo positivo (VPP) 62 vs. 50%, valor predictivo negativo (VPN) 80 vs. 68%, y precisión 70 vs. 58%)26. Sin embargo, cuando se consideró la RM basándose en los criterios de McDonald 201027, en un estudio realizado por Teixeira et al. sobre 82 pacientes con un cuadro de SCA, la RM fue positiva en 63 (76%) y BOC estuvieron presentes en 48 (58%) (es importante destacar que estas no se realizaron al total de los sujetos, solo a 69), además confirmó el diagnóstico de SCA a 10 personas con BOC presentes y RM sin lesiones desmielinizantes, y a otros 16 con BOC negativas y RM con lesiones desmielinizantes28.
Cuando los pacientes son diagnosticados con base en anomalías en la RM, en lugar de sospecha clínica de EM, la tasa de no confirmación es mucho mayor (89 vs. 54%)29. En general, la RM no es concluyente, especialmente en las primeras etapas de la enfermedad30, sobre todo en personas con sospecha de EM con factores de riesgo vascular, migraña o que presentan síntomas atípicos, en estos casos, las BOC suelen ser negativas, sin embargo, unas BOC presentes pueden tener un papel importante en la exclusión de otras causas de lesiones de RM31.
También, hay que tener en cuenta que las BOC no son exclusivas de la EM, ya que pueden encontrase en otras enfermedades inflamatorias e infecciosas que afectan al SNC32, tales como patologías vasculares, metabólicas o degenerativas33,34. Además, los métodos utilizados para la detección de BOC, requieren de laboratorios expertos para su correcta interpretación, lo que puede provocar variabilidad de resultados entre estos. No obstante, los criterios de McDonald han elevado el papel de las BOC en LCR y han mejorado el valor de los hallazgos de la RM al incluir lesiones corticales y sintomáticas. Ambos tienen el potencial de reducir el tiempo de diagnóstico8. De esta forma, la presencia de BOC, junto con lesiones en la RM, pueden mejorar la precisión diagnóstica general al aumentar la especificidad y el valor predictivo negativo de los resultados de la RM12,35.
Las BOCM no son un buen parámetro para el diagnóstico de SCA, ya que solo están presentes entre en el 28 al 55% de los pacientes con EMCD36,37, tasa muy inferior a las BOC y RM25,26,28.
Un κ index > 10,62, es un buen parámetro para confirmar un SCA. En el estudio realizado por Menéndez et al.38, κ index no presentó diferencias estadísticamente significativas entre pacientes de los tres grupos controles: sujetos con hidrocefalia de presión normal, personas con otras enfermedades neurológicas no infamatorias y con enfermedades inflamatorias neurológicas, el valor presentado por los pacientes de estos tres grupos fue de1,96 (1,13 a 3,56). Pero sí hubo diferencias estadísticamente significativas entre los valores de los individuos de los grupos controles y aquellos con SCA. El valor del κ index, fue de 35,61 (4,48 a 132,73) en SCA. Aunque un κ index > 10,62, tiene una ligera menor sensibilidad y especificidad que las BOC (93,1 vs. 96,5% y 95,7 vs. 98,6%), un κ index es la alternativa más interesante al análisis BOC en la detección de EM38. Un índice de kappa libre ≥ 5,9, es útil como un marcador mas sensible de SITG, pero algo menos específico (sensibilidad 96%; especificidad 86%) que la detección de BOC. Su determinación podría proporcionar información valiosa de diagnóstico y pronóstico, especialmente en pacientes con SCA o posible sospecha de EM que son BOC negativos39,40, y reforzar el valor diagnóstico de unas BOC negativas con RM positiva o viceversa.
Los NFLL y CHI3L1 no son específicos de EM. Tanto la determinación de NfLL o NfLS identifica lesión axonal, que es una consecuencia de muchas enfermedades neurológicas, tales como lesiones de la sustancia blanca y otras formas de daño en las regiones subcorticales del cerebro41–43, patología vascular (enfermedad de vasos pequeños)44,45, demencia frontotemporal46, EM47, hidrocefalia idiopática de presión normal48, esclerosis lateral amiotrófica49 y diversas infecciones del SNC50,51, por lo que deben usarse principalmente como marcador de lesión axonal y no como diagnóstico marcador para cualquier enfermedad neurológica específica52. La proteína CHI3L1 tampoco es específica de EM, suele aumentar en trastornos en los que existe la posibilidad de inflamación activa como la neuromielitis óptica, infección por virus de la inmunodeficiencia humana (VIH), accidente cerebrovascular y enfermedad de Alzheimer. En suero, puede estar aumentada debido a una multitud de enfermedades inflamatorias, especialmente en aquellas que cursan con inflamación crónica53–56.
Predicción de la conversión de SCA a EMCDEn diversos estudios hospitalarios, tanto retrospectivos como prospectivos, la tasa de conversión de un SCA a EMCD, osciló entre el 16% en el primer año y el 60% después de dos años de seguimiento57-61. Diferentes variables han demostrado ser útiles para predecir esta conversión, aunque la RM es el marcador pronóstico más fiable, unas BOC presentes y otros marcadores como NfL y CHI3L1 determinados tanto en LCR como en suero pueden tener un papel importante33,62. La imagen por RM es la herramienta más utilizada para evaluar a los pacientes que presentan una clínica de SCA sugestiva de EM, y es ampliamente aceptado su uso para predecir la conversión a EMCD63. Con los resultados de RM sobre 1.047 SCA, basados en varios estudios, Kuhle et al. establecieron una gradación del riesgo de conversión a EMCD64 (tabla 1), teniendo en cuentan los criterios de McDonald (RM) para la demostración de DIS65.
Riesgo de conversión de SCA a EMCD dependiendo del número de lesiones T2 en la RM
| Convertidores (623) | No convertidores (424) | ||||
|---|---|---|---|---|---|
| RM Número de lesiones T2 | Riesgo conversión a 2 años % | Riesgo conversión a 5 años % | HR 0/1 lesiones T2 | HR 2-9 lesiones T2 | RM Número de lesiones T2% |
| > 9 | 51,7 | 82,5 | 3,26 | 1,43 | 31,1 |
| 2-9 | 39,9 | 74,5 | 2,28 | 44,6 | |
| 0-1 | 14,6 | 54,7 | 24,3 | ||
SCA: síndrome clínico aislado; EMCD: esclerosis múltiple clínicamente definida; HR: hazard ratio/índice de riesgo; RM: resonancia magnética.
Fuente: Kuhle et al.64
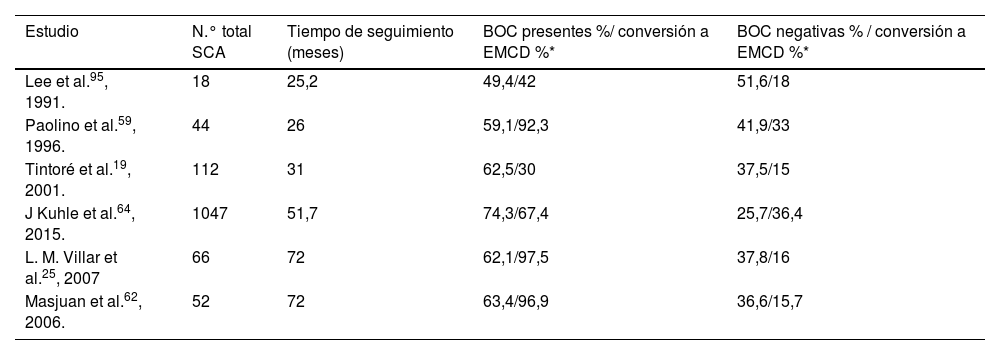
Unas BOC presentes identifican a pacientes con SCA y alto riesgo de conversión a EMCD25,32. En los diferentes estudios, se observa cómo a mayor tiempo de seguimiento, el porcentaje de conversión de pacientes con BOC es mayor (tabla 2).
Porcentajes de conversión a EMCD sobre el porcentaje de BOC presentes y BOC negativas
| Estudio | N.° total SCA | Tiempo de seguimiento (meses) | BOC presentes %/ conversión a EMCD %* | BOC negativas % / conversión a EMCD %* |
|---|---|---|---|---|
| Lee et al.95, 1991. | 18 | 25,2 | 49,4/42 | 51,6/18 |
| Paolino et al.59, 1996. | 44 | 26 | 59,1/92,3 | 41,9/33 |
| Tintoré et al.19, 2001. | 112 | 31 | 62,5/30 | 37,5/15 |
| J Kuhle et al.64, 2015. | 1047 | 51,7 | 74,3/67,4 | 25,7/36,4 |
| L. M. Villar et al.25, 2007 | 66 | 72 | 62,1/97,5 | 37,8/16 |
| Masjuan et al.62, 2006. | 52 | 72 | 63,4/96,9 | 36,6/15,7 |
BOC: bandas oligoclonales IgG; EMCD: esclerosis múltiple clínicamente definida; SCA: síndrome clínico aislado.
Unas BOC presentes duplican el riesgo de conversión a EM con respecto a aquellos pacientes que son BOC negativos66, con un hazard ratio (HR) de 2,4964.
La presencia y el número de lesiones por RM en el SNC y unas BOC presentes en LCR de los pacientes con SCA se han asociado de forma independiente con un mayor riesgo de conversión a EM33,62,63,67. Los SCA que presentan BOC y una RM con más de dos lesiones T2 tienen 21,69 veces más probabilidad de convertirse en EMCD68.
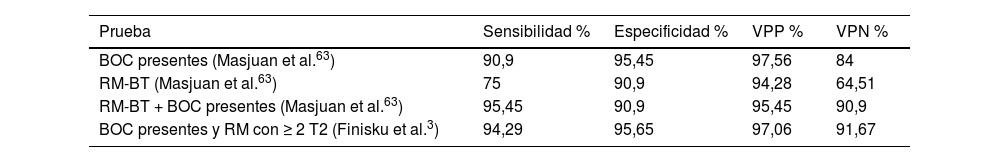
Cuando se analizan en conjunto ambas exploraciones, mejoran sustancialmente los resultados (tabla 3).
Comparación de lesiones en la RM según los criterios de BT, Mcdonald 2010 y BOC presentes en la conversión de CIA a EMCD
| Prueba | Sensibilidad % | Especificidad % | VPP % | VPN % |
|---|---|---|---|---|
| BOC presentes (Masjuan et al.63) | 90,9 | 95,45 | 97,56 | 84 |
| RM-BT (Masjuan et al.63) | 75 | 90,9 | 94,28 | 64,51 |
| RM-BT + BOC presentes (Masjuan et al.63) | 95,45 | 90,9 | 95,45 | 90,9 |
| BOC presentes y RM con ≥ 2 T2 (Finisku et al.3) | 94,29 | 95,65 | 97,06 | 91,67 |
BOC: bandas oligoclonales IgG; SCA: síndrome clínico aislado; EMCD: esclerosis múltiple clínicamente definida; RM: resonancia magnética; RM-BT: criterios de Barkhof modificados por Tintoré; VPN: valor predictivo negativo;VPP: valor predictivo positivo.
De esta forma, unas BOC presentes y las lesiones en la RM predicen que la gran mayoría de pacientes con SCA evolucionarán a EMCD. No obstante, estos parámetros no han demostrado ser tan útiles en pronosticar la evolución en etapas muy tempranas de la enfermedad16,69. Aunque los sujetos con más riesgo, aquellos que presentan BOC y una RM con más de nueve lesiones en T2, tienen más probabilidades de evolucionar antes (tabla 4).
Riesgo de conversión de SCA a EMCD considerando BOC presentes y número de lesiones T2 (RM)
| Prueba | % conversión 2 años | % conversión 5 años |
|---|---|---|
| BOCGp + RM 0-1 T2 | 19,2 | 69,9 |
| BOCGp + RM 2-9 T2 | 43,9 | 77 |
| BOCGp + RM >9 T2 | 57 | 86 |
BOC: bandas oligoclonales IgG; BOCGp: bandas oligoclonales IgG positivas; EMCD: esclerosis múltiple clínicamente definida; RM: resonancia magnética; SCA: síndrome clínico aislado.
Fuente: Kuhle et al.64
Las BOCM están presentes entre en el 28 al 55% de los pacientes con EMCD (36,37). En un estudio de Ferraro et al.16, de 55 individuos con SCA que evolucionan a EMCD, 40 presentaban BOCM. El tiempo medio para una recaída fue de 35 meses para los sujetos con BOCM negativas. Para las personas con BOCM presentes, el tiempo medio fue de 20 meses, y baja a 12 meses si el SCA comienza antes de los 30 años. Estos resultados son similares a los encontrados por Villar et al.69 y Boscá et al.66. El riesgo de recaída se incrementó con la presencia de BOCM restringidas a LCR, ya que 17 de estos pacientes (43%) desarrollaron EMCD durante el primer año de seguimiento (tabla 5)16.
Conversión de SCA a EMCD dependiendo del número de lesiones T2 (RM), BOC presentes y BOCM. De 205 SCA, 150 evolucionan a EMCD (55, 36% en un año)
| PRUEBA | SCA con prueba positiva | Evolución EMCD 1 año * |
|---|---|---|
| RM 0 T2 | 19 | 4 (22%) |
| RM 1-2 T2 | 29 | 11 (38%) |
| RM >2 T2 | 157 | 40 (26%) |
| BOC presentes | 175 | 46 (27%) |
| BOCM | 40 | 17 (43%) |
BOC: bandas oligoclonales IgG; BOCM: bandas oligoclonales IgM; EMCD: esclerosis múltiple clínicamente definida; RM: resonancia magnética; SCA: síndrome clínico aislado.
Fuente: Diana Ferraro et al.16
Cuando estas BOCM están dirigidas contra los lípidos de la mielina (BOCM-LE) muestran una mayor progresión de la discapacidad69–76. Todos los pacientes con BOCM-LE (68% de BOCM) sufrieron una segunda recaída a los 11 meses después del inicio de la enfermedad. La presencia de BOCM resultó en un mayor riesgo de sufrir una segunda recaída (HR: 3,54; intervalo de confianza: 1,65 a 7,55), sin embargo, el riesgo fue considerablemente mayor en pacientes con BOCM-LE (HR: 11,41)77.
Las cadenas ligeras libres elevadas en LCR también predicen la conversión de SCA a EMCD78–81, además, estudios previos correlacionan los niveles de cadenas ligeras libres Kappa en LCR con la carga de lesión de la RM y la progresión a EM en pacientes con neuritis óptica aislada81. Los sujetos con SCA, con un κ index >10,62, presentan un riesgo de conversión a EM 7,34 veces mayor. Este índice también se correlacionó con BOC presentes y los criterios de lesión en la RM. Con un κ index > 10,62, se transforma el 71,4% de los SCA (35/49), con un tiempo medio de conversión de 19 meses. El primer año, se convierten aproximadamente el 40%. De los 28 pacientes con un SCA y κ index < 10,62, el 89,3% de estos permanecían como SCA38.
Los NfLL se correlacionan bien con las lesiones de RM82–88. Con un cut-off > 500 ng/L, la gran mayoría se convierten en un período entre cuatro y seis años82. No obstante, los NfLL son un factor de riesgo débil para predecir la conversión a EM y el valor de estos debe considerarse en contexto de BOC presentes y los hallazgos radiológicos en la RM (número de lesiones T2)84,89,90. Sin embargo, unos niveles elevados de NfLL (> 1.208 ng /L) indican un mayor riesgo de evolución a EM, y se han asociado con un elevado número de lesiones T2 al inicio y al primer año de seguimiento84. Håkansson et al.82, observaron que con un valor > 1.348 ng/L, se convierten en dos años siete (78%) de nueve SCA y con valores inferiores se transforman uno de 10. Lo mismo sucede en el estudio realizado por Mañé et al., sobre 109 pacientes con SCA, en 53 se encuentran valores superiores a 1.150 ng/L. De estos 53, el 50% se transforman al año (a los cuatro años el 90%). Valores inferiores nos dan una tasa de conversión al año del 18% (70% en cuatro años)91. En el suero de 222 pacientes con SCA, Dalla et al.92 observaron que 78 de estos tenían niveles altos de NfLS mayores de 40,4 pg/mL (>75 percentil). Estos valores altos se correlacionan con la presencia en la RM basal de una carga alta de imágenes en T2 y lesiones que se realzan con gadolinio, además tenían un alto riesgo de desarrollar EMCD en dos años92. Al contrario, Disanto et al., 201583, al comparar los niveles de NfLS de pacientes con SCA que se convertían rápidamente a EMCD (79 a 139 días) con no convertidores (seguimiento entre 5,3 a 7,9 años), los niveles de NfLS no se asociaron con una conversión más rápida a EMCD. La diferencia en los niveles séricos de NfLS entre convertidores rápidos y no convertidores no fue estadísticamente significativa84.
Las concentraciones de CHI3L1L fueron significativamente más altas en pacientes con SCA que se convertían a EMCD con respecto a los no convertidores54,91,93,94. Sin embargo, el papel de esta proteína como biomarcador asociado a la conversión a EM, es probablemente modesto, en cambio su función como biomarcador pronóstico es particularmente relevante como predictor para el desarrollo de discapacidad. No obstante, altos niveles de CHI3L1S (>33 ng/mL) se convierten más rápidamente a EMCD, con una probabilidad de no transformarse de un 10% a los 10 meses de seguimiento94.
DiscusiónActualmente, no existe una prueba que por sí sola nos confirme un primer ataque clínico de EM. La RM se usa ampliamente para respaldar este diagnóstico clínico9. Cuando la RM se valora basándose en los criterios de McDonald para la demostración de DIS95, tiene una buena sensibilidad (72%)21 y especificidad (70 a 88%)23, sin embargo, a veces no es concluyente30. Por otro lado, unas BOC presentes tienen mayor sensibilidad (78%) pero menor especificidad (65%)26. Ahora bien, la realización conjunta de RM y BOC, en el diagnóstico del SCA, mejoran la precisión diagnóstica general de ambas pruebas por separado, aumentando la especificidad y el valor predictivo negativo12,35. Un κ index >10,62, no se da en otras enfermedades neurológicas tanto inflamatorias como no inflamatorias79 y nos podría ayudar a confirmar un diagnóstico clínico en casos con bandas oligoclonales IgG (BOC) negativas38–40 o cuando la RM no es concluyente.
La EM comienza como un SCA en aproximadamente el 85% de los pacientes96,97, y entre el 60 y el 70% de estos desarrollan CDMS en un plazo de 20 años3. Predecir la conversión a EM en etapas tempranas de un SCA es de gran importancia, ya que suele comportarse con más agresividad y se les podría prescribir tratamientos eficaces para que no aumentara su discapacidad. Tanto la RM como las BOC son débiles predictores de conversión de SCA a EMCD a corto plazo70,79. Aunque sucede lo mismo con κ index y la concentración de NfLL, los pacientes con un valor mayor de 10,6238 en el caso del κ index y de NfLL > 1.150 ng/L92 tienen un riesgo mayor de conversión, 40 y 50%, respectivamente. En un estudio publicado por Hinsinger et al., los niveles de CHI3L1S >33 ng/mL en suero se convierten más rápidamente a EMCD (90% en menos de un año). La probabilidad de permanecer libre de un segundo ataque al año es muy baja (< 10%)95.
Las BOCM y BOCM-LE restringidas a LCR nos permiten identificar a un grupo de pacientes, cuyo mecanismo inmunopatogénico está mediado por anticuerpos IgM con altas probabilidades de conversión a EMCD en un corto período de tiempo. Aproximadamente, el 43% de los SCA con un patrón de BOCM y edad inferior a 30 años se convierten en EMCD antes de un año, sin embargo, este riesgo es del 100% cuando estos pacientes presentan BOCM-LE. Todos los sujetos con BOCM-LE (68% de los que presentan un patrón BOCM) sufren una segunda recaída antes del año del comienzo de la enfermedad78.
ConclusiónLa demostración de lesiones por RM, basándose en los criterios de McDonald para la demostración de DIS65, junto con unas BOC presentes son indicadores de que la mayoría de los pacientes con SCA evolucionarán a EMCD.
Un κ index >10,6 usado como marcador del sistema inmune y NfLL > 1.150 ng/L (marcador de daño axonal) nos indican que los SCA tienen más probabilidades de convertirse en EMCD durante el primer año (40/50%).
Los marcadores relacionados con el sistema inmune, BOCM y BOCM-LE identifican a un grupo de pacientes con altas probabilidades de conversión a EMCD al año de un SCA, especialmente BOCM-LE (100%).
La proteína CHI3L1S (>33 ng/mL) nos podría permitir la posibilidad de detectar a una mayoría de pacientes con riesgo más elevado de conversión en EMCD durante el primer año y con un comportamiento más agresivo de su patología.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.