Analizar el perfil clínico, los tipos de tumor asociado y la respuesta al tratamiento de los síndromes neurológicos paraneoplásicos asociados a anticuerpos contra proteínas Ma.
MétodosEstudio retrospectivo de los pacientes con anticuerpos contra proteínas Ma identificados en un laboratorio de referencia en neuroinmunología.
ResultadosSe diagnosticó a 32 pacientes, 20 con reactividad frente a Ma2 aislada (anticuerpos anti-Ma2), 11 con reactividad frente a Ma1 y Ma2 (anticuerpos anti-Ma) y uno con reactividad frente a Ma1 aislada (anticuerpos anti-Ma1). La presentación clínica más frecuente fue un cuadro neurológico que de forma aislada o en combinación afectó al sistema límbico, diencéfalo y mesencéfalo. Tres pacientes presentaron un cuadro cerebeloso aislado con anti-Ma y 2 un síndrome periférico con anti-Ma2. Los tumores testiculares fueron los más frecuentes (40%) en los casos anti-Ma2. En el grupo asociado a anti-Ma1, los más frecuentes fueron los tumores de pulmón (36%), seguidos de los testiculares. Todos los casos idiopáticos fueron reactivos frente a Ma2. La evolución clínica fue significativamente mejor en el grupo anti-Ma2. El paciente con anti-Ma1 presentó un cuadro de encefalitis límbica y mesodiencefálica asociado a un cáncer linfoepitelial de vejiga.
ConclusionesLa determinación específica de las diferentes reactividades de las proteínas Ma, diferenciando los anticuerpos frente a Ma1 y Ma2, es importante pues los síndromes neurológicos asociados a anticuerpos anti-Ma2 responden mejor al tratamiento. Finalmente, se confirma por primera vez que puede haber casos con anticuerpos que solo reaccionan contra Ma1.
Analyse the clinical profile, associated tumour types, and response to treatment of paraneoplastic neurological syndromes associated with antibodies against Ma proteins.
MethodsA retrospective study of patients with antibodies against Ma proteins identified in a neuroimmunology laboratory of reference.
ResultsOf the 32 patients identified, 20 showed reactivity against Ma2 only (anti-Ma2 antibodies), 11 against Ma1 and Ma2 (anti-Ma antibodies), and 1 with reactivity against Ma1 only (anti-Ma1 antibodies). The most common clinical presentations were limbic encephalopathy, diencephalic dysfunction, or brainstem encephalopathy, frequently appearing as a combination of these features. Three patients had isolated cerebellar dysfunction with anti-Ma antibodies, and 2 exhibited peripheral nervous system syndrome with anti-Ma2 antibodies. Testicular tumours were the most common neoplasms (40%) in the anti-Ma2 cases. In the group associated with anti-Ma1 antibodies, the most common were lung tumours (36%), followed by testicular tumours. All idiopathic cases were reactive to Ma2. The clinical outcome was significantly better in the anti-Ma2 group. The patient with anti-Ma1 presented with limbic encephalitis and brainstem dysfunction associated with lymphoepithelioma of the bladder.
ConclusionsSpecifically determining the different reactivities of anti-Ma protein antibodies in order to differentiate between Ma1 and Ma2 antibodies is important because anti-Ma2-associated paraneoplastic syndromes have a better outcome. Lastly, this study is the first to confirm that there may be cases that react exclusively to antibodies against Ma1.
El presente trabajo no ha sido presentado en ninguna reunión ni congreso y no ha recibido ningún tipo de financiación. No existen conflictos de intereses.
IntroducciónLos síndromes paraneoplásicos son cuadros clínicos que permiten realizar el diagnóstico precoz de un tumor asociado y ahí radica la importancia de su reconocimiento1,2. Los anticuerpos contra proteínas Ma se incluyen en el grupo de «anticuerpos onconeuronales bien caracterizados» que nos permiten realizar un diagnóstico de «síndrome paraneoplásico definitivo» incluso en ausencia de detección tumoral3. El anticuerpo Ma2 se presenta en pacientes varones con tumores testiculares y encefalitis límbica (EL), diencefálica (ED) o de tronco del encéfalo (ET), bien de forma aislada o en combinación. Antes del descubrimiento de los anticuerpos Ma2, se habían descrito los anticuerpos Ma en 4 pacientes cuyos tumores asociados fueron de diversa estirpe histológica y localización (parótida, mama, pulmón no microcítico y colon), con síndromes pancerebelosos o afectación de tronco4. Ambos anticuerpos tienen en común que reconocen miembros de la familia Ma, proteínas que se encuentran exclusivamente en las neuronas y en las células germinales testiculares, dos lugares considerados privilegiados desde el punto de vista inmunológico. Mientras que los anticuerpos Ma2 reconocen solamente la proteína Ma2 (PNMA2), los anticuerpos Ma reconocen las proteínas Ma1 y Ma2 (PNMA1 y PNMA2)5.
El interés suscitado por la asociación de los anti-Ma2 con EL/ED/ET y cáncer de testículo6 llevó a que algunos pacientes que estrictamente tenían anticuerpos Ma fueran clasificados como Ma2 o que en otros casos solo se analizara la reactividad contra Ma2, con lo que no quedaba claro si el paciente tenía anticuerpos Ma2 o Ma. El diferenciar los 2 anticuerpos es importante pues el cuadro neurológico y los tumores a los que se asocian parecen diferentes. Con el objetivo de clarificar este tema revisamos nuestra serie de pacientes con anti-Ma y anti-Ma2 para definir mejor los cuadros neurológicos y los tipos de tumor asociados, así como la respuesta al tratamiento.
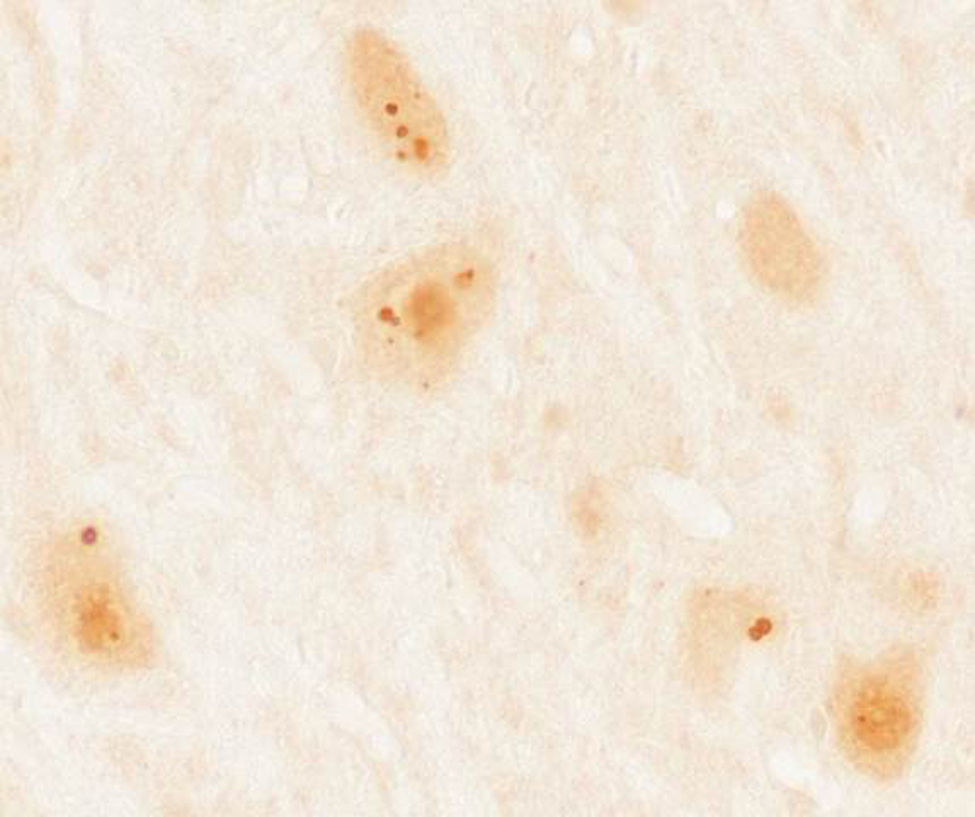
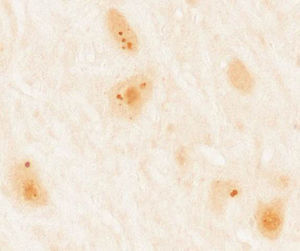
Pacientes y métodosSe recopilaron un total de 36 casos de pacientes mayores de 18 años con diagnóstico de síndrome paraneoplásico asociado a anticuerpos contra proteínas Ma diagnosticados en el laboratorio de investigación de neuroinmunología del Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS), Hospital Clínic de Barcelona. Se descartó a 4 pacientes por falta de información clínica, quedando una muestra final de 32 pacientes. En todos los casos se realizó inicialmente un cribado con inmunohistoquímica sobre secciones congeladas de cerebelo de rata perfundido y posfijado con paraformaldehído al 2% y, posteriormente, en aquellos que mostraban una inmunorreactividad característica (fig. 1) se realizó una confirmación por inmunoblot comercial (Ravo Diagnostika, Friburgo, Alemania) (fig. 2). Los datos clínicos de los pacientes fueron recopilados de las historias y exploraciones en dicho hospital o de las aportaciones de los neurólogos responsables en los diversos centros. Por otro lado, se realizó una revisión de nuevos casos descritos en la literatura desde el año 2008, por ser inmediatamente posterior a la última revisión de este tema7, consultando la base de datos Pubmed a través de las siguientes palabras clave: «anti-Ma», «anti-Ta», «anti-Ma2», «Ma1», «Ma2» y «paraneoplastic neurological syndromes».
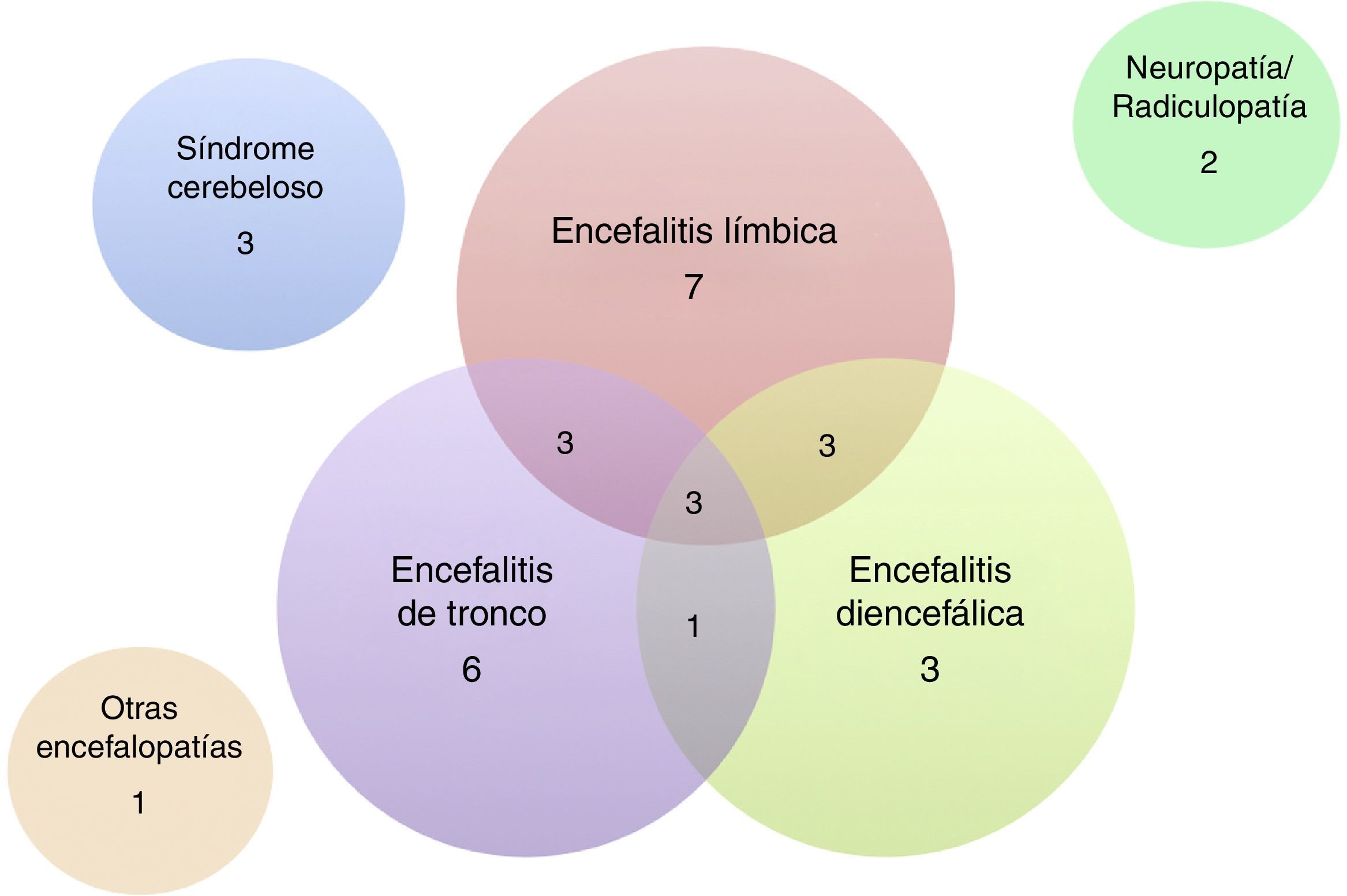
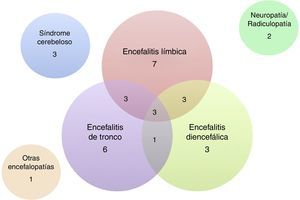
De los 32 pacientes incluidos, 24 (75%) eran varones. La mediana de edad fue de 60 años (intervalo: 18 a 81 años). Las características clínicas de los pacientes se resumen en las tablas 1 y 2. La presentación más frecuente fue la EL en 7 pacientes, seguida de ET y ED o diversas combinaciones de estas 3 entidades (fig. 3). Cinco pacientes se presentaron con crisis comiciales de semiología del lóbulo temporal, todas de difícil manejo farmacológico, y de ellos solo un paciente cursó con epilepsia como única manifestación clínica. Además de las formas encefalíticas, 3 pacientes presentaron un síndrome cerebeloso puro (2 de ellos cursaron con un síndrome pancerebeloso y el otro con afectación vermiana y opsoclonus), 2 pacientes una afectación exclusiva del sistema nervioso periférico en forma de una ganglionopatía sensitiva y de una radiculopatía cérvico-braquial bilateral, ambas severas, y un paciente un cuadro encefalopático con deterioro cognitivo subagudo de perfil frontal asociado a una alteración de la marcha.
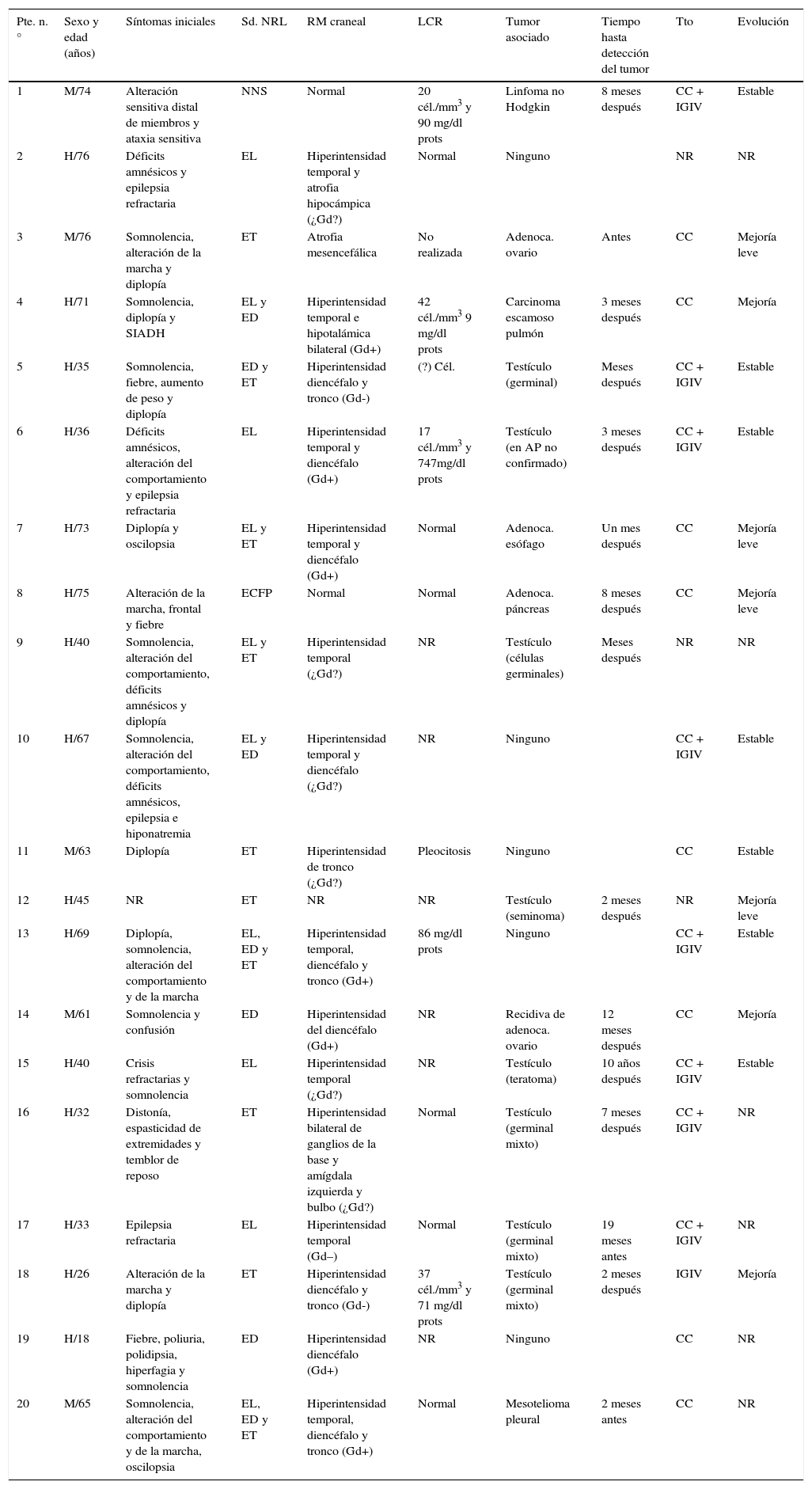
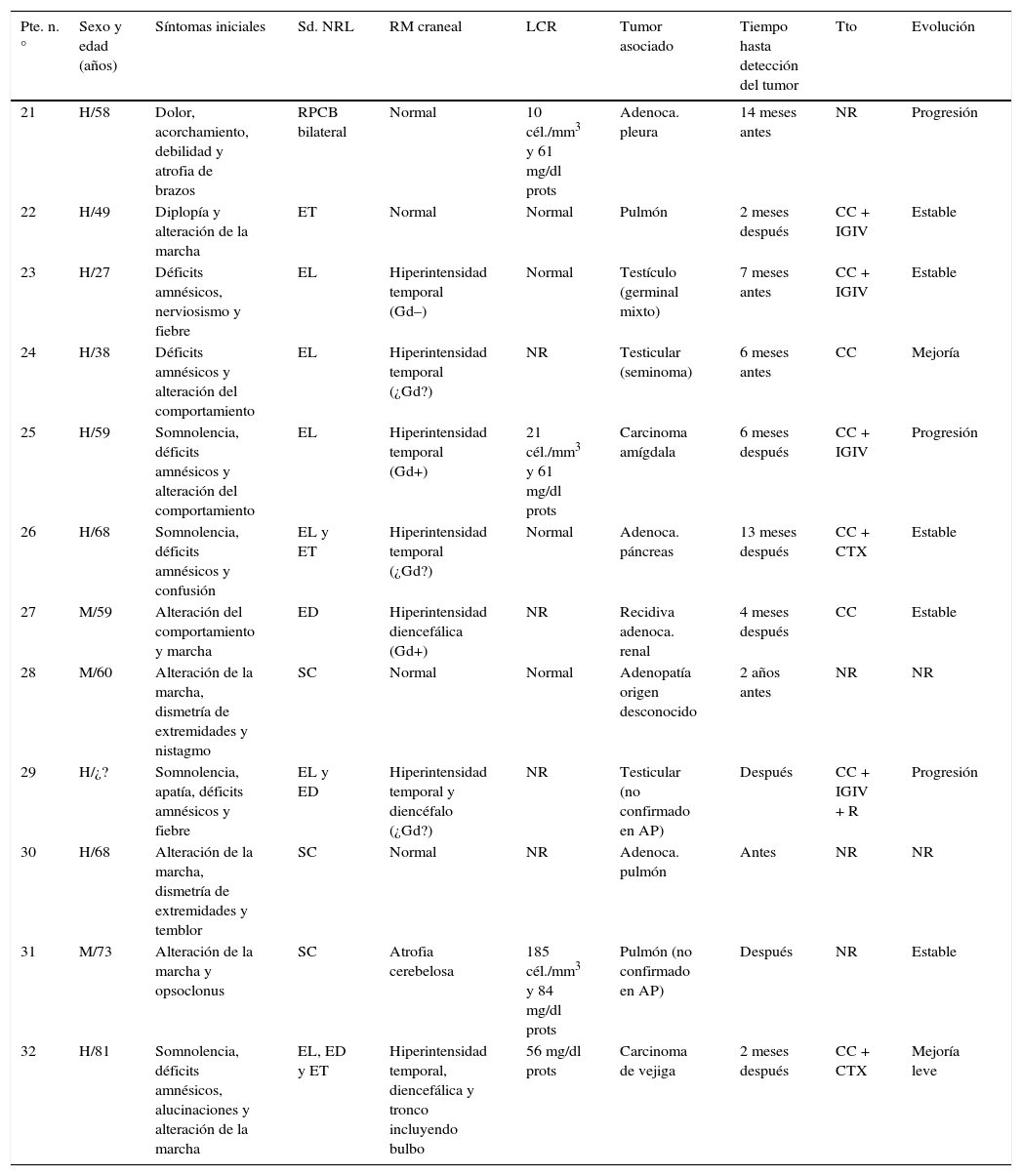
Características clínicas de los 20 pacientes con síndromes paraneoplásicos asociados a anticuerpos anti-Ma2
| Pte. n.° | Sexo y edad (años) | Síntomas iniciales | Sd. NRL | RM craneal | LCR | Tumor asociado | Tiempo hasta detección del tumor | Tto | Evolución |
|---|---|---|---|---|---|---|---|---|---|
| 1 | M/74 | Alteración sensitiva distal de miembros y ataxia sensitiva | NNS | Normal | 20 cél./mm3 y 90 mg/dl prots | Linfoma no Hodgkin | 8 meses después | CC + IGIV | Estable |
| 2 | H/76 | Déficits amnésicos y epilepsia refractaria | EL | Hiperintensidad temporal y atrofia hipocámpica (¿Gd?) | Normal | Ninguno | NR | NR | |
| 3 | M/76 | Somnolencia, alteración de la marcha y diplopía | ET | Atrofia mesencefálica | No realizada | Adenoca. ovario | Antes | CC | Mejoría leve |
| 4 | H/71 | Somnolencia, diplopía y SIADH | EL y ED | Hiperintensidad temporal e hipotalámica bilateral (Gd+) | 42 cél./mm3 9 mg/dl prots | Carcinoma escamoso pulmón | 3 meses después | CC | Mejoría |
| 5 | H/35 | Somnolencia, fiebre, aumento de peso y diplopía | ED y ET | Hiperintensidad diencéfalo y tronco (Gd-) | (?) Cél. | Testículo (germinal) | Meses después | CC + IGIV | Estable |
| 6 | H/36 | Déficits amnésicos, alteración del comportamiento y epilepsia refractaria | EL | Hiperintensidad temporal y diencéfalo (Gd+) | 17 cél./mm3 y 747mg/dl prots | Testículo (en AP no confirmado) | 3 meses después | CC + IGIV | Estable |
| 7 | H/73 | Diplopía y oscilopsia | EL y ET | Hiperintensidad temporal y diencéfalo (Gd+) | Normal | Adenoca. esófago | Un mes después | CC | Mejoría leve |
| 8 | H/75 | Alteración de la marcha, frontal y fiebre | ECFP | Normal | Normal | Adenoca. páncreas | 8 meses después | CC | Mejoría leve |
| 9 | H/40 | Somnolencia, alteración del comportamiento, déficits amnésicos y diplopía | EL y ET | Hiperintensidad temporal (¿Gd?) | NR | Testículo (células germinales) | Meses después | NR | NR |
| 10 | H/67 | Somnolencia, alteración del comportamiento, déficits amnésicos, epilepsia e hiponatremia | EL y ED | Hiperintensidad temporal y diencéfalo (¿Gd?) | NR | Ninguno | CC + IGIV | Estable | |
| 11 | M/63 | Diplopía | ET | Hiperintensidad de tronco (¿Gd?) | Pleocitosis | Ninguno | CC | Estable | |
| 12 | H/45 | NR | ET | NR | NR | Testículo (seminoma) | 2 meses después | NR | Mejoría leve |
| 13 | H/69 | Diplopía, somnolencia, alteración del comportamiento y de la marcha | EL, ED y ET | Hiperintensidad temporal, diencéfalo y tronco (Gd+) | 86 mg/dl prots | Ninguno | CC + IGIV | Estable | |
| 14 | M/61 | Somnolencia y confusión | ED | Hiperintensidad del diencéfalo (Gd+) | NR | Recidiva de adenoca. ovario | 12 meses después | CC | Mejoría |
| 15 | H/40 | Crisis refractarias y somnolencia | EL | Hiperintensidad temporal (¿Gd?) | NR | Testículo (teratoma) | 10 años después | CC + IGIV | Estable |
| 16 | H/32 | Distonía, espasticidad de extremidades y temblor de reposo | ET | Hiperintensidad bilateral de ganglios de la base y amígdala izquierda y bulbo (¿Gd?) | Normal | Testículo (germinal mixto) | 7 meses después | CC + IGIV | NR |
| 17 | H/33 | Epilepsia refractaria | EL | Hiperintensidad temporal (Gd–) | Normal | Testículo (germinal mixto) | 19 meses antes | CC + IGIV | NR |
| 18 | H/26 | Alteración de la marcha y diplopía | ET | Hiperintensidad diencéfalo y tronco (Gd-) | 37 cél./mm3 y 71 mg/dl prots | Testículo (germinal mixto) | 2 meses después | IGIV | Mejoría |
| 19 | H/18 | Fiebre, poliuria, polidipsia, hiperfagia y somnolencia | ED | Hiperintensidad diencéfalo (Gd+) | NR | Ninguno | CC | NR | |
| 20 | M/65 | Somnolencia, alteración del comportamiento y de la marcha, oscilopsia | EL, ED y ET | Hiperintensidad temporal, diencéfalo y tronco (Gd+) | Normal | Mesotelioma pleural | 2 meses antes | CC | NR |
AP: anatomía patológica; CC: corticoides; ECFP: encefalopatía; ED: encefalitis diencefálica; EL: encefalitis límbica; ET: encefalitis troncoencefálica; Gd: realce tras gadolinio; H: hombre; IGIV: inmunoglobulinas intravenosas; M: mujer; NNS: neuronopatía sensitiva; NR: no reseñado; Sd. NRL: síndrome neurológico; Tto: tratamiento.
Características clínicas de los 11 pacientes con síndromes paraneoplásicos asociados a anticuerpos anti-Ma y anti-Ma1
| Pte. n.° | Sexo y edad (años) | Síntomas iniciales | Sd. NRL | RM craneal | LCR | Tumor asociado | Tiempo hasta detección del tumor | Tto | Evolución |
|---|---|---|---|---|---|---|---|---|---|
| 21 | H/58 | Dolor, acorchamiento, debilidad y atrofia de brazos | RPCB bilateral | Normal | 10 cél./mm3 y 61 mg/dl prots | Adenoca. pleura | 14 meses antes | NR | Progresión |
| 22 | H/49 | Diplopía y alteración de la marcha | ET | Normal | Normal | Pulmón | 2 meses después | CC + IGIV | Estable |
| 23 | H/27 | Déficits amnésicos, nerviosismo y fiebre | EL | Hiperintensidad temporal (Gd–) | Normal | Testículo (germinal mixto) | 7 meses antes | CC + IGIV | Estable |
| 24 | H/38 | Déficits amnésicos y alteración del comportamiento | EL | Hiperintensidad temporal (¿Gd?) | NR | Testicular (seminoma) | 6 meses antes | CC | Mejoría |
| 25 | H/59 | Somnolencia, déficits amnésicos y alteración del comportamiento | EL | Hiperintensidad temporal (Gd+) | 21 cél./mm3 y 61 mg/dl prots | Carcinoma amígdala | 6 meses después | CC + IGIV | Progresión |
| 26 | H/68 | Somnolencia, déficits amnésicos y confusión | EL y ET | Hiperintensidad temporal (¿Gd?) | Normal | Adenoca. páncreas | 13 meses después | CC + CTX | Estable |
| 27 | M/59 | Alteración del comportamiento y marcha | ED | Hiperintensidad diencefálica (Gd+) | NR | Recidiva adenoca. renal | 4 meses después | CC | Estable |
| 28 | M/60 | Alteración de la marcha, dismetría de extremidades y nistagmo | SC | Normal | Normal | Adenopatía origen desconocido | 2 años antes | NR | NR |
| 29 | H/¿? | Somnolencia, apatía, déficits amnésicos y fiebre | EL y ED | Hiperintensidad temporal y diencéfalo (¿Gd?) | NR | Testicular (no confirmado en AP) | Después | CC + IGIV + R | Progresión |
| 30 | H/68 | Alteración de la marcha, dismetría de extremidades y temblor | SC | Normal | NR | Adenoca. pulmón | Antes | NR | NR |
| 31 | M/73 | Alteración de la marcha y opsoclonus | SC | Atrofia cerebelosa | 185 cél./mm3 y 84 mg/dl prots | Pulmón (no confirmado en AP) | Después | NR | Estable |
| 32 | H/81 | Somnolencia, déficits amnésicos, alucinaciones y alteración de la marcha | EL, ED y ET | Hiperintensidad temporal, diencefálica y tronco incluyendo bulbo | 56 mg/dl prots | Carcinoma de vejiga | 2 meses después | CC + CTX | Mejoría leve |
El paciente n.° 32 es el asociado a anti-Ma1.
AP: anatomía patológica; CC: corticoides; CTX: ciclofosfamida; ED: encefalitis diencefálica; EL: encefalitis límbica; ET: encefalitis troncoencefálica; Gd: realce tras gadolinio; H: hombre; IGIV: inmunoglobulinas intravenosas; M: mujer; NR: no reseñado; R: rituximab; RPCB: radiculopatía cérvico-braquial; SC: síndrome cerebeloso; Sd. NRL: síndrome neurológico; Tto: tratamiento.
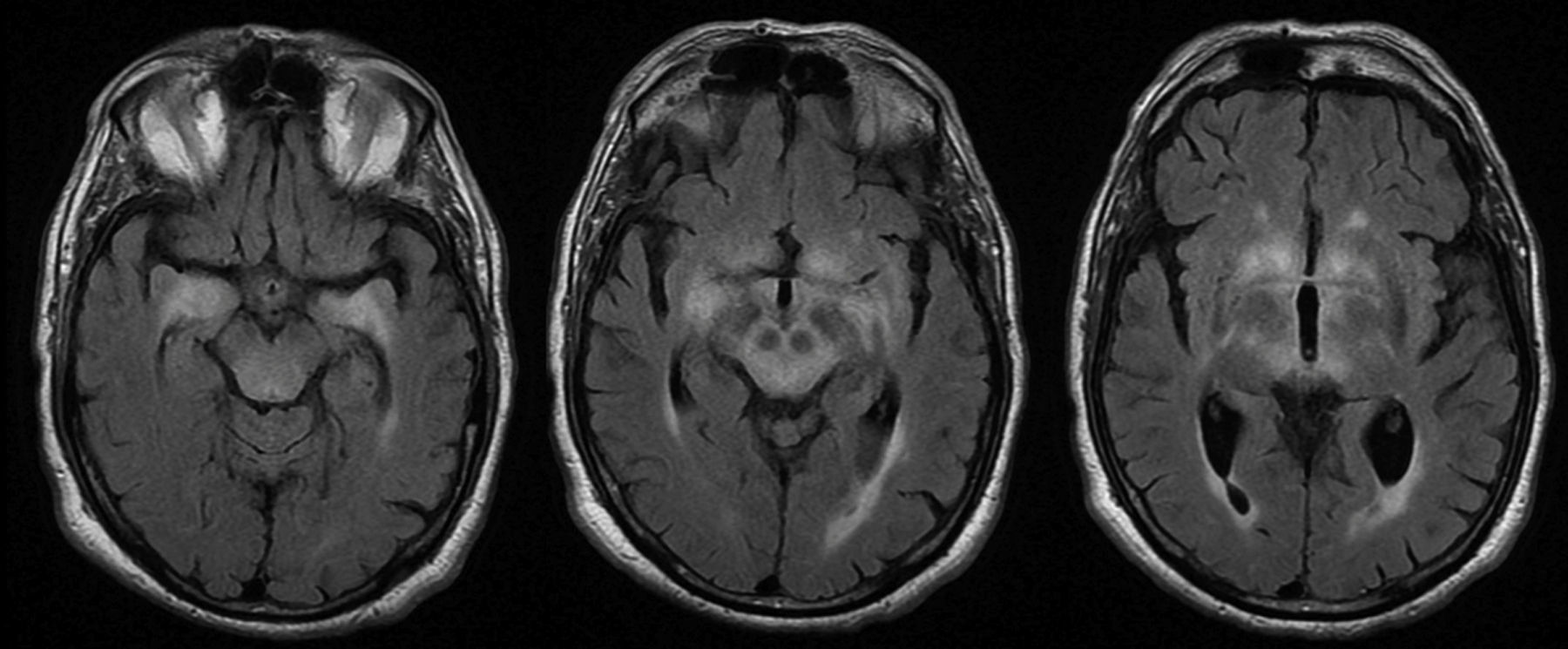
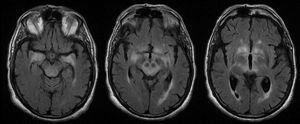
La RM fue patológica en 25 (78%) pacientes. El hallazgo radiológico más frecuente fue la hiperintensidad en secuencias T2 y FLAIR de los lóbulos temporales uni o bilateral (hipocampo y amígdala, fundamentalmente), diencéfalo (tálamo e hipotálamo) y/o mesencéfalo (fig. 4), detectada en 23 pacientes. En los casos de ET, la afectación clínica y radiológica se produjo exclusivamente en mesencéfalo, a excepción de 2 pacientes que asociaron también afectación bulbar. En 9/23 pacientes con lesiones hiperintensas en T2 se observó realce tras la administración de contraste (aunque en 8 pacientes este dato es desconocido). Se detectó atrofia en la RM inicial de 3 pacientes: uno de ellos con EL y esclerosis de hipocampo, otro paciente con atrofia mesencefálica aislada y un último con atrofia cerebelosa.
La información sobre el análisis del LCR la obtuvimos en 21 pacientes. En el 52% de estos fue patológico, con hiperproteinorraquia leve-moderada en la mitad de los casos analizados o pleocitosis mononuclear en el 35%.
Asociación tumoral y cronología respecto al síndrome neurológicoEn 27 (84%) pacientes se encontró un tumor asociado. Los tumores más frecuentes encontrados fueron los de testículo (n=11), seguidos por adenocarcinomas de pulmón y pleura (n=6) y del tubo digestivo (n=4, incluyendo 2 tumores pancreáticos, uno esofágico y uno de amígdala). En el resto, los tumores hallados fueron adenocarcinoma de ovario (n=2), linfoma no Hodgkin (n=1), adenocarcinoma renal (n=1), carcinoma de vejiga (n=1) y en uno de los casos se encontró una adenopatía cervical metastásica de adenocarcinoma de origen desconocido en la que no se identificó el tumor primario en el seguimiento.
En 19 (70%) pacientes, el síndrome paraneoplásico precedió al diagnóstico del tumor o a la recidiva en una media de 12,8 meses (mediana 4 meses). En 8 (30%) pacientes, los síntomas neurológicos se presentaron con posterioridad al diagnóstico del cáncer, con una media de 12 meses después (mediana 10,5 meses) y un máximo de 2 años. En 2 pacientes, la aparición del síndrome neurológico paraneoplásico llevó al diagnóstico de recidiva tumoral en pacientes con enfermedad oncológica previamente tratada y controlada.
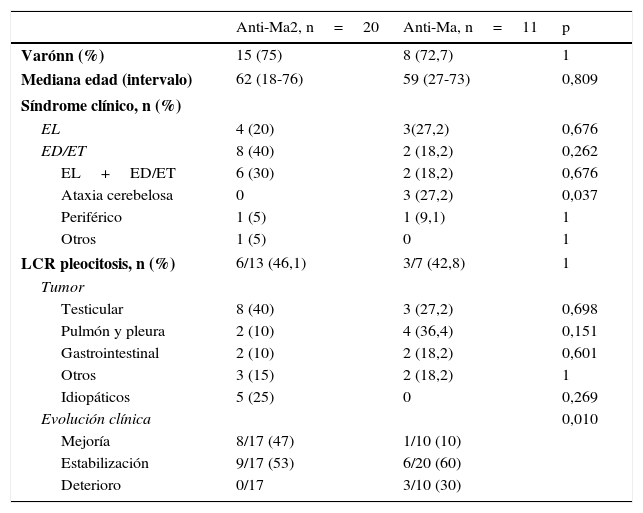
Anticuerpo asociado y características de cada grupoVeinte pacientes resultaron positivos para anticuerpos anti-Ma2 (62,5%), 11 para anti-Ma (34,3%) y un paciente tenía anticuerpos solamente contra Ma1 (3,1%) (tabla 3). Las únicas diferencias estadísticamente significativas que se observaron entre los pacientes con anti-Ma2 y anti-Ma fueron que todos los pacientes que cursaron con afectación cerebelosa se encontraban en el grupo anti-Ma (p=0,037) y la mejor respuesta al tratamiento de los pacientes con anti-Ma2 (p=0,01). Se encontraron diferentes porcentajes de tumores asociados en ambos grupos. En el grupo anti-Ma2 los tumores testiculares fueron los más frecuentes (40%) y en el anti-Ma los tumores de pulmón y pleura (36,4%), aunque seguidos en segundo lugar del cáncer de testículo (27,2%). En el análisis estadístico de las diferentes asociaciones tumorales, no se encontraron diferencias significativas. De los 5 pacientes en los que no se detectó tumor, todos asociaron anticuerpos anti-Ma2.
Características de los pacientes según el tipo de anticuerpo
| Anti-Ma2, n=20 | Anti-Ma, n=11 | p | |
|---|---|---|---|
| Varónn (%) | 15 (75) | 8 (72,7) | 1 |
| Mediana edad (intervalo) | 62 (18-76) | 59 (27-73) | 0,809 |
| Síndrome clínico, n (%) | |||
| EL | 4 (20) | 3(27,2) | 0,676 |
| ED/ET | 8 (40) | 2 (18,2) | 0,262 |
| EL+ED/ET | 6 (30) | 2 (18,2) | 0,676 |
| Ataxia cerebelosa | 0 | 3 (27,2) | 0,037 |
| Periférico | 1 (5) | 1 (9,1) | 1 |
| Otros | 1 (5) | 0 | 1 |
| LCR pleocitosis, n (%) | 6/13 (46,1) | 3/7 (42,8) | 1 |
| Tumor | |||
| Testicular | 8 (40) | 3 (27,2) | 0,698 |
| Pulmón y pleura | 2 (10) | 4 (36,4) | 0,151 |
| Gastrointestinal | 2 (10) | 2 (18,2) | 0,601 |
| Otros | 3 (15) | 2 (18,2) | 1 |
| Idiopáticos | 5 (25) | 0 | 0,269 |
| Evolución clínica | 0,010 | ||
| Mejoría | 8/17 (47) | 1/10 (10) | |
| Estabilización | 9/17 (53) | 6/20 (60) | |
| Deterioro | 0/17 | 3/10 (30) | |
De los casos descritos en la literatura, se identificaron 19 con síndromes paraneoplásicos anti-Ma28-26 y 4 con anti-Ma27-30. Sin embargo, de los 19 casos anti-Ma2, únicamente se especificó el estatus para Ma1 en 4 de ellos10,11,14,15, por lo que no se puede asegurar que realmente todos ellos se tratasen de casos anti-Ma2. Por último, cabe reseñar el único paciente que presentó exclusivamente anticuerpos anti-Ma1 en nuestra serie. Se trataba de un paciente de 81 años que consultó por un cuadro inicial de ataques de sueño intenso de un mes y medio de evolución, añadiendo posteriormente una alteración de la marcha, síntomas parkinsonianos y mioclonías. La RM craneal puso de manifiesto una afectación límbica, diencefálica y mesencefálica bilateral, sin realce tras la administración de contraste, y en el LCR se encontró una leve hiperproteinorraquia. El LCR fue positivo para anticuerpos anti-Ma1 de forma exclusiva. El rastreo tumoral objetivó una masa en la vejiga, demostrando tras la biopsia un carcinoma vesical indiferenciado, variante linfoepitelial y de alto grado. El paciente fue tratado con metilprednisolona y ciclofosfamida ante el empeoramiento neurológico progresivo que condicionó incluso su ingreso en UVI, con una mejoría solo parcial del nivel de consciencia. El tumor vesical fue desestimado para tratamiento debido al mal estado general que presentaba el paciente. Murió al poco tiempo del diagnóstico tras una broncoaspiración. La familia no autorizó la realización una autopsia clínica.
Manejo de los pacientesEn 25 (78,1%) de los pacientes se obtuvieron datos del tratamiento: todos ellos fueron tratados con inmunosupresión, utilizándose los corticoides en 24 (96%) de ellos, tanto en formulaciones intravenosas intensivas como orales. Las inmunoglobulinas intravenosas se utilizaron en 13 (52%) casos asociadas a corticoides, salvo en un paciente. Dos pacientes con síntomas meso-diencefálicos graves (a expensas, fundamentalmente, de deterioro del nivel de consciencia) fueron tratados además con ciclofosfamida y un tercero con rituximab como terapias de segunda línea, produciéndose únicamente mejoría leve en uno de ellos, estabilización en otro y la progresión de la clínica en el último. Se encontraron 2 pacientes en los que se empleó la cirugía como tratamiento de su epilepsia temporal refractaria asociada a esclerosis de hipocampo. En el paciente que solo presentaba crisis comiciales, la cirugía no resolvió sus crisis y en aquel que presentaba crisis además de encefalopatía la cirugía fue curativa de la epilepsia.
En algunos de los pacientes se realizaron controles evolutivos de los títulos de anticuerpos, sin que se pudiera observar una correlación clínico-analítica. Hubo pacientes que presentaron una evolución neurológica satisfactoria, con resolución de sus síntomas, y sin embargo los anticuerpos permanecieron persistentes en suero. Por otro lado, otros pacientes evolucionaron desfavorablemente a pesar de la disminución del título de los mismos.
DiscusiónEl análisis clínico de nuestra serie de pacientes con síndromes neurológicos paraneoplásicos y anticuerpos contra proteínas Ma pone de manifiesto algunas diferencias con las previamente publicadas7,31. En nuestra serie, la edad de presentación no fue diferente según el tipo de anticuerpo y el porcentaje de varones del 70% fue significativamente más alto que el 43% descrito previamente31. La forma de presentación más frecuente fue la combinación de EL, ED, ET pero algunos pacientes presentaron cuadros neurológicos diferentes, como son síndromes cerebelosos puros, asociados a anti-Ma, o la afectación aislada del sistema nervioso periférico, asociados a anti-Ma2. En nuestra revisión de la literatura encontramos 5 casos similares, 2 de ellos síndromes cerebelosos (uno aislado, con anti-Ma29 y otro asociado a polineuropatía con anti-Ma219), una mielorradiculopatía11 y una mononeuropatía múltiple23 (aunque este paciente también presentaba lesiones asintomáticas en lóbulos temporales en la RM), estos 2 últimos con anti-Ma2. Por último, se ha descrito un posible caso de esclerosis lateral primaria-like en un paciente con paraparesia espástica progresiva22 asociada a anti-Ma2.
En la primera serie de síndromes neurológicos paraneoplásicos anti-Ma2 y anti-Ma31, se describió a 38 pacientes, de los cuales 34 cursaron con los síndromes clásicos de EL, ED o ET y solo 4 con otros atípicos: 2 con síndrome cerebeloso, uno con mielopatía y el último con una mielo-radículo-plexopatía, aunque las 2 últimas asociadas a EL y ET. La afectación cerebelosa se detectó en 11 pacientes (siendo 9 anti-Ma), aunque asociada a los síndromes clásicos salvo en 2. En una segunda serie de esta entidad7, se presentaron 22 pacientes (14 con anticuerpos anti-Ma y 8 anti-Ma2), de los cuales 19 cursaron con los síndromes típicos y solo 3 presentaron atipicidad clínica: un paciente una polineuropatía aislada, otro enfermedad de primera y segunda motoneurona (ambos anti-Ma2) y otro paciente con un síndrome cerebeloso asociado a parkinsonismo y anti-Ma. La afectación cerebelosa, aunque asociada a los cuadros clínicos típicos, se encontró en 8 pacientes (7 eran anti-Ma).
En los trabajos citados, los pacientes anti-Ma2 eran de forma mayoritaria varones jóvenes con tumores testiculares. Sin embargo, en la presente serie y otras recientes, en el grupo anti-Ma2 el porcentaje de tumores testiculares fue el mayoritario pero sin llegar a representar la mitad de los casos de cáncer (40%). En comparación con el grupo anti-Ma, no se obtuvieron diferencias significativas en las asociaciones con diferentes tipos de tumores (testicular-células germinales, pulmón y pleura, gastrointestinal y otros menos frecuentes). Todos los casos considerados idiopáticos se han asociado a anticuerpos Ma2 en nuestra muestra y en la revisión de la literatura existen 4 casos idiopáticos asociados a anti-Ma2 (si bien es cierto que no detallan la reactividad frente a Ma1)8,17,19,22.
La evolución clínica de los pacientes Ma2 parece más favorable, con mejoría o estabilización en todos ellos en comparación con los pacientes Ma en los que su curso clínico es más negativo7,31. Quizá en estas diferencias, además de mecanismos probablemente inmunológicos desconocidos, influya el hecho de encontrar porcentajes variables de tumores en ambos grupos, aunque no se hayan encontrado diferencias significativas, con tumores testiculares más frecuentes en los Ma2 (neoplasias con elevada tasa de curación tras orquiectomía). En otros tipos de tumores, con mayor infiltración o extensión y con un tratamiento curativo más difícil como el cáncer de pulmón, la persistencia de enfermedad oncológica quizás contribuya a la mala evolución neurológica.
Como conclusión, nuestra serie nos indica que tanto los anticuerpos anti-Ma2 como anti-Ma1 se asocian a un cuadro neurológico caracterizado por asociación variable de EL, ED y ET pero que algunos pacientes presentan cuadros cerebelosos aislados o síndromes del sistema nervioso periférico. La determinación de la reactividad del anticuerpo frente a Ma1 y Ma2 es importante pues los síndromes neurológicos asociados a anticuerpos anti-Ma2 responden mejor al tratamiento. Finalmente, se confirma que puede haber casos con anticuerpos que solo reaccionan contra Ma1. La caracterización del espectro clínico asociado a anti-Ma1 requerirá el estudio de más pacientes.
FinanciaciónEl presente trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesNo existen conflictos de intereses.
El presente trabajo no ha sido presentado en ninguna reunión ni congreso.