Son muchos los conocimientos y publicaciones existentes sobre la siringomielia relacionada con la malformación de Chiari, pero existe poca difusión de este cuadro cuando no se presenta en relación con dicha malformación. Ello es importante ya que es una entidad propia que precisa de un conocimiento y manejo específico. Presentamos esta revisión con el objetivo de dar a conocer las ideas más aceptadas y difundidas a día de hoy al respecto de la fisiopatología, manejo y otros aspectos de la siringomielia no secundaria a malformación de Chiari.
DesarrolloSe ha realizado una revisión de la literatura más relevante en torno a esta patología, centrándose en su fisiopatología, presentación clínica, estudio diagnóstico y manejo.
ConclusionesLa siringomielia no relacionada con malformación de Chiari es una entidad propia que precisa de un conocimiento adecuado en su profundidad para su sospecha, seguimiento y manejo adecuado. Ante el hallazgo de este cuadro debe realizarse un estudio detallado encaminado a intentar identificar la causa, quedando el tratamiento sintomático como opción de rescate.
Much has been published on syringomyelia related to Chiari malformation. In contrast, little is known about the condition when it is not associated with this malformation, but this presentation of syringomyelia constitutes a different entity and therefore requires specific management. We conducted a literature review to summarise the most accepted and widespread ideas about the pathophysiology, management and other aspects of syringomyelia unrelated to Chiari malformation.
DevelopmentWe reviewed the most relevant literature on this condition, focusing on the pathophysiology, clinical presentation, diagnosis, and treatment.
ConclusionsSyringomyelia unrelated to Chiari malformation is a distinct entity that must be well understood to guarantee correct diagnosis, monitoring, and management. When the disease is suspected, a thorough study should be conducted to identify its aetiology. Treatment must aim to eliminate the cause of the disease; symptomatic treatment should remain a second-line option.
En la actualidad cuando hablamos de la siringomielia solemos pensar prácticamente de manera inherente en un cuadro presentado junto con la malformación de Chiari, debiéndose ello a la extensa literatura existente sobre su asociación. Esto hace que caigamos en el olvido de otras muchas condiciones que pueden generar una siringomielia, y que esta por sí misma, constituye una entidad patológica. Esta revisión está orientada a profundizar en la etiopatogenia de este cuadro y las distintas opciones de manejo de la siringomielia no relacionada con malformación de Chiari.
Habitualmente se entiende por siringomielia el hallazgo de una dilatación quística expansiva intramedular. Esta definición es la más aceptada en la comunidad científica, si bien es criticada por algunos autores por ignorar condiciones como podrían ser la hidromielia (acúmulo de líquido intersticial considerada por algunos como una situación previa a la siringomielia) o una dilatación del canal central no patológica1, siendo características de este la presencia de un canal central dilatado con aspecto lineal, fusiforme, un diámetro máximo en cortes axiales de 2-4mm y que característicamente disminuye con la edad.
DesarrolloEtiologíaBatzdorf1,2 acuñó el término de siringomielia primaria o idiopática para describir aquel cuadro de siringomielia que se presente en ausencia de una anomalía a nivel del foramen magno. Este término se ha ampliado en la literatura para hacer referencia a aquellos cuadros en los que no se encuentra una causa específica que altere la circulación normal de líquido cefalorraquídeo (LCR)3. Dentro de la siringomielia secundaria destaca el Chiari tipo I, que justifica hasta el 50% de los casos. La segunda causa, y en la que más se centra la literatura existente es el traumatismo medular, presentándose en el 0,5-4,5% de lesionados medulares aunque dicha cifra se puede elevar hasta un 30% atendiendo a los hallazgos en autopsias en esta población4. Como tercer grupo destacan las infecciosas siendo más frecuentes en meningitis producidas por tuberculosis y listeria5. Otras causas descritas son las iatrogénicas, donde encontramos casos producidos en el contexto de aracnoiditis posquirúrgicas o tras procedimientos diagnósticos (punción lumbar, mielografía). Todas estas situaciones presentan en común la génesis de una obstrucción a la circulación normal del LCR.
Factores de riesgoSe conocen algunos elementos que pueden ser considerados como factores de riesgo para desarrollar siringomielia dentro de ciertos grupos. Por ejemplo, en aquellas de origen iatrogénico una mayor cantidad de sangre en el lecho quirúrgico, o múltiples punciones traumáticas aumentan la posibilidad de generar una fibrosis que obstruya la circulación de LCR. Los posibles factores de riesgo más estudiados los encontramos en la siringomielia postraumática. El mayor factor de riesgo probablemente sea la presencia de una lesión medular completa. Series como la de Masry6 y Curati7 llegan a proponer que una lesión medular completa (grado A en la escala de discapacidad «American Spinal Injury Association Impairment Scale» –ASIA–) duplica el riesgo de desarrollo de siringomielia clínica. Otros factores reconocidos dentro de este grupo son la presencia de una estenosis de canal >25% y una cifosis postraumática >15°. El hecho de presentar estos factores de riesgo no supone en ningún momento que el paciente deba ser sometido a una cirugía para prevenir la aparición de la siringomielia4.
FisiopatologíaA lo largo de los años se han formulado numerosas y variadas teorías que han intentado explicar el origen de la siringomielia. A día de hoy, se busca una teoría que consiga explicar todos los cuadros que pueden originar una siringomielia. Si bien, parece que la teoría de pulso intramedular propuesta por Greitz8 consigue cumplir este criterio, todavía no existe consenso en su aceptación, publicándose actualmente artículos basados en otras teorías que ya han sido rechazadas por parte de la comunidad científica.
Tanto teorías antiguas como teorías modernas parten de un mismo punto común, la presencia de una obstrucción a la circulación normal del LCR por el espacio subaracnoideo medular. Las primeras teorías fueron basadas en el trauma medular partiendo de una lesión isquémica que llevaba a una degeneración quística medular que se sumaría en una gran cavidad final9. Otras teorías proponían que al atrofiarse el parénquima medular, el canal central se dilata y empuja el resto de parénquima hacia fuera comprimiendo la circulación de líquido por el espacio subaracnoideo. Dicho líquido encuentra un stop, por lo que no podría descender por la vía que le correspondería y entraría al parénquima donde se acumularía dando una cavidad rellena de líquido. Estas teorías iniciales fueron mantenidas durante mucho tiempo, pero claramente rechazadas a día de hoy por razones físicas. Si bien se produjese un stop, el líquido se acumularía encima de esa obstrucción y aumentaría la presión en esta región, lo que llevaría al acúmulo de líquido por fuera de la médula que comprimiría el parénquima medular10.
Otras teorías que han sido abandonadas son el origen congénito por fallos de diferenciación y defectos de cierre11 o la teoría de Gardner12 o Williams13 basadas en alteraciones de la circulación del LCR en el cuarto ventrículo o foramen magno, similares a la teoría de pistón de Heiss y Oldfield propuesta para la siringomielia en contexto de malformación de Chiari que no discutiremos en esta revisión.
Probablemente la teoría que comienza a ser más aceptada y en la que se basan la mayoría de los artículos recientes sería la teoría de pulso intramedular mencionada previamente. Esta teoría además de explicar el cuadro independientemente de la causa, justifica la opción de tratamiento más usada en la actualidad que presenta los mejores resultados. Fue propuesta por Greitz en 1995. Esta teoría se basó en modelos diseñados inicialmente para explicar el origen y desarrollo de la hidrocefalia crónica del adulto y, antes de profundizar en ella, debemos recordar algunos conceptos que suelen caer en el olvido de la comunidad científica. El parénquima medular comparte muchas propiedades físicas con el cerebral, lo cual lleva a que ante microdistensiones repetidas, su complianza y elasticidad se vean alteradas (al igual que ocurre con el tejido cerebral en la hidrocefalia crónica del adulto). También debe tenerse en cuenta, que en contra de la creencia popular, la mayor parte del LCR se absorbe a nivel de la circulación capilar14.
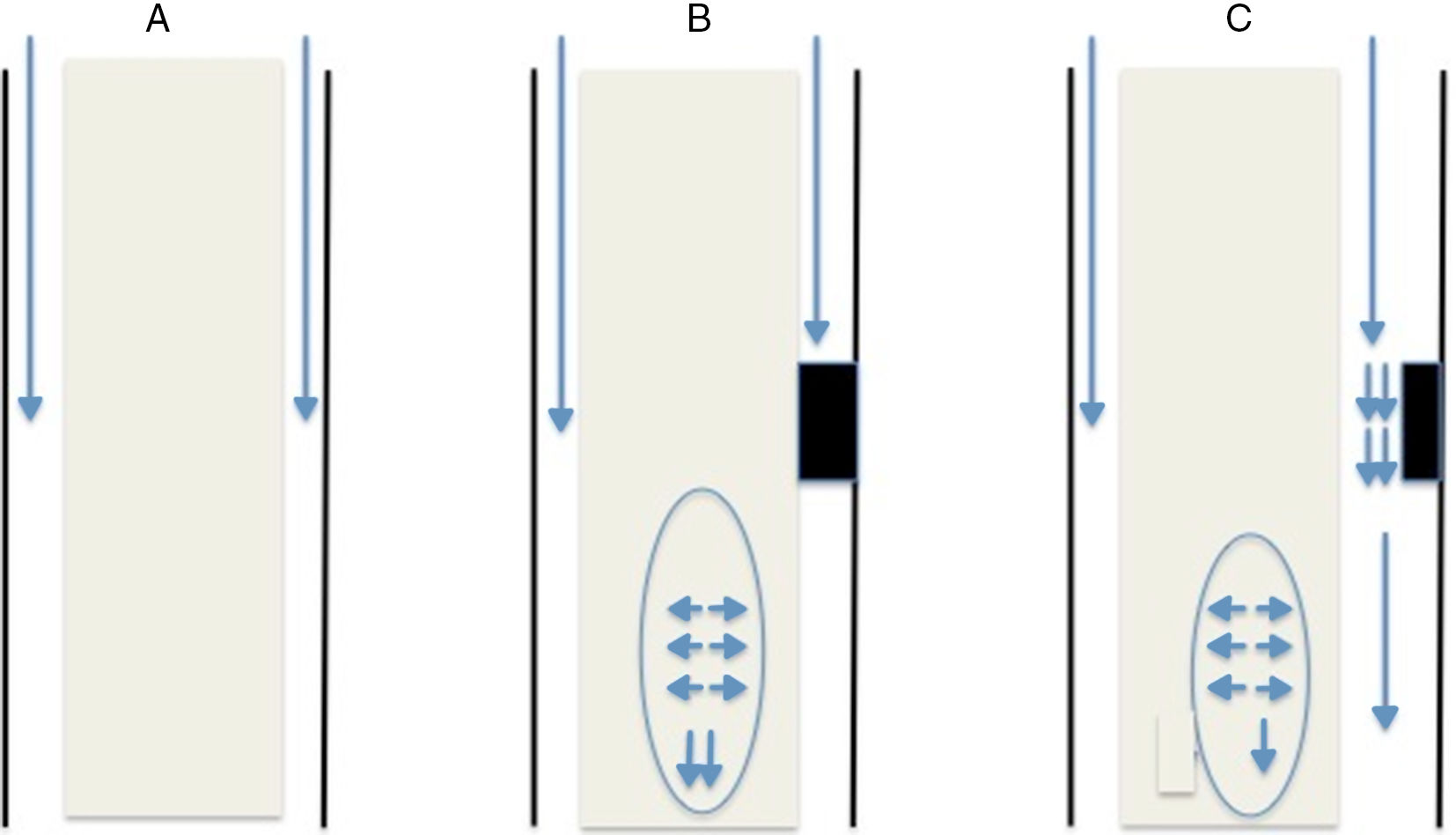
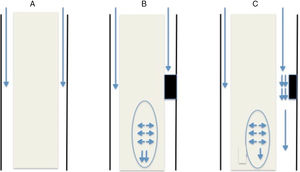
Esta teoría, al igual que las previas, parte del punto de obstrucción al tránsito normal de líquido por el espacio subaracnoideo medular. Dicha obstrucción suele ser secundaria a una fibrosis/aracnoiditis y suele ocurrir en la cara posterior de la médula, ya que anatómicamente, es donde existen una serie de septos de tejido aracnoideo que transcurren desde la médula hasta la duramadre15 que no se observan con tanta frecuencia en la región anterior. Dicha obstrucción puede ser de dos modos (fig. 1):
- •
Obstrucción completa: cuando la onda de presión del líquido alcanza el punto de bloqueo, dicha onda de presión se transmite a la médula y sigue descendiendo. Justo por debajo del bloqueo, la presión en el espacio subdural es menor ya que no existe circulación de líquido por ese punto por lo que el parénquima medular que presenta una presión mayor de la habitual por fuerza centrífuga se dilata para rellenar dicho espacio. No toda la presión se transmite caudalmente, pudiendo parte transmitirse en sentido craneal lo cual explicaría la presencia de quistes por encima del nivel de obstrucción.
- •
Obstrucción parcial: en el caso de que la obstrucción no sea completa y permita el paso de parte del LCR a su través se generan dos fenómenos físicos. El primero de ellos, consiste en que el líquido aumenta su velocidad de flujo por circular por un canal estrecho, lo cual lleva a una disminución de la presión en dicha región (teorema de Bernoulli). El otro fenómeno físico que se produce en esta situación es el efecto Venturi, el cual ante un líquido que circula a alta velocidad crea a su alrededor un efecto de succión. Ambas situaciones llevan a la dilatación del parénquima por debajo de la obstrucción.
Una vez se ha producido la dilatación del parénquima, aumenta el espacio extracelular permitiendo el acúmulo de líquido en esta cavidad. Dicho acúmulo lleva a comprimir la circulación capilar lo cual tiene dos consecuencias. Por un lado, un aumento de los espacios de Virchow-Robin que fuerza la salida de líquido de los vasos por los que circulan y por otro una disminución de la superficie capilar efectiva, encargada de la absorción de LCR que permanecerá en el espacio extracelular llevando al acúmulo de líquido y crecimiento progresivo de la cavidad siringomiélica9.
ClínicaHay muy poco escrito al respecto de la historia natural de la siringomielia, y más de aquella no relacionada con la malformación de Chiari. En este aspecto vuelve a destacar la investigación existente en la siringomielia postraumática. Dentro de este subgrupo, la presentación habitual suele ser un cuadro de deterioro clínico brusco en un paciente con una lesión medular previamente estable con un promedio de 9 años tras la lesión inicial4. La forma más frecuente de comienzo suele ser la presentación clínica de alteraciones sensitivas, dolor y debilidad motora.
La siringomielia no se caracteriza por ser una patología que genere un cuadro clínico específico. La presentación más habitual es el síndrome centromedular y dependerá en gran parte de su localización. Algunas de las manifestaciones que pueden presentarse son pérdida de la sensibilidad termoalgésica suspendida, desarrollo de úlceras o signos de segunda motoneurona. Ya Bogdanov15 quiso analizar si la siringomielia secundaria a malformación de Chiari producía una clínica diferente a la que no. En su serie los pacientes presentaban las mismas manifestaciones en mismos porcentajes independientemente del grupo al que pertenecían. La manifestación más frecuente fue la pérdida de sensibilidad suspendida (93%), seguida de signos piramidales (82%) y atrofia muscular (60%).
Finalmente mencionar que no se ha podido establecer ninguna relación entre el tamaño del quiste, localización y severidad clínica16. Entre las diversas manifestaciones clínicas que ya se han comentado, tan solo existe evidencia, y muy débil, a favor de indicación quirúrgica cuando el paciente presente pérdida de fuerza. La existencia de parestesias o dolor no justifica la intervención ya que la respuesta no ha mostrado ser tan favorable en estas situaciones. Tampoco existe indicación quirúrgica ante la evidencia de una cavidad quística que progrese radiológicamente, pero que no produzca clínica4. El empleo de estudios neurofisiológicos en el seguimiento al paciente pueden modificar la actitud a tomar ante el paciente ya que pueden objetivarse signos de empeoramiento progresivo que no sean clínicamente visibles.
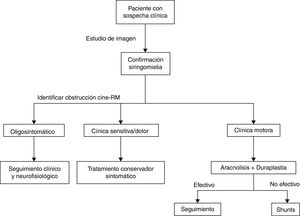
DiagnósticoDebe partir siempre de una sospecha clínica que motive el estudio del paciente. Es habitual sospechar de una posible siringomielia ante un paciente con lesión medular estable o déficit neurológico previo, secundario a proceso medular o intervención, que comienza con deterioro súbito y progresivo con evolución más lenta que el comienzo. A día de hoy, no existe ninguna prueba que pueda ser considerada como «gold standard» para el diagnóstico de la siringomielia, si bien, se pueden extrapolar algunas ideas generales de la literatura publicada.
Clásicamente la prueba diagnóstica más usada en el contexto de la siringomielia ha sido la del escáner con mielografía17. Esta prueba ha caído en desuso por varias razones. Primero es un procedimiento invasivo que puede ser causa de siringomielia iatrogénica ya que precisa de una punción lumbar que puede ser traumática y del contraste que puede inducir a una respuesta inflamatoria y fibrosis consecuente. La mayoría de las obstrucciones a la circulación de líquido a nivel medular se producen en la región posterior por la existencia de tabiques aracnoideos que no existen en la cara anterior de la médula. Esta distribución desigual permite la circulación de contraste por la parte anterior y relleno completo del espacio subaracnoideo pudiendo dar lugar a falsos negativos.
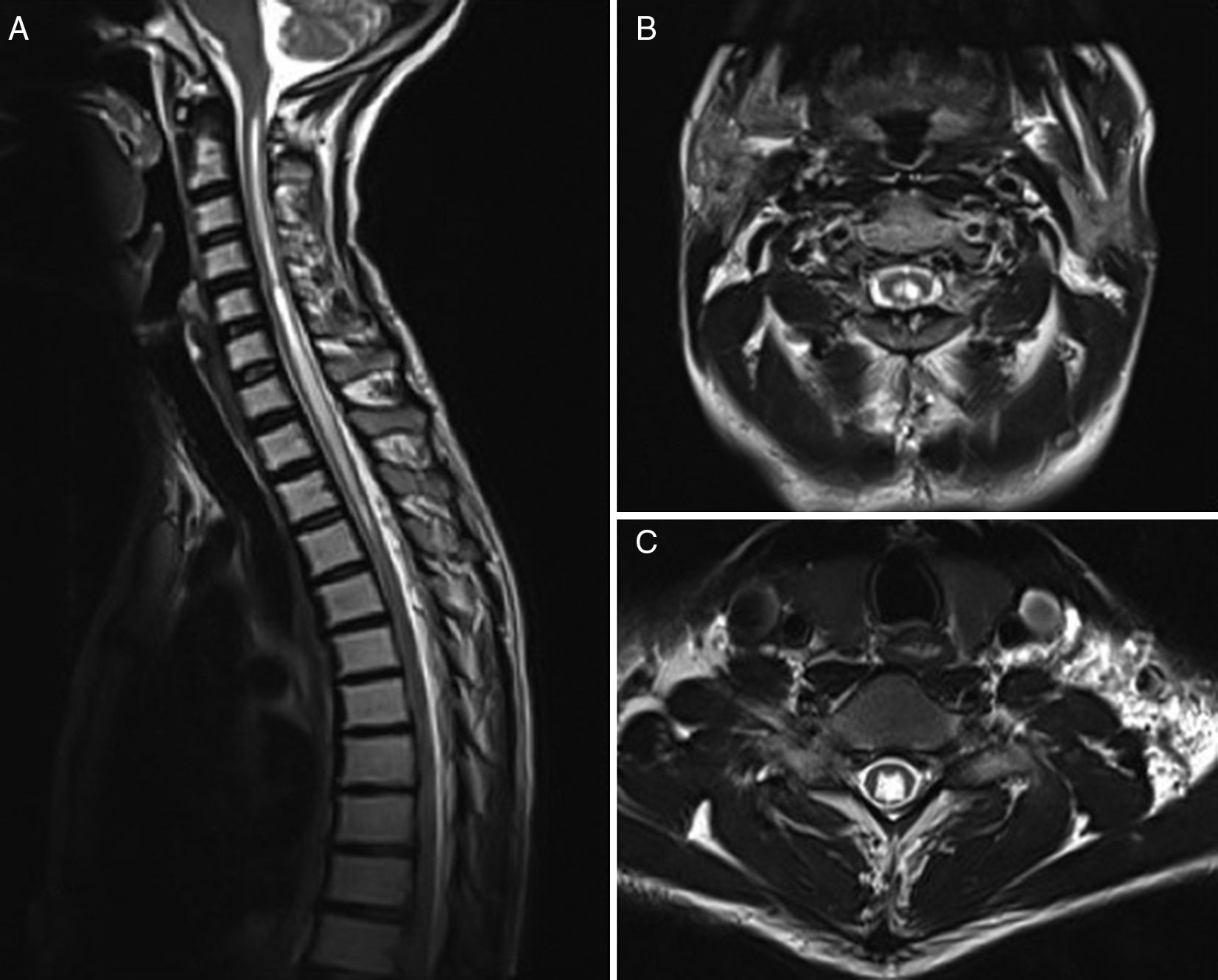
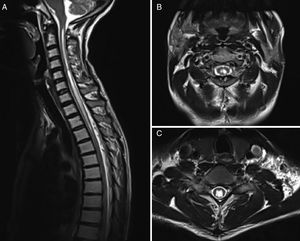
En la actualidad el método de imagen más usado es la RM (fig. 2) complementado con la cine-RM. Dicha técnica permite detectar el movimiento de LCR, teniéndose bastante experiencia en otros terrenos como la hidrocefalia, pero poco usada en este campo. Mauer et al.18 publicó una serie de más de 300 pacientes con siringomielia, siendo la mitad de origen desconocido. Dentro de este subgrupo, la mielografía tan solo identificó un punto de bloqueo en dos pacientes mientras que la cine-RM objetivó bloqueo en hasta 33, quedando el resto de pacientes sin identificar un punto claro de bloqueo, con lo que se demostró una clara superioridad de esta técnica diagnóstica.
Aunque existen algunos autores como Inoue19 que sugieren que en base a la morfología, extensión y progresión del quiste se puede identificar el punto de bloqueo, el consenso general es que ello no es posible basándonos solo en el aspecto de la RM18. No existe en el momento actual ninguna referencia bibliográfica que permita citar tasas de sensibilidad, especificidad y otros parámetros para elegir una técnica sobre otra. Sí que llama la atención que a pesar de que la cine-RM ha demostrado ser superior respecto a la mielografía o mielo-TC, no se llega a identificar un bloqueo claro en un alto porcentaje de casos.
Mencionar la utilidad de la ecografía intraoperatoria, citada por muchos autores y utilizada de manera rutinaria en muchos centros a la hora de intervenir a un paciente. Dicha ecografía permite en muchos casos en los que no se había identificado un bloqueo previamente, encontrar el stop en la circulación del LCR y diseñar la intervención en base a ello20. El estudio neurofisiológico es de gran utilidad para poder realizar un seguimiento que permita evaluar cambios que pueden modificar la actitud de manejo.
En resumen, se debe entender que ante un hallazgo radiológico de una cavidad siringomiélica el estudio del paciente no hace más que comenzar encaminado fundamentalmente a encontrar aquel punto en el que se ha generado una alteración de la circulación del LCR.
TratamientoSe han descrito múltiples opciones y posibles esquemas de manejo para esta entidad. Encontramos un largo recorrido, que va desde el manejo conservador (siempre una opción de manejo) pasando por el tratamiento médico de los síntomas hasta la intervención quirúrgica ya sea con objetivo sintomático o etiológico. La mayor parte de la bibliografía aboga en la actualidad por el tratamiento etiológico, basándose en la alta tasa de malos resultados y recurrencias de los tratamientos sintomáticos a pesar de sus buenos resultados en los momentos iniciales.
Existen bastantes casos publicados de seguimiento con vigilancia y resolución espontánea. Probablemente el primero fue descrito por Sudo21 en el 90. Desde entonces hasta 37 casos se pueden encontrar en diversas series22, siendo la mayoría de ellos secundarios a malformación de Chiari, aunque algunos no lo son23,24. Principalmente se atribuyen a niños, aunque los hay también en población geriátrica. Algunas de las explicaciones aportadas son el crecimiento de la fosa posterior, la atrofia de las amígdalas cerebelosas con la edad, la destrucción espontánea de los tabiques que obstruyen la circulación de líquido o la apertura del quiste al espacio subdural. Existen también casos descritos de mejoría con medidas que podríamos considerar como conservadoras como fisioterapia centrados fundamentalmente en siringomielias postraumáticas y la corrección de la curvatura de la columna. En casos de pacientes con síntomas aislados como dolor o alteraciones sensitivas se debe optar por tratamiento conservador con tratamiento de los síntomas.
Dentro del tratamiento quirúrgico diferenciamos dos grupos en función del objetivo. Por un lado los tratamientos sintomáticos, cuya finalidad es vaciar el quiste comunicándolo con otras cavidades por medio de tubos; y por otro lado, los etiológicos que tienen como objetivo identificar el punto en que se produce la obstrucción y restituir la circulación normal de LCR. Dentro del primer grupo destacan los sistemas de derivación a la cavidad pleural o al espacio subdural. Entre los tratamientos etiológicos destacan la aracnólisis como primera entidad y luego otras opciones que serán comentadas como la cordectomía o más novedosas como el bypass de la obstrucción.
La primera derivación de una siringomielia a cavidad pleural es atribuida a Abbe en 189225. Si bien, en el ámbito de la neurocirugía los sistemas de shunt se han derivado históricamente a la cavidad peritoneal, en este terreno se ha preferido utilizar la cavidad pleural por vecindad y facilitar la técnica quirúrgica26. Existen diversas series con resultados favorables a corto plazo27,28 en el control de síntomas y funcionalidad de los pacientes. La otra técnica, dentro de este grupo, en la que se tiene gran experiencia es la derivación al espacio subdural. Esta técnica se ha empleado a lo largo de muchos años por la facilidad respecto a la anterior u otras técnicas, encontrando también mucha bibliografía con buenos resultados inmediatos con un 72,5% de pacientes con mejoría29,30 y poca morbilidad. Sin embargo, esta técnica muestra dudas en cuanto a su funcionamiento como asegurar la existencia de flujo a través del tubo o la ausencia de flujo reverso.
En los últimos años estos sistemas han sido muy criticados por la alta tasa de recurrencias y revisiones quirúrgicas que presentan (llegando algunos estudios a cifrar la tasa de recurrencias en un 92% en un plazo de 3 años31). Si nos centramos en estudios que han revisado la eficacia de los shunts en comparación con otras alternativas, como la aracnólisis, se insiste mucho en este punto. Ghobrial32 revisó la literatura publicada hasta 2015, llegando a contabilizar un total de 410 pacientes intervenidos. Se compararon los factores que influyen en la reaparición de clínica, detectando como factores de riesgo para recurrencia clínica con significación estadística la edad (a mayor edad, mayor riesgo de recurrencia) y el tipo de intervención (donde someterse a un shunt supone siete veces más riesgo de presentar recurrencia clínica que si se somete a aracnólisis).
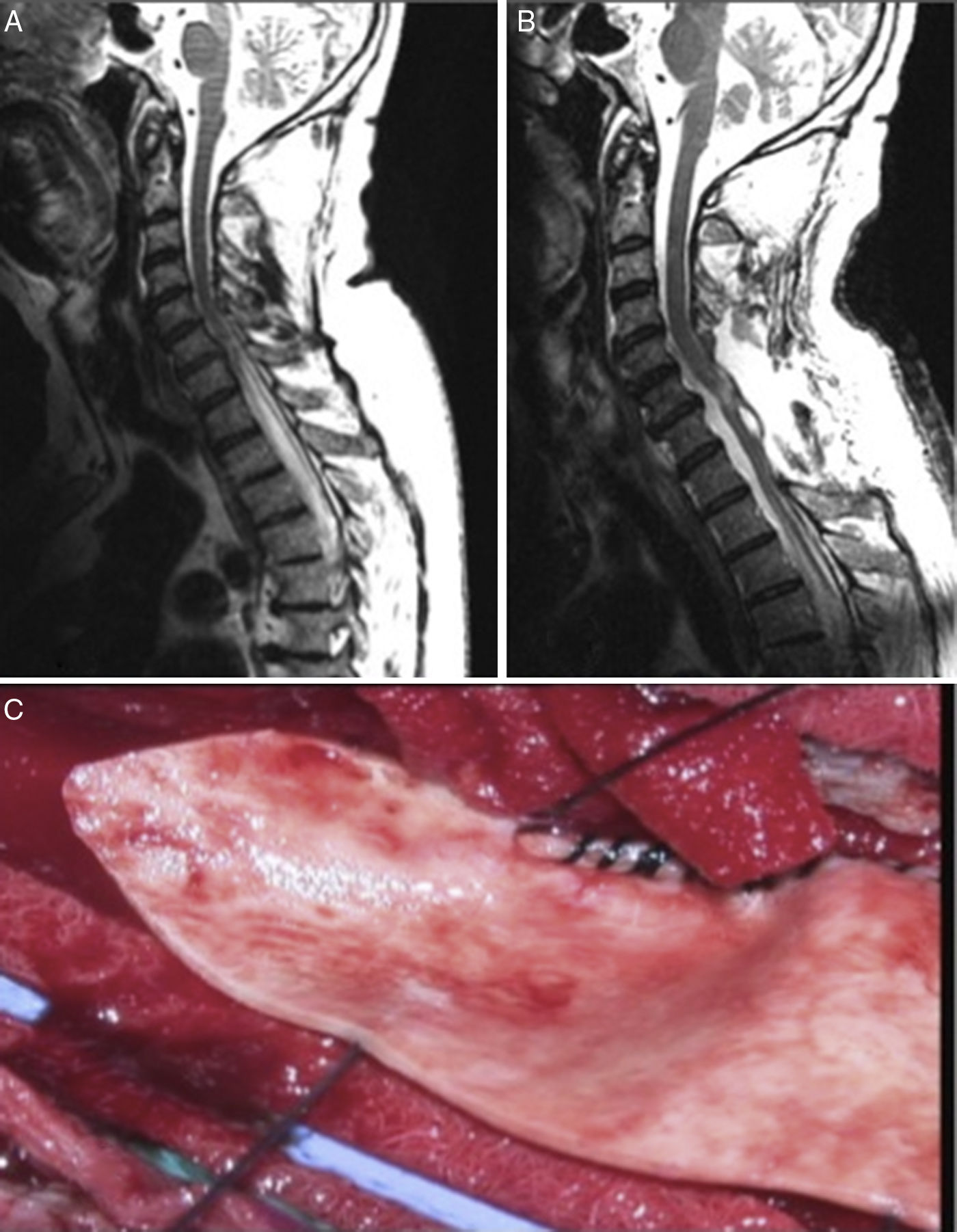
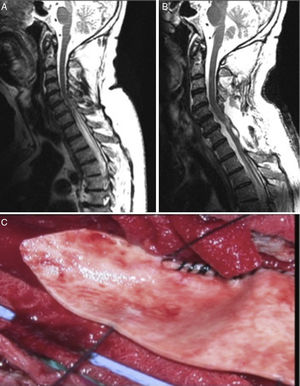
Por tanto, ante la alta tasa de fracaso terapéutico a largo plazo de los sistemas de shunt se han instaurado como técnicas de primera elección los tratamientos etiológicos (aracnólisis) orientados a permitir la circulación normal de LCR. En este apartado destacan las series publicadas por Klekamp31. El procedimiento se realiza de la siguiente manera. Primero se realiza laminectomías o laminoplastia de los niveles a los cuales se extiende el quiste. Luego se realiza una ecografía intraoperatoria para identificar aquel punto de mayor obstrucción al flujo de LCR y se abre la duramadre por encima de dicho punto. Posteriormente se realiza la aracnólisis, consistente en destruir todas las adherencias para permitir el flujo de LCR extendiéndose caudalmente hasta hallar tejido normal. Finalmente para el cierre se realiza una duraplastia para aumentar el espacio para el LCR (fig. 3).
En su serie Klekamp31 decidió diferenciar sus resultados entre pacientes con aracnopatías focales (<2 niveles) y extensas. De los pacientes intervenidos mostró mejoría el 95% con revisiones a 5 y 10 años de 34 y 40% respetivamente. Los resultados fueron mucho mejores en el grupo de <2 niveles con revisiones del 17 y 22% respecto a las tasas de 63 y 69% del grupo de >2 niveles. Otra serie relevante publicada por Klekamp20 se centró en siringomielias postraumáticas, donde en el mismo centro y el mismo cirujano decidió cambiar de técnica pasando del shunt a técnicas de aracnólisis. En dicha serie se confirma una mayor tasa de revisiones en el grupo de los shunts y la buena eficacia clínica de ambas intervenciones, siendo la diferencia entre ambas la duración de las mismas.
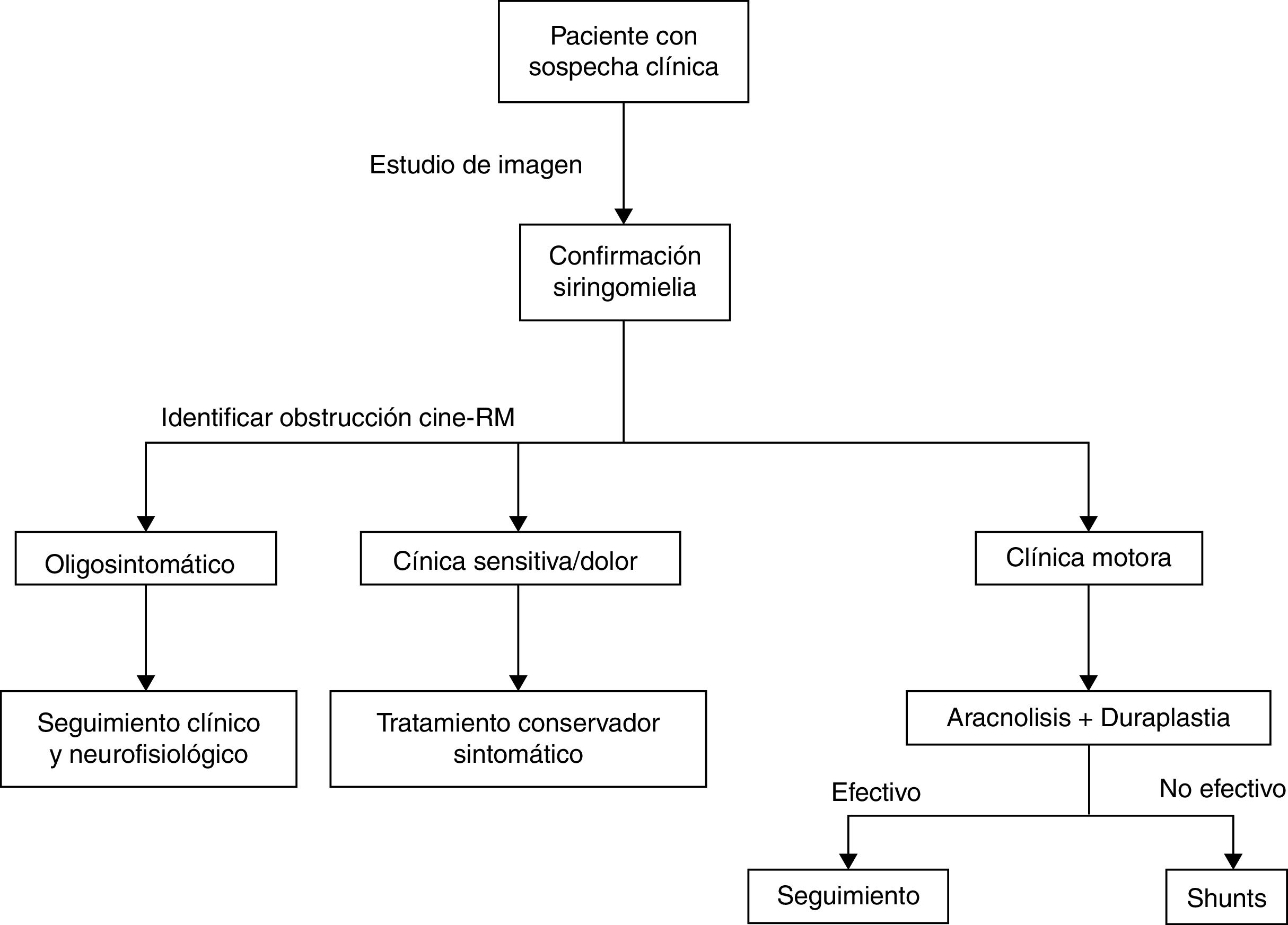
Por todo ello las técnicas de shunt han sido relegadas a un segundo plano como técnicas de rescate para cuando no se pueda realizar la aracnólisis o esta haya fallado. Otra técnica de rescate es la cordectomía33 que permite la recirculación de LCR y, en ocasiones, hasta la comunicación del quiste con el espacio subdural. Obviamente este procedimiento debe quedar siempre como última opción por el impacto psicológico que puede suponer y siempre en pacientes con lesiones medulares completas. Finalmente mencionar alguna técnica alternativa como el bypass subaracnoideo, consistente en insertar un tubo en el espacio subdural que salve craneal y caudalmente la obstrucción permitiendo el paso de LCR34 con resultados similares a los descritos por otras técnicas. La estrategia de manejo realizada en nuestro centro prioriza el tratamiento etiológico a raíz de la evidencia ya comentada (fig. 4).
ConclusionesLa siringomielia no secundaria a malformación de Chiari es una entidad propia que, aunque poco frecuente, debe ser conocida investigando en su etiopatogenia ya que ello nos permitirá realizar la indicación quirúrgica en los casos que precisen y escoger la opción de tratamiento orientada a solucionar la causa del problema, ya que dicha opción ha mostrado a largo plazo ser más efectiva que las otras opciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.