La esclerosis múltiple (EM) es una enfermedad crónica del sistema nervioso central de probable origen autoinmune. Su tratamiento temprano con interferón beta o acetato de glatirámero reduce el número de brotes y la progresión de la discapacidad, y mejora la calidad de vida, sin embargo, estos tratamientos son efectivos sólo parcialmente y requieren administración parenteral.
ObjetivoRevisar la situación actual de laquinimod como tratamiento inmunomodulador oral para la EM recurrente-remitente (EMRR).
DesarrolloLaquinimod es una nueva quinolonecarboxamida que ha demostrado eficacia en modelos animales de varias enfermedades autoinmunes, incluyendo la EM. Muestra efectos inmunomoduladores, probablemente a través de la alteración del balance Th1/Th2, y no conduce a la inmunosupresión. Se metaboliza en el hígado, principalmente por la vía del CYP3A4. Los estudios de fase II en EMRR han demostrado un efecto dosis-respuesta de laquinimod sobre la actividad de la enfermedad, medida por el número de lesiones activas en la resonancia magnética cerebral, y muestran una tolerabilidad y seguridad favorables, basadas en indicadores clínicos y de laboratorio. En la actualidad, se está evaluando la eficacia de laquinimod en dos estudios de fase III en la EMRR, usando la dosis de 0,6mg/día. Se ha concedido al fármaco la categoría de revisión rápida (fast track) por la FDA en 2009.
ConclusionesLaquinimod es un inmunomodulador nuevo, administrado por vía oral, que ha pasado a la etapa de estudio en fase III, previo a su evaluación por las agencias reguladoras y podría ser una alternativa a los actuales tratamientos inyectables de primera línea para la EMRR.
Multiple sclerosis (MS) is a chronic disease of the central nervous system, probably of autoimmune origin. Its early treatment with interferon beta or glatiramer acetate reduces the number of exacerbations, slows disability progression and improves the quality of life, but these treatments are only partially effective and require parenteral administration.
AimTo review current experience with laquinimod as a novel immunomodulatory therapy for relapsing-remitting MS (RRMS).
DevelopmentLaquinimod is a new quinolone-carboxamide that has shown efficacy in various animal models of autoimmune disease, including MS. Laquinimod shows immunomodulatory effects, probably through Th1/Th2 shift, but does not lead to immunosuppression. Laquinimod is metabolised primarily by the CYP3A4 enzyme in the liver. Phase II studies in RRMS demonstrate a dose-response effect on disease activity, measured by the number of active lesions on brain magnetic resonance imaging, and show favourable tolerability and safety based on clinical and laboratory indicators. Two Phase III studies currently in progress are evaluating the efficacy of laquinimod 0.6mg/day in RRMS. The drug was granted a fast track review by the FDA in 2009.
ConclusionsLaquinimod is a novel, orally administered immunomodulator that has advanced to phase III study, a pre-submission stage to the regulatory agencies, and may become an alternative to the current injectable first-line treatments for RRMS.
La esclerosis múltiple (EM) es una enfermedad crónica del sistema nervioso central que se caracteriza por inflamación, desmielinización y destrucción axonal. Actualmente, según los datos derivados del Atlas of MS, existen aproximadamente 2 millones de personas con EM en el mundo, de ellos 630.000 casos en Europa, constituyendo la principal causa de discapacidad en adultos jóvenes1,2. La tasa de prevalencia en España alcanza cifras de 50-80 casos por cada 100.000 habitantes3–5.
La EM es una enfermedad muy heterogénea, tanto en los aspectos patogénicos, neuropatológicos, clínicos, como de la respuesta a los tratamientos. Por ello es muy difícil establecer el pronóstico en un paciente concreto, así como evaluar la eficacia de los fármacos empleados en su tratamiento. Los primeros síntomas clínicos de la EM generalmente se producen entre la segunda y cuarta década de vida, aunque existen casos fuera de este rango etario. La actividad inflamatoria de la enfermedad, representada por los brotes, está presente durante unas dos a tres décadas, disminuyendo a lo largo del tiempo. La EM es una enfermedad crónica que causa discapacidad, debida a la acumulación de lesiones en el sistema nervioso central a lo largo del tiempo. La valoración de la discapacidad acumulada es fundamental en la toma de decisiones sobre el tratamiento y el intento de evitar su acumulación justifica el tratamiento temprano en el curso de la enfermedad.
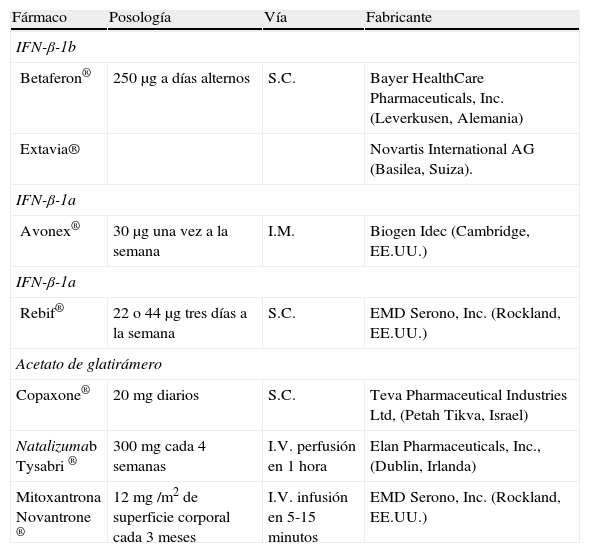
El pronóstico de la EM ha mejorado de manera significativa después de la aprobación del primer interferón beta en 1993. La disponibilidad de modelos animales, como el de la encefalomielitis autoinmune experimental (EAE) ha facilitado el estudio de nuevos fármacos modificadores de la evolución de la enfermedad orientados a disminuir la presentación antigénica, la proliferación, la activación o el tráfico de las células T activadas a través de la barrera hematoencefálica (BHE). Los fármacos aprobados para el tratamiento de la EM se muestran en la tabla 1.
Fármacos aprobados en la actualidad para el manejo de la EM
| Fármaco | Posología | Vía | Fabricante |
| IFN-β-1b | |||
| Betaferon® | 250μg a días alternos | S.C. | Bayer HealthCare Pharmaceuticals, Inc. (Leverkusen, Alemania) |
| Extavia® | Novartis International AG (Basilea, Suiza). | ||
| IFN-β-1a | |||
| Avonex® | 30μg una vez a la semana | I.M. | Biogen Idec (Cambridge, EE.UU.) |
| IFN-β-1a | |||
| Rebif® | 22 o 44μg tres días a la semana | S.C. | EMD Serono, Inc. (Rockland, EE.UU.) |
| Acetato de glatirámero | |||
| Copaxone® | 20mg diarios | S.C. | Teva Pharmaceutical Industries Ltd, (Petah Tikva, Israel) |
| Natalizumab Tysabri ® | 300mg cada 4 semanas | I.V. perfusión en 1 hora | Elan Pharmaceuticals, Inc., (Dublin, Irlanda) |
| Mitoxantrona Novantrone ® | 12mg /m2 de superficie corporal cada 3 meses | I.V. infusión en 5-15 minutos | EMD Serono, Inc. (Rockland, EE.UU.) |
La mayoría de los pacientes con esclerosis múltiple recurrente-remitente (EMRR) se benefician del tratamiento con interferón beta o acetato de glatirámero, mediante la obtención de un control parcial sobre la actividad de la enfermedad, medida por la tasa anual de brotes, el número de lesiones realzadas con gadolinio en la resonancia magnética (RM) cerebral, la acumulación de lesiones en las secuencias ponderadas en T2 o la reducción de lesiones que evolucionan a agujeros negros en T1. Las cuatro terapias inyectables comercializadas en Europa representan la primera línea de tratamiento para la EMRR. El natalizumab se utiliza actualmente, sobre todo, en pacientes que siguen teniendo actividad de la enfermedad a pesar del tratamiento de primera línea. Su uso está condicionado por el riesgo de un evento adverso potencialmente fatal, la leucoencefalopatía multifocal progresiva (LMP). La mitoxantrona está reservada para pacientes con una forma EMRR que no responden a otros tratamientos y en las formas clínicas secundariamente progresivas (EMSP), debido a su toxicidad acumulativa, en particular la cardiotoxicidad y el riesgo de leucemia mieloide aguda6, motivos por los que su uso se está reduciendo de forma progresiva.
Todas las terapias aprobadas actualmente para el tratamiento de la EM requieren administración parenteral, tienen efectos secundarios, o su uso implica riesgo de acontecimientos adversos. Además, como tratamientos modificadores de la enfermedad, sólo son parcialmente eficaces en la disminución de la frecuencia de los brotes y retrasando la progresión de la discapacidad. Tanto los clínicos como los pacientes con EM esperan con impaciencia la aparición de tratamientos más eficaces y con administración oral. En ensayos clínicos en Fase II y III, varios compuestos orales, con nuevos mecanismos de acción, han mostrado resultados muy prometedores, incluyendo fingolimod, cladribina oral, ácido fumárico, teriflunomida y laquinimod. En esta revisión se resumen los conocimientos sobre laquinimod y se revisa su potencial para el tratamiento de la EMRR.
Introducción a laquinimodLa molécula de laquinimod (ABR-215062) fue sintetizada por Active Biotech AB (Lund, Suecia) y en 2004 fue licenciada a Teva Pharmaceutical Industries Ltd como un agente inmunomodulador para el tratamiento de la EM. Laquinimod es un derivado de roquinimex (Linomide®), el cual es estructuralmente similar a laquinimod y fue ensayado anteriormente en el tratamiento de la EM7,8. Roquinimex mostró que efectivamente inhibía los modelos animales de la EAE aguda y crónica9,10 y estimulaba la producción de citocinas antiinflamatorias in vitro10. En los ensayos clínicos en pacientes con EM, el tratamiento con roquinimex demostró una reducción en el número y volumen de lesiones realzadas con gadolinio en la RM cerebral, una medida primaria de la actividad de la enfermedad utilizada en estudios de Fase II. Los ensayos clínicos de Fase III con roquinimex se interrumpieron de forma inesperada en 1999, debido a la ocurrencia de eventos cardíacos adversos graves, tales como la pericarditis y el infarto de miocardio11–13. Durante el desarrollo de laquinimod se ha prestado especial atención a la identificación de un producto con una menor probabilidad de desarrollar efectos secundarios inflamatorios, tales como las serositis y las vasculitis.
La molécula de laquinimod es pequeña (N-etil-N-fenil-5-cloro-1,2-dihidro-4-hidro-1-metil-2-oxo-3-quinolina-carboxamida), con un peso molecular de 357 Da. Ha sido investigada in vivo para determinar la potencia de su actividad, así como el perfil de efectos secundarios y la seguridad del compuesto. Utilizando el modelo de EAE se han estudiado más de 60 moléculas diferentes de la familia de las quinolonas, observándose con especial atención los efectos proinflamatorios, la aparición de fiebre y la alteración de los marcadores de inflamación. Estos mismos estudios se han repetido en un modelo que utiliza perros Beagle14. De todas estas moléculas, se seleccionó laquinimod para su desarrollo posterior, debido a su efecto, muy robusto, inhibiendo el desarrollo de la EAE15, y suprimiendo la neuritis autoinmune experimental16. La dosis equivalente de laquinimod utilizada en esta investigación fue 10 a 100 veces más eficaz en el control de la actividad de la enfermedad en el modelo de EAE que su predecesor, el roquinimex14.
Mecanismo de acciónEl mecanismo de acción de laquinimod como el de otros fármacos para el tratamiento de la EM no es único. Ha demostrado tener un efecto antiinflamatorio y otro neuroprotector de forma independiente. Las dianas concretas sobre las que actúa se encuentran ahora mismo en estudio.
Efecto antiinflamatorioLa administración de laquinimod en la EAE, como modelo animal de la EM, mostró una reducción de la infiltración de linfocitos CD4, CD5, CD8 y macrófagos. Así pues, la reducción de la expansión de CD5 por laquinimod podría tener importantes implicaciones terapéuticas15,17. La supresión de la EAE por laquinimod se explica por la modulación de la respuesta Th1/Th2 que produce una inhibición de las citocinas proinflamatorias (IL-12, TNF-α), disminuye la actividad de las células NK y aumenta las citocinas antiinflamatorias IL-4, IL-10, y TGF-β. Además el uso de laquinimod en este modelo no condujo a una reducción en el número de células B y T, no inhibió la proliferación de los linfocitos, ni dio lugar a inmunosupresión15,18. Laquinimod también redujo la producción de IFN-γ, TNF-α, IL-6, IL-13 e IL-17 en los estudios con modelos animales; estudios in vitro en líneas celulares humanas de voluntarios sanos mostraron una disminución de la IL-1719.
Efecto neuroprotectorLaquinimod también evidenció que inhibe tanto el desarrollo de la enfermedad, como los cambios histopatológicos en la EAE crónica en ratones. Este efecto ha demostrado ser independiente de la producción endógena de IFN-β. Laquinimod aumenta los niveles del factor neurotrófico BDNF in vivo, en pacientes con EM20. Además inhibe la actividad de la microglía y de los macrófagos, lo que sería beneficioso para los pacientes con EM21. Finalmente el tratamiento con laquinimod es capaz de reducir el grado de infiltración de macrófagos y células T, la desmielinización y el daño axonal. Estos resultados indican que laquinimod podría tener capacidad de proteger los axones, además de su efecto antiinflamatorio y por tanto, podría desempeñar un papel relevante en el tratamiento futuro de la EMRR y la EMSP con brotes22.
Farmacodinámica, farmacocinética y metabolismoLas propiedades farmacocinéticas de laquinimod han sido estudiadas en varios modelos preclínicos, incluyendo ratones, ratas, conejos y perros23. Laquinimod tiene una alta biodisponibilidad oral, un pequeño volumen de distribución (10l) y una baja tasa de aclaramiento total. La concentración plasmática máxima (Cmáx) de laquinimod se alcanza dentro de la primera hora de la administración oral y en humanos es inferior a 5μM después de la administración de 0,05 a 2,4mg del fármaco. Hay una pequeña fluctuación entre la concentración plasmática mínima (Cmín) y el estado estacionario de la Cmáx, una vez alcanzado. Laquinimod se metaboliza por una de las enzimas del CYP, es un sustrato de baja afinidad por el CYP3A4 en los microsomas hepáticos. Se elimina principalmente a través de la orina en cuatro metabolitos hidroxilados y dos desalquilados metabólicamente inactivos. Menos del 5% de laquinimod se elimina inalterado en la orina o las heces.
Las enzimas de la familia del CYP3A pueden estar implicadas en el metabolismo de ≤ 50% de los medicamentos utilizados en los seres humanos, lo que siempre resulta relevante por las potenciales interacciones entre fármacos que comparten la misma vía metabólica. Se han estudiado in vitro inhibidores del CYP3A4, como la prednisolona, la eritromicina y el ketoconazol. Sólo se conoce que el ketoconazol podría llegar en humanos a los niveles plasmáticos que tendrían un efecto metabólico sobre el CYP3A4 y en consecuencia afectar la eliminación de laquinimod. En otro sentido, la baja afinidad de laquinimod por las enzimas del CYP3A4, reduce el riesgo de la inhibición competitiva de otros sustratos. El nivel de laquinimod necesario para causar la inhibición competitiva por otros fármacos que comparten la misma vía metabólica, como el etinilestradiol, es 30 veces superior a la Cmáx esperada con las dosis actuales utilizadas en los ensayos clínicos24.
EficaciaEstudios Fase IEn los estudios Fase I completados, el compuesto fue bien tolerado en dosis desde 0,1mg/día hasta 1,2mg/día. Después de 1 a 2 semanas de tratamiento con 2,4mg/día de laquinimod se observó una elevación de los marcadores inflamatorios25.
Estudios Fase IIEstudio 01506203Fue el primer estudio piloto con laquinimod en EMRR, publicado en 200525. Se trata de un estudio Fase II, multicéntrico (20 centros de los Países Bajos, Rusia, Suecia y Reino Unido), doble ciego y aleatorizado, que evaluó los efectos de laquinimod en dosis de 0,1 o 0,3mg/día frente a placebo a 24 semanas. El estudio se monitorizó con RM cerebral con triple dosis de gadolinio (0,3 mmol/kg) en el momento basal y en las semanas 4, 8 y 24 de tratamiento y 8 semanas después de la interrupción del mismo. El objetivo principal del estudio fue el número acumulado de lesiones activas (suma de lesiones que captan gadolinio en T1 o que aparecen nuevas o aumentadas de tamaño en T2) en el cerebro a la semana 24. El estudio incluyó a 209 pacientes con EMRR o EMSP, una EDSS no superior a 5,5, y evidencia de actividad de la enfermedad en la RM o presencia de un brote clínico en los 1-2 años previos. Ambas dosis de laquinimod fueron bien toleradas y el 95% de los pacientes completaron el estudio. La terapia oral con laquinimod a la dosis de 0,3mg/día durante 24 semanas dio lugar a una reducción del 44% (p=0,0498) en la media del número acumulado de lesiones activas vs placebo. En un subgrupo de pacientes con al menos una lesión activa en la RM basal, la reducción media en el número de lesiones activas acumuladas alcanzó el 52% (p=0,005). También hubo una diferencia significativa en el volumen acumulado de lesiones realzadas con gadolinio a las 24 semanas de tratamiento favorable al grupo tratado con laquinimod 0,3mg/día frente a placebo. La RM cerebral obtenida 8 semanas después de la interrupción de la medicación del estudio mostró un incremento en actividad de la enfermedad en ambos grupos de tratamiento; este dato podría apoyar el efecto biológico del compuesto o interpretarse como una tendencia que sugiere un efecto de rebote.
Estudio LAQ/ 5062Los efectos de laquinimod en el tratamiento de la EMRR se continuaron investigando en un segundo ensayo multicéntrico, internacional, doble ciego, controlado con placebo, publicado en 200826. La eficacia, tolerabilidad y seguridad de laquinimod 0,3mg/día (n=98) y laquinimod 0,6mg/día (n=106) frente a placebo (n=102) se evaluó tras más de 36 semanas de tratamiento. Los pacientes elegibles para este estudio tenían un diagnóstico de EMRR confirmado por los criterios de McDonald, con una EDSS no superior a 5 y con al menos una lesión realzada con gadolinio en la RM cerebral. Se realizó una RM cerebral sin y con dosis estándar de gadolinio (0,1 mmol/kg) en el momento basal, la semana 4, y mensual entre las semanas 12 y 36 de tratamiento. La medida principal de evaluación de la eficacia fue el número acumulado de lesiones realzadas con gadolinio en las últimas 4 RM durante el tratamiento (semanas 24, 28, 32 y 36). Comparado con placebo, la terapia oral con laquinimod 0,6mg/día resultó en una reducción de 40,4% en el número medio acumulado de lesiones realzadas con gadolinio por RM, ajustados a los valores basales (media placebo=4,2; SD=9,2 vs media laquinimod 0,6mg/día=2,6; SD=5,3; p=0,0048).
Estas diferencias eran significativas a favor del grupo tratado con la dosis de 0,6mg/día, y también se observaron en casi todas las variables secundarias del estudio. El número acumulado de lesiones nuevas en T2 y el número acumulado de lesiones nuevas hipointensas en T1 en el grupo con laquinimod 0,6mg/día se redujeron significativamente en un 44 y un 51%, respectivamente, en comparación con el grupo placebo.
Los sujetos tratados con laquinimod 0,6mg/día tuvieron una tasa anual de brotes, de 0,52 (SD=0,92) frente a 0,77(SD=1,25) para el grupo placebo (NS, p=0,0978), sin embargo, estudios de este tamaño y duración (36 semanas) no tienen poder suficiente para detectar cambios en la actividad de la enfermedad utilizando la tasa de brotes como medida de resultado. El análisis de la variable primaria o las secundarias en el grupo de laquinimod 0,3mg/día no mostró diferencias significativas respecto a placebo. En cambio, Polman et al25 encontraron significación estadística en los resultados de la RM cuando se comparan los 0,3mg/día frente al grupo placebo; ellos utilizaron una dosis triple de gadolinio, lo que aumenta la sensibilidad para determinar la alteración de la permeabilidad de la BHE. En el estudio publicado por Polman, para evaluar el objetivo primario también se consideraron dos tipos de lesiones, las realzadas con gadolinio y las nuevas o que aumentaron de tamaño en T2, por lo tanto puede haber tenido mayor sensibilidad al cambio de actividad de la enfermedad basada en estos resultados de la RM.
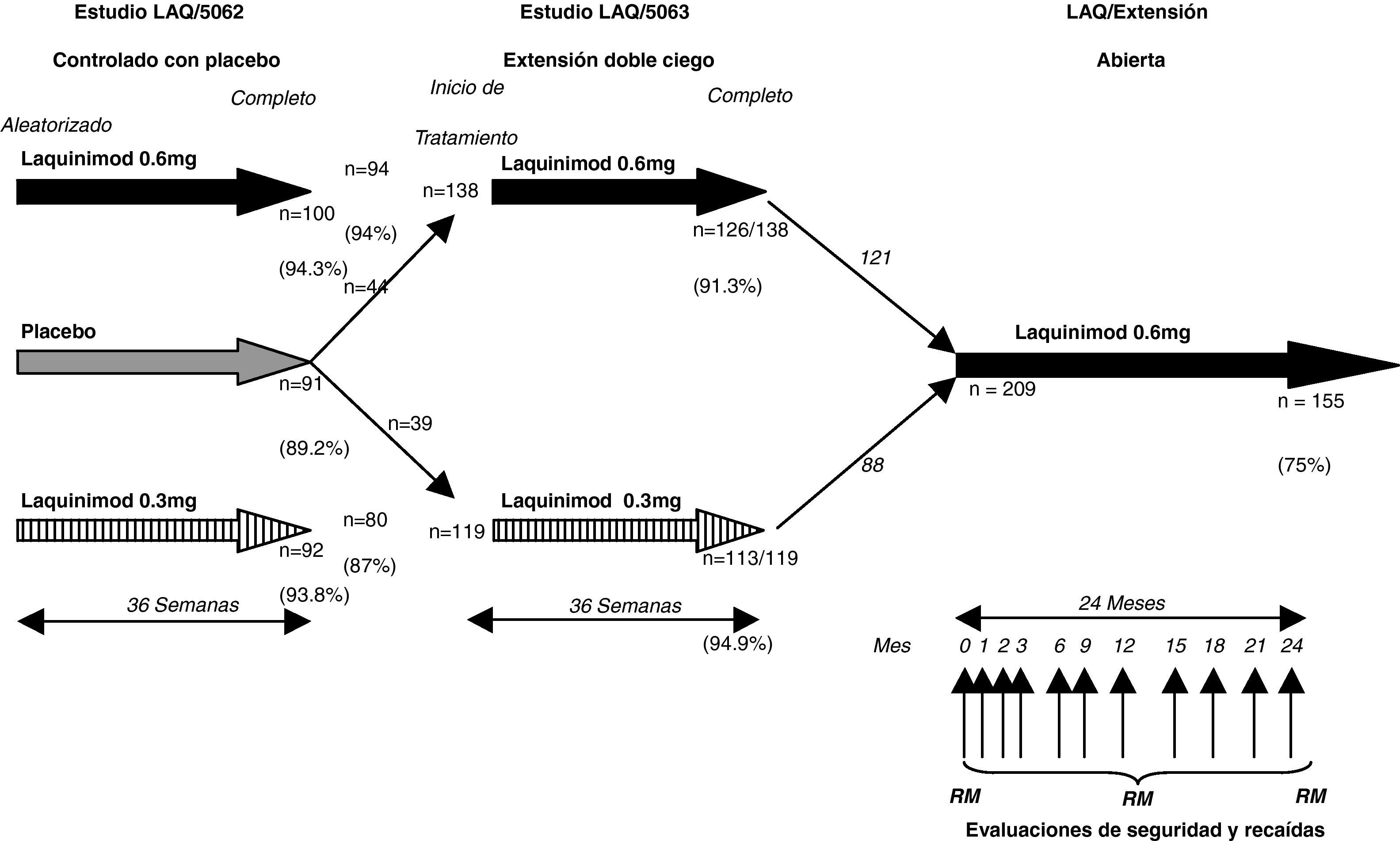
Extensión del estudio – LAQ/ 5063A los sujetos incluidos en el ensayo clínico LAQ/ 5062 publicado por Comi et al26 se les ofreció la oportunidad de participar en una extensión del estudio (91% reclutados) por un tiempo adicional de 36 semanas. El grupo placebo fue realeatorizado para recibir laquinimod a una dosis de 0,3 o 0,6mg/día. Hubo una reducción del 52% (p<0,0007) en el número promedio de lesiones realzadas con gadolinio en los pacientes que cambiaron de placebo a tratamiento activo con laquinimod. Esta reducción fue significativa para cualquiera de los pacientes, los que cambiaron a la dosis alta (p<0,009) o la dosis baja (p<0,03) de laquinimod. De los pacientes que iniciaron tratamiento activo en esta fase de extensión, el 47% (p<0,012) no desarrolló nuevas lesiones realzadas con gadolinio. El promotor del estudio tomó la decisión de proseguir con 0,6mg/día de dosis en futuros estudios Fase III. La investigación continúa como un estudio abierto, con los mismos pacientes que completaron la fase de extensión y proporcionará datos importantes para la seguridad en el uso de laquinimod a una dosis de 0,6mg/día en pacientes con EMRR a lo largo del tiempo27.
El diseño de los estudios Fase II se muestra en la figura 1.
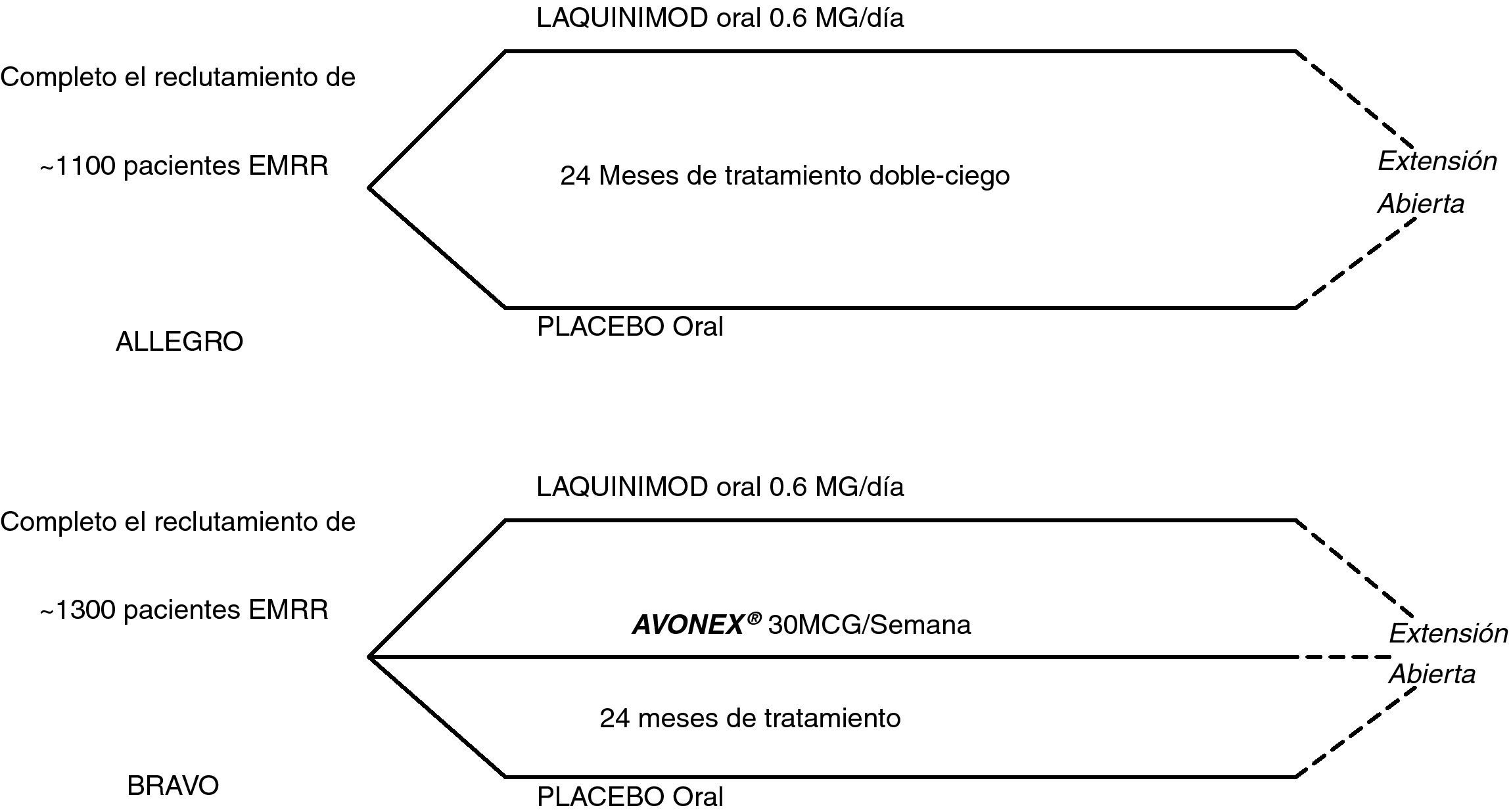
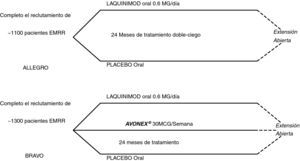
Estudios Fase IIIEstudio LAQ/301- AllegroEs un estudio doble ciego, diseñado para evaluar la eficacia, seguridad y tolerabilidad de laquinimod a dosis de 0,6mg/día frente a placebo en el tratamiento de la EMRR28. El reclutamiento se completó en noviembre de 2008, con 1.107 pacientes de 152 centros en 25 países29. El objetivo primario es el número de brotes durante el periodo doble ciego. Los objetivos secundarios incluyen el tiempo de progresión sostenida en la escala EDSS y los resultados de la RM a los 12 y 24 meses. Los sujetos del estudio llegarán a los 24 meses de seguimiento antes de finales de verano de 2010, con la posibilidad de una fase de extensión a 30 meses de tratamiento.
Estudio LAQ/302- BravoSe inició en abril de 2008, y ha completado la inclusión de 1.300 pacientes30. Este estudio internacional, multicéntrico, aleatorizado pretende comparar el efecto del tratamiento oral con dosis de 0,6mg/día de laquinimod y otros dos grupos: IFN- β-1a o placebo en pacientes con EMRR. El objetivo primario del estudio es la tasa anual de brotes a los 24 meses de tratamiento, junto a la discapacidad acumulada y los resultados de RM cerebral como objetivos secundarios.
El diseño de los estudios Fase II se muestra en la figura 2.
Seguridad y tolerabilidadEn general, todas las dosis de laquinimod utilizadas en estudios de Fase II fueron bien toleradas con un ∼ 95% de los pacientes que completaron los períodos de estudio por protocolo. Las principales preocupaciones de seguridad fueron la elevación de las enzimas hepáticas y los posibles efectos proinflamatorios. No hubo indicios clínicos o de laboratorio de eventos inflamatorios no deseados (serositis), infarto de miocardio, trombosis o embolia pulmonar. Hubo un caso de trombosis con obstrucción del flujo venoso del hígado (síndrome de Budd-Chiari) que se produjo después de 1 mes de tratamiento con laquinimod a dosis de 0,6mg/día en un paciente con antecedentes de hipercoagulabilidad (heterocigotico para la mutación del factor V de Leiden). Los aumentos en las enzimas hepáticas fueron dependientes de la dosis y reversibles. No hubo evidencia de eventos adversos graves cardiacos, ni alteraciones electrocardiográficas26.
Estado regulatorioSe ha presentado a la FDA una solicitud de nuevo fármaco en investigación. La FDA concedió a laquinimod la condición de revisión por vía rápida (fast track) en febrero de 2009 para el tratamiento de la EMRR29. Se encuentran en marcha ensayos clínicos para probar la eficacia de laquinimod en el tratamiento de la enfermedad de Crohn.
ConclusionesLaquinimod es un derivado de una quinoleína sintética 3-carboxamida con propiedades inmunomoduladoras. El tratamiento con laquinimod es eficaz en la reducción de la gravedad de la enfermedad, disminuyendo la inflamación, la desmielinización y el daño axonal en el modelo animal de EAE de la EM15,22. Laquinimod es administrado por vía oral una vez al día. Se ha pasado a la etapa de estudios de Fase III y podría convertirse en una alternativa a los tratamientos inyectables actuales de primera línea para modificar la evolución de la EMRR. Conocer cómo se posicionará entre las terapias existentes y futuras dependerá de un balance en el que deberán ser consideradas la seguridad, la eficacia y la tolerabilidad de laquinimod frente a los otros fármacos. Con los datos disponibles, su excelente tolerabilidad, en una dosis única oral diaria, da a laquinimod una ventaja entre los futuros fármacos orales. La seguridad en estudios de Fase II fue muy buena. No hay signos de efectos secundarios irreversibles a la dosis de 0,6mg/día.
Conflicto de interesesEl autor ha recibido honorarios como consultor, moderador y ponente en reuniones, y ha participado y participa en ensayos clínicos y otros proyectos de investigación promovidos por Teva, Bayer-Schering; Merck-Serono, Biogen-Idec y Novartis. Actualmente está participando en un ensayo clínico en Fase III de laquinimod como investigador principal en su centro.