A pesar de los avances en nuestra comprensión del accidente cerebrovascular isquémico, los accidentes cerebrovasculares criptogénicos siguen siendo un reto diagnóstico y terapéutico. El accidente cerebrovascular embólico de origen indeterminado (ESUS) es causado por enfermedad embólica y está asociado con un elevado riesgo de accidentes cerebrovasculares isquémicos recurrentes y lesiones isquémicas cerebrales clínicamente silenciosas. La prevención secundaria óptima del ESUS no está establecida. El tratamiento estándar actual en estos pacientes es el ácido acetilsalicílico, a pesar de la alta prevalencia de fibrilación auricular paroxística aún no detectada y otras potenciales etiologías embólicas. El riesgo de mortalidad a largo plazo en el ESUS es menor en comparación con los accidentes cerebrovasculares cardioembólicos, a pesar de poseer tasas similares de recurrencia. El riesgo de accidente cerebrovascular recurrente es mayor en el ESUS que en los accidentes cerebrovasculares no cardioembólicos.
Despite many advances in our understanding of ischemic stroke, cryptogenic strokes remain as a diagnostic and therapeutic challenge. Embolic stroke of unknown source (ESUS) is caused by embolic disease and associated with an elevated risk of recurrent ischemic strokes and clinically silent cerebral ischemic lesions. Optimal secondary prevention of ESUS is not established. The current standard in these patients is acetylsalicylic acid, despite high prevalence of yet undetected paroxysmal atrial fibrillation and other potential embolic etiologies. Long-term mortality risk in ESUS is lower compared with cardioembolic strokes, despite similar rates of recurrence and composite cardiovascular end point. Recurrent stroke risk is higher in ESUS than in noncardioembolic strokes.
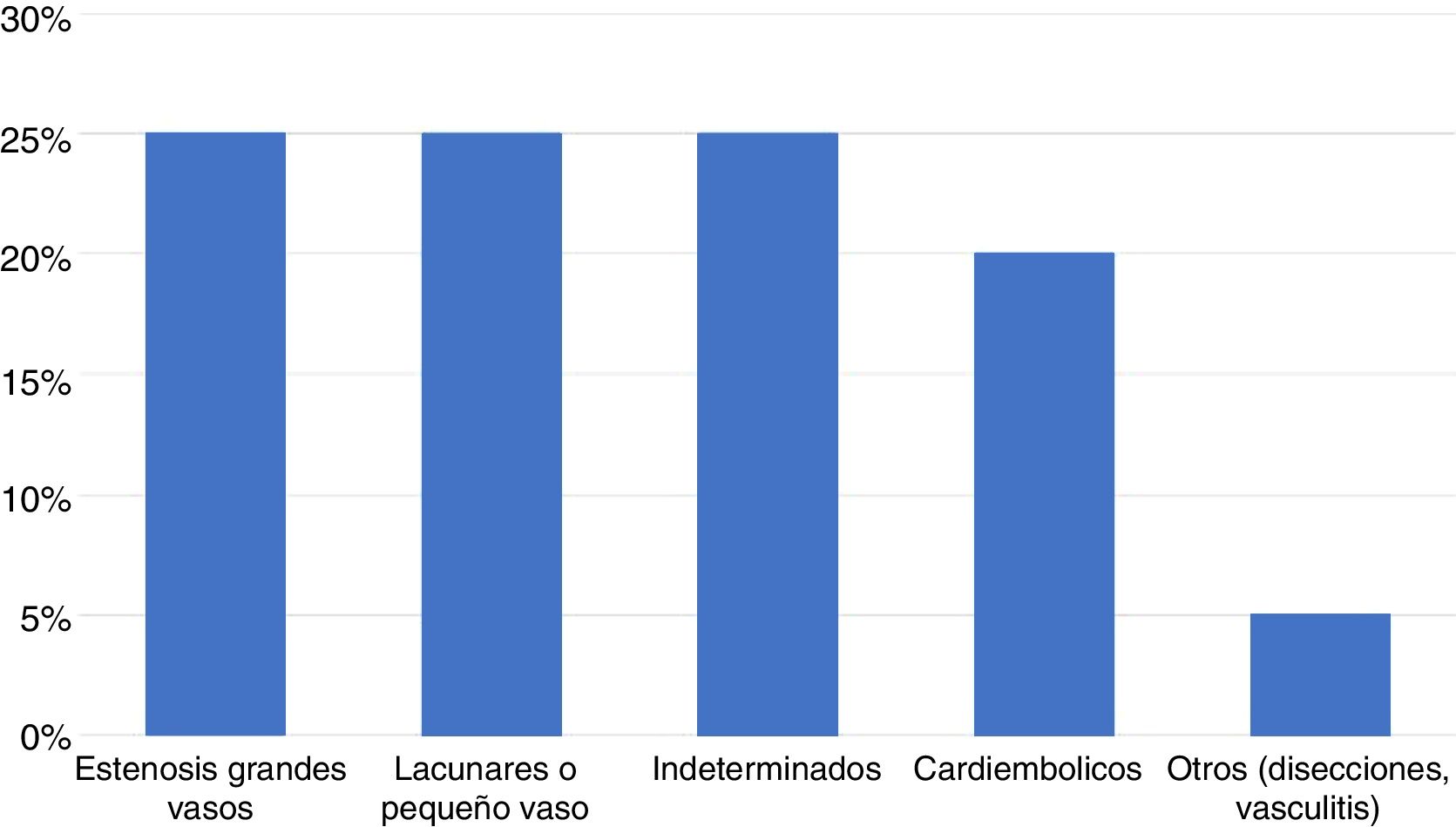
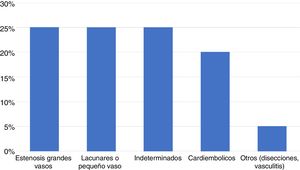
La enfermedad cerebrovascular es una de las causas más importante de muerte en el mundo1 y representa la causa más frecuente de discapacidad permanente en adultos2. El accidente cerebrovascular (ACV) es una entidad heterogénea tanto en sus formas de presentación como en su etiopatogenia. Su pronóstico a corto y largo plazo varía según el subtipo de ACV. Los ACV isquémicos predominan sobre los ACV hemorrágicos, clasificándose según los criterios TOAST en ACV de grandes vasos, de pequeños vasos o lacunares, cardioembólicos, criptogénicos o indeterminados, y de otras causas o inusuales3 (fig. 1).
Distribución de los subtipos de accidente cerebrovascular isquémico según la clasificación TOAST3.
El cardioembolismo causa aproximadamente el 20% de los ACV isquémicos, siendo la fibrilación auricular la condición más frecuente. Sin embargo, en numerosos pacientes, el origen del embolismo es incierto. Existen diversas entidades potencialmente embolígenas de diferente riesgo relativo, tales como la disfunción ventricular izquierda, la calcificación del anillo mitral, el foramen oval permeable, las placas ateromatosas carotídeas y la ateromatosis en cayado aórtico.
El ACV isquémico criptogénico o indeterminado constituye alrededor del 25% del total de los ACV en diversas series4.
La mayoría de los ACV isquémicos no lacunares y no asociados a enfermedad ateromatosa obstructiva son embólicos5. El émbolo que se dirige hacia el cerebro puede originarse en las válvulas mitral o aórtica, en las cámaras cardiacas, en el arco aórtico, en las arterias cervicales, y en las venas (embolia paradojal).
Si bien los émbolos pueden contener una composición variada, como células tumorales, fragmentos de calcio, material séptico, etc., la mayoría poseen un elevado componente de plaquetas y/o trombina. Esta es la base fisiopatológica del término ACV tromboembólico y su interés terapéutico radica en actuar sobre la fuente trombótica.
A pesar de la elevada frecuencia del ACV criptogénico, no es clara la mejor estrategia de prevención secundaria de esta entidad6. Si estos eventos fueran embólicos, los anticoagulantes podrían tener una eficacia mayor que los antiagregantes en la recurrencia de la isquemia cerebral.
Definición de embolic stroke of unknown sourceEl término ESUS (acrónimo en inglés para embolic stroke of unknown source) define a los ACV isquémicos embólicos (no lacunares) sin una causa cardioembólica de alto riesgo identificada y sin una obstrucción ateromatosa significativa de las arterias del territorio infartado6. Las causas de ESUS son variadas y se describen en la tabla 1.
Potenciales causas de accidente cerebrovascular embólico
| Valvular |
| Valvulopatía mixomatosa con prolapso mitral |
| Calcificación del anillo mitral |
| Estenosis valvular aórtica |
| Calcificación del anillo valvular aórtico |
| Arritmias supraventriculares |
| Episodios de taquicardia auricular |
| Estasis sanguínea con reducción del flujo o ecodensidades espontáneas dentro de la orejuela auricular |
| Anormalidades en la estructura auricular |
| Aneurisma del septum auricular |
| Red de Chiari |
| Fibrilación auricular paroxística oculta |
| Cáncer |
| Endocarditis trombótica no bacteriana oculta |
| Émbolo tumoral asociado a cáncer oculto |
| Embolia aterotrombótica |
| Placas en cayado aórtico |
| Placas ulceradas no estenosantes en vasos cervicales |
| Embolia paradojal |
| Foramen oval permeable |
| Anomalías del septum auricular |
| Fístula arteriovenosa pulmonar |
Fuente: Hart et al.6.
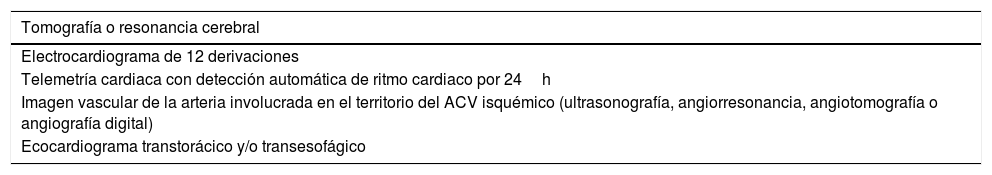
Los exámenes requeridos para este diagnóstico están dirigidos a confirmar un infarto cerebral con características compatibles con embolia (no lacunar) por medio de una tomografía computarizada o resonancia magnética cerebral. Además, se deben descartar causas de cardioembolia, principalmente fibrilación auricular y trombo intraventricular (electrocardiograma, Holter y Doppler cardiaco) y obstrucción ateromatosa significativa de las arterias del territorio infartado (tabla 2).
Criterios diagnósticos para ACV embólico de origen indeterminado (ESUS)
| ACV isquémico (no lacunara) en tomografía o resonancia cerebral |
| Ausencia de estenosis arterial superior al 50% de vasos cervicales o intracraneales |
| Ausencia de origen cardioembólico de alto riesgob |
| Ausencia de otra causa específica de ACV (arteritis, disección, migraña/vasoespasmo) |
ACV lacunar se define como infarto subcortical o de arterias perforantes menor de 1,5cm en estudios de neuroimágenes.
Fibrilación auricular, trombo intracardiaco, válvula protésica, mixoma auricular, estenosis mitral severa, disfunción ventricular severa (FEY <30%), endocarditis infecciosa.
Fuente: Hart et al.6
La frecuencia de este subtipo de ACV parece variar en el mundo, probablemente por características de la población y de la extensión de los protocolos diagnósticos. En nuestro medio se ha reportado alta frecuencia de ESUS7.
Diagnóstico de ESUSPara establecer el diagnóstico de ESUS debe descartarse el origen cardioembólico de alto riesgo (p.ej., fibrilación auricular), estenosis ateromatosas de los vasos de cuello o intracerebrales del territorio infartado y los ACV lacunares.
El abordaje gradual para el diagnóstico de ESUS consiste en (tabla 2 y tabla 3):
- -
Evidencia de infarto cerebral en la neuroimagen que confirma el diagnóstico de ACV isquémico y excluir el ACV lacunar basándose en la topografía del infarto.
- -
Excluir el origen cardioembólico de alto riesgo con ECG y monitorización Holter para detectar fibrilación auricular y con ecocardiografía para descartar trombo intraventricular o valvulopatía.
- -
A través de una imagen vascular (angiotomografía, angiorresonancia o ultrasonido) se debería excluir la ateromatosis obstructiva de vasos cervicales o intracerebrales del territorio infartado.
- -
Excluir otras causas poco frecuentes de ACV isquémico como las arteritis, disección arterial, síndrome de vasoconstricción cerebral.
Métodos diagnósticos para detección de ACV embólico de origen indeterminado (ESUS)a
| Tomografía o resonancia cerebral |
|---|
| Electrocardiograma de 12 derivaciones |
| Telemetría cardiaca con detección automática de ritmo cardiaco por 24h |
| Imagen vascular de la arteria involucrada en el territorio del ACV isquémico (ultrasonografía, angiorresonancia, angiotomografía o angiografía digital) |
| Ecocardiograma transtorácico y/o transesofágico |
No es necesaria la evaluación del cayado aórtico. Los estudios de trombofilias solo serán necesarios si existe una historia familiar o si la clínica actual lo amerita.Fuente: Hart et al.6
La fibrilación auricular paroxística oculta puede ser detectada en un 10-20% de los pacientes con ACV criptogénico, pero muchos de estos episodios duran segundos o pocos minutos8,9. Existe poca evidencia que ayude a definir qué duración es requerida para incrementar el riesgo de ACV isquémico y por lo tanto requerir anticoagulación. No hay un consenso global sobre la duración de la monitorización electrocardiográfica luego del ACV isquémico para excluir la fibrilación auricular. Las recomendaciones en las guías han sido escasas sobre este tema. Estas recomiendan la monitorización por Holter cardiaco por al menos 24h luego del ACV isquémico10,11.
Aspectos clínicos de los pacientes con ESUSLos datos aportados por el ESUS Global Registry indican que los pacientes con ESUS son relativamente jóvenes con accidentes cerebrovasculares leves. La terapia antiplaquetaria fue la terapia antitrombótica estándar para la prevención secundaria del ACV en todas las regiones12.
El riesgo de ACV isquémico recurrente / TIA y muerte en ESUS puede estratificarse por las puntuaciones CHADS2 y CHA2DS2-VASc. En comparación con el grupo de bajo riesgo, los pacientes en el grupo de alto riesgo CHA2DS2-VASc tienen un riesgo mayor de recidiva de ACV/TIA y muerte de 3 a 13 veces13.
La edad, pero no el sexo, es un fuerte predictor de recurrencia y muerte en el ESUS. El riesgo es de 3 a 8 veces mayor en los pacientes mayores de 80 años en comparación con los menores de 60 años, respectivamente. La distribución por edades en los ensayos en curso de ESUS puede influir potencialmente en su poder para detectar una asociación significativa de tratamiento14.
Una muestra transversal del ESUS Global Registry muestra una frecuencia elevada de detección de fibrilación auricular en todo el mundo. El rendimiento de la monitorización del ritmo cardiaco convencional de corta duración es relativamente bajo. Los pacientes con ACV asociado a fibrilación auricular fueron típicamente personas de edad avanzada (>75años) y más frecuentemente mujeres15.
Terapéutica antitrombótica en pacientes con ESUSEl estudio WARSS (Warfarin-Aspirin Recurrent Stroke Study) incluyó pacientes con ACV isquémico reciente y aleatorizó la estrategia antitrombótica en aspirina 325mg vs. warfarina a dosis bajas (media de RIN 1,9). Para el subgrupo de pacientes con ACV criptogénico (576 pacientes, 26%), el objetivo primario, que consistía en ACV isquémico recurrente o muerte, ocurrió en un 15% del grupo warfarina vs. un 16,5% del grupo aspirina durante 2 años de seguimiento (HR: 0-92; IC 95%: 0,6-1,4)16. De los 388 pacientes con diagnóstico de ACV criptogénico en quienes la tomografía computarizada mostraba topografía embólica (no lacunar, cortical o cerebelosa, o infartos en diferentes territorios vasculares) el ACV isquémico recurrente o muerte en 2 años de seguimiento fue del 12% con warfarina vs. el 18% con aspirina (HR: 0-66; IC 95%: 0,4-1,2)17. Los datos aportados por este subgrupo del WARSS apoyan el concepto de que la anticoagulación podría ser más eficaz que la aspirina en pacientes con ACV isquémico criptogénico no lacunar17,18.
Para los pacientes con riesgo cardioembólico elevado, los estudios aleatorizados demuestran que la anticoagulación reduce el riesgo embólico comparado con antiagregantes19,20. La fibrilación auricular es la causa más frecuente de ACV isquémico de origen cardiembólico, debido a su elevada prevalencia en la población general. El riesgo medio anual de ACV en pacientes con fibrilación auricular es de un 5%21. Los scores de riesgo más utilizados y recomendados son el CHADS2 y el CHADS2VASC222. El CHADS2 es útil para cuantificar el riesgo de ACV en pacientes con fibrilación auricular y riesgo de embolia y en base a ello seleccionar la terapéutica antitrombótica. Esta escala parece ser útil también en pacientes con ESUS13.
La anticoagulación con warfarina reduce la frecuencia de ACV isquémico en pacientes con disfunción ventricular izquierda sin fibrilación auricular22. Los anticoagulantes orales directos (AODS) apixabán, rivaroxabán, dabigatrán y edoxabán son igual o más eficaces que la warfarina para prevenir el riesgo de ACV isquémicos en pacientes con fibrilación auricular con un riesgo sustancialmente menor de sangrado cerebral23.
En vista del mecanismo común de tromboembolismo, es razonable la hipótesis de que la anticoagulación podría reducir el riesgo de recurrencia de ACV isquémico más eficazmente que la antiagregación en pacientes con ESUS.
En los estudios aleatorizados sobre prevención secundaria del ACV isquémico que comparan warfarina con antiagregantes en pacientes con ACV isquémico24,25, las tendencias hacia la reducción de la isquemia cerebral fueron compensadas por el aumento del sangrado tanto intracraneal como extracraneal. Los pacientes con diagnóstico de ESUS podrían beneficiarse con los anticoagulantes, dado su mecanismo embólico. Los AODS han reducido considerablemente los riesgos de hemorragia intracraneal en comparación con la anticoagulación con warfarina23. Además, el riesgo de hemorragia extracraneal con algunos de los AODS parece ser más baja que con warfarina o acenocumarol26-28.
Por lo tanto, en términos de beneficio clínico, teniendo en cuenta la combinación de ACV isquémico y hemorragia mayor (en particular hemorragia intracraneal), los AODS podrían ofrecer un beneficio neto importante en pacientes con ESUS23.
Se están realizando estudios multicéntricos que evalúan la estrategia anticoagulante con AODS vs. antiagregación con aspirina en pacientes con ACV criptogénico que cumplen con los criterios de ESUS (NAVIGATE-ESUS, RE-SPECT ESUS, ATTICUS-ESUS)29-31.
ConclusiónEl subtipo de ACV llamado ESUS constituye una nueva construcción clínica definida como ACV isquémicos embólicos (no lacunares) sin una causa cardioembólica identificada y sin una obstrucción ateromatosa sustancial de las arterias del territorio infartado.
Los estudios diagnósticos demuestran la variedad de orígenes potencialmente embolígenos que podrían causar ESUS. En el paciente individual, la asociación causal con el ACV puede ser difícil de probar, ya que en ocasiones más de una etiología está presente en el mismo individuo.
El mecanismo subyacente dominante del ESUS es la embolia de origen no establecido. No debemos considerar al ESUS como un diagnóstico de exclusión, sino un diagnóstico basado en el hallazgo imagenológico de un infarto no lacunar en ausencia de aterosclerosis oclusiva proximal o elevado riesgo de origen cardioembólico, como la fibrilación auricular o el trombo intraventricular.
Será necesario evaluar los resultados de los estudios aleatorizados en curso que comparan la anticoagulación con la antiagregación en prevención secundaria de pacientes con ESUS.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.