El grupo respiratorio ventral incluye el complejo de pre-Botzinger, que contiene neuronas fundamentales para la ritmogénesis respiratoria. La red de neuronas respiratorias del tronco cerebral recibe inputs de los quimiorreceptores centrales y periféricos, de los niveles de anhídrido carbónico y oxígeno sanguíneos y de estructuras cerebrales que controlan la respiración. La manifestación más importante de la alteración de esta red son las apneas de sueño, que son una alteración del ritmo respiratorio que frecuentemente se asocian con trastornos del control vasomotor simpático y cardiovagal. Las enfermedades neuromusculares son aquellas en las que la insuficiencia respiratoria es más frecuente. Por otra parte son más raras las alteraciones del control cardiorrespiratorio; estas pueden ser debidas a un ACV de tronco, compresión del mismo por tumores, siringobulbia, malformación de Chiari, lesiones de la médula cervical alta y atrofia multisistémica.
The ventral respiratory group includes pre-Bötzingen complex, which contains neurons critical for respiratory ritmogenesis. The network of brain stem respiratory neurons receive inputs of central and peripheral chemoreceptors, the levels of carbon dioxide and oxygen blood and brain structures that control breathing. The most important alteration of this network include sleep apnea, a breathing rhythm disorder that is frequently associated with disturbances of cardiovagal and sympathetic vasomotor control. Neuromuscular diseases are those in respiratory failure is more common. On the other hand are more rare disorders cardiorespiratory control. These may be due to a stroke of trunk, compression of the tumors, syringobulbia, Chiari malformation, cervical spinal injury high, and atrophy multistémica.
El ritmo respiratorio es generado por la acción coordinada de neuronas inspiratorias, post-inspiratorias y espiratorias, que forman parte de una red central generadora del ritmo respiratorio1–3. La generación y el mantenimiento del ritmo respiratorio normal requiere de un drive tónico mínimo, que mantiene la excitabilidad de las neuronas respiratorias. Este drive puede aumentar a través de la activación de los sistemas de alerta, o a través de los quimiorreceptores centrales o periféricos sensibles a los cambios de PaO2, PaCO2 o ambos, como así también de las aferencias de los mecanorreceptores respiratorios. La actividad coordinada de las neuronas respiratorias es importante para la respiración y ventilación, pero también para la vocalización, la deglución, la tos y el vómito.
La disfunción respiratoria, aunque es una manifestación precoz inusual en las enfermedades neurológicas, puede ocurrir en algunas enfermedades estructurales y degenerativas, tanto del sistema nervioso central como periférico, o aun en las encefaloptatías metabólicas. Lesiones neurológicas pueden afectar diferentes componentes del sistema del control respiratorio: receptores sensoriales, vías aferentes, interneuronas de tronco y promotoras, vías motoras descendentes, neuronas motoras, nervios motores, unión neuromuscular o músculos respiratorios.
En muchos casos estas lesiones dan lugar a una disfunción no sólo respiratoria, sino también del control cardiovascular. Este hecho enfatiza la interacción que hay entre el control respiratorio, cardiovagal y simpático, todos ellos integrando la llamada red cardiorrespiratoria central3,4.
El objetivo de este artículo es revisar brevemente las principales características de la red central respiratoria involucrada en el control automático de la respiración, así como las afecciones asociadas con un compromiso del control central de la respiración y exponer una síntesis de las enfermedades neuromusculares que llevan a la insuficiencia respiratoria.
Se han publicado diversos trabajos discutiendo este tema en profundidad5–8.
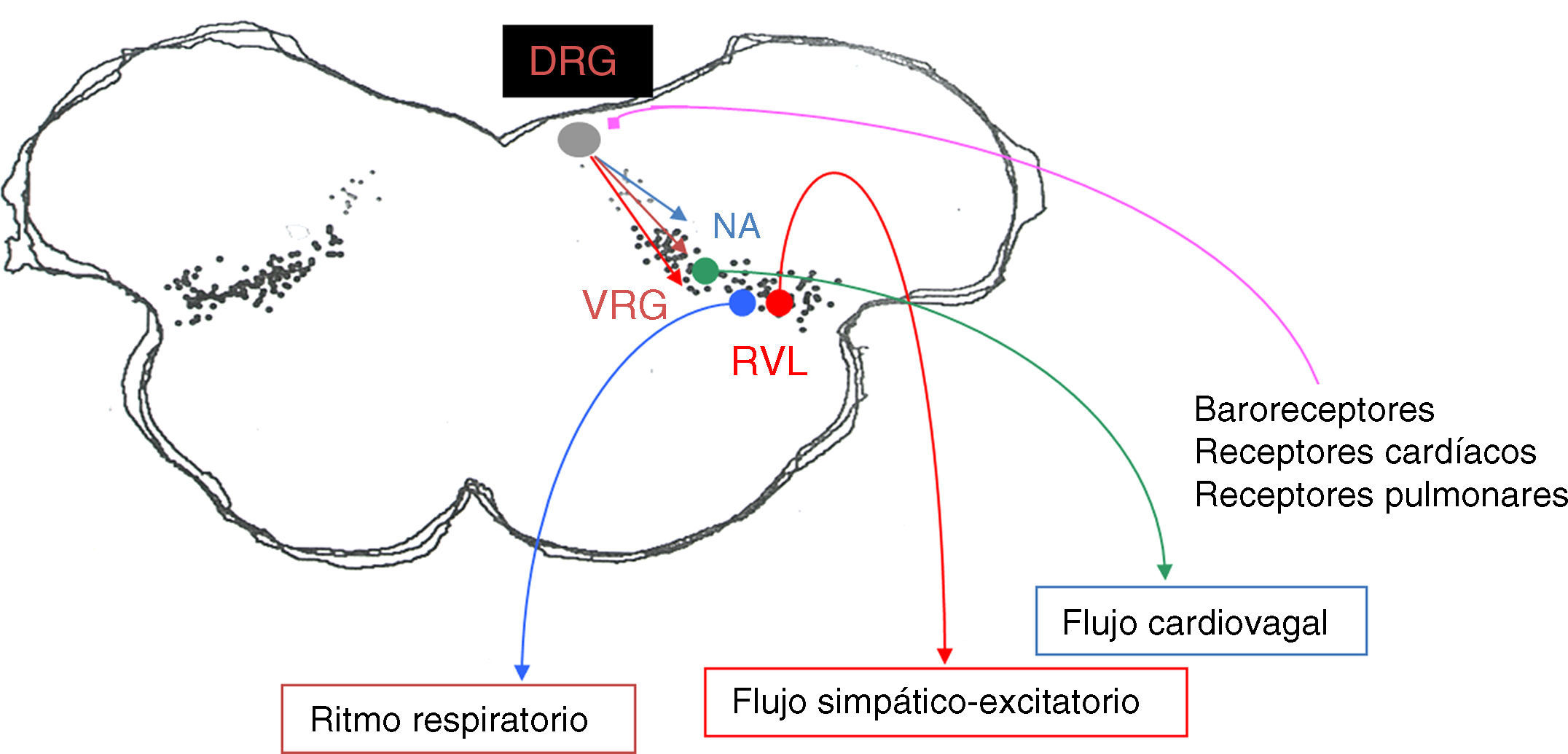
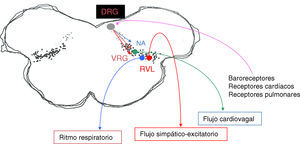
Fisiología y fisiolopatología del control de la respiraciónControl respiratorio en estructuras del tronco cerebralGrupos respiratorios del tronco cerebralLa respiración en mamíferos depende de una red neural localizada en la parte inferior del tronco cerebral encargada de controlar el ritmo respiratorio. Esta red comprende tres grupos de neuronas interconectadas entre sí: el grupo respiratorio pontino, el grupo respiratorio dorsal y los grupos respiratorios ventrales (VRG)3,4 (fig. 1).
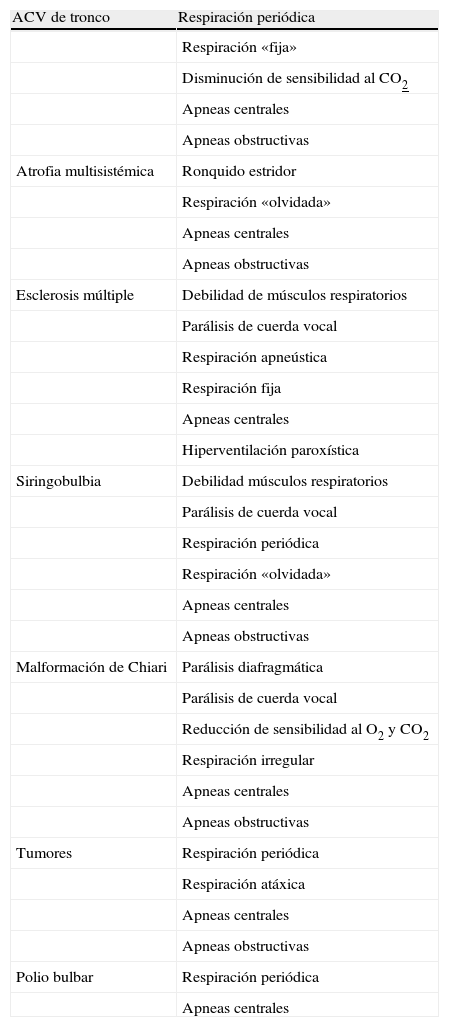
Diagrama de las principales áreas de la red cardiorrespiratoria del bulbo involucradas en la ritmogénesis respiratoria. DRG: grupo respiratorio dorsal; NA: núcleo ambiguo; RVL: región ventrolateral del bulbo; VGR: grupo respiratorio ventral. El área punteada del diagrama indica la «región intermedia» en lo que se integran los reflejos cardiovasculares y respiratorios.
El grupo respiratorio pontino incluye el complejo parabraquial/Kölliker-Fuse, localizado en la protuberancia en su región rostral, dorsolateral, que se corresponde con el centro «neumotáxico» descripto en animales experimentales y que tiene varias funciones de control de la respiración, incluyendo el timing de fase respiratoria y reflejos integrados iniciados por mecanorreceptores pulmonares. Otro componente es el núcleo parabraquial, que transmite la actividad de las neuronas respiratorias bulbares a la amígdala, el hipotálamo y otras estructuras suprapontinas.
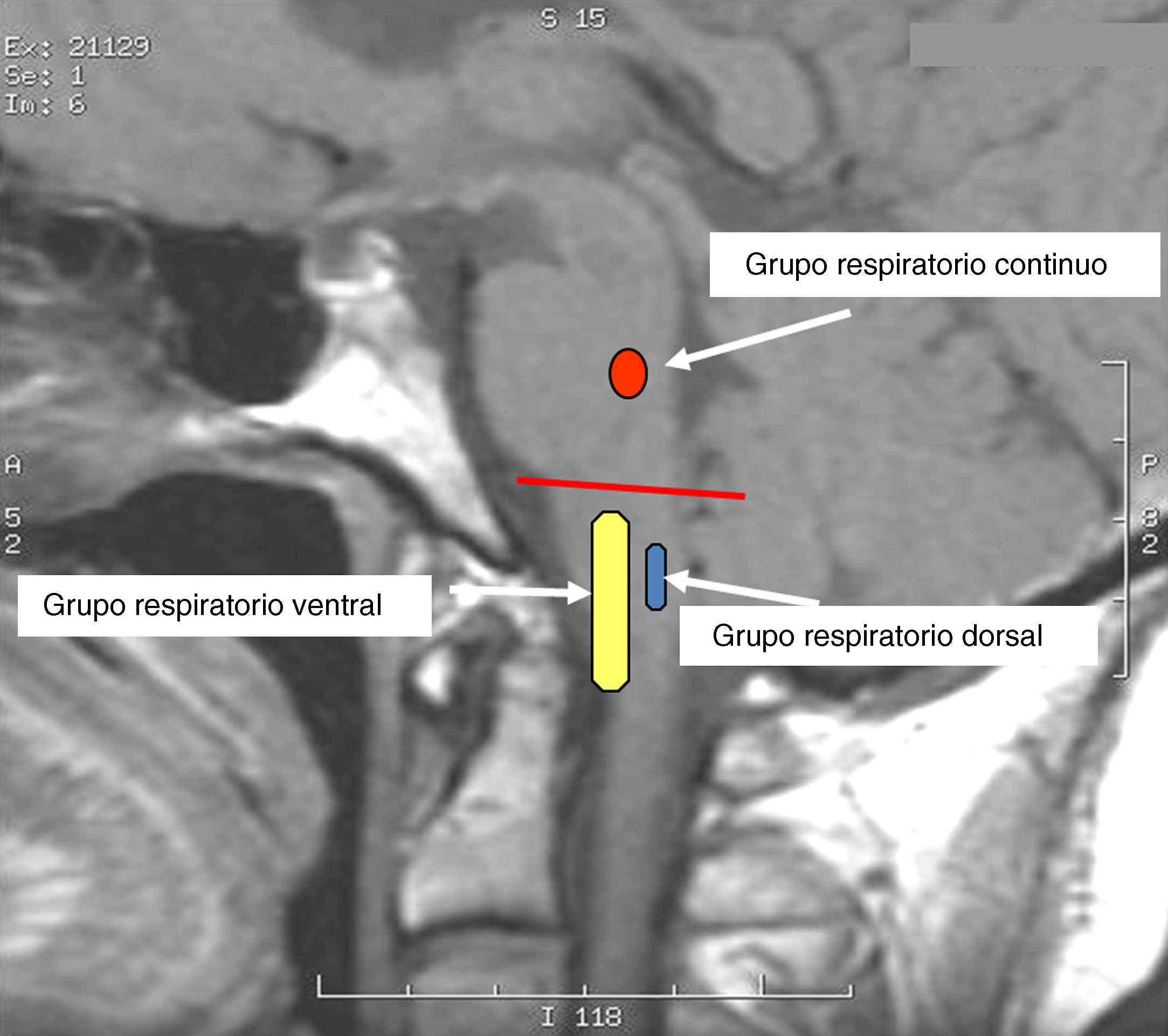
El grupo respiratorio dorsal, localizado en el núcleo del fascículo solitario (NTS), es la primera estación de relevo de los aferentes de los quimiorreceptores y mecanorreceptores periféricos4 (fig. 2). El NTS también recibe aferencias de barorreceptores, receptores cardiacos, barorreceptores arteriales, y por lo tanto constituye la primera estación de procesamiento e integración para varios reflejos respiratorios y cardiovasculares.
El VRG consiste en columnas bilaterales longitudinales de neuronas localizadas en el bulbo ventrolateral y que se extienden desde el nivel C1 de la médula cervical hasta por debajo del núcleo del facial. La porción más rostral del VRG incluye el complejo Bötzinger, que contiene neuronas espiratorias que inhiben a las neuronas inspiratorias, al VRG y a la médula espinal. El complejo pre-Bötzinger consiste de neuronas propio bulbares, que desempeñan un rol crítico en la generación del ritmo respiratorio1,3. Estas neuronas se identifican por la presencia de receptores de neuroquinina-1 (NK-1R) para la sustancia P9. Inmediatamente caudal al complejo pre-Bötzinger se encuentra el VRG rostral, localizado en posición ventral al núcleo ambiguo y que contiene neuronas bulboespinales inspiratorias. La porción más caudal del VRG corresponde al núcleo retroambigual, que se extiende desde el obex hasta el nivel C1 de la médula espinal y que contiene neuronas espiratorias bulboespinales que proyectan a motoneuronas intercostales y abdominales.
Efecto de los quimiorreceptores sobre la red respiratoria y control de la respiraciónEl control automático de la respiración depende en parte del feedback químico que producen los niveles sanguíneos de CO2 y O2. Los quimiorreceptores carotídeos, que detectan O2, proveen una excitación tónica a las neuronas respiratorias del tronco cerebral a través del NTS y son activados por la hipoxia.
Los quimiorreceptores centrales, localizados fundamentalmente en la superficie ventrolateral del bulbo2,4, son muy sensibles a los cambios de la CO2 local. Pequeños incrementos de PCO2 aumentan de forma significativa la respiración, y viceversa. Los quimiorreceptores centrales proveen una estimulación tónica a la red neuronal respiratoria, y un feedback en los niveles sanguíneos de CO2, y por lo tanto una adaptación de la ventilación a las necesidades metabólicas. Estudios experimentales indican que las neuronas glutamatérgicas localizadas inmediatamente debajo de la superficie ventral del bulbo responden no sólo a la hipercapnia, sino también a la hipoxia, proveyendo abundante input al complejo preBötzinger10. Las neuronas serotoninérgicas del núcleo del rafe caudal también son muy quimiosensitivas11, proyectándose a las motoneuronas medulares, motoneuronas del bulbo que controlan las vías respiratorias superiores y a las motoneuronas espinales respiratorias. Ellas han sido implicadas en el mecanismo de plasticidad respiratoria4. Estudios de resonancia magnética funcional12 sugieren que el núcleo arcuato, localizado en la superficie ventral del bulbo que contiene neuronas glutomatérgicas y serotoninérgicas pueden constituir el homólogo al área ventromedial sensible al CO2 descrita en animales experimentales13.
Más aún, estudios recientes sugieren que las áreas que contienen neuronas quimiosensitivas pueden tener una distribución más amplia, incluyendo no sólo la superficie bulbar ventral, sino también el VRG, el NTS, el núcleo del rafe caudal, el locus ceruleus y el núcleo fastigio. La significación funcional de esta redundancia no es fácil de explicar11.
Control cerebral de la respiraciónLas estructuras suprapontinas que incluyen la corteza cerebral, el hipotálamo, la amígdala y la sustancia periaqueductal del mesencéfalo desempeñan un rol importante en el control respiratorio normal durante el lenguaje, la locomoción y la respuesta al estrés, incluyendo la reacción de defensa, como se ha demostrado en estudios experimentales14. La tomografía por emisión de positrones (PET) y la resonancia magnética funcional han mostrado activación de las áreas motoras suplementaria, primaria motora y promotora durante periodos de aumento de la fuerza respiratoria15. Por otra parte, las neuronas del hipotálamo caudal tienen una influencia excitatoria sobre el drive respiratorio basal, son sensibles a la hipoxia y a la hipercania y pueden ser activadas durante la marcha14. La sustancia gris periacueductal recibe inputs del hipotálamo y de la amígdala, y se proyecta a los grupos respiratorios pontinos y bulbares. Estas proyecciones pueden ser importantes para el control respiratorio durante la vocalización, las respuestas emocionales y de defensa.
Vías descendentes de control de las motoneuronas respiratoriasLos axones que controlan la respiración se proyectan desde los núcleos VRG, NTS, parabraqueal/Kölliker-Fuse, descendiendo a lo largo de la sustancia blanca anterolateral de la médula espinal hacia las neuronas frénicas intercostales y de los músculos abdominales. Las vías automáticas descendentes probablemente se ubican en la formación reticular paramediana del bulbo y del tegmento pontino, y tienen una ubicación lateral en la médula espinal cervical, próximas al haz espinotalámico, mientras que las vías descendentes de control voluntario se asocian con los haces corticoespinales en el tronco cerebral y en la médula espinal cervical alta.
Manifestaciones clínicas de la afectación del control automático de la ventilaciónVarias enfermedades del sistema nervioso central pueden afectar de forma selectiva e importante núcleos y vías involucrados en el control respiratorio (tabla 1). Ellos incluyen afecciones agudas y subagudas, como el ACV o la esclerosis múltiple (MS), o trastornos crónicos, como la atrofia multisistémica (MSA) o la siringobulbia. Cuanto más aguda es la lesión, mayor es la probabilidad de desarrollar síntomas de insuficiencia respiratoria. Por el contrario, en los trastornos crónicos los síntomas son menos marcados y los pacientes pueden tolerar alteraciones aun sin contar con apoyo respiratorio.
Enfermedades neurológicas que comprometen la red neuronal cardiorrespiratoria y efectores
| Aferentes sensitivos |
| Neuropatía diabética |
| GBS |
| Porfiria |
| Malformación de Chiari |
| Impresión basilar |
| Agregados neuronales en el tronco cerebral |
| ACV |
| Esclerosis múltiple |
| Atrofia multisistémica |
| Siringobulbia |
| Loop arterial |
| Poliomielitis |
| Encefalitis40 |
| Motoneuronas espinales y vías descendentes motoras |
| Cordotomía |
| Esclerosis múltiple |
| Trauma |
| Siringomielia |
| Enfermedad de motoneurona |
| Eferentes motores |
| Polineuropatía del paciente crítico |
| Neuropatía motora multifocal |
| Neuralgia amiotrófica |
| Síndrome de POEMS |
| Transmisión neuromuscular |
| Botulismo |
| Miastenia gravis |
| Síndrome de Lambert-Eaton |
| Drogas |
| Músculo |
| Distrofia miotónica |
| Deficiencia de maltasa ácida |
| Distrofia muscular de Duchenne |
| Polimiositis |
Las lesiones que afectan al grupo respiratorio pontino, NTS, VRG o a los quimiorreceptores centrales se pueden manifestar con hipoventilación alveolar central (síndrome de Ondine), un ritmo respiratorio anormal o ambos (tabla 2). El síndrome de hipoventilación alveolar central incluye cefaleas matutinas repetidas, disrupción del sueño nocturno, cansancio diario y somnolencia. Otro síntoma puede ser la cianosis, un patrón irregular de la respiración durante el sueño o la vigilia o la ausencia de disnea durante el ejercicio. El diagnóstico se confirma demostrando una respuesta ventilatoria anormal a la hipercapnia provocada, con una respuesta normal o casi normal a la hipoxia en ausencia de infección, enfermedad cardíaca, pulmonar o neuromuscular. La polisomnografía con monitorización de gases sanguíneos demuestra de forma característica hipercapnia y apneas centrales, más prevalentes durante el sueño no lento (no-REM), y menos aún en el REM o la vigilia.
Alteraciones respiratorias en lesiones bulbares
| ACV de tronco | Respiración periódica |
| Respiración «fija» | |
| Disminución de sensibilidad al CO2 | |
| Apneas centrales | |
| Apneas obstructivas | |
| Atrofia multisistémica | Ronquido estridor |
| Respiración «olvidada» | |
| Apneas centrales | |
| Apneas obstructivas | |
| Esclerosis múltiple | Debilidad de músculos respiratorios |
| Parálisis de cuerda vocal | |
| Respiración apneústica | |
| Respiración fija | |
| Apneas centrales | |
| Hiperventilación paroxística | |
| Siringobulbia | Debilidad músculos respiratorios |
| Parálisis de cuerda vocal | |
| Respiración periódica | |
| Respiración «olvidada» | |
| Apneas centrales | |
| Apneas obstructivas | |
| Malformación de Chiari | Parálisis diafragmática |
| Parálisis de cuerda vocal | |
| Reducción de sensibilidad al O2 y CO2 | |
| Respiración irregular | |
| Apneas centrales | |
| Apneas obstructivas | |
| Tumores | Respiración periódica |
| Respiración atáxica | |
| Apneas centrales | |
| Apneas obstructivas | |
| Polio bulbar | Respiración periódica |
| Apneas centrales |
CSA: apneas de sueño centrales; OSA: apneas de sueño obstructivas; respiración apneústica: inspiración prolongada, profunda, con incapacidad para espirar, de segundos de duración; respiración fija: incapacidad de iniciar cualquier tipo de movimiento respiratorio volitivo; respiración «olvidada»: apneas prolongadas durante la vigilia; respiración periódica: inspiraciones irregulares seguidas de periodos de apnea.
Posiblemente la alteración clínica más común de la alteración del control respiratorio es la interrupción temporaria central del drive respiratorio que puede seguir a una convulsión generalizada16. Tanto las convulsiones generalizadas como las parciales complejas pueden asociarse a cambios en la respiración y el ritmo cardíaco. De particular importancia es la bradicardia mediada por el vago durante la apnea que sigue a una convulsión, constituyendo un reflejo cardiorrespiratorio que puede aumentar el riesgo de paro cardíaco en una situación en la que la respiración del paciente está deprimida17. Puede haber bradiarritmias potenciadas por reflejos cardiorrespiratorios disparadas por apneas, hipoxia o ambas. Esto puede ser un importante mecanismo de muerte inesperada súbita en la epilepsia, y suele ser más común en pacientes jóvenes, quienes normalmente tienen un tono vagal incrementado.
Trastornos centrales que afectan la ventilaciónVarias enfermedades focales estructurales y neurodegenerativas que afectan el tronco cerebral se pueden manifestar con un deficiente control de la ventilación18 (tabla 2). Estas alteraciones frecuentemente se asocian con un defectuoso control cardiovascular, enfatizando la interacción que hay entre las redes de control respiratorio, cardiovagal y simpático vasomotor.
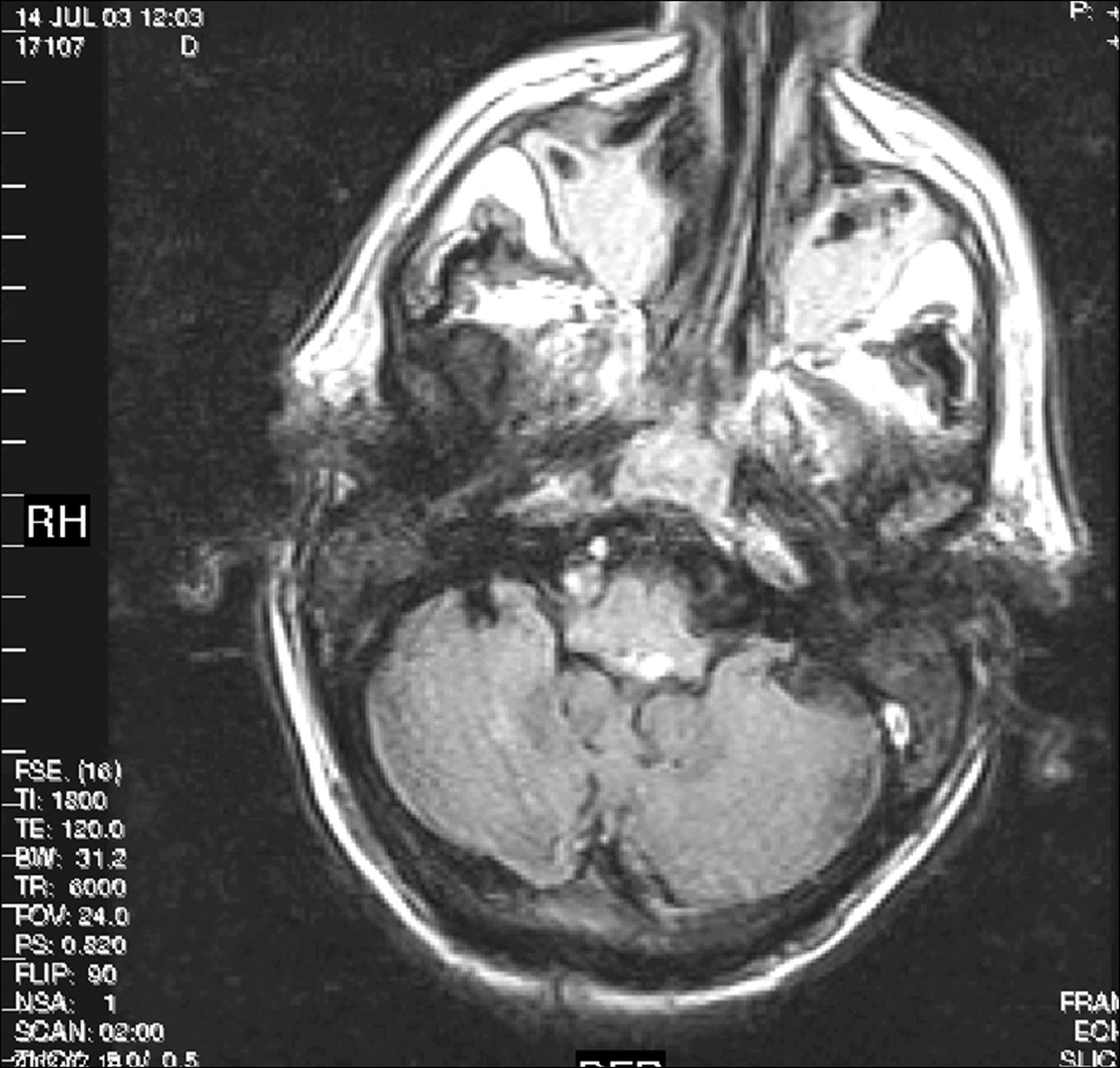
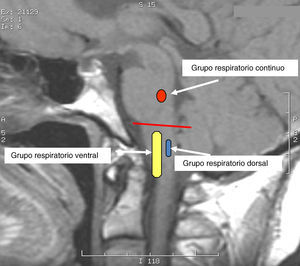
Lesiones estructuralesACVLos infartos bulbares bilaterales dan lugar a la destrucción de las pirámides y de las vías corticoespinales, afectando la respiración voluntaria pero no la automática. Por el contrario, aquellas que afectan al tegmento bulbar producen fallos de la respiración automática, una defectuosa respuesta ventilatoria al CO2 y apneas de sueño, respetando la respiración voluntaria durante la vigilia19 (fig. 3). Aun las lesiones unilaterales del segmento bulbar ventrolateral, que comprometen el NTS, VRG o sus conexiones, pueden producir una defectuosa respiración automática y apneas de sueño, ocasionalmente pueden afectar la respiración voluntaria, incluso cuando se respete la forma completa de los haces corticoespinales20. Las lesiones unilaterales del bulbo lateral, incluyendo el VRG, como ocurre en el síndrome de Wallenberg, dan lugar a un aplanamiento de las respuestas ventilatorias de CO221; los infartos laterales del bulbo también pueden dar lugar a un síndrome de apneas de sueño, particularmente cuando hay otros factores predisponentes, como una úvula grande o desviación del tabique nasal. Otra alteración de la respiración que frecuentemente se observa en el ACV isquémico que compromete el tronco cerebral es la respiración del Cheyne-Stokes, de forma característica acompañando a los infartos bilaterales de los hemisferios cerebrales22.
Por otra parte, la alteración de la función respiratoria parecería que puede incrementar el riesgo de daño isquémico al cerebro, por ejemplo las lesiones isquémicas de sustancia blanca y los infartos lacunares en pacientes de edad avanzada podrían ocurrir en relación con una disfunción respiratoria23.
Enfermedades desmielinizantesLas MS y la enfermedad de Devic o neuromielitis óptica pueden producir una insuficiencia respiratoria, en general en presencia de lesiones grandes que comprometen la médula cervical o el bulbo. Una mielitis transversa a nivel cervical alto puede dar lugar a una «respiración automática» con pérdida de la capacidad de iniciar movimientos respiratorios voluntarios debido a un compromiso bilateral de los haces corticoespinales24. Por el contrario, la desmielinización de la región ventrolateral de la médula espinal cervical puede dar lugar a una pérdida de la respiración automática25. Asimismo, las lesiones de la región dorsolateral del bulbo producen alteración de la respiración automática, asociadas a trastornos deglutorios y de la tos, por lo tanto con un aumento del riesgo de neumonía aspirativa. Las lesiones de la región dorsolateral de la protuberancia pueden dar lugar a una respiración apneústica, y las del mesencéfalo a una hiperventilación paroxística central. En los estadios terminales de la MS es frecuente la neumonía aspirativa debida al compromiso bulbar26,27.
Siringomielia y siringobulbiaLas alteraciones respiratorias en la siringomielia se deben en general a debilidad muscular por daño de las neuronas motoras espinales causadas por la cavidad. Más raramente, hay compresión de las vías espinales en la médula espinal, ya sea descendentes o ascendentes, por la cavidad o la malformación de Chiari I, dando lugar a apneas de sueño centrales28. En la siringobulbia las hendiduras tienen una tendencia a localizarse en la región dorsolateral del bulbo caudal, extendiéndose en dirección ventrolateal desde el piso del IV ventrículo. Los núcleos ambiguo y del fascículo solitario se afectan frecuentemente, dando lugar a disfagia y disfonía, alteraciones cardiovasculares y respiratorias. Estas lesiones afectan neuronas del DRG, VRG o ambos, y sus interconexiones a nivel de la formación reticular intermedia del bulbo (fig. 2). El compromiso del núcleo ambiguo puede explicar también la frecuente presencia de apneas obstructivas29.
La malformación de Chiari también puede acompañarse de apneas en la infancia30 y apneas obstructivas, a veces acompañadas de severos cambios de la presión arterial31,32.
Traumatismos medularesLas lesiones medulares superiores a C5 van a causar insuficiencia respiratoria inmediata debido a la interrupción de las fibras bulboespinales. Inclusive lesiones medulares más bajas, a nivel C6 o C7, pueden, a pesar de haber una función diafragmática conservada, comprometer la respiración debido al compromiso de músculos accesorios e intercostales.
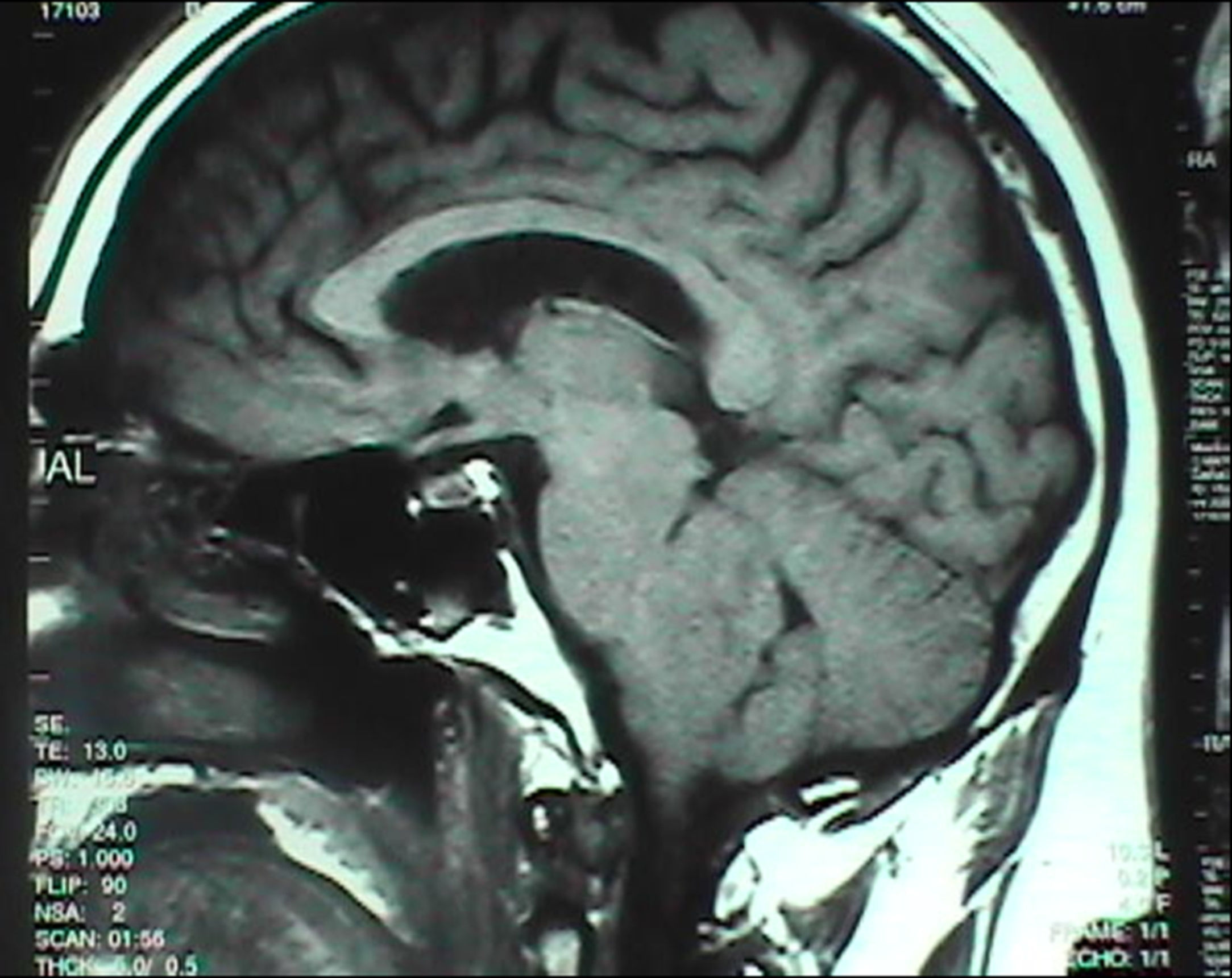
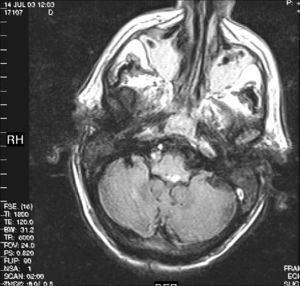
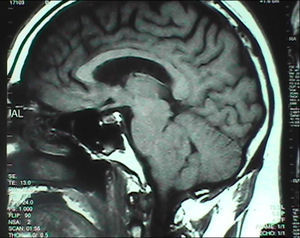
Otras lesiones que afectan la respiración automáticaLos tumores de tronco, como el ganglioglioma, el medulobastoma33, la metástasis medular34, el astrocitoma y el linfoma pueden producir hiperventilación neurogénica central35. Las manifestaciones respiratorias pueden ser el síntoma de presentación del tumor y pueden solucionarse después de su resección36 (fig. 4). La alteración de la respiración puede ser la manifestación inicial de la esclerosis tuberosa37 y puede complicar el síndrome de Möbius38.
Resonancia magnética de un hombre de 65 años de edad con diplopía e inestabilidad de la marcha de un año de evolución. Horas después de la resección del tumor del IV ventrículo (ependimoma) el paciente presenta una respiración irregular, apneas centrales y paro respiratorio. El paciente tiene una buena recuperación después de ser tratado con asistencia respiratoria mecánica durante un par de semanas.
También las alteraciones de la respiración son típicas de la enfermedad de Leigh y consisten en hiperventilación periódica, apneas y respiración irregular, incluyendo muerte debida a insuficiencia respiratoria39-40.
Trastornos neurodegenerativosAtrofia multisistémicaLa MSA puede manifestarse con una amplia variedad de trastornos respiratorios, incluyendo estridor laríngeo, OSA, hipoventilación nocturna, apneas centrales y disritmia respiratoria41–47.
Si no se tratan estas alteraciones pueden dar lugar a muerte súbita durante el sueño. El estridor laríngeo se debería a parálisis de los músculos abductores, o actividad tónica sostenida de los aductores de las cuerdas vocales48–52.
Las apneas centrales en general son manifestaciones tardías de la enfermedad53.
La hipoventilación alveolar y las apneas centrales pueden ser una manifestación de un compromiso ventilatorio quimiosensitivo54,55.
La hipoventilación alveolar central y las alteraciones del ritmo respiratorio seguramente reflejan compromiso de las áreas quimiosensitivas y los generadores del ritmo respiratorio, principalmente neuronas glutamatérgicas y serotoninérgicas en la región ventrolateral del bulbo56 y en el complejo pre-Botzinger41.
Enfermedad de ParkinsonLas alteraciones respiratorias son comunes en la enfermedad de Parkinson avanzado, y la neumonía aspirativa es una causa frecuente de muerte57,58. Puede ocurrir un estridor laríngeo nocturno en enfermedad de Parkinson, aunque es más raro que en la atrofia multisistémica, y en general se asocia a disfagia severa.
Parkinsonismo, depresión, pérdida de peso e hipoventilación central (síndrome de Perry)El síndrome de Perry es un trastorno autosómico dominante con hipoventilación alveolar central como la manifestación más importante59–62.
Trastornos del desarrolloSíndrome de muerte súbita del recién nacidoHay evidencia neuropatológica de compromiso de la red neuronal serotoninérgica bulbar en el síndrome de muerte súbita. Estas alteraciones son más comunes en varones63.
Síndrome de hipoventilación central congénitaEl síndrome de hipoventilación central congénita se manifiesta en el recién nacido con hipoventilación alveolar con alteración a las repuestas a la hipoxia y a la hipercapnia64. Se puede asociar a la enfermedad de Hirschsprung y a los tumores de la cresta neural, tales como el neuroblastoma.
Disautonomía familiarLa disautonomía familiar (síndrome de Riley-Day o neuropatía hereditaria sensitiva-autosómica tipo III) tiene como síntomas fundamentales o cardinales la alacrima, ausencia de papilas fungiformes en la lengua, disminución de reflejos osteotendinosos y un test de histamina anormal65. Estos hallazgos, en un individuo de origen judío asquenazí, es suficiente para hacer el diagnóstico. Hay tres factores potenciales que pueden afectar la función respiratoria y contribuir a un aumento de la morbilidad y mortalidad en individuos con disautonomía familiar:
- 1.
Enfermedad pulmonar crónica debida a aspiraciones recurrentes.
- 2.
Enfermedad pulmonar restrictiva por la escoliosis y la debilidad muscular.
- 3.
Disfunción quimiosensitiva con alteración de la respuesta a la hipoxia y a la hipocapnia.
Los pacientes no pueden adaptarse a situaciones de hipoxia o hipocapnia, aumentando el volumen minuto, y esto se manifiesta en altas alturas, en viajes en avión o durante una neumonía intercurrente66. Lo mismo ocurre con la natación, debajo del agua. Estos hechos y situaciones dan lugar a saturación de oxígeno y acidosis respiratoria y pueden llevar a una hipotensión y bradicardia severa; pueden resultar en síncope e inclusive en paro respiratorio66.
ConclusionesLas alteraciones respiratorias tienen un gran impacto en la calidad de vida de muchos enfermos neurológicos. El diagnóstico de disfunción respiratoria resultante de enfermedades neurológicas requiere de un alto nivel de sospecha clínica y de la aplicación de pruebas específicas, dado que la falta de movilidad en muchas enfermedades neurológicas a menudo oscurece los síntomas usuales.
El estudio de la respiración automática se justifica en pacientes con lesiones que pueden afectar la red de control respiratorio bulbar y pontino. Las alteraciones respiratorias descritas pueden tener un efecto deletéreo en la enfermedad neurológica. Por ejemplo, en pacientes con un accidente cerebrovascular de tronco la hipoxemia resultante de la alteración de la respiración automática y la alteración asociada de la reactividad cerebrovascular a la hipercapnia pueden contribuir a la extensión del daño isquémico. Asimismo, en la siringobulbia un aumento en la presión intracraneana, que ocurre episódicamente durante las apneas obstructivas, puede contribuir a cambios hidrodinámicos que favorezcan el crecimiento de la cavidad.
El gold standard para el estudio de las alteraciones respiratorias asociadas al sueño es la polisomnografía. La respiración automática puede ser evaluada a través de la respuesta ventilatoria al CO2 y a la hipoxia provocada. Asimismo, las presiones bucales al 0,1 segundos después del comienzo de la inspiración (P 0,1), durante el rebreathing de CO2, pueden ser de gran utilidad.
El tratamiento con sistemas de presión positiva continua durante el sueño mejora la sensibilidad respiratoria al CO2 y la eficiencia del sueño, reduce la hipersomnolencia diurna y las fatigas asociadas con apneas de sueño, disminuye los niveles de las oscilaciones de presión arterial asociadas con las apneas y el riesgo de muerte súbita en estas enfermedades67.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.