Estudios previos sugieren que polimorfismos del gen CD24 tendrían un rol importante en el riesgo de desarrollo y progresión de esclerosis múltiple (EM). Objetivos: Investigar la asociación entre los polimorfismos P226 (T/C), P1056 (A/G), P1527 (TG/del) y P1626 (A/G) del gen CD24 y EM, comparando las frecuencias alélicas y genotípicas de pacientes versus controles.
Materiales y métodosSe estudiaron 102 pacientes con EM y 205 individuos sanos no relacionados. Se extrajo ADN a partir de sangre periférica, se amplificaron las regiones polimórficas por PCR anidada. Las mismas fueron genotipificadas partir de los fragmentos obtenidos mediante enzimas de restricción. El tiempo desde el inicio de la enfermedad hasta llegar a EDSS 6 y hasta alcanzar la fase secundaria progresiva (SP) fueron utilizados como variable de sobrevida. Se usó el test log rank para la comparación de los datos (p significativa menor a 0,05).
ResultadosNo se encontraron diferencias en las frecuencias alélicas o genotípicas en los polimorfismos del gen CD24 entre casos y controles. Un 44,6% de los pacientes con el genotipo AA (P1626) alcanzaron un EDSS de 6 vs 16% de los pacientes portadores de otros genotipos (p<0,001; HR: 3,2; IC 95%: 1,4 a 7,4). Un 45,8% de los pacientes con el genotipo AA llegó a SP vs 16,7% sin el mismo (p<0,001; HR: 3,4; IC 95%: 1,5 a 7,8).
ConclusionesEste estudio evidenció una fuerte asociación entre la presencia del genotipo AA en el polimorfismo 1626 del gen CD24 y el riesgo de progresión de EM.
Previous reports have shown that CD24 gene polymorphisms have an important role in the risk of development and progression of multiple sclerosis (MS). Objetivos: To investigate the association between P226 polymorphisms (T/C), P1056 (A/G), P1527 (TG/of) and P1626 (A/G) of the CD24 gene and MS, comparing allele and genotype frequencies of patients versus controls.
Materials and methodsWe analyzed 102 patients with MS and 205 unrelated healthy individuals. DNA was extracted from peripheral blood; and polymorphic regions were amplified by nested PCR. Genotyping was performed by restriction fragments length polymorphisms. Time from disease onset to reach EDSS 6 and time to conversion to the secondary progressive phase (SP) were used as variables of survival. We used the log Rank test for comparison of data (significant p ≤ than 0.05).
ResultsWe found no differences between cases and controls in the frequency of polymorphisms at CD24 gene. 44.6% of patients with the AA genotype (P1626) reached an EDSS of 6 vs 16% of patients with other genotypes (p<0.001; HR: 3,2, 95% CI: 1.4 to 7.4). 45.8% of patients with the AA genotype reached SPMS vs 16.7% without this genotype (p<0.001; HR: 3.4; 95% CI: 1.5 to 7.8).
ConclusionsThis study showed a strong association between the presence of AA genotype in the 1626 polymorphism of the CD24 gene and the risk of disease progression in MS patients.
La esclerosis múltiple (EM) es una enfermedad inflamatoria desmielinizante que afecta al SNC. Los datos disponibles respecto a las causas de la enfermedad sugieren una etiología multifactorial, incluyendo tanto factores genéticos como factores ambientales1,2.
En cuanto a los factores genéticos el locus que ha sido asociado con el riesgo de desarrollar la enfermedad es el HLA de clase II, haplotipo DR2 (DRB1 * 15, DQA1 * 01 de DQB1 * 06)3,4. En trabajos previos se han mencionado otros genes que pueden desempeñar un papel en la patogénesis de la enfermedad, dentro de los que se incluyen los genes de los receptores de IL2 e IL7, así como el gen CD245–7.
El gen CD24 mapea en la banda 21 del brazo largo del cromosoma 6 (6q21)8. Este gen codifica una glucoproteína de anclaje de 32 aminoácidos localizada en la superficie de linfocitos T y B activados, macrófagos y células dendríticas7,9,10.
Evidencias directas del rol de este gen en las enfermedades desmielinizantes han mostrado que la proteína CD24 es necesaria para el desarrollo del modelo experimental de EM, la encefalitis experimental autoinmune (EAE)8,11–14. Recientemente se publicaron estudios realizados en América del Norte y Europa que investigan la relación que existiría entre los polimorfismos del gen CD24 y el riesgo de desarrollar EM, así como la capacidad del gen de actuar como modificador del curso clínico de la enfermedad5,11,13. Sin embargo, no hay estudios sobre dichas asociaciones en poblaciones de América del Sur, donde los factores ambientales y genéticos son diferentes.
El objetivo del presente estudio fue investigar la asociación de 4 polimorfismos del gen CD24 en pacientes con EM, en comparación con un grupo de controles sanos en Buenos Aires, Argentina, con el fin de identificar el rol de los polimorfismos del gen CD24 en el riesgo de desarrollar EM, así como su posible implicación sobre la progresión de la enfermedad en los pacientes afectados.
MétodosPacientesEl estudio fue aprobado por el Comité de Ética del Hospital Italiano de Buenos Aires (HIBA), Argentina; todas las muestras se obtuvieron posteriormente a la firma (casos y controles) del consentimiento informado. Los pacientes fueron seleccionados de la sección de EM HIBA. Se incluyeron en el presente trabajo los pacientes con diagnóstico de certeza de EM en forma brotes y remisiones, definidos por criterios clínicos o de laboratorio propuestos por Poser et al14, y que tuvieran por lo menos 8 años de seguimiento desde el inicio de la enfermedad. Todos los pacientes fueron examinados al menos por uno de los autores con experiencia en EM.
Se registraron por un especialista en EM las variables demográficas, clínicas, la escala de discapacidad EDSS (Expanded Disability Status Scale) durante el curso de la enfermedad año tras año. Las variables «tiempo desde el inicio de la enfermedad» (momento de aparición de los primeros síntomas compatibles) hasta llegar a EDSS 6 (momento en que los pacientes requirieron ayuda unilateral para caminar) y «tiempo de conversión a la fase secundaria progresiva (SP) de la enfermedad» (definida como una progresión sostenida de la discapacidad, con o sin superposición de recaídas y remisiones menores) se utilizaron como variables de sobrevida para el análisis.
Se utilizaron como grupo control individuos sanos no relacionados, provenientes del banco de ADN del Hospital Italiano de Buenos Aires, emparejados por edad y sexo a los casos identificados.
Análisis de los polimorfismosEl ADN genómico fue aislado a partir de leucocitos de sangre periférica (PBL), mediante la utilización del QIAamp Minikit (Qiagen, http://www.qiagen.com). Se realizó el análisis de los polimorfismos en la región 3 ‘UTR del gen CD24 mediante PCR; las variables polimórficas fueron determinadas por la técnica de PCR-RFLP (del inglés Restriction Fragment Length Polymorphisms) y confirmadas por secuenciación directa del ADN7. Debido a la identificación en el genoma humano de pseudogenes del gen CD249, el locus funcional del gen CD24 fue amplificado de forma selectiva por PCR anidada en el cromosoma 6. La primera amplificación por PCR abarca desde el intrón 1 hasta el final del exón 2, por medio de un cebador sentido (5′-CTA AAG AGA ACC ATG TTG GTG GGT TGA G-3′) y un cebador anti-sentido (5′-CAC AGT AGC TTC AAA ACT CGA GTT-3′). Las condiciones de PCR fueron las siguientes: 94°C durante 30 segundos, 55°C por 30 segundos, y 68°C durante 2 minutos por 20 ciclos. El producto de PCR obtenido fue de 2.017 pb de longitud. La segunda amplificación por PCR se basa en cada sitio polimórfico de acuerdo a las siguientes condiciones: amplificación del polimorfismo 1056 A/G (P1056) con cebador sentido (5′-TCC GGC ATT TAT CTG TTT CAC-3’) y cebador anti-sentido (5′-AAT CTA CCC CCA CCA GAT AGC A -3′); polimorfismo 1527 TG/del (P1527) con cebador sentido (5′-GCA ATT TTG CCT TCA AAA CAG-3′) y cebador anti-sentido (5′-AGG TTT CTT AGG AGG CAC TTC-3′); polimorfismo 1626 A/G (P1626) con cebador sentido (5′-CAA CTA TGG ATC AGA ATA ACG ACA AT-3′) y cebador anti-sentido (5′-GGAACATCTAAGCATCAGTGTGTG-3′), las condiciones para la realización de las 3 PCR fueron las siguientes: 94°C durante 30 segundos, 58°C por 30 segundos y 72°C durante 30 segundos por 35 ciclos7. Los productos de PCR fueron digeridos con las siguientes enzimas de restricción, BstUI a 60°C (P1056); BsrI a 65°C (P1527); MfeI a 37°C (P1626). Los productos de restricción se sometieron a electroforesis en geles de agarosa al 3%. Cuando los sitios de restricción se encontraban presentes para las enzimas antes mencionadas los genotipos se designaron como «G», «TG», o «G» y cuando se encontraban ausentes «A», «del» o «A» respectivamente. Se confirmaron los resultados obtenidos por RFLP mediante secuenciación directa de diferentes muestras correspondientes a cada genotipo7.
El polimorfismo 226 (P226) es un SNP (del inglés single nucleotide polymorphism) previamente reportado que implica el reemplazo de una C por una T en el exón 2 del gen CD24, resultando en una sustitución de una alanina en la posición 57 de la proteína por una valina11. Se amplificó la región polimórfica por PCR utilizando un cebador sentido (5¿-TTG TTG CCA CTT GGC ATT TTT GAG GC-3¿) y cebador anti-sentido (5¿-GGA TTG GGT TTA GAA GAT GGG GAA A-3¿). Las condiciones de la PCR fueron las siguientes: 94°C durante un minuto, 56,5°C por un minuto y 72°C por un minuto durante 35 ciclos. Los productos de PCR fueron digeridos durante 4 horas por medio de la utilización de BstXI, posteriormente se resolvieron en geles de agarosa al 3%. La enzima de restricción corta en las muestras que poseen la variable alélica T11.
Análisis estadísticoLos datos obtenidos fueron almacenados y analizados en el software STATA 9.1.
Los datos continuos se reportaron a través de sus medias con desviación estándar y los datos categóricos a través de los porcentajes. La comparación entre datos categóricos se realizó a través de test de Chi cuadrado, mientras que la comparación entre datos continuos se hizo a través de test de «t» o del método Mann-Whitney, dependiendo de si demostraban normalidad o no en la distribución de la muestra, respectivamente. Para establecer la comparación entre los grupos respecto a las variables de sobrevida se utilizó el test de log-rank. La diferencia fue considerada estadísticamente significativa para un valor de p<0,05.
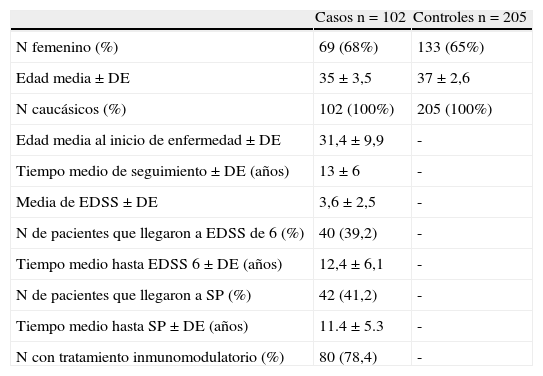
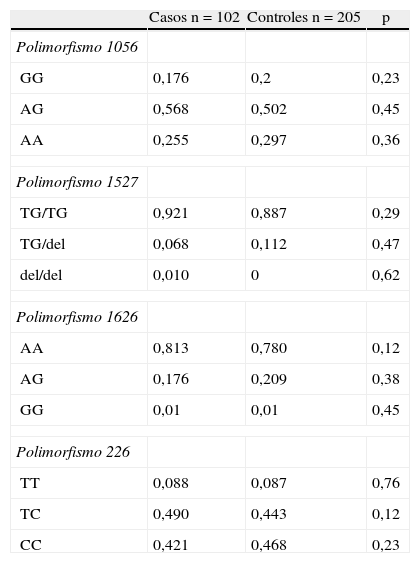
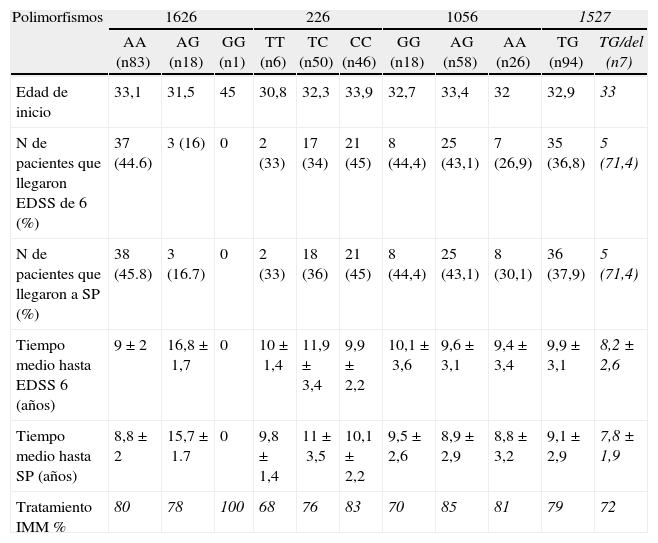
ResultadosSe incluyeron en el estudio 102 pacientes con EM en brotes y remisiones y 205 controles sanos emparejados por edad y sexo. La tabla 1 muestra las características clínicas y demográficas de los casos y controles. La distribución genotípica de estos polimorfismos se encontró en equilibrio de Hardy-Weinberg. No se observaron diferencias en las frecuencias de las variables polimórficas al comparar los resultados obtenidos en los casos y controles (tabla 2). En la tabla 3 se describe la distribución de las variables clínicas, incluyendo los resultados de sobrevida, en relación con las variables genotípicas de cada polimorfismo del gen CD24.
Características de los pacientes con EM y de los controles
| Casos n=102 | Controles n=205 | |
| N femenino (%) | 69 (68%) | 133 (65%) |
| Edad media±DE | 35±3,5 | 37±2,6 |
| N caucásicos (%) | 102 (100%) | 205 (100%) |
| Edad media al inicio de enfermedad±DE | 31,4±9,9 | - |
| Tiempo medio de seguimiento±DE (años) | 13±6 | - |
| Media de EDSS±DE | 3,6±2,5 | - |
| N de pacientes que llegaron a EDSS de 6 (%) | 40 (39,2) | - |
| Tiempo medio hasta EDSS 6±DE (años) | 12,4±6,1 | - |
| N de pacientes que llegaron a SP (%) | 42 (41,2) | - |
| Tiempo medio hasta SP±DE (años) | 11.4±5.3 | - |
| N con tratamiento inmunomodulatorio (%) | 80 (78,4) | - |
DE: desviación estándar; EDSS: Expanded Disability Status Scale; SP: secundaria progresiva.
Frecuencias genotípicas en pacientes y controles
| Casos n=102 | Controles n=205 | p | |
| Polimorfismo 1056 | |||
| GG | 0,176 | 0,2 | 0,23 |
| AG | 0,568 | 0,502 | 0,45 |
| AA | 0,255 | 0,297 | 0,36 |
| Polimorfismo 1527 | |||
| TG/TG | 0,921 | 0,887 | 0,29 |
| TG/del | 0,068 | 0,112 | 0,47 |
| del/del | 0,010 | 0 | 0,62 |
| Polimorfismo 1626 | |||
| AA | 0,813 | 0,780 | 0,12 |
| AG | 0,176 | 0,209 | 0,38 |
| GG | 0,01 | 0,01 | 0,45 |
| Polimorfismo 226 | |||
| TT | 0,088 | 0,087 | 0,76 |
| TC | 0,490 | 0,443 | 0,12 |
| CC | 0,421 | 0,468 | 0,23 |
Distribución estratificada de las variables clínicas y los polimorfismos de CD24
| Polimorfismos | 1626 | 226 | 1056 | 1527 | |||||||
| AA (n83) | AG (n18) | GG (n1) | TT (n6) | TC (n50) | CC (n46) | GG (n18) | AG (n58) | AA (n26) | TG (n94) | TG/del (n7) | |
| Edad de inicio | 33,1 | 31,5 | 45 | 30,8 | 32,3 | 33,9 | 32,7 | 33,4 | 32 | 32,9 | 33 |
| N de pacientes que llegaron EDSS de 6 (%) | 37 (44.6) | 3 (16) | 0 | 2 (33) | 17 (34) | 21 (45) | 8 (44,4) | 25 (43,1) | 7 (26,9) | 35 (36,8) | 5 (71,4) |
| N de pacientes que llegaron a SP (%) | 38 (45.8) | 3 (16.7) | 0 | 2 (33) | 18 (36) | 21 (45) | 8 (44,4) | 25 (43,1) | 8 (30,1) | 36 (37,9) | 5 (71,4) |
| Tiempo medio hasta EDSS 6 (años) | 9±2 | 16,8±1,7 | 0 | 10±1,4 | 11,9±3,4 | 9,9±2,2 | 10,1±3,6 | 9,6±3,1 | 9,4±3,4 | 9,9±3,1 | 8,2±2,6 |
| Tiempo medio hasta SP (años) | 8,8±2 | 15,7±1.7 | 0 | 9,8±1,4 | 11±3,5 | 10,1±2,2 | 9,5±2,6 | 8,9±2,9 | 8,8±3,2 | 9,1±2,9 | 7,8±1,9 |
| Tratamiento IMM % | 80 | 78 | 100 | 68 | 76 | 83 | 70 | 85 | 81 | 79 | 72 |
EDSS: Expanded Disability Status Scale; SP: secundaria progresiva.
Respecto a la progresión de la enfermedad, de los 83 pacientes con el genotipo AA para el polimorfismo 1626 del gen CD24, el 44,6% alcanzaron un EDSS de 6 durante el seguimiento frente al 16% de los pacientes con los genotipos AG o GG (p<0,001; HR: 3,2; IC 95%: 1,4 a 7,4). El 45,8% de los pacientes con el genotipo AA se convirtió a la fase SP de la enfermedad, mientras que el 16,7% de los pacientes con los otros dos genotipos llegaron a la misma fase (p<0,001; HR: 3,4; IC 95%: 1,5 a 7,8) (tabla 3) considerando la ausencia de diferencias en el tiempo de seguimiento entre los grupos comparados. El tiempo en alcanzar un EDSS de 6 en los pacientes con el genotipo AA (P1626) fue significativamente menor comparado con los pacientes que presentaron un genotipo AG o GG (9,2 vs 16,8 años, p<0,001), así como el tiempo en alcanzar la fase SP de la enfermedad (8,8 vs 15,7, p<0,001) (tabla 3). Los otros polimorfismos evaluados no mostraron diferencias en la progresión de la enfermedad en pacientes con EM.
DiscusiónEste es el primer estudio realizado en una población de América del Sur que evalúa si las variables alélicas de los polimorfismos del gen CD24 se heredaron de forma diferencial en pacientes con EM en comparación con controles sanos. No se encontró asociación en la frecuencia genotípica de los polimorfismos del gen CD24 entre casos y controles.
En un estudio previo realizado en América del Norte se observó que una deleción dinucleotídica en el polimorfismo 1527 en el gen CD24 confiere protección contra el riesgo de desarrollar EM7. En el presente estudio no pudimos encontrar dicha asociación. Por otro lado, en varios trabajos previos realizados en América del Norte y Europa se observó asociación entre la variable alélica T del polimorfismo 226 y el desarrollo de EM5,11,15. Tanto en el trabajo de Goris et al como en nuestro trabajo no se pudo evidenciar dicha asociación16. Nosotros atribuimos estas diferencias a la composición genética de la población, debido a que el origen de los caucásicos estadounidenses y de los caucásicos sudamericanos es diferente, además de los aportes genéticos que puede haber adquirido cada población a partir de sus pueblos originarios. Por otro lado, no puede descartarse que las diferencias entre los estudios se relacionen con el tamaño de las muestras.
Sin embargo, encontramos una fuerte asociación entre la presencia del genotipo AA en el polimorfismo 1626 del gen CD24 y el riesgo de progresión de la enfermedad en pacientes con EM. Dicha progresión incluye el riesgo de alcanzar un EDSS 6, así como el riesgo de conversión a la fase SP de la enfermedad. Este genotipo también se asoció con una mayor velocidad de progresión de la enfermedad, que modifica la evolución entre la población de pacientes con EM evaluados. En este caso nuestros resultados confirman los hallazgos de Wang L et al7.
Una explicación para esta asociación sería que la ubicación del polimorfismo 1626 en el 3¿UTR del gen CD24 produciría un cambio en la estabilidad del ARNm, induciendo alteraciones en la expresión de la proteína en la membrana celular17,18.
Tomando en consideración las similitudes y diferencias de nuestros resultados con los trabajos previos de otras partes del mundo, no podría simplemente explicarse el desarrollo de EM por diferencias en la información genética de los individuos, ya que estamos tratando de asociar cambios genéticos con alteraciones en los valores de expresión de una proteína; de esta manera estamos dejando de lado los factores ambientales, que desempeñan un rol muy importante en el desarrollo de enfermedades multifactoriales como la EM. En trabajos recientes se ha observado que los factores ambientales influyen en la expresión de los genes a través de mecanismos epigenéticos, y esta podría ser una posible explicación al hecho de que los pacientes no compartan determinadas variables polimórficas pero desarrollen de igual modo la enfermedad. Estudios futuros deberán evaluar la expresión de CD24 en pacientes con las mismas variables polimórficas que provengan de diferentes ambientes, de esta manera se podría analizar la influencia de los factores ambientales sobre la expresión del gen CD24, permitiendo asociar de manera simplificada las variables polimórficas con el desarrollo de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses