El ataque cerebrovascular isquémico (ACVi) y el cáncer se encuentran dentro de las causas más frecuentes de discapacidad y muerte en el mundo. Recientemente, Bang et al. describieron las características imagenológicas de los pacientes con ACVi y cáncer (ACVi-C). Si bien se carece de factores de riesgo y de biomarcadores específicos que identifiquen a estas poblaciones, los niveles de dímero-D (DD) aparecen como un predictor de coagulopatía, respuesta inflamatoria y mortalidad.
ObjetivoDescribir el patrón imagenológico de resonancia magnética (RM) en ACVi-C. Comparar los factores de riesgo cardiovasculares (FRC) y los valores de DD en estos pacientes.
Materiales y métodosRealizamos una revisión retrospectiva de pacientes hospitalizados con ACVi entre junio de 2012 y diciembre de 2014. Incluimos pacientes con ACVi confirmado por RM, antecedente de cáncer conocido o diagnosticado durante la internación. Definimos cáncer activo como aquel diagnosticado en los últimos 6 meses, con metástasis o recurrencia posterior al tratamiento. Los ACVi se clasificaron según su patrón imagenológico. Los FRC y DD del grupo ACVi-C se compararon con aquellos sin cáncer (ACVi-nC).
ResultadosIncluimos a 24 pacientes con ACVi-C y a 113 con ACVi-nC. Se compararon los niveles de DD de 18 pacientes con ACVi-C y de 85 con ACVi-nC y se halló una elevación significativa en el primer grupo. No se obtuvieron diferencias significativas en FRC; el patrón de lesión más frecuente en ACVi-C fue aquel relacionado con infarto único (tipo 1).
ConclusiónEl patrón imagenológico de ACVi tipo lesión única fue el más frecuente. No hallamos diferencias significativas en FRC entre ACViC y ACVi-nC. La elevación de niveles de DD aparecería como un marcador útil de cáncer en la población con ACVi.
Isquemic Stroke (IS) and cancer are amongst the leading causes of death worldwide. Recently, Bang et al. described imagenological patterns in magnetic resonance (MR) from patients with IS and cancer (IS-C). Biomarkers and risk factors (RF) in IS-C are not well stablished. Dimer-D (DD) as a predictor for inflammatory response and coagulation disorders has become a novelty.
ObjectivesDescribe MR patterns in IS-C. Compare RF and DD values (DDv) in IS-C and IS without cancer (IS-wC).
MethodsA retrospective analysis of patients admitted between June 2012 and December 2014 was conducted. We included IS confirmed by MR, known cancer or diagnosed during hospitalization. Active cancer includes diagnosis in the last 6 months, metastasis or recurrence after treatment. IS-C were classified according MR pattern. RF and DD were compared between IS-C and IS-wC.
ResultsA total of 24 patients with IS-C and 113 IS-wC were included. MR pattern isolated lesion (type 1) was the most common in IS-C. DDv were obtained in 18 IS-C and 85 IS-wC. DDv were greater in IS-C.
ConclusionsSingle lesion MRI pattern was the most frequent. No statistical difference were found in RF between IS-C and IS-wC. High DD levels would appear helpful showing cancer in IS.
El ataque cerebrovascular isquémico (ACVi) y el cáncer se encuentran dentro de las causas más frecuentes de muerte y discapacidad a escala mundial. Un estudio de autopsias mostró que el 14,6% de los pacientes oncológicos tenía evidencia anatomopatológica de enfermedad cerebrovascular y el 7,4% de los pacientes habían presentado síntomas de ACV1. Además, los pacientes con neoplasias presentan más frecuentemente cuadros de hipercoagulabilidad y es conocida la mayor incidencia de tromboembolia venosa en estos pacientes2. Por otro lado, los pacientes que en forma concomitante padecen ACVi y cáncer (ACVi-C) presentan un peor pronóstico y mayor número de días de internación3.
Las causas de ACVi en pacientes con y sin enfermedad oncológica pueden variar, y diversas publicaciones han mostrado resultados contradictorios. Si bien la revisión de Grisold et al. no halló diferencias estadísticamente significativas en factores de riesgo cerebrovasculares (FRC), antecedentes coronarios ni ACVi entre pacientes con y sin cáncer4, estudios realizados por Kwangsoo et al. y Schwarzbach et al. sí han encontrado diferencias5,6.
La patogenia del ACV en pacientes oncológicos es motivo de estudio. Se reconocen, hasta el momento, múltiples mecanismos entre los cuales se destacan: estado de hipercoagulabilidad, especialmente en adenocarcinomas; embolia paradojal a través de un foramen oval permeable con shunt derecha-izquierda; endocarditis trombótica no bacteriana; compresión vascular directa por el tumor o metástasis; hiperviscosidad en caso de enfermedades oncohematológicas como la policitemia o hipergamaglobulinemia; invasión vascular (poco frecuente, observada en linfomas intravasculares); vasculopatía posradioterapia y asociadas a quimioterapia y a otros mecanismos desconocidos7.
Adicionalmente, los valores de dímero-D (DD) han sido previamente utilizados como una medida directa de un estado de hipercoagulabilidad4 y se han descripto como posibles biomarcadores en pacientes sin neoplasia conocida que presentan un ACVi8.
Con el propósito de simplificar ciertas características imagenológicas en resonancia magnética (RM) de pacientes con ACVi-C, recientemente, fue propuesta por el grupo de Bang et al. una clasificación que consta de 4 patrones imagenológicos de ACVi-C, que toman en cuenta el número de lesiones y el territorio arterial comprometido8. Esta clasificación muestra la variabilidad de presentación del ACVi, sin presumir una relación entre el patrón imagenológico y la etiología oncológica.
ObjetivosDescribir el patrón imagenológico de ACVi en nuestra población de pacientes con cáncer, comparar los FRC y los niveles plasmáticos de DD en población con ACVi-C activo y no activo y ACVi sin cáncer (ACVi-nC).
Materiales y métodosRealizamos un estudio retrospectivo. Se obtuvieron datos de historias clínicas de pacientes ingresados a nuestra institución, que presentaban concomitantemente diagnóstico de ACVi y cáncer entre junio de 2012 y diciembre de 2014.
Criterios de inclusión: pacientes con diagnóstico de ACVi confirmado por RM, y antecedente de cáncer ya conocido. Pacientes con ACVi confirmado por RM en quienes se diagnosticó cáncer durante la internación por su ACVi.
Criterios de exclusión: ACV hemorrágico, ACV en postoperatorio inmediato, pacientes con trombosis venosa profunda, tumores benignos, del sistema nervioso central y oncohematológicos.
Para la estadificación y subanálisis de pacientes oncológicos se utilizó la clasificación de TNM9.
Definimos cáncer activo como: enfermedad oncológica diagnosticada en los últimos 6 meses, metástasis (estadio IV) o recurrencia de enfermedad oncológica posterior al tratamiento10.
Recabamos factores de riesgo de enfermedad vascular: edad, sexo, hipertensión arterial, dislipidemia, diabetes, tabaquismo y fibrilación auricular crónica o paroxística, según propia referencia del paciente, por estar en tratamiento o por diagnóstico de estos durante la internación. Se consideró como extabaquismo a partir de un año del cese tabáquico. Determinaciones séricas habituales: perfil lipídico (colesterol total, LDL-C, HDL-C, triglicéridos). Se determinó el DD por método enzimático ELFA-VIDAS, considerándose valores normales aquellos menores a 0,5 μg/ml y la homocisteína por ELISA, considerándose valores normales los menores de 15mmol/l.
Los ACVi se clasificaron según lo propuesto por Bang et al. con relación a los hallazgos en RM en 4 patrones: 1) lesión única, 2) lesiones múltiples en un solo territorio arterial, 3) lesiones múltiples pequeñas dentro de múltiples territorios arteriales y 4) lesiones múltiples diseminadas pequeñas y grandes8.
Se estableció como grupo control, para comparación de factores de riesgo y DD de estos pacientes, a los pacientes sin antecedente referido de enfermedad oncológica con primer evento de ACVi diagnosticado por RM de encéfalo dentro del mismo período de tiempo. Los criterios de exclusión fueron: antecedentes de ACVi previo, infarto agudo de miocardio, ACV hemorrágico, ACV en postoperatorio inmediato, pacientes con trombosis venosa profunda reciente, tumores benignos, tumores del sistema nervioso central y tumores oncohematológicos.
Análisis estadísticoSe realizó estadística descriptiva y testeos no paramétricos, mediante test de Mann-Whitney para comparar variables cuantitativas entre 2 grupos y test de Chi2, con corrección de Fisher, para variables dicotómicas. Se empleó el paquete estadístico G-Stat 2.0.
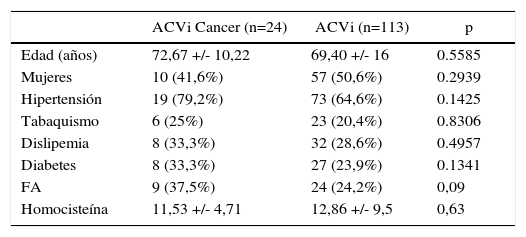
ResultadosLa muestra incluyó a 24 pacientes con ACVi-C y a 113 pacientes con ACVi-nC. Se obtuvieron variables de FRC para ambos grupos y el DD se determinó en 18 de los ACVi-C y 85 de los ACVi-nC. La edad promedio de los ACVi-C fue de 72,67 ±10,22 años con 41,6% de mujeres, mientras que para el grupo de ACVi-nC la edad fue de 69,4 ±16 años con 50,6% de mujeres.
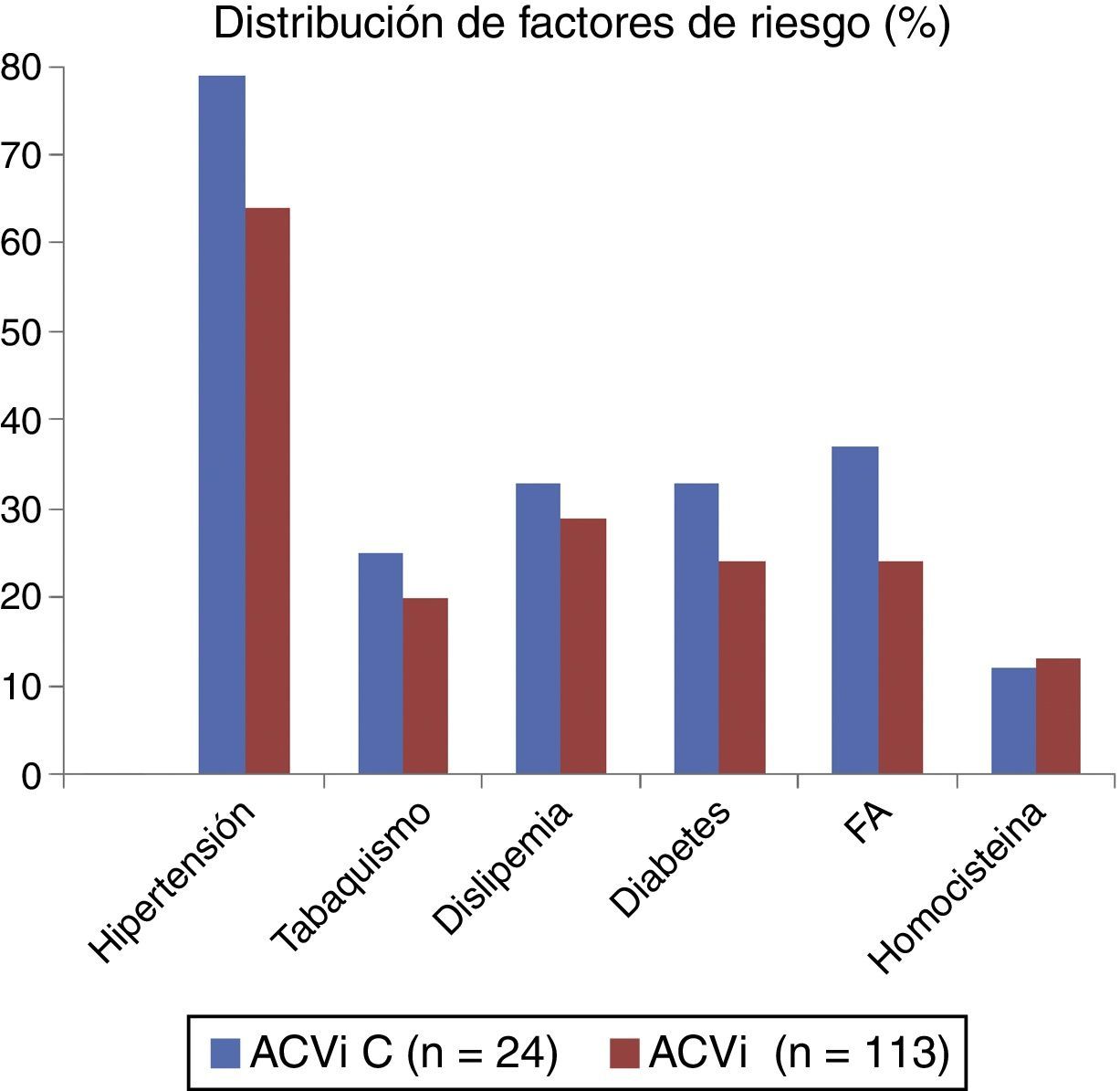
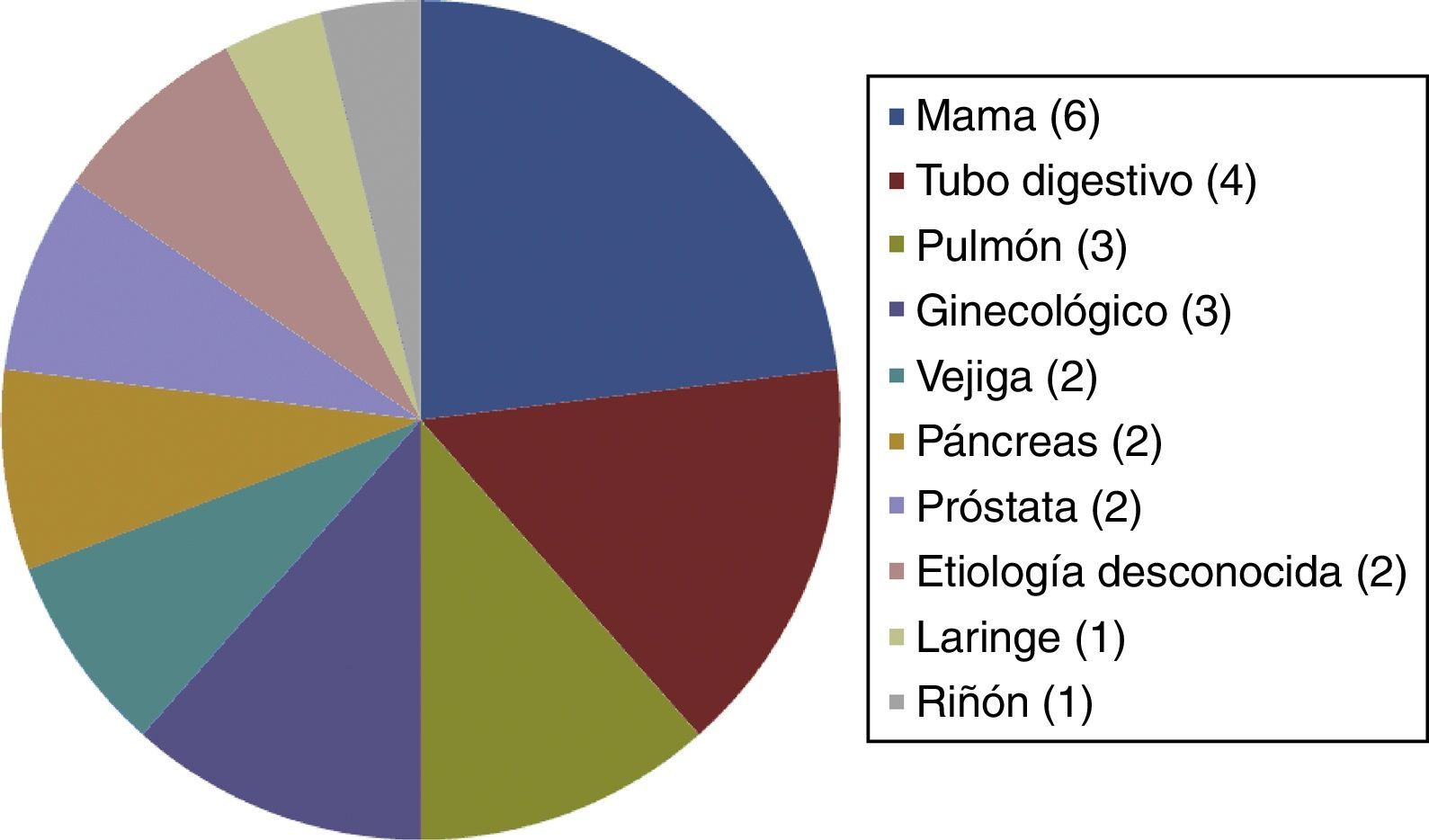
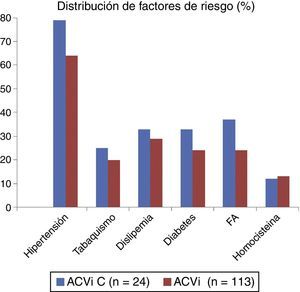
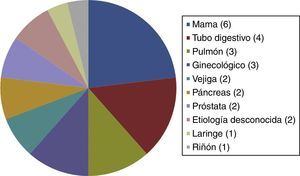
El resto de las variables se encuentran representadas en la tabla 1 y figura 1, sin alcanzar ninguna de estas variables significación estadística. En la tabla 2 y figura 2 se muestra la estirpe tumoral del total de los pacientes con cáncer.
Distribución de factores de riesgo
| ACVi Cancer (n=24) | ACVi (n=113) | p | |
|---|---|---|---|
| Edad (años) | 72,67 +/- 10,22 | 69,40 +/- 16 | 0.5585 |
| Mujeres | 10 (41,6%) | 57 (50,6%) | 0.2939 |
| Hipertensión | 19 (79,2%) | 73 (64,6%) | 0.1425 |
| Tabaquismo | 6 (25%) | 23 (20,4%) | 0.8306 |
| Dislipemia | 8 (33,3%) | 32 (28,6%) | 0.4957 |
| Diabetes | 8 (33,3%) | 27 (23,9%) | 0.1341 |
| FA | 9 (37,5%) | 24 (24,2%) | 0,09 |
| Homocisteína | 11,53 +/- 4,71 | 12,86 +/- 9,5 | 0,63 |
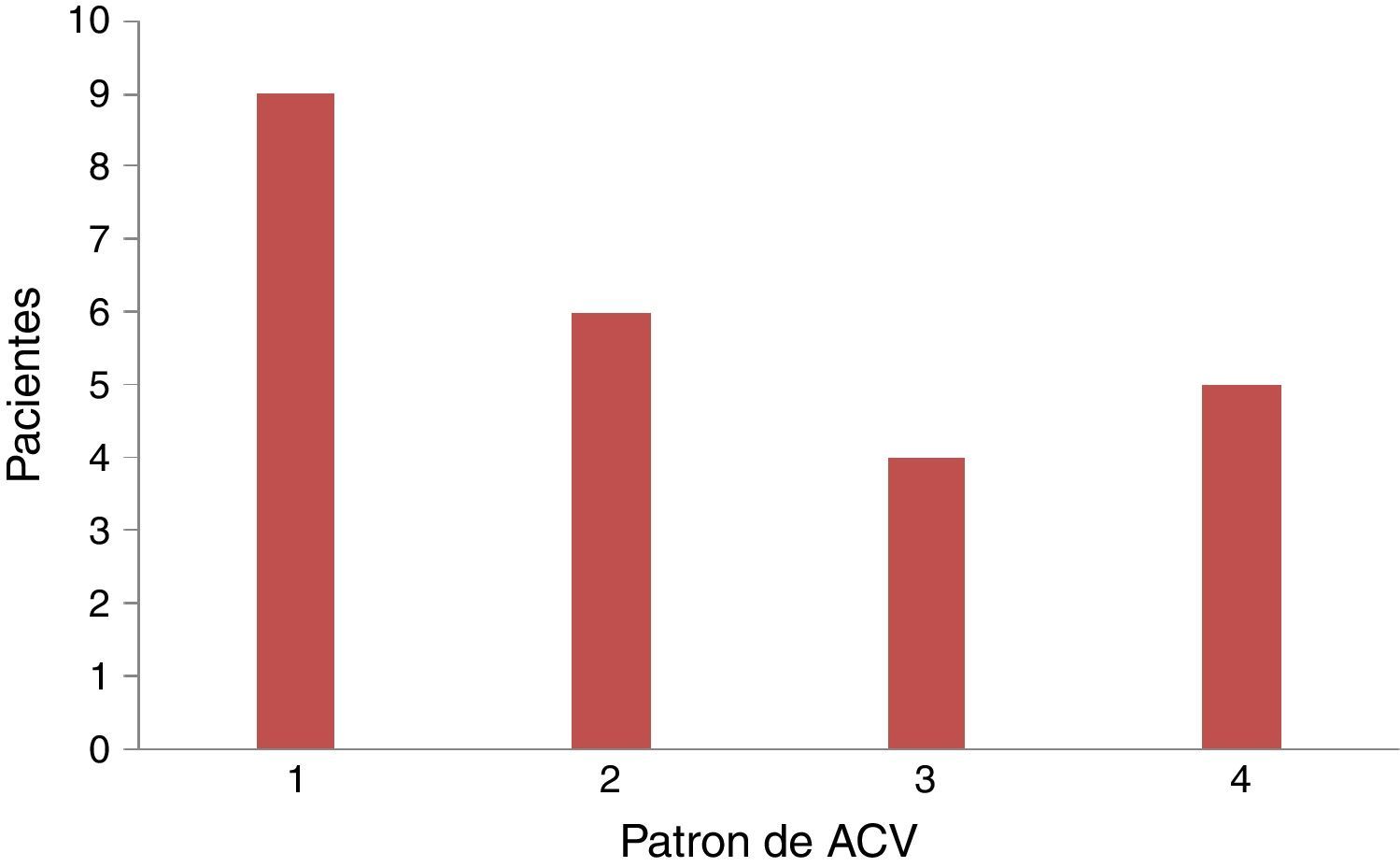
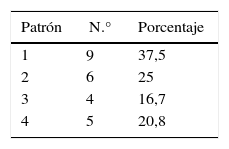
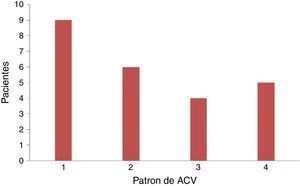
De los pacientes con ACVi-C, el patrón de lesión más frecuentemente observado en nuestra población fue el tipo 1 con 9 pacientes (37,5%), seguido del tipo 2 con 6 pacientes (25%), del tipo 4 con 5 pacientes (20,83%) y del tipo 3 con 4 pacientes (16,67%). De los 24 pacientes, 14 presentaban cáncer activo de su enfermedad oncológica. En estos, el patrón más frecuente fue el tipo 4 (lesiones múltiples diseminadas pequeñas y grandes), con 5 pacientes (35,71%), sin alcanzar significación estadística (tabla 3 y figura 3).
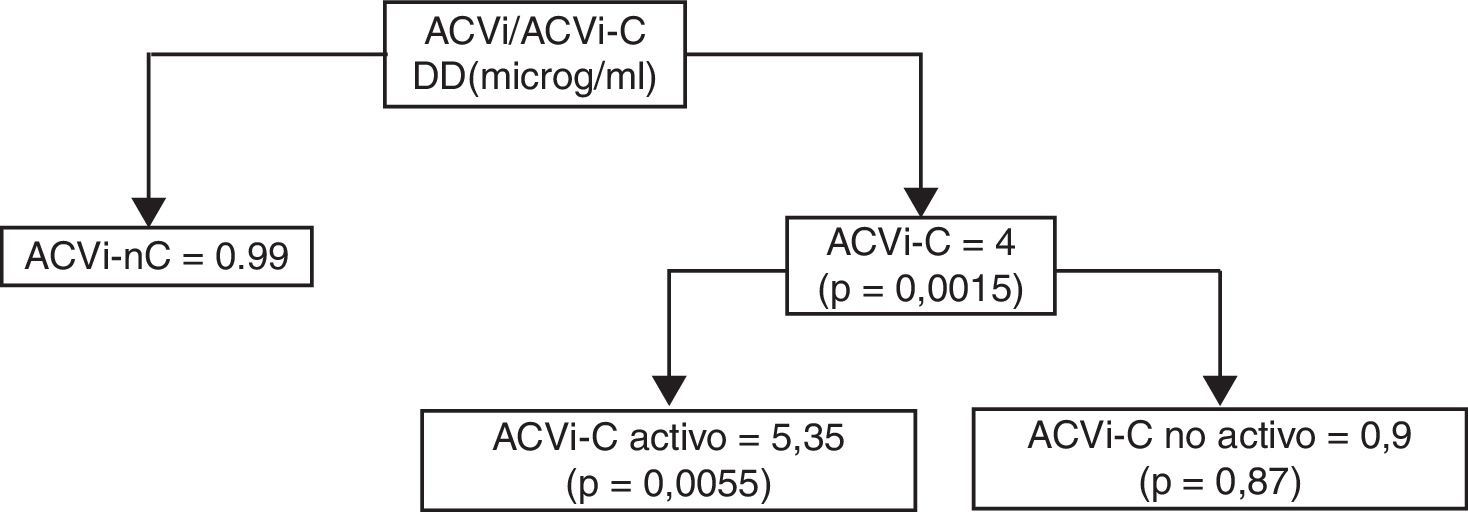
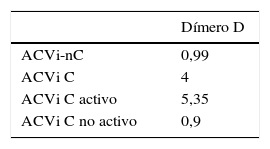
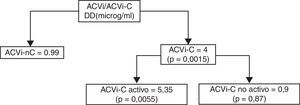
La media de nivel de DD fue de 3,58±3,6 μg/ml para el grupo ACVi-C; contra 0,99±0,92 μg/ml de los pacientes con ACVi-nC, p = 0,0015.
El subanálisis del grupo de pacientes ACVi-C mostró 11 pacientes con cáncer activo con una media del valor de DD de 5,35±3,6 μg/ml, en tanto que en los 7 pacientes del grupo ACVi-C no activo el valor promedio de DD fue de 0,9±0,83 μg/ml, siendo esta diferencia significativa (p: 0,0055).
No obstante ello, la comparación de los niveles de DD para ACVi-C activo y no activo respecto del grupo ACVi-nC fue estadísticamente significativa p<0,001 y p=0,8463, para el primer grupo y no para el segundo (tabla 4 y figura 4).
En la presente serie los niveles de DD muestran una significativa elevación en aquellos pacientes con ACV y cáncer respecto de los pacientes sin cáncer. Destaca, además, que esta diferencia es aún más notable en aquellos individuos portadores de cáncer activo. Si bien la literatura refiere varios estudios que muestran resultados similares, en nuestro medio se carece de datos. Por ello, creemos necesario explorar aún más el valor de este marcador, sobre todo considerando que se trata de una determinación sencilla, de bajo costo y ampliamente accesible en nuestro medio. Su medición rutinaria, en el ACV agudo criptogénico, podría ser de utilidad para identificar poblaciones de riesgo, incentivar la búsqueda de neoplasia en los casos en los que se desconociera y permitiría, además, establecer un pronóstico potencial de evolución en estos individuos.
Por otra parte, encontramos en nuestra serie un patrón imagenológico diferente del descripto en la literatura. Efectivamente, en la descripción original de Bang et al. el patrón de RM cerebral más frecuente fue el tipo 38, en tanto que en nuestra serie el tipo 1, con lesión única, fue el más frecuente. Esto reafirma la idea de ausencia de un patrón típico, si bien tampoco puede descartarse que se deba a diferencias poblacionales.
Con respecto a los FRC, en el grupo ACVi-C los hallazgos de la literatura son contradictorios. Puntualmente en nuestro caso no se identificaron diferencias relevantes en los FRC para ambos grupos.
Debe mencionarse que el presente estudio posee algunas debilidades tales como su diseño retrospectivo, el tamaño muestral reducido y que corresponde a un solo centro.
No obstante ello, posee varias fortalezas: es uno de los primeros estudios focalizados en la asociación ACVi y cáncer en nuestro medio, la determinación de DD fue dentro de los primeros 4 días desde el ingreso determinándose en un alto porcentaje de pacientes, la población corresponde a un mismo nivel socioeconómico y aporta información en un grupo poco estudiado de pacientes, como lo son aquellos con enfermedad oncológica no activa, lo que abre el camino a nuevos estudios prospectivos más extensos.
En conclusión, según nuestro conocimiento, este sería el primer estudio argentino que analiza FRC, patrones imagenológicos en RM y DD en pacientes con ACVi y cáncer.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Jose Biller por la corrección del manuscrito.