La dieta cetogénica puede ser una medida terapéutica eficaz en el manejo coadyuvante de la epilepsia refractaria. Aunque su uso es más frecuente en niños, cada vez hay mayor evidencia de los beneficios en pacientes adultos.
ObjetivoEvaluar los efectos de la dieta cetogénica como tratamiento coadyuvante de la epilepsia refractaria en pacientes adultos atendidos por el servicio de neurología en 2 instituciones de Bogotá entre 2016 y 2020.
Pacientes y métodosSe incluyeron 17 adultos con epilepsia refractaria, atendidos en 2 instituciones de Bogotá que iniciaron dieta cetogénica, 10 de ellos estuvieron en seguimiento por nutrición durante 6 meses. Se evaluó el tipo de dieta, la adherencia, frecuencia mensual de crisis en el primer, tercer y sexto mes de tratamiento, efectos secundarios, estado nutricional, paraclínicos, uso concomitante de otros fármacos antiepilépticos y calidad de vida.
ResultadosSe observó beneficios en el 80% (n=8) del total de pacientes que completaron el seguimiento (10), con reducción de la frecuencia de crisis entre el 50% y el 100% a los 6 meses, siendo la dieta tipo Atkins modificada la más prescrita en combinación con la fórmula cetogénica. El 60% de los pacientes fueron adherentes a la dieta, los efectos secundarios se encontraron en el 20%.
ConclusionesLa dieta cetogénica demostró efectividad en la reducción de la frecuencia de crisis epilépticas en el 80% de los pacientes, con efectos secundarios comparables a los reportados por otros autores. Se requiere de un programa institucional de seguimiento para evaluar los efectos a largo plazo.
Ketogenic diet has been described as an effective adjuvant therapeutic option to treat drug resistant epilepsy. Although it is commonly prescribed in children, in recent years more evidence of its benefits in adult population has been obtained.
ObjectiveThe aim of this study was to evaluate the effects of the ketogenic diet as an adjuvant treatment for refractory epilepsy in adults. The target group corresponded to patients from Neurology department of 2 institutions in Bogota (Colombia) between 2016 and 2020.
Patients and methodsSeventeen adults with drug resistant epilepsy were included, who initiated ketogenic diet under nutritionist supervision for at least 6 months. We evaluated the type of dietary treatment, adherence, seizure frequency at the first, third and sixth months since the beginning of the diet, adverse effects, nutritional state, laboratories, concomitant use of antiepileptic drugs and the quality of life.
ResultsThis case series study reported benefits in 80% (n=8) of patients, with a seizure frequency reduction between 50% and 100% after 6 months, being the modified Atkins diet the most prescribed in combination with a ketogenic formula. The frequency of adverse events was 20%, and 60% of patients were adherent to the diet.
ConclusionsThe ketogenic diet was effective in the reduction of seizure frequency in 80% of the patients, who exhibited adverse effects comparable to previous reports. The implementation of an institutional program for following and evaluation of its long term outcome effects is recommended.
La epilepsia es un trastorno neurológico que afecta a alrededor de 50 millones de personas en todo el mundo1. En Colombia, según datos del Ministerio de Salud y Protección Social cerca del 1,3% de la población padece esta enfermedad, la cual puede llegar a interferir con el desarrollo físico y social de la persona, afectando su calidad de vida2. Aproximadamente el 60-65% de los pacientes con epilepsia se controlan con fármacos anticonvulsivantes, sin embargo el 35% restante presenta epilepsia refractaria3,4, en quienes el uso de otras alternativas terapéuticas, entre ellas la dieta cetogénica (DC) se ha descrito como una opción prometedora de tratamiento.
La DC implica una significativa redistribución de los macronutrientes consumidos, en la que se incrementa el aporte de grasa (>60% del valor calórico total, se mantiene el aporte de proteínas y se restringe el aporte de hidratos de carbono (<10% del valor calórico total). Esta redistribución de nutrientes busca mimetizar el metabolismo del ayuno, favoreciendo la síntesis de cuerpos cetónicos como principal sustrato energético5,6. La relación entre las grasas (componente cetogénico) y los hidratos de carbono más proteínas (componente anticetogénico) se denomina tasa o radio cetogénico (TC). Existen varios tipos de DC; la más flexible es la de bajo índice glucémico, caracterizada por una ingesta de hidratos de carbono entre 40-60g/día y un índice glucémico inferior a 50, le sigue la dieta Atkins modificada (DAM), en la que los hidratos de carbono generalmente se restringen a 10-20g/día y la TC es de 1:1. En los últimos años esta opción ha sido la más utilizada en adolescentes y adultos por su flexibilidad y eficacia. Otros tipos de DC son la DC clásica (DCC) cuyo aporte lipídico puede estar alrededor del 90% del valor calórico total, predominando los ácidos grasos de cadena larga, y la DC con triglicéridos de cadena media; en ambas dietas la TC puede variar de 1:1 a 4:1 en función de los resultados del paciente5,7.
Este estudio evaluó los efectos de la introducción de la DC como tratamiento coadyuvante en pacientes con diagnóstico de epilepsia refractaria, atendidos por la clínica de epilepsia del Hospital Militar Central y la IPS Clínicos en Bogotá.
Pacientes y métodosEste estudio observacional retrospectivo evaluó los efectos de la DC en pacientes adultos con epilepsia refractaria atendidos entre diciembre de 2016 y febrero de 2020. La epilepsia refractaria (farmacorresistente) se define por la ILAE como la falla de 2 fármacos anticonvulsivantes apropiadamente elegidos y tolerados a dosis y horarios adecuados (ya sea en monoterapia, ya en combinación) para lograr un control o libertad de crisis sostenido8. El tipo de epilepsia y de crisis epilépticas se determinó según la clasificación ILAE 2017 que se basa predominantemente en la clínica presentada por el paciente. Las epilepsias se clasifican como generalizadas o focales y un síndrome epiléptico (encefalopatía epiléptica) se define como «un grupo de características que incorporan tipo de crisis, hallazgos en el electroencefalograma e imagenológicos que tienden a ocurrir juntos». Los factores que contribuyen a un síndrome epiléptico son la edad de inicio, remisión, desencadenantes, variación diurna, disfunción intelectual y psiquiátrica, hallazgos en el electroencefalograma, hallazgos imagenológicos, historia familiar y genética.
Este estudio evaluó la frecuencia ictal, adherencia, tipo de dieta, efectos adversos, estado nutricional, paraclínicos y uso concomitante de fármacos antiepilépticos (FAE) en estos pacientes antes y después de la introducción de la DC. Como criterio de inclusión se tuvo en cuenta pacientes con diagnóstico de epilepsia refractaria con indicación de DC remitidos a consulta de nutrición para inicio de predieta, entendiéndose la predieta como la fase de adaptación y transición entre la dieta convencional y la DC. Como criterio de exclusión se consideró a pacientes que requirieron ajuste de los anticonvulsivantes durante el primer mes de iniciada la dieta, y aquellos que tenían trastornos metabólicos por deficiencias o trastornos en la cetogénesis.
Se verificó el seguimiento en 3 momentos posteriores a la prescripción de la predieta: al final del primer mes (T1) cuando se evalúa la tolerancia, se realizan ajustes a la DC y se considera el uso de fórmula cetogénica(FC); entre 30 a 40 días posteriores (T2) y entre 3 a 6 meses después del T2 (T3). Se excluyeron casos que requirieron ajuste de FAE en el transcurso del primer mes de iniciada la DC. La variación en la frecuencia ictal en cada seguimiento se clasificó según el porcentaje de control de crisis así: 100%, control entre el 91 y 99%, control del 50-90%, control menor al 50%, sin cambios en la frecuencia y aumento de crisis9. Una vez el neurólogo definió un paciente como candidato a la DC, ordenó los paraclínicos de rutina que incluyeron hemograma, glucemia, función hepática (TGP, TGO, bilirrubinas), función renal (BUN y creatinina), electrólitos (Na, K, P, Mg), perfil lipídico (colesterol total, HDL, LDL, triglicéridos) y vitamina D. Por último, se evaluó la calidad de vida a través del formulario QOLIE-31P en su versión validada al español10,11. Se empleó Microsoft Excel® para el análisis de resultados.
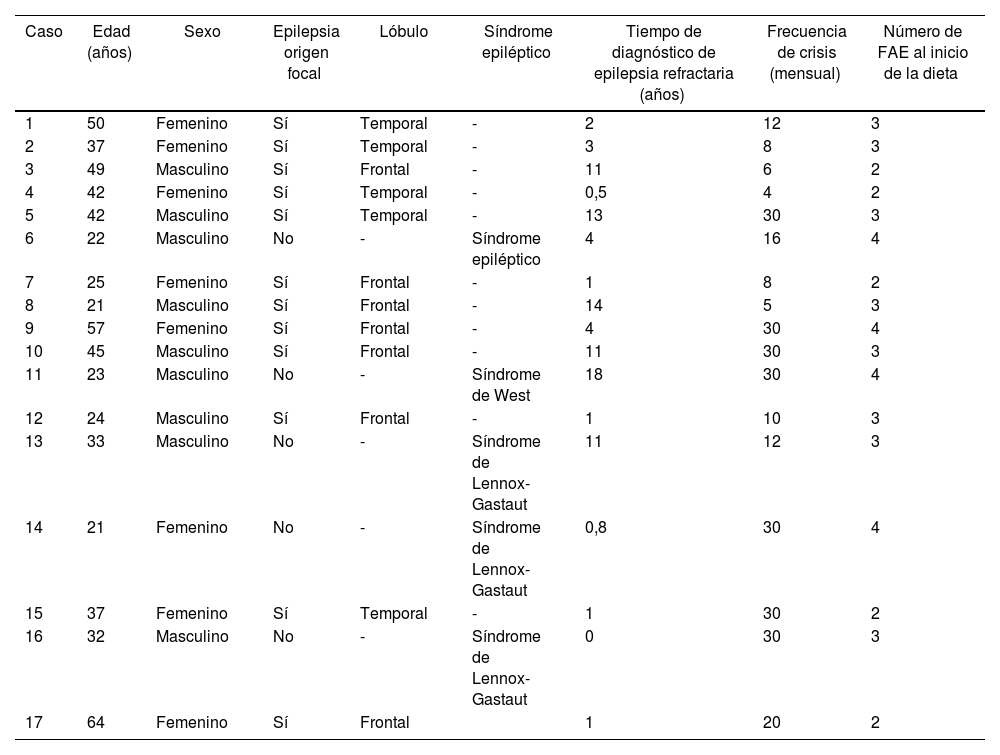
ResultadosUn total de 496 pacientes con diagnóstico de epilepsia fueron atendidos en las 2 instituciones donde se realizó el estudio, de los cuales el 15% (75) tenían diagnóstico de epilepsia refractaria, y de estos, 17 pacientes fueron elegibles para conformar el estudio y 10 de los cuales completaron el seguimiento. Del total de pacientes, un 53% eran hombres y un 47% mujeres, la mayoría de ellos residentes en Bogotá. La media de edad fue de 36 años (±13): 32 (±10) en los hombres y 41 (±14) en las mujeres. Con relación a la discapacidad, un 53% tenía algún grado de discapacidad de tipo cognitivo, requiriendo acompañamiento de su cuidador.
El diagnóstico más frecuente fue epilepsia focal (71%), correspondiendo un 58% al lóbulo frontal y un 42% al temporal, seguido de encefalopatía epiléptica (29%), la mayoría de estos últimos con diagnóstico de síndrome de Lennox-Gastaut. La mediana en el tiempo de confirmación diagnóstica de epilepsia refractaria fue de 5,6 años y el promedio de crisis epilépticas antes del inicio de la dieta fue de 18 por mes (±10). El 70% de los pacientes estaba recibiendo 3 o 4 FAE y el 29% tenía prescritos 2. El medicamento más frecuente fue levetiracetam con dosis entre 500 y 3.000mg/día, seguido de clobazam con dosis entre los 20 y 80mg/día.
Predieta (n=17)Al inicio del periodo de la predieta, el 58% de los pacientes presentó índices de masa corporal dentro de los límites normales, el 23% sobrepeso u obesidad y el 11% delgadez, según los parámetros de clasificación antropométrica del estado nutricional para adultos12. Solo se obtuvo información de paraclínicos en 14 de los pacientes; de estos, como hallazgo relevante se observó que el 23% de los casos presentó niveles de LDL por encima de 100mg/dl, el 11% de ellos con valores del colesterol total por encima de 200mg/dl y el 11% con valores de triglicéridos por encima de 150mg/dl, el 11% de los pacientes presentó deficiencia e insuficiencia de vitamina D respectivamente. Solo en uno de los casos se contaba con resultados de densitometría la cual reportó baja densidad mineral ósea. El resto de paraclínicos se encontró en límites normales (tabla 1).
Características de los pacientes que participaron en el estudio
| Caso | Edad (años) | Sexo | Epilepsia origen focal | Lóbulo | Síndrome epiléptico | Tiempo de diagnóstico de epilepsia refractaria (años) | Frecuencia de crisis (mensual) | Número de FAE al inicio de la dieta |
|---|---|---|---|---|---|---|---|---|
| 1 | 50 | Femenino | Sí | Temporal | - | 2 | 12 | 3 |
| 2 | 37 | Femenino | Sí | Temporal | - | 3 | 8 | 3 |
| 3 | 49 | Masculino | Sí | Frontal | - | 11 | 6 | 2 |
| 4 | 42 | Femenino | Sí | Temporal | - | 0,5 | 4 | 2 |
| 5 | 42 | Masculino | Sí | Temporal | - | 13 | 30 | 3 |
| 6 | 22 | Masculino | No | - | Síndrome epiléptico | 4 | 16 | 4 |
| 7 | 25 | Femenino | Sí | Frontal | - | 1 | 8 | 2 |
| 8 | 21 | Masculino | Sí | Frontal | - | 14 | 5 | 3 |
| 9 | 57 | Femenino | Sí | Frontal | - | 4 | 30 | 4 |
| 10 | 45 | Masculino | Sí | Frontal | - | 11 | 30 | 3 |
| 11 | 23 | Masculino | No | - | Síndrome de West | 18 | 30 | 4 |
| 12 | 24 | Masculino | Sí | Frontal | - | 1 | 10 | 3 |
| 13 | 33 | Masculino | No | - | Síndrome de Lennox-Gastaut | 11 | 12 | 3 |
| 14 | 21 | Femenino | No | - | Síndrome de Lennox-Gastaut | 0,8 | 30 | 4 |
| 15 | 37 | Femenino | Sí | Temporal | - | 1 | 30 | 2 |
| 16 | 32 | Masculino | No | - | Síndrome de Lennox-Gastaut | 0 | 30 | 3 |
| 17 | 64 | Femenino | Sí | Frontal | 1 | 20 | 2 |
FAE: fármacos antiepilépticos.
La dieta más comúnmente prescrita fue la DAM como tratamiento exclusivo con alimentos o en combinación con la FC. El 17% recibió DCC con tasas de 2:1 a 3:1 con FC; uno de los pacientes recibió dieta de bajo índice glucémico en combinación con FC. En principio se prefiere iniciar con una DAM y según la respuesta se mantiene la TC en 1:1 o se aumenta a TC mayores incluso hasta 4:1 (DCC) según la tolerancia del paciente, con el fin de aumentar cetosis y lograr un mejor control de crisis. El uso de la FC se consideró para mejorar adherencia y tolerancia a la DC, para lograr un mejor control de las crisis en aquellos con una epilepsia más compleja de controlar, o en los casos que presentaban un estado nutricional específico que se beneficiaba de la tecnificación de la terapia (tabla 2).
Dieta prescrita durante el seguimiento
| Caso | T1 | T2 | T3 |
|---|---|---|---|
| (n=17) | (n=12) | (n=10) | |
| 1 | DAM (1:1), FCa | DAM (1:1), FCa | DAM (1:1), FCa |
| 2 | DAM (1:1), FCb | DAM (1:1), FCb | DAM (1:1), FCb |
| 3 | DAM (1:1), FCa | DAM (1:1), FCa | DAM (1:1), FCa |
| 4 | Predieta | - | - |
| 5 | DCC (3:1), FCb | DCC (3:1), FCb | DAM (1:1), FCb |
| 6 | DAM (1:1) | DAM (1:1) | Suspende |
| 7 | Suspende | - | - |
| 8 | Predieta | DAM (1:1), FCb | DAM (1:1), FCb |
| 9 | DCC (2:1), Fca | DTC (2:1), FCa | DAM (1:1), FCa |
| 10 | DCC (2:1), FCb | Suspende | - |
| 11 | DAM (1:1), FCb | DAM (1:1), FCb | DAM (1:1), FCb |
| 12 | DBIG, FCb | DBIG, FCb | DBIG (1:1), FCb |
| 13 | Suspende | - | - |
| 14 | Suspende | - | - |
| 15 | DAM (1:1) | DAM (1:1) | DAM (1:1) |
| 16 | DAM (1:1), FCb | DAM (1:1), FCb | DAM (1:1), FCb |
| 17 | Suspende | - | - |
DAM: dieta de Atkins modificada; DBIG: dieta de bajo índice glucémico; DCC: dieta cetogénica clásica; FC: fórmula cetogénica.
aFórmula cetogénica con triglicéridos de cadena media.
bFórmula cetogénica con triglicéridos de cadena larga.
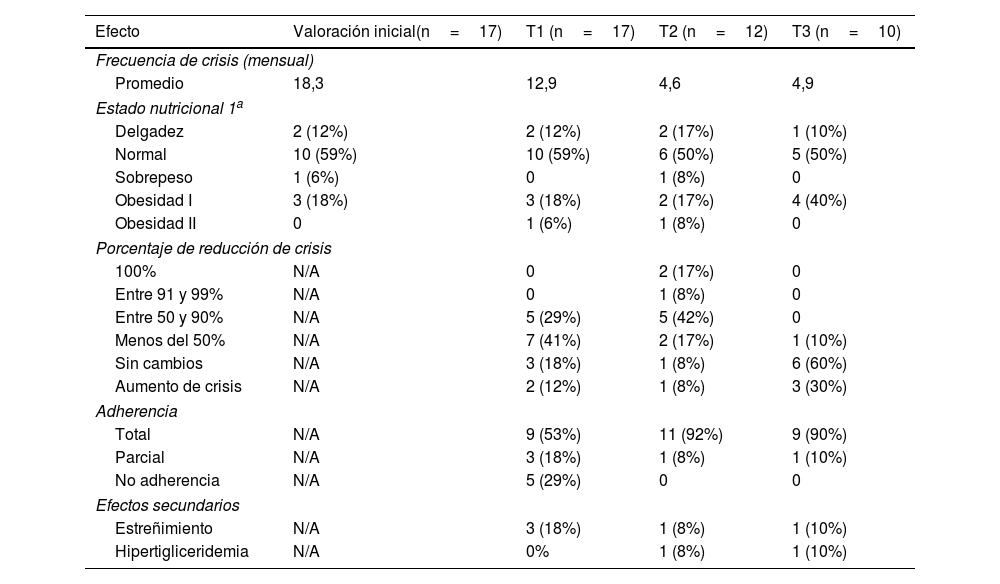
La valoración al T1 evidenció cambios en el estado nutricional en el 11% de los casos. Los demás pacientes mantuvieron su estado nutricional respecto a la valoración inicial. Con el inicio de la predieta, el 30% de los pacientes reportó reducción de crisis, la mitad de ellos manifestando una disminución entre el 50 y el 90% de su frecuencia ictal. Los estudios paraclínicos durante este periodo no estuvieron disponibles y por lo tanto no fue posible evaluar los cambios en los exámenes de laboratorio durante este tiempo. En cuanto a efectos secundarios, el 18% de los casos manifestó presentar estreñimiento y el 29% de los casos interrumpió la terapia cetogénica con la predieta debido a la no mejora o incremento en la frecuencia de las crisis epilépticas, causas económicas, gastroparesia o intolerancia gástrica.
Seguimiento T2 (n=12)A la valoración del T2, se evidenció cambio en el estado nutricional de un paciente quien pasó de obesidad grado i a sobrepeso. La reducción promedio de la frecuencia ictal fue del 64% y 2 pacientes lograron estar libres de crisis epilépticas respecto al T1, con DAM con FC, y el otro, DC exclusiva con alimentos. Los niveles de colesterol total, LDL y triglicéridos mostraron un incremento del 16%; el resto de paraclínicos estuvieron en rangos normales. Durante el seguimiento en T2, se presentaron efectos secundarios en 2 casos (16%), uno de ellos manifestó estreñimiento y en otro se observó hipertrigliceridemia.
Seguimiento T3 (n=10)En el T3 se registraron 2 pérdidas más en el seguimiento, por lo que se obtuvo resultados en 10 pacientes de los 17 iniciales. El 20% de ellos presentó cambios en su estado nutricional, pasando de sobrepeso a obesidad grado i y de delgadez a estado normal. El 60% de los pacientes mantuvo la misma frecuencia ictal y el 30% mostró un incremento en el número de crisis en comparación al T2. Los paraclínicos se mantuvieron estables excepto por el perfil lipídico que mostró persistencia de la hipertrigliceridemia en uno de los pacientes. Se observaron cambios en las dosis de los FAE en 3 casos, el primero, con incremento en la dosis de levetiracetam, el segundo tuvo reducción en la dosis de este mismo medicamento y también disminución en la dosis de clobazam, y otro al que se le aumentó la dosis de clobazam. Los 3 casos que tuvieron modificaciones en la prescripción de FAE registraron incremento en la frecuencia de crisis respecto a T2. El registro del control de crisis, el estado nutricional, la adherencia y los efectos secundarios en cada momento del seguimiento se puede visualizar en la tabla 3.
Efectos de la dieta cetogénica en la valoración inicial, al mes, 3 y 6 meses del seguimiento
| Efecto | Valoración inicial(n=17) | T1 (n=17) | T2 (n=12) | T3 (n=10) |
|---|---|---|---|---|
| Frecuencia de crisis (mensual) | ||||
| Promedio | 18,3 | 12,9 | 4,6 | 4,9 |
| Estado nutricional 1a | ||||
| Delgadez | 2 (12%) | 2 (12%) | 2 (17%) | 1 (10%) |
| Normal | 10 (59%) | 10 (59%) | 6 (50%) | 5 (50%) |
| Sobrepeso | 1 (6%) | 0 | 1 (8%) | 0 |
| Obesidad I | 3 (18%) | 3 (18%) | 2 (17%) | 4 (40%) |
| Obesidad II | 0 | 1 (6%) | 1 (8%) | 0 |
| Porcentaje de reducción de crisis | ||||
| 100% | N/A | 0 | 2 (17%) | 0 |
| Entre 91 y 99% | N/A | 0 | 1 (8%) | 0 |
| Entre 50 y 90% | N/A | 5 (29%) | 5 (42%) | 0 |
| Menos del 50% | N/A | 7 (41%) | 2 (17%) | 1 (10%) |
| Sin cambios | N/A | 3 (18%) | 1 (8%) | 6 (60%) |
| Aumento de crisis | N/A | 2 (12%) | 1 (8%) | 3 (30%) |
| Adherencia | ||||
| Total | N/A | 9 (53%) | 11 (92%) | 9 (90%) |
| Parcial | N/A | 3 (18%) | 1 (8%) | 1 (10%) |
| No adherencia | N/A | 5 (29%) | 0 | 0 |
| Efectos secundarios | ||||
| Estreñimiento | N/A | 3 (18%) | 1 (8%) | 1 (10%) |
| Hipertigliceridemia | N/A | 0% | 1 (8%) | 1 (10%) |
a Un caso en el cual no se obtuvo información sobre peso y talla en la historia clínica.
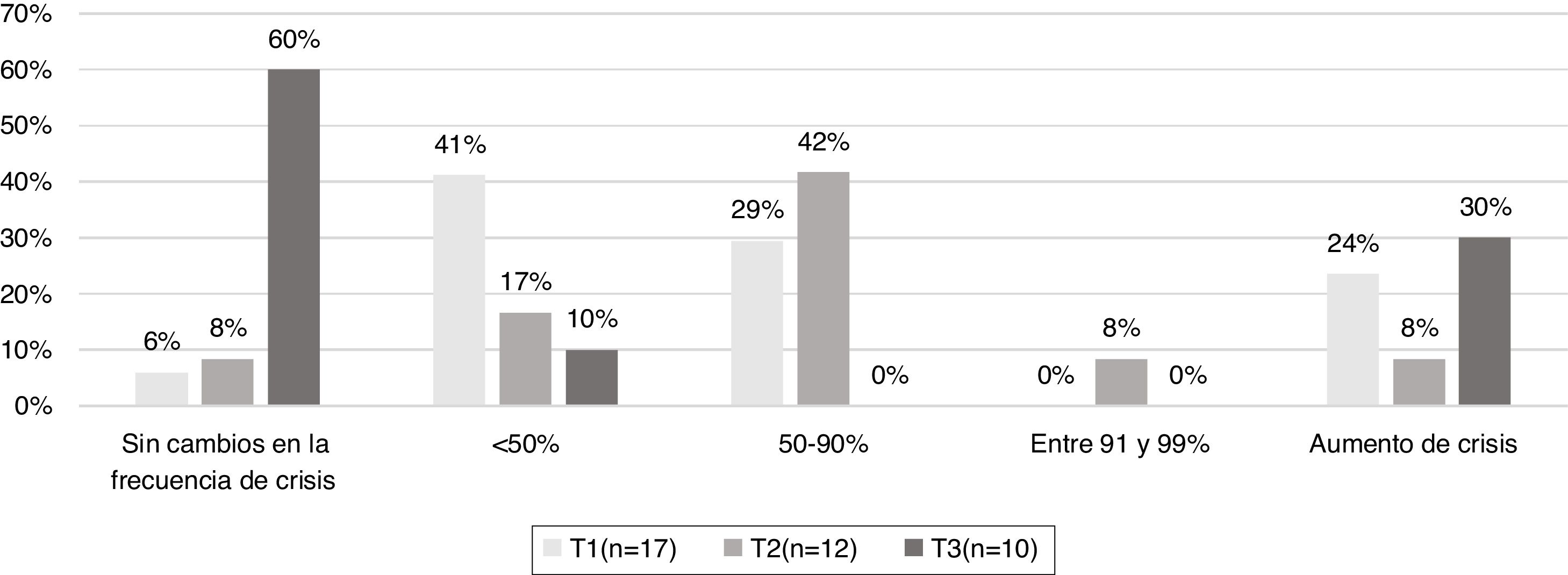
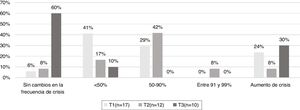
Al evaluar la frecuencia de las crisis a lo largo del tratamiento, el 30% 3 de los casos alcanzó control del 50-90% en el primer mes (T1). Sin embargo, a los 6 meses la respuesta fue favorable para el 80% 8 de los pacientes. En 5 de los casos se redujo la frecuencia de crisis entre el 50 y 90%, un paciente redujo en más del 90% sus crisis y 2 presentaron reducción del 100% de sus crisis en el T3 respecto al T1. Los pacientes que lograron el 100% de control en las crisis fueron adherentes a la dieta durante todo el periodo de seguimiento. El 10% de estos pacientes alcanzó la libertad de crisis con una dieta exclusiva con alimentos (fig. 1).
Porcentaje de reducción de crisis entre el mes y los 6 meses de tratamiento con la dieta cetogénica.
Clasificación del control de crisis según Kossoff y Dorward9: Control del 100%, entre 91% y el 99%, entre el 50-90%, <50%, aumento de crisis y sin cambios en la frecuencia de crisis.
El análisis de calidad de vida relacionada con la epilepsia se realizó a través del QOLIE-31P y fue medida una única vez, posterior al T3. Esta información se obtuvo en 8 de los 17 pacientes, encontrando un valor promedio de 56 (DE±0,06), siendo el máximo 66 y mínimo 47. Se observó que los dominios con mayor afectación de la calidad de vida en ese grupo de pacientes son los efectos de la medicación (9,8 puntos) y la preocupación por las crisis (30,8 puntos). Seis de 10 pacientes que completaron el seguimiento a T3 respondieron la escala QOLIE-31P, encontrándose una calificación global del 57%. Dos de los casos tuvieron la calificación más alta, siendo ellos parte del grupo que alcanzó un control del 100% de las crisis en T3.
ConclusionesEl uso de la DC como parte de las medidas no farmacológicas en el tratamiento adyuvante de la epilepsia refractaria se ha convertido en una alternativa eficaz y segura para el control de las crisis en la población adulta afectada9,13. Otros estudios han demostrado que aproximadamente la mitad de los pacientes que sigue una DC disminuirán en un 50% o más la frecuencia de sus crisis, y cerca de un tercio presentarán solo una décima parte de su frecuencia ictal basal14,15.
Klein et al. reportaron los casos de 12 pacientes con epilepsia refractaria en quienes se indicó DC con una relación 3:1, de los cuales el 11%, el 38% y el 33% mostraron reducción>75%, 42% y>50% respectivamente, y un paciente resolvió el 100% de sus convulsiones16. Lambrechts et al. evaluaron a 15 adultos tratados con DCC durante 12 meses, encontrando que de los 5 pacientes que completaron el estudio, 2 reportaron reducción de crisis entre el 50-90% y 3 una reducción mayor al 50%17. En 2018, un metaanálisis realizado por Liu et al. demostró que la DC fue efectiva, con el 13% de los pacientes alcanzando la libertad de crisis y el 53% una reducción superior al 50%18.
En esta serie de casos se observó un beneficio superior al reportado en los estudios mencionados, encontrando que el 80% de los pacientes redujo su frecuencia de crisis en más del 50% después de 6 meses de instaurada la DC, siendo la DAM la más comúnmente utilizada, con una aceptable tolerancia y adherencia. En el 11% de los pacientes se observó aumento de crisis con el inicio de la dieta, uno de los cuales se retiró del estudio por esta razón. Baborka reportó un aumento de la frecuencia ictal en el 6%19, Klein et al. en el 8%16 y Lambrechts et al. hasta en el 33% de los pacientes17. Uno de los pacientes en este estudio presentó una mejora significativa de su frecuencia ictal con la dieta 100% con alimentos. En este paciente, al iniciarse FC se observó una exacerbación de su frecuencia ictal, la cual mejoró significativamente al suspender la FC y retomar la DC exclusiva con alimentos.
En Latinoamérica se han descrito series de casos en el uso de DC en adultos con epilepsia refractaria en Chile y Brasil20,21. Este estudio obtuvo resultados similares al caso de Chile, en donde se evaluó la eficacia de la dieta, observándose una reducción de las crisis de más del 50% y tolerancia en más del 90% de los pacientes22.
Respecto al uso y dosis de FAE, pocos estudios han reportado los cambios en dosificación de FAE durante la dieta. Klein et al. reportaron en su estudio de 11 pacientes que en el 82% no hubo modificaciones en dosis de FAE, un paciente pasó de tener 4 FAE a 3 a los 6 meses de iniciada la dieta y otro paciente suspendió sus FAE por completo continuando solo con la DC16; Lambrechts et al. incluyeron a 15 pacientes con un seguimiento de 12 meses en el que se reportó cambios en FAE en 3 de los pacientes dados por reducción de la dosis o descontinuación de un FAE, cambios que se observaron a los 6 meses de iniciada la dieta17. En este estudio el número de FAE se mantuvo y además se evidenció que en el 70% (n=7) de los casos, no se requirió variaciones en la dosificación al final del seguimiento (T3) respecto al inicial (T0) y, en otro de los casos, se observó una reducción en la dosis diaria del medicamento (levetiracetam y clobazam).
La DC fue en general bien tolerada, como ha sido referido en otros reportes7,23. El metaanálisis de Liu et al. indicó que la presencia de efectos adversos es frecuente, dados principalmente por síntomas gastrointestinales (diarrea, vómito y estreñimiento), los cuales pueden ser identificados e intervenidos oportunamente18. Esta serie de casos reportó efectos secundarios leves tales como estreñimiento e hipertrigliceridemia, que fueron manejados con estrategias nutricionales. No se reportaron otros efectos secundarios adicionales, lo que podría estar en relación con el corto tiempo de seguimiento. Contrariamente a otros estudios que reportan una disminución de peso hasta de 5kg17,21, este estudio reportó aumento de peso en el 11% de los pacientes, lo que indica un incremento en la ingesta calórica o de grasas sin una reducción suficiente en el consumo de hidratos de carbono. Adicionalmente, la falta de un seguimiento regular impidió obtener datos de perfil lipídico y otros paraclínicos de manera periódica, los cuales permiten relacionar los resultados con el aumento de peso de los pacientes contrario a otros estudios6,24. Se debe considerar además la posibilidad de que la adherencia a la dieta no siempre fue la esperada. Al no tener el reporte de cetosis, se desconoce si hubo o no exceso de ingesta de hidratos de carbono.
Se consideró importante evaluar el impacto de la DC en la calidad de vida y en el estado de ánimo de los pacientes que siguen la terapia cetogénica, teniendo en cuenta que otras publicaciones han evidenciado efectos favorables7,24. Kossoff y Dorward reportaron que 6 de los pacientes que siguieron la DC durante 12 semanas con DC, mejoraron en 13 puntos su percepción de calidad de vida en general y 3 experimentaron mejoría en más de 20 puntos9. Además, Mosek et al. describieron otros efectos beneficiosos de la DC a nivel del estado de alerta y la concentración a pesar de que en el grupo en general la puntuación a nivel de calidad de vida no presentó cambios significativos24. Lambrechts et al. informaron que el 60% de los pacientes reportó mejoría en el estado de alerta durante la DC17. Esta serie de casos evaluó la calidad de vida posterior al inicio de la dieta, encontrado una valoración general como mala, siendo los efectos de la medicación y la preocupación por las crisis lo que parece afectar en mayor medida su percepción.
Los investigadores reconocen las limitaciones metodológicas dadas por la baja frecuencia de pacientes candidatos, y también operativas por las dificultades para el seguimiento por no contar con un programa interdisciplinario de terapia cetogénica que permitiera realizar los seguimientos por neurología, nutrición y exámenes bioquímicos, dentro de los tiempos y parámetros recomendados; por otra parte, al no contar con la valoración de la calidad de vida previo al inicio de la dieta, no se pudo determinar si se presentó algún cambio en la percepción asociado a la misma. Se requiere implementar un programa multidisciplinario de evaluación y seguimiento en el ámbito ambulatorio en las instituciones participantes en el estudio. No obstante, estos resultados podrían constituirse en un insumo para las instituciones interesadas en incorporar programas de seguimiento y uso de la DC como alternativa terapéutica en pacientes adultos con epilepsia refractaria para los cuales no hay otras opciones de tratamiento. Si bien se requiere de un equipo entrenado, los recursos en talento humano necesarios están disponibles en la mayoría de las instituciones.
Se requieren más estudios aleatorizados para documentar la respuesta a largo plazo, el tipo de DC más conveniente para el grupo poblacional, el efecto en la reducción de las hospitalizaciones, los ahorros para el sistema de salud y el mejoramiento de la calidad de vida de los pacientes.
Consideraciones éticasEl presente es un estudio con riesgo mínimo para la salud y la integridad de los participantes; en él no se realizaron intervenciones en las variables biológicas, fisiológicas, sicológicas o sociales de los sujetos de estudio. Adicionalmente se cumple con los principios bioéticos de la declaración de Belmont y los principios éticos consignados en la declaración de Helsinki. El estudio fue aprobado por el comité de ética del Hospital Militar Central bajo el protocolo 2017-037.
Conflicto de interesesLuz Helena Castaño trabaja en el departamento de asuntos médicos de Nutricia Colombia. El resto de los autores declaran que no existe ninguna relación económica, personal, política o académica con cualquier fuente que tenga algún interés en los resultados de la investigación y que pudiera influenciar los resultados de la investigación.