La incorporación de nuevas terapéuticas en el ataque cerebrovascular isquémico (ACVi), junto al desarrollo de imágenes con inteligencia artificial (IA) han permitido extender la ventana terapéutica (VT) generando un cambio de paradigma en la atención de estos padecimientos. Nuestro objetivo es presentar la experiencia en la implementación del uso de software automatizado de análisis de imágenes en el screening de pacientes con sospecha de ACV hiperagudo en un centro integral de stroke (CIACV).
Material y métodosRegistro observacional prospectivo de pacientes con sospecha de ACVi ingresados en un CIACV, estudiados con neuroimágenes analizadas con el software RAPID-AI. Las variables discretas se expresaron en porcentajes, las continuas en media y desvío estándar o mediana con intervalo intercuartil, según corresponda.
ResultadosSe realizaron 2.062 análisis en 1.092 pacientes, 303 fueron ACVi/AIT, 138 ACV hemorrágicos (HIC). Edad media 64,8 (DE 17,1) años, 55% femenino. La media de e-ASPECTS 8,4 (± 2,1); en 37 (10,5%) pacientes el score fue ≤ 5. El analisis de detección automatizada diagnosticó 85 oclusiones de arteria cerebral media y 149 HIC. El core isquémico en perfusión por tomografía fue 35,4mL (± 39,6) y en resonancia de 41,5mL (± 69,1). El volumen de Tmax> 6” fue 107,8mL (± 157,2). La penumbra isquémica fue de 42,6mL (± 114,6). Se realizaron 113 tratamientos de reperfusión.
ConclusiónLa implementación de un software de análisis de imágenes por IA permite estandarizar la información obtenida de las neuroimágenes en forma rápida y segura, aportando datos necesarios para el tratamiento de pacientes con ACVi en VT prolongadas.
The implementation of new therapies for acute ischemic cerebrovascular attack (AIS) together with the development of images with artificial intelligence (AI) has made it possible to extend the therapeutic windows generated a paradigm shift in the care of AIS. The aim is to present the experience in the implementation of the use of automated image analysis software in the screening of patients with suspected hyperacute stroke in a comprehensive stroke center (CSC).
Material and MethodsProspective observational registry of patients with suspected stroke admitted to a CIS, evaluated with neuroimaging analyzed with the RAPID-AI software. Discrete variables were expressed as percentages, continuous variables as mean and standard deviation or median with interquartile range as appropriate.
Results2062 analyzes were performed in 1092 patients, 303 were stroke / TIA, 138 hemorrhagic strokes (ICH). Mean age 64.8 (SD 17.1) years, 55% female. The mean of e-ASPECTS 8.4 (± 2.1); in 37 (10.5%) patients the score was ≤ 5. Automated detection analysis diagnosed 85 large vessel occlusions and 149 ICH. The ischemic core in perfusion by tomography was 35.4mL (± 39.6) and in magnetic resonance imaging was 41.5mL (± 69.1). The volume of Tmax> 6” was 107.8mL (± 157.2). The ischemic penumbra was 42.6mL (± 114.6). 113 reperfusion treatments were performed.
ConclusionThe implementation of an AI image analysis software allows to standardize the information obtained from the neuroimaging in a fast and safe way, providing the necessary data for the treatment of patients with CVA in prolonged VT.
La incorporación de nuevas posibilidades terapéuticas para el ataque cerebrovascular isquémico agudo (ACVi), de la mano de tecnologías novedosas en imágenes, han permitido identificar exitosamente el tejido cerebral pasible de ser reperfundido aun en ventanas terapéuticas inimaginables. Esto, unido a los avances en el campo de la neuroradiología intervencionista, en principio, con los stent retriever de segunda generación y las técnicas de tromboaspiración, han generado un cambio en el paradigma de la reperfusión cerebral1–5.
Las imágenes han permitido entender mejor los cambios que ocurren en el tejido cerebral cuando se enfrenta a cambios en su perfusión por la oclusión de un gran vaso cerebral (OGVC). Dichos avances permitieron identificar la existencia de un patrón de comportamiento tisular capaz de extender la ventana terapéutica (VT) más allá de las 4,5 h. Esto se logró con el desarrollo de investigaciones que surgen a partir de estudios como el DEFUSE y EPITHET, que utilizaron la resonancia magnética (RMI) para el estudio del ACVi con técnicas de diffusion-weighted imaging (DWI) y perfusion-weighted imaging (PWI), seguidos por varios trabajos más (tabla 1)6-9.
Trabajos que dieron desarrollo a los conceptos que llevaron a la plataforma RAPID
| Estudio | |
|---|---|
| DEFUSE (DW/PWI Evaluation For Understanding Stroke Evolution study) | Evaluó el uso de tPA-IV de 3 a 6 h; estableció empíricamente un perfil maligno entre la relacion DWI/PWI. Lo definió como una restricción en DWI basal ≥100mL y/o un volumen de Tmax>8”≥100mL. Fue el primer estudio que mostró una respuesta clínica diferente post reperfusión entre subgrupos de pacientes con diferentes perfiles en la RMI6 |
| EPITHET | Realizó un análisis más adecuado del MM para seleccionar candidatos elegibles para tPA-IV más allá de las 3 h a través del coregistro de áreas de DWI/PWI. Planteó la necesidad de desarrollar un software apropiado para proporcionar un análisis rápido de estas imágenes, dado que el principal inconveniente de esta técnica era que los algoritmos de procesamiento de RMI disponibles requerían la entrada manual de los datos y, por lo tanto, consumían mucho tiempo siendo además dependiente de un operador7 |
| Refining the Definition of the Malignant Profile | Redefine mejor el patrón maligno que se comporta desfavorablemente luego de la reperfusión. Este patrón se predijo con mayor sensibilidad a través del estudio de PWI y correspondió a un volumen>85mL de Tmax>8”. La secuencia de DWI tambien pudo establecer un patrón predictivo de mal resultado pero con menor sensibilidad, correspondiendo a un volumen de DWI>80mL8 |
| RAPID Automated Patient Selection for Reperfusion Therapy | Su objetivo fue determinar si se podía utilizar un software de análisis de RMI automatizada para identificar a los pacientes con ACVi en los que la reperfusión se asocia con mayor probabilidad de buen resultado. El target MM correspondía a una relacion>1.2 entre el Tmax>6”/volumen de DWI, con una diferencia absoluta>10mL entre Tmax>6” y volumen de DWI (penumbra isquémica) y que además no cumplían los criterios para los perfiles maligno (volumen de DWI o Tmax>8” igual o mayor a 100 mL) o pequeño (volumen <10mL en DWI y en el Tmax>6”)9 |
Fue asi que ocurrió un cambio de paradigma en la atención médica del ACVi, comprendiendo que el tiempo no era un limitante principal para excluir a los pacientes del tratamiento de reperfusión, sino más bien lo eran los cambios tisulares originados durante la isquemia, surgiendo asi los marcadores tisulares.
El beneficio que presenta este tipo de analisis es claro cuando observamos los resultados de los estudios DAWN, DEFUSE 3 y su metodología de selección de pacientes para el tratamiento endovascular del ACVi por OGVC en VT entre las 6 y 24 h; ambos utilizaron el software RAPID de análisis automatizado de imágenes basados en inteligencia artificial (IA). Analizaron imágenes de tomografía computada (TC) o RMI y sus resultados cambiaron la forma en que pensamos la fisiopatología de la isquemia cerebral, entendiendo que el tiempo transcurrido en isquemia no es absoluto y que de esta relatividad surgirán pacientes que a pesar de las varias horas transcurridas en isquemia, pueden beneficiarse de la trombectomía mecánica (TM)10,11. Dicha información se ve reflejada en las guías terapéuticas tanto a nivel nacional como internacional con los más altos grados de evidencia para su uso12,13. Es asi que hoy este tipo de análisis es vital para poder tratar pacientes con ventanas hiperextendidas.
¿Y qué relacion tiene lo antedicho con la IA? Entendemos que el objetivo de la misma en algún punto es imitar las funciones cognitivas humanas y que para esto requiere del procesamiento de grandes volúmenes de información para obtener como resultado una respuesta esperable del razonamiento humano. Es así que los software basados en IA analizan la información proveniente del estudio de un paciente en un momento dado y esto se compara y analiza con la información proveniente de la experiencia previa de múltiples estudios y la teoría aportada por investigaciones previas. De la integración de estos datos surge una respuesta útil en el manejo hiperagudo del ACVi que permite la estandarización de la información permitiendo rápidamente detectar la presencia de un evento cerebrovascular, la extensión del mismo ya sea a nivel de su core isquémico, su penumbra y la presencia de OGVC. Esta respuesta puede ser dicotómica o sea «sí/no», «OGVC sí» vs. «OGVC no», «Hemorragia sí» vs. «Hemorragia no», «TM sí» vs. “TM no» o categórica por ejemplo un cálculo del score de la escala de Alberta Stroke Program Early CT Score (ASPECTS). La interpretación de estos resultados se realiza por medio de un algoritmo, que determina si el paciente estudiado tiene los perfiles adecuados para obtener un buen resultado funcional frente a la reperfusión (fig. 1C).
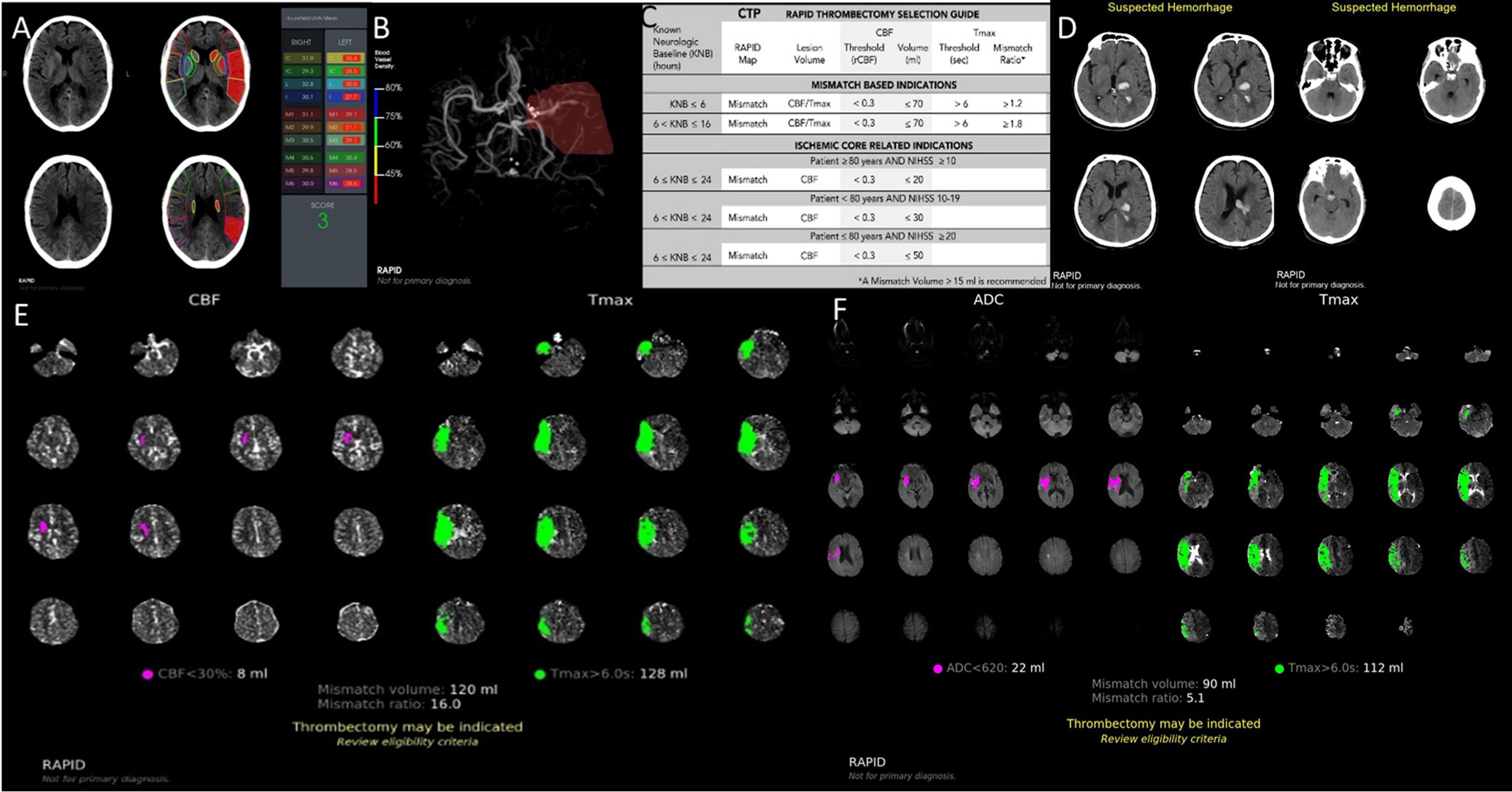
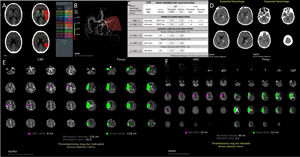
Presentación de imágenes por plataforma RAPID-AI. A. Cálculo automatizado del e-ASPECTS. B. Detección automatizada de OGVC, en este caso ACM izquierda con reducción de la densidad de señal del 0-45% respecto contralateral. C. Guía para la selección de pacientes candidatos a TM. D. Detección automatizada de hemorragia intracraneal. E. Mismatch (MM) en TC, entre core isquémico medido en perfusión, corresponde al volumen del flujo sanguíneo cerebral (CBF) <30% y la penumbra que corresponde al volumen de Tmax>6”; en este caso el MM volumen es de 120mL y el MM ratio (CBF <30%/Tmax>6”) de 16,0. F. Cálculo del MM en RMI, core isquémico medido en ADC<620 y penumbra medido en Tmax>6”; en este caso el MM volumen es de 90mL y el MM ratio (ADC<620/Tmax>6”) es de 5,1.
La implementación de dichas técnicas produce información heterogénea generada por los distintos métodos de procesamiento de imágenes. Para superar estas barreras se diseñó RAPID, un sistema independiente del operador para el análisis de información proveniente estudios de PWI y DWI, constituyéndose en un software de procesamiento de imágenes de RMI automatizado que proporciona una evaluación objetiva en un paciente determinado. Su utilidad reside en que los mapas cuantitativos de DWI y PWI generados se utilizan para seleccionar pacientes en los que la reperfusión se asocia con una mayor probabilidad de buen resultado. Posteriormente se incorporó el analisis de la TC no contrastada (TC-NC), los mapas de perfusión por TC (TC-P), y la angiotomografía de cerebro (TC-A). Esto hizo que el software de análisis de imágenes automatizado proveniente, tanto de la RMI o la TC, sea una herramienta potencialmente útil para la selección de pacientes en ensayos clínicos de reperfusión cerebral en ACVi.
Es nuestro objetivo presentar la experiencia en la implementación de la IA a través del software RAPID para el screening de pacientes con sospecha de ACV hiperagudo en un centro integral de ACV.
Material y métodosSe llevo a cabo un registro observacional prospectivo que incluyó a pacientes con sospecha de ACVi ingresados en un centro integral de ACV, que fueron estudiados con TC o RMI y sus resultados analizados con el software RAPID-AI. Las variables discretas se expresaron en porcentajes, las continuas en media y desvío estándar o mediana con intervalo intercuartil según corresponda. En todos los casos se obtuvo consentimiento informado al ingreso a la institución.
El software comenzó a utilizarse en la institución en el mes de febrero de 2020, los tres meses iniciales correspondieron a un período de instrucción, aprendizaje e inserción del algoritmo diagnóstico. Durante el período de instrucción todos los médicos vinculados al tratamiento agudo del ACV (neurólogos, radiólogos, neurorradiólogos intervencionistas) debieron cumplir el período de entrenamiento y certificación del programa RAPID-U.
En el mes de marzo de 2020 se modificó el protocolo de estudio de los pacientes que ingresaban con diagnóstico de déficit neurológico focal debido al inicio de los primeros casos de coronavirus en el país. Dicho protocolo dejó de priorizar a la RMI como estudio de primera línea por la TC-NC, TC-P, TC-A de vasos de cuello y cerebro, y por último TC de torax. La RMI con protocolo de ACV se utilizó según criterio del neurólogo a cargo14.
Las imágenes fueron adquiridas con un tomógrafo computado espectral de doble capa de detectores IQon Spectral CT (Philips Healthcare, Best, Holanda) y con equipo de resonancia magnética Phillips Achieva 3 Tesla.
Plataforma RAPID-AILa plataforma de software Rapid basa su utilidad en la aplicación de la IA en el análisis de las imágenes, y así la información generada se incorpora en el flujo de trabajo del equipo médico por medio de las aplicaciones móviles permitiendo la toma de conductas más rápida y estandarizada. Para lograrlo el software está conformado por una serie de módulos de análisis utilizados en la evaluación y caracterización de las neuroimágenes para el diagnóstico del ACV isquémico y hemorrágico. El software procesa información de un escáner de TC o RMI generando imágenes automatizadas que se utilizan en la toma de decisiones en el ACV agudo. Los resultados son transmitidos al Picture Archiving and Communication System (PACS) de la institución, a la aplicación (app) móvil en los smartphone, correo electrónico y aplicación web de los médicos del equipo, todas herramientas aplicadas para el acceso rápido a la información por el equipo tratante. Los módulos de tomografía incluyen TC-NC para el cálculo automatizado de la escala de Alberta Stroke Program Early CT Score (e-ASPECTS), detección de hemorragia intracraneal (HIC) y TC contrastadas para la obtención de estudio de TC-P, TC-A para reconocimiento automatizado de OGVC del circuito anterior. Los módulos de RMI evalúan las secuencias de imágenes DWI y PWI.
La escala de ASPECTS se genera automáticamente para evaluar los signos tempranos de la isquemia cerebral que identifica las regiones con cambio isquémico temprano predictoras de daño irreversible del tejido en TC sin contraste. El programa recibe datos de la TC estándar e identifica las 10 regiones ASPECTS. Las regiones con asimetría de densidades en unidades Hounsfield (UH) son identificadas por un sistema de clasificación basado en algoritmos de aprendizaje informático validado. Se genera una tabla adyacente a las imágenes donde pueden compararse los datos en UH para cada región (fig. 1)15.
La detección de OGVC se realiza sobre vasos de la circulación anterior, el software analiza diferencias de la densidad vascular que depende del flujo intravascular. El algoritmo de análisis trabaja comparando las densidades a derecha e izquierda del segmento M1 de la arteria cerebral media (ACM). Si no se detecta asimetría significativa en el segmento M1, el sistema seguidamente evalúa regiones más distales del territorio de la ACM, en búsqueda de asimetría en la densidad vascular (fig. 1)16.
El análisis de la TC-P se realiza generando mapas paramétricos. Uno de ellos es el mapa de mismatch (fig. 1), constituido por el parámetro de perfusión de Tmax (zonas donde el contraste llega en forma retrasada). En color verde sobre el cerebro se representa el área de Tmáx > a 6” que corresponde de alguna manera con el tejido en penumbra (riesgo de daño irreversible en caso de no reperfundir). Por otro lado, en forma paralela se genera el mapa de flujo sanguíneo cerebral (CBF), representando en color rosa la zona con reducción considerable del mismo, menor al 30% del contralateral y que corresponde con el área que posee altas posibilidades de evolucionar a un infarto por lo que se lo considera “core isquémico”. La diferencia (mismatch) de volúmenes entre ambos mapas se utiliza para estimar el tejido que aún podría recuperarse.
ResultadosEn el periodo de febrero de 2020 a marzo de 2021 se estudiaron 1.092 pacientes realizando 2.063 análisis de módulos con el sistema RAPID. El período correspondiente a febrero-abril de 2020 se consideró de instrucción. Del total de análisis, 1.957 (94,5%) fueron exitosos; de los 106 (4,5%) análisis no exitosos, 55 (51,9%) correspondieron a los primeros tres meses de uso.
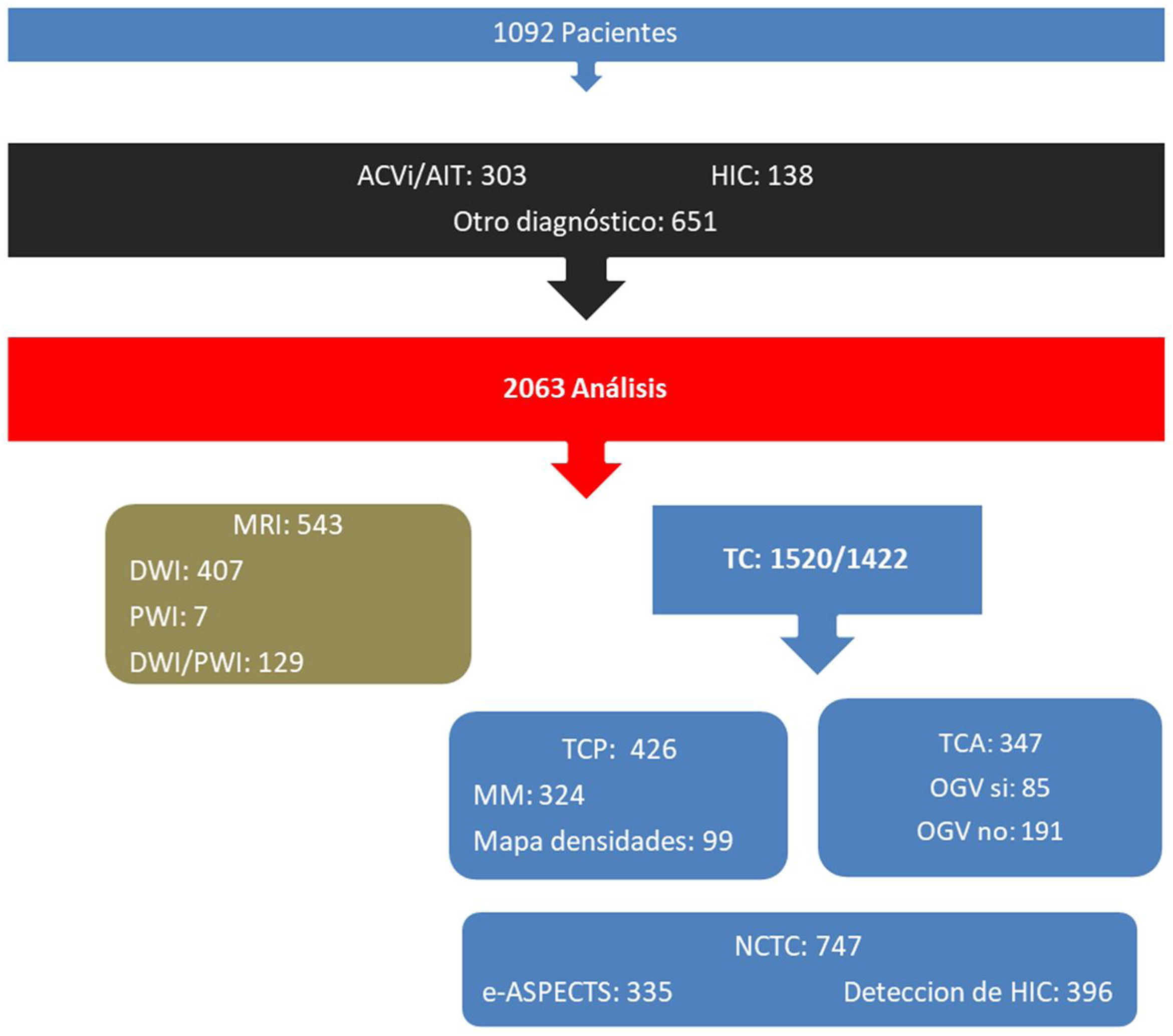
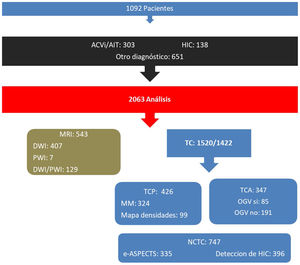
De los 1.092 pacientes estudiados, 441 (40,4%) se diagnosticaron como ACV, de los cuales 303 fueron ACVi/AIT y 138 ACV hemorrágicos, mientras que los 651 (59,6%) pacientes restantes correspondieron a otros diagnósticos (fig. 2). En la figura 3 se observa la distribución de pacientes analizados por mes.
Pacientes ingresados con déficit focal neurológico (1.092) con su posterior división diagnóstica y distribución de análisis por módulos de imágenes realizados (total: 2.063; exitosos 1.957) según tipo de estudio.MRI: imagen de resonancia magnética; DWI: diffusion-weighted imaging; PWI: perfusion-weighted imaging; TC: tomografía computada; TCP: perfusión por tomografía computada; TCA: angiografía por tomografía computada; OGVC: oclusión de gran vaso cerebreal; e-ASPECTS: cálculo de Alberta Stroke Program Early CT Score automatizado por inteligencia artificial; NCTC: tomografía computada no contrastada; HIC: detección automatizada por inteligencia artificial de hemorragia intracraneal.
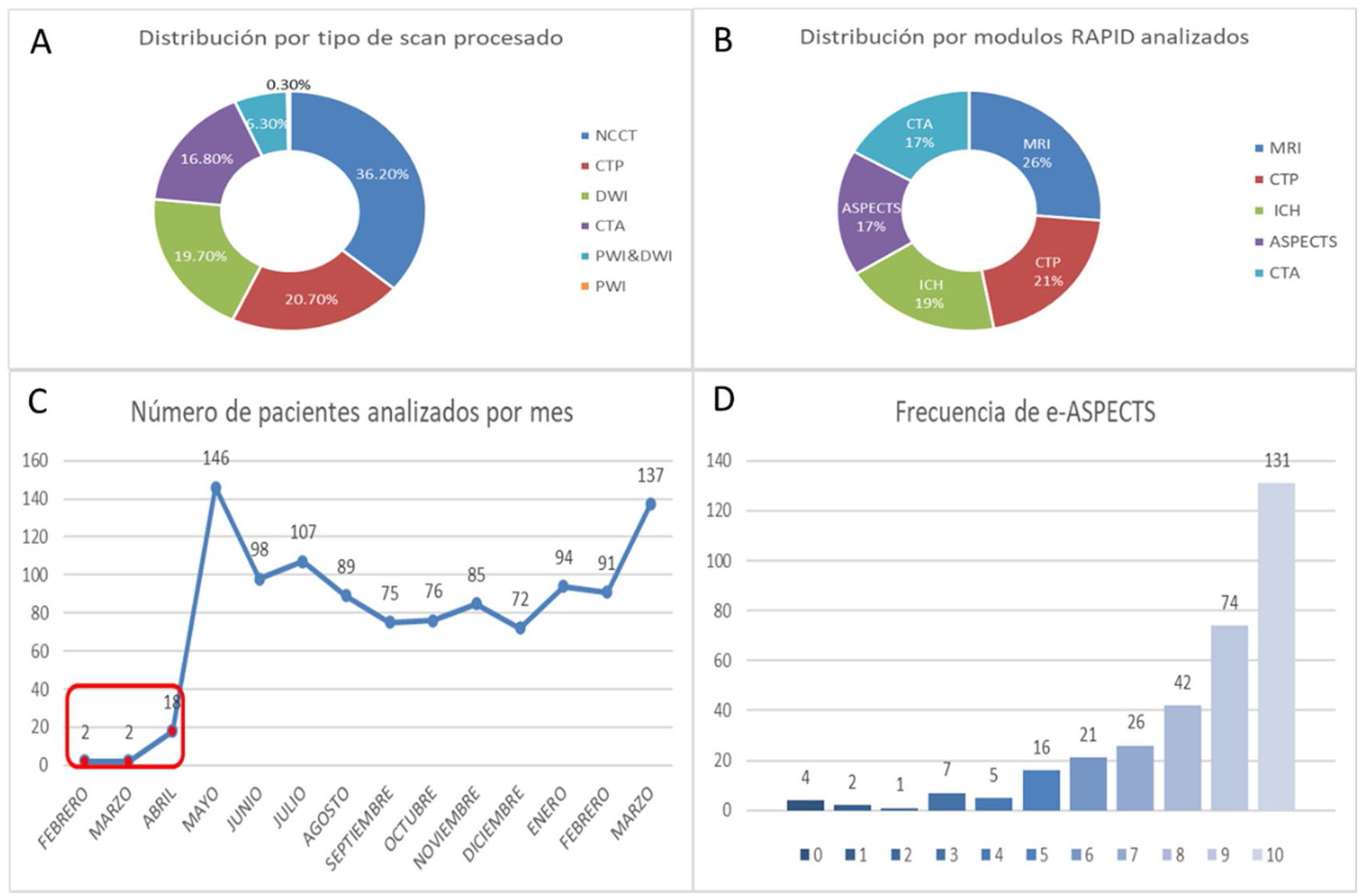
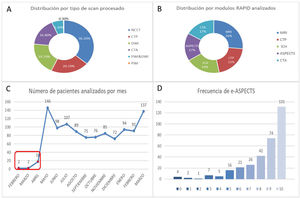
A. Distribución por tipo de estudio analizado. B. Distribución por módulo de imagen. C. Número de pacientes analizados por mes, en rojo corresponde el periodo de instrucción y ajuste técnico. D. Frecuencia de presentación de score de e-ASPECTS. NCCT: tomografía no contrastada; CTP: perfusión por tomografía computada; DWI: diffusion-weighted imaging; CTA: angio tomografía computada; PWI: perfusion-weighted imaging; MRI: imagen de resonancia magnética; ICH: hemorragia intracraneal; ASPECTS: Alberta Stroke Program Early CT Score.
La edad media fue de 64,8 (DE 17,1) años, el 55% correspondió a género femenino. La distribución de módulos analizados fue RMI 543 (26,3%), TC-P 426 (20,7%), análisis de HIC 398 (19,2%), cálculo de e-ASPECTS 353 (17,0%) y TC-A 347 (16,8%). El análisis por tipo de scan correspondió a TC-NC 747 (36,2%), TC-P 426 (20,7%), DWI 543 (19,7%), TC-A 347 (16,8%), PWI/DWI 129 (6,3%) y PWI 7 (0,3%) (figs. 2 y 3).
El tiempo medio de procesamiento del módulo (segundos) se distribuyó de la siguiente manera: TC-A 109,2”, TC-P 89,6”, DWI 90”, TC-NC 210.0,1”, PWI 26,9”, PWI/DWI 49”, que sobre un total de 1.957 analisis da un promedio de tiempo de procesamiento por módulo de 87,4”.
El análisis de detección automatizada de OGVC diagnosticó 85 (30%) oclusiones de ACM sobre 283 análisis, el mismo es realizado sobre los datos aportados por la TC-A, incluyen a la reducción de la densidad vascular respecto al contralateral entre 0-45% y 46-60%, graficadas en color rojo y amarillo, respectivamente. Con el software de detección automática de hemorragias se diagnosticaron 149 (37,9%) HIC sobre un total de 393 análisis en el módulo de TC-NC (fig. 1).
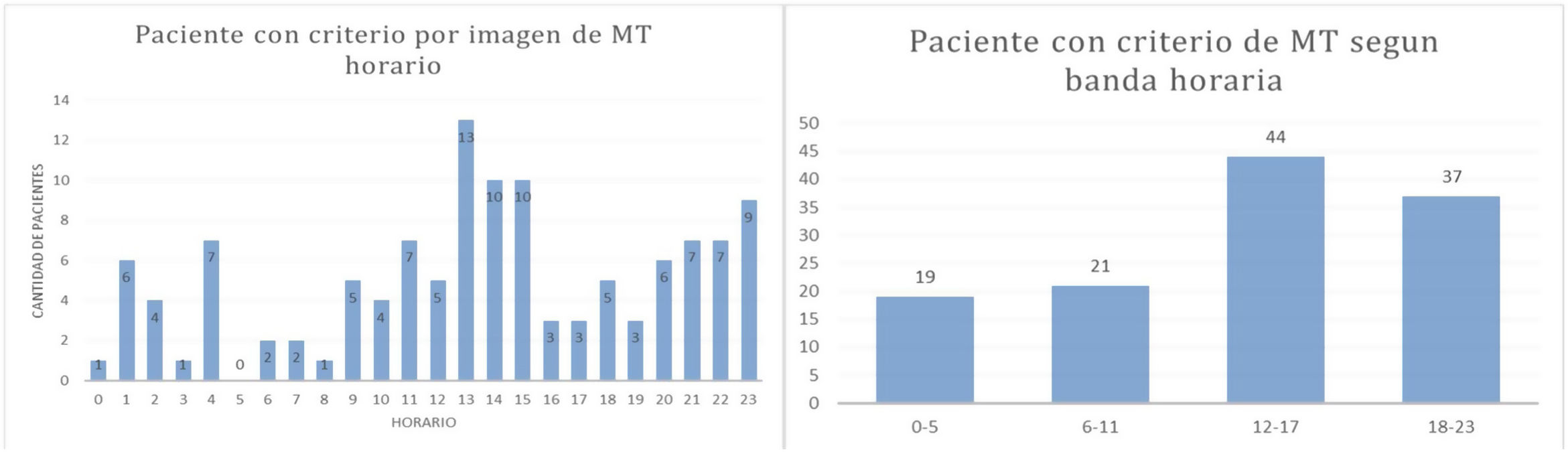
Si se aplican los criterios de selección por imágenes para TM (SWIFT-PRIME, EXTEND-IA, DEFUSE 3) encontramos que, sobre un total de 444 pacientes, 121 (37,5%) cumplen con los mismos. La principal franja horaria de ingreso de estos pacientes fue entre las 12:00 y 23:00 horas, consultando en este horario 81 (66,9%) pacientes.
De los 353 cálculos de e-ASPECTS, fueron analizados con éxito 335, la media correspondió a 8 (± 2) y 37 (10,5%) de estos pacientes presentaron un score 0-5. El core isquémico fue medido en TC-P por el volumen de CBF <30% o en RMI por el volumen de ADC<620; estos se correspondieron con una media de 35,4mL (± 39,6) y 41,5mL (± 69,1), respectivamente.
El volumen de Tmax>6 segundos mostró una media de 107,8mL (± 157,2) y fue medido tanto en los estudios de TC-P como en PWI. El cálculo de la penumbra isquémica que corresponde a la diferencia entre el volumen del core isquémico y el volumen del Tmax>6 s es informado como volumen de mismatch (MM) y su media fue de 42,6mL (±114,6). Tambien se calculó el volumen de tejido que se correlaciona con mayor compromiso de la circulación colateral, lo que se realiza a través del cálculo del Tmax> 10 segundos y que correspondió a una media de 17,4mL (± 57,3).
DiscusiónLuego de un periodo de instrucción técnico y teórico del equipo multidisciplinario de ACV, se logró obtener información consistente del uso de RAPID-AI, con bajo margen de error, dentro de los estándares más altos para el tratamiento del ACVi agudo que permitió integrar a los pacientes al tratamiento endovascular en VT mayores a las 6 h, según las normas actuales de tratamiento hiperagudo del ACVi.
RAPID fue validado luego del estudio DEFUSE 2 en 2012 y recibió la aprobación de la Food and Drug Administration (FDA) en 2013 para su uso en la evaluación de pacientes con diagnóstico de ACVi agudo. En diciembre de 2018, iSchemia-View recibió la aprobación 510 (k) por la FDA como guía para la selección de pacientes para TM. En la Argentina, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó su uso en enero de 2020 como software de procesamiento de imágenes para el estudio de ACV en su fase aguda.
Luego del período de instrucción inicial de tres meses en el que el equipo multidisciplinario cumplió la etapa de formación teórica y técnica, se continuó con la etapa de trabajo de campo.
El software analizó los estudios de perfusión de TC y RM generando mapas de perfusión colorimétricos para el core isquémico y la penumbra (fig. 1)17. La tecnología de IA se utilizó en los ensayos de terapia endovascular (TEV) para OGVC, como fueron EXTEND-IA, SWIFT-PRIME, CRISP, DEFUSE 2, DEFUSE 3 y DAWN2,5,10,11,17,18. Sus resultados fueron utilizados en las guías de manejo del ACVi agudo para desarrollar los criterios de selección de pacientes con OGVC en ventana hiperextendida candidatos a TEV.
Un aspecto fundamental para la comprensión de este punto es que no en todos los pacientes el tejido cerebral se comporta igual frente a la isquemia, dependiendo de distintas variables que hacen que algunos pacientes progresen rápidamente a infartos de gran volumen y otros de forma más lenta. Es así que pacientes con poco tiempo de evolución desde el inicio delos síntomas, por ejemplo menos de una hora, pueden tener un gran core isquémico mayor o igual a 50mL, mientras que otros pacientes con más de 12 h de evolución desarrollan un core isquémico de tan solo 5mL, surgiendo el concepto de «la paradoja de la VT tardía», en alusión al comportamiento paradójico no lineal tiempo/volumen19.
Es importante reconocer que la aprobación de estos algoritmos que otorga la FDA y la ANMAT permite que sean utilizados por profesionales capacitados, y no como un sustituto de la toma de decisiones médicas. Por lo tanto, en la práctica clínica, el uso del software de IA puede ayudar a los médicos a detectar con precisión las características de comportamiento de un ACV20.
Es de destacar que el inicio del uso de la plataforma en nuestra institución coincidió con las primeras manifestaciones de la pandemia por COVID-19 en la Argentina, lo que motivó cambios en los protocolos de recepción de los pacientes con sospecha de ACV que generaron mayor demanda de tiempo en el triage inicial del paciente. Por lo tanto, se debió enfrentar dos aspectos, uno vinculado con la implementación de una nueva tecnología y, el otro, el de la inserción de la misma en una situación de cambios en los protocolos de triage junto con la implementación de nuevas normas de bioseguridad.
El procesamiento automatizado de las imágenes puede favorecer las métricas, ya que aporta rápidamente información estandarizada a todo el equipo terapéutico facilitando la toma de conducta integrada y sin demoras. La información distribuida a todo el equipo corresponde a los patrones de MM, la detección automática de OGVC, e-ASPECTS, la presencia o no de HIC. Esto se llevó a cabo con el uso integrado de las app JOIN y RAPID a nivel de los equipos de smartphone, lo que permitió la transversalidad de la información y una rápida toma de conducta integrando la telemedicina y la IA. Se ha descrito que el uso de la aplicación JOIN se asoció con una reducción significativa en los tiempos puerta a aguja a lo largo de los períodos pre y post implementación de la misma (mediana, 90 [rango intercuartílico, 75-106] vs. 63 [rango intercuartílico, 61-117] minutos; =0,03)21. La mejora de las métricas como el tiempo puerta-ingle ha sido descrita con el uso de la app RAPID Mobile logrando una significativa reducción del tiempo puerta-ingle de 33 minutos22.
En nuestro país, cada vez se ponen en práctica con mayor frecuencia los modelos «drip and ship» o «drip and drive» en el cual los pacientes con sospecha de ACVi son atendidos en centros primarios donde pueden recibir tratamiento fibrinolítico y bajo la confirmación/sospecha de OGVC el paciente se deriva a un centro integral para continuar tratamiento endovascular o directamente una vez evaluado el paciente por el servicio de emergencia domiciliaria y ante la sospecha de OGVC realizar directamente el traslado al CIACV23–26. En el primer caso, se generan tiempos entre el inicio de los síntomas y la punción inguinal más prolongados, precisando por lo tanto más frecuentemente de estudios de imágenes que puedan habilitar el tratamiento de reperfusión endovascular en ventanas prolongadas10,11.
El número de scan analizados con éxito estuvo directamente relacionado con el periodo en que fue adquirido el estudio, el 51.9% de los analisis no exitosos correspondieron a los primeros 3 meses de uso del software, llegando en el último mes a solo 1 error sobre 262 analisis (0.004%). Esto demuestra que superado el periodo de aprendizaje en la adquisición de las imágenes según los requisitos solicitados por Ischemia View, la obtención de datos técnicos confiables es factible a pesar del trabajo en situación de pandemia.
La utilidad del e-ASPECTS fue estudiada en el ACVi agudo, encontrando una mejor coincidencia en su cálculo automatizado que entre observadores médicos15. Uno de los usos más interesantes de la escala es la de detectar eventos de gran volumen de core por sus consecuencias en el pronóstico y tratamiento. En este tipo de pacientes el cálculo automatizado fue más preciso que el cálculo de los médicos experimentados en la identificación de signos tempranos de isquemia cerebral, teniendo como referencia lo documentado en DWI27. En 37 pacientes (10,5%) observamos que el score de e-ASPECTS fue ≤ 5, situando a estos pacientes en el grupo ACVi con gran volumen de core isquémico, con el peor curso evolutivo tanto en resultados de discapacidad y sobrevida. Dicho grupo de pacientes se encuentra actualmente en estudio en ensayos clínicos para determinar su evolución frente a la TEV, dado que los reportes provenientes de series de casos son alentadores teniendo en cuenta que una proporción de pacientes de hasta el 25% pueden obtener un mRS ≤ 228–30.
Con respecto a la detección automatizada de OGVC intracraneal (arteria carótida interna y/o segmento M1) el software presenta una sensibilidad, valor predictivo negativo y especificidad de 0,94, 0,98 y 0,76, respectivamente. Con respecto a la oclusión del segmento M2 de la ACM y OGVC, los valores fueron 0,92, 0,97 y 0,81, respectivamente16. El 30,4% (85) de los pacientes a los que se le realizó una TC-A por sospecha de ACVi y fueron analizados por el software de detección automática, donde se les diagnóstico una OGVC en territorio de la arteria carótida interna intracraneal o ACM.
Durante el período en estudio se realizaron 113 tratamientos de reperfusión, pero sólo 85 paciente fueron diagnosticados con OGVC por el software automatizado. Esta diferencia tiene varios motivos, el primero es que de los 1.092 pacientes estudiados, solo a 283 se les realizó el analisis por TC-A; el segundo es que solo analiza el territorio de la ACM, y el tercero es que el 26% de los pacientes fueron estudiados por RMI y en ese caso no se realiza el análisis automatizado de OGVC.
De la realización de los mapas de MM y cuantificación del core isquémico, tanto por TC como para RMI, se establece una guía para la selección de pacientes candidatos a TM basada ya sea en el MM (core/penumbra) o en la relación del volumen del core isquémico, edad y el score en National Institutes o Health Stroke Scale (NIHSS) dependiendo de la VT en curso sea <6h o de 6 a 24 h (fig. 1). El estudio FRAME reafirma el concepto de la utilización del MM (volumen de core <70mL, MM ratio> 1,2 y MM volumen>10mL) como herramienta para identificar a los pacientes con posibilidades de responder favorablemente a la reperfusión endovascular en VT tempranas, mientras que los estudios DAWN y DEFUSE 3 lo hacen para VT extendidas10,11,31,32. Otro aspecto de la importancia de poder evaluar de esta manera los pacientes antes de realizar una TM en ventana hiperextendida, es identificar a los pacientes con un perfil core/penumbra que prediga la futilidad del resultado de la reperfusión.
Se registró con la aplicación una distribución horaria polarizada de la llegada de pacientes con criterio imagenológicos (SWIFT-PRIME, EXTEND-IA, DEFUSE 3) para TM, y el horario con mayor cantidad de estudios que aplican corresponde a la banda horaria de 12:00 a 17:00 h donde se concentraron 44 (36,4%) pacientes de los 121 identificados por el sistema (fig. 4)2,5,11.
Un aspecto a resaltar es la alta proporción de ACV hemorrágico en la muestra analizada. Sobre 441 ACV 138 (31,3%) fueron hemorrágicos, notablemente superior a la proporción epidemiológica entre ACVi/hemorrágicos, lo que se explica por la derivación de pacientes a la institución para el tratamiento con diagnóstico de hemorragia subaracnoidea y hemorragias asociadas a malformaciones arteriovenosas.
Una limitación del estudio es que en este caso solo estamos haciendo el analisis de la implementación del uso de la IA en el analisis de las imágenes en el ACVi hiperagudo, y no la utilidad del mismo en el manejo de los pacientes con esta patología en nuestra institución, analisis que será motivo de un próximo trabajo.
ConclusiónEl empleo de un software automatizado de analisis de imágenes con técnica de IA permite estandarizar la información obtenida de las neuroimágenes en forma rápida y segura, aportando los datos necesarios para el tratamiento de pacientes con ACVi hiperagudo en VT prolongadas, siguiendo las recomendaciones de manejo de las guías nacionales e internacionales.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interésLos autores declaran no tener ningún conflicto de intereses.