La neuromielitis óptica es una enfermedad inflamatoria, desmielinizante, inmunomediada y recurrente del sistema nervioso central que afecta a los nervios ópticos y la médula espinal; puede coexistir con enfermedades autoinmunes, como el lupus eritematoso sistémico. Existen escasos reportes sobre el curso de la neuromielitis óptica durante el embarazo y el posparto que describen exacerbaciones graves. Se presenta el caso de una mujer de 27 años con diagnóstico de neuromielitis óptica y lupus eritematoso sistémico con embarazo sin complicaciones y recién nacido vivo a término y sin malformaciones congénitas, con curso estable de neuromielitis óptica y lupus eritematoso sistémico durante el embarazo y el puerperio. La evolución de estas enfermedades durante el embarazo y el posparto parece ser deletérea. Deben extremarse medidas para prevenir toxicidad fetal de drogas utilizadas para tratar estas afecciones.
Neuromyelitis optica is an inflammatory, demyelinating, recurrent immune-mediated central nervous system disorder that affects optic nerves and spinal cord and may coexist with autoimmune diseases like systemic lupus erythematosus. There are few reports on the effect of neuromyelitis optica during pregnancy and postpartum describing severe exacerbations. We report a 24 year old woman diagnosed with neuromyelitis optica and systemic lupus erythematosus with uncomplicated pregnancy and a full term live birth without congenital malformations with stable course of neuromyelitis optica and systemic lupus erythematosus during pregnancy and puerperium. The evolution of neuromyelitis optica and systemic lupus erythematosus during pregnancy and postpartum seems to be deleterious. A special effort should be put in place to prevent fetal toxicity of drugs used to treat these diseases.
La neuromielitis óptica (NMO) de Devic es una enfermedad inflamatoria, desmielinizante, severa y monofásica o recurrente del sistema nervioso central (SNC) que afecta a los nervios ópticos y la médula espinal en forma de mielitis transversa longitudinal extensa1.
El descubrimiento de un biomarcador sérico específico, el autoanticuerpo NMO-IgG dirigido contra el canal de agua acuaporina 4 (AQP4) en el SNC, indica que la enfermedad es inmunomediada. La NMO puede coexistir con enfermedades sistémicas autoinmunes, como el lupus eritematoso sistémico (LES)2. Existen escasos reportes en la literatura acerca del curso de la NMO durante el embarazo3-7, en los que se describen exacerbaciones graves durante el mismo y también en el posparto. Por otra parte, el LES, que también es una enfermedad inmunomediada por células B, empeora durante el embarazo8.
En este trabajo reportamos un caso de embarazo a término y sin complicaciones, con un recién nacido vivo en una mujer con NMO asociada a LES.
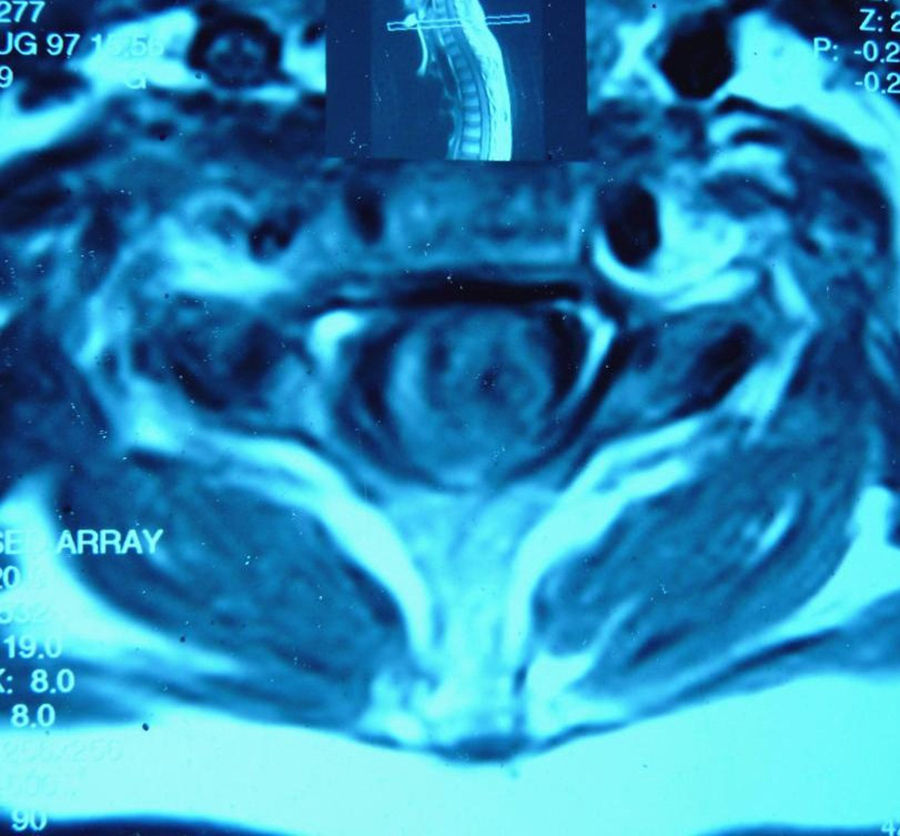
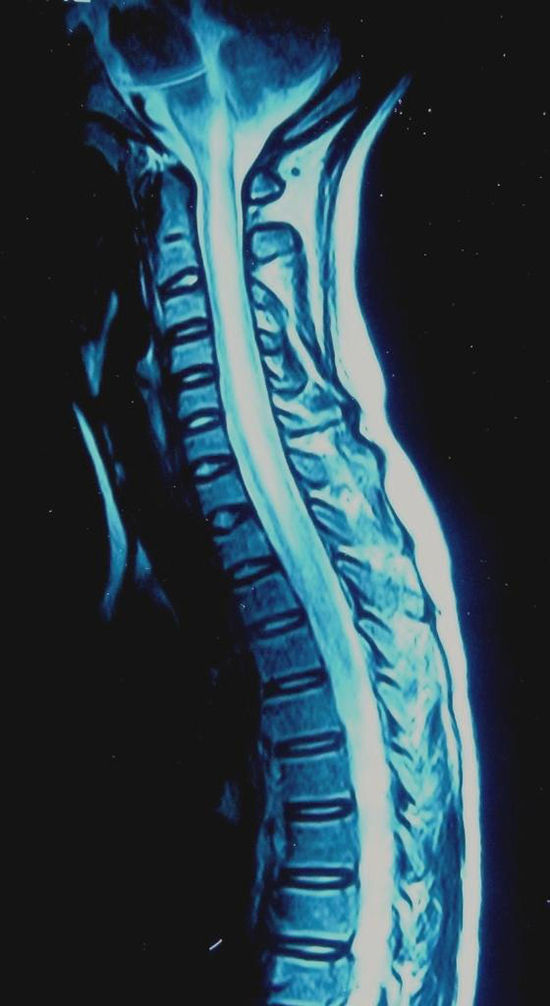
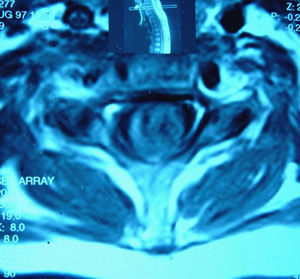
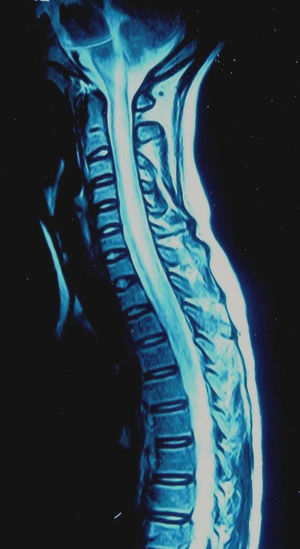
Caso clínicoSe presenta a una paciente mujer, de 27 años, que en agosto de 1997, a los 12 años de edad, es hospitalizada por presentar fiebre, paraparesia asociada a trastornos esfinterianos y de la sensibilidad superficial y profunda, con fondo de ojo normal. Evolucionó con vasculitis leucocitoclástica y fenómeno de Raynaud. El líquido cefalorraquídeo (LCR) mostró 436 células a predominio polimorfonuclear; cultivos para bacterias, hongos y serologías virales, negativos, electroforesis normal y bandas oligoclonales, negativas. Las resonancia magnéticas (RM) de encéfalo y columna lumbar fueron normales y la RM cervicodorsal evidenció una imagen longitudinal extensa, hiperintensa en T2, en segmentos cervicales y primeros dorsales sin refuerzo con el gadolinio (figs. 1 y 2). El laboratorio presentó FAN positivo 3 cruces, moteado grueso, anti-ADNn, anti-Sm y anti-Ro positivos, C3-C4 disminuidos y anticoagulante lúpico negativo. Con diagnóstico de mielitis transversa asociada a LES, recibió tratamiento con metilprednisolona (MP) por vía IV, con buena evolución. Durante la misma, presentó eritema malar y úlceras orales y en diciembre de 1998 presentó nuevo episodio de mielitis transversa asociado a disminución de la agudeza visual. El estudio del LCR y la RM de cerebro fueron normales, y la RM cervicodorsal mostró múltiples lesiones hiperintensas en T2. El potencial evocado visual evidenció anormalidad de la vía prequiasmática a izquierda. Recibió MP por vía IV y azatioprina en dosis de 75mg/día, evolucionando en forma favorable con amaurosis en el ojo izquierdo secuelar.
Un año después, en enero del 2000, repitió episodio de mielitis transversa, por lo que se suspendió la azatioprina; recibió 3 pulsos de MP y se inició ciclofosfamida (CF), 7 pulsos mensuales y 4 trimestrales hasta julio del 2001.
En julio del 2002, a los 17 años, presentó episodio de mielitis transversa asociado a neuritis óptica (NO) izquierda. La RM cervicodorsal mostró lesiones a nivel C3-C4/D6-D7, con captación de contraste. Recibió MP por vía IV y varios pulsos de CF por vía IV hasta marzo del 2003, continuando con CF por vía oral 100mg/día asociada a prednisona 2mg/día, suspendiendo la CF por presentar leucopenia y linfopenia.
En octubre del 2007 es evaluada por primera vez por los autores por presentar mielitis transversa, diagnosticándose NMO asociada a LES. Recibió MP por vía IV con recuperación completa, con visión de luz en ojo izquierdo secuelar y atrofia de papila en el ojo izquierdo. Inició azatioprina 150mg/día, calcio, vitamina D, ácido acetilsalicílico 100mg/día, enoxaparina sódica 0,4ml/día e hidroxicloroquina 200mg/día, permaneciendo estable y asintomática. Se realizó determinación en suero de NMO Ig G por inmunofluorescencia indirecta (IFI) con resultado positivo.
En mayo del 2011 se confirmó embarazo no planificado, con fecha de última menstruación (FUM) el 22 de marzo del 2011. La paciente realizó todo el seguimiento de su embarazo en el área de embarazo de alto riesgo del servicio de Obstetricia de un hospital de la ciudad de Buenos Aires.
En septiembre del 2011, la ecografía obstétrica mostró una gestación con feto único, de 25 semanas, coincidente con la FUM, presentación cefálica, placenta posterior, líquido amniótico en normal cantidad, movimientos fetales presentes, cinética cardíaca conservada y eco-Doppler fetal normal.
En octubre del 2011, una nueva ecografía mostró adecuada edad gestacional: 30,1±2,3 semanas, placenta posterior, madurez placentaria grado i; eco-Doppler normal. Chagas (−), toxo IgG (+) e IgM (−).
El 21 de diciembre del 2011 se realizó parto por cesárea, por falta de dilatación del cuello uterino con recién nacido vivo, a término, de sexo masculino, con peso de 3.850g y talla de 45cm. La paciente continuó con hidroxicloroquina 200mg/día y azatioprina 150mg hasta la semana 31 de embarazo, y 100mg desde entonces, no suspendiendo en ningún momento la medicación inmunosupresora y permaneciendo estable, sin recaídas de NMO ni LES y sin cambios en su examen neurológico hasta su último control, en junio del 2012.
DiscusiónEl curso del embarazo en esta paciente portadora de NMO y LES fue sin complicaciones, con un crecimiento fetal dentro de los parámetros esperados, con un recién nacido vivo de sexo masculino, a término, nacido por parto por cesárea, por falta de dilatación del cuello uterino, sin presentar recaídas de la NMO ni del LES durante el embarazo ni el puerperio.
La asociación de NMO y LES es muy poco frecuente, con pocos casos reportados hasta la fecha3–7. Aún más escasos son los reportes relacionados con el curso del embarazo en la asociación de estas 2 entidades9.
Desde el punto de vista inmunológico, el embarazo normal parece estar asociado con un cambio de la respuesta inmunitaria mediada por células a un aumento de la inmunidad humoral. Esto es, en parte, debido al disbalance entre las citocinas TH1 y TH2, lo que podría explicar por qué el embarazo mejora algunas enfermedades autoinmunes, como la esclerosis múltiple o la artritis reumatoidea (enfermedades autoinmunes TH1), mientras que otras, como el LES o la NMO, enfermedades mediadas por células B (TH2), tienen un curso impredecible o tienden a empeorar durante el embarazo.
Varios estudios han reportado un aumento de la tasa de recaídas en pacientes con LES durante el embarazo y en los 3 meses siguientes al parto comparadas con pacientes con LES no embarazadas7-9.
Un estudio comunicó una paciente con NMO tratada con rituximab hasta una semana antes de la concepción, que permaneció estable durante el embarazo, con un recién nacido vivo y sano, pero presentó 2 exacerbaciones severas en el primer trimestre posparto10.
Otro reporte corresponde a una primípara de 27 años, que presentó mielitis transversa en la semana 20 de embarazo, con mala evolución y antecedentes de episodios previos de NO, con AQP4 positivo y cesárea en la semana 35, con feto vivo11.
Encontramos un solo reporte de una mujer con LES que desarrolló NMO en el curso de un embarazo y exacerbaciones en el posparto9.
Bourne et al. evaluaron en forma retrospectiva a 85 mujeres en una cohorte francesa. Del total, se incluyeron 20 mujeres con 25 embarazos en las que el primer ataque de NMO ocurrió antes o cercano al momento del embarazo.. Comparando la tasa de recaídas en cada trimestre del embarazo, en el año preembarazo y el año posparto se evidenció un aumento no significativo en el tercer trimestre del embarazo y una tendencia aumentada en la tasa de recaídas en el segundo trimestre del posparto. Hubo incremento en el EDSS comparado con el año previo al embarazo. Ni la analgesia epidural ni la lactancia tuvieron influencia en el curso de la NMO. Los autores concluyeron que estos hallazgos justifican un seguimiento muy cercano del embarazo y posparto en este grupo de mujeres12.
Kim et al.13, en un estudio reciente, identificaron a 190 mujeres con NMO, de las cuales 40 tuvieron 54 embarazos y todas ellas eran AQP4 positivo. La influencia del embarazo en el curso de NMO se caracterizó por un aumento significativo en la tasa de recaídas después del parto, mientras que la tasa de recaídas no cambió significativamente durante la gestación. Aproximadamente 3 de 4 embarazos exitosos se asociaron a recaídas después del parto. Sin embargo, aunque la mayoría de las pacientes incluidas tenían relativamente baja actividad de la enfermedad antes del embarazo, este número significativo de las recaídas asociadas al parto es notable. Además, 14 pacientes desarrollaron la enfermedad, ya sea durante el embarazo o dentro de un año después del parto o el aborto. Estos resultados indican que el efecto perjudicial del embarazo y el posparto en la NMO puede ser mayor que en la EM14. La tasa de recaídas después del parto fue de 5,3. Los autores indican que el riesgo de recaídas después del parto es alto, independientemente de la actividad antes del embarazo. El riesgo de recaída también fue mayor durante los 6-12 meses después del parto si las pacientes no estaban recibiendo inmunoterapia. Por lo tanto, recomiendan mantener o iniciar inmunoterapia inmediatamente después del parto13.
Nuestra paciente continuó con la medicación inmunosupresora durante todo el embarazo y el posparto sin interrupciones, no presentando recaídas de la NMO ni del LES.
En relación con la medicación habitualmente usada para tratar pacientes con LES y NMO, podemos destacar que la hidroxicloroquina en dosis baja no parece representar riesgo significativo para el feto, por lo que se recomienda su uso durante todo el embarazo, ya que son mayores los beneficios sobre la enfermedad que el riesgo asociado a su uso15. La Academia Americana de Pediatría clasifica la hidroxicloroquina como compatible con la lactancia, aunque se encuentran bajas concentraciones del fármaco en la leche materna16.
En relación con los corticoides, se deben utilizar en la menor dosis posible que controle la actividad de la enfermedad. Se recomienda el uso de prednisona, prednisolona o metilprednisolona, ya que estas se metabolizan a nivel de la placenta y el feto solo se expone a menos del 10% de la dosis materna. La MP por vía IV es el fármaco de elección para el tratamiento de las recaídas. Es necesario un lapso no menor de 4 a 6h después de una dosis para reiniciar lactancia15.
Se recomienda el uso de azatioprina en mujeres embarazadas con enfermedades reumáticas graves o potencialmente mortales, ya que el hígado fetal carece de la enzima que convierte la azatioprina en su metabolito activo. La reducción de la dosis a partir de la semana 32 de gestación puede prevenir la leucopenia y trombocitopenia neonatales severas. Es necesaria la monitorización del crecimiento fetal e incluso la evaluación a largo plazo de niños expuestos a azatioprina debido al potencial riesgo de carcinogénesis. Este fármaco está contraindicado durante la lactancia15.
La paciente redujo la dosis de azatioprina en la semana 31 del embarazo, con embarazo a término y parto por cesárea, con un recién nacido vivo sin complicaciones y con talla y peso adecuados a la edad gestacional.
Las mujeres en edad fértil con NMO y LES deben recibir asesoramiento reproductivo por la posibilidad de presentar exacerbaciones durante el embarazo y el posparto, y se sugiere mantener o iniciar inmunoterapia inmediatamente después del parto, así como extremar las medidas para prevenir la toxicidad fetal de los fármacos usualmente utilizados para tratar estas afecciones.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.