La embolia grasa cerebral (EGC) es una forma incompleta y poco frecuente del síndrome de embolia grasa (SEG). Se caracteriza por compromiso neurológico variable, que incluye irritabilidad, cefalea, convulsiones, estupor y coma. Por lo general ocurre en las primeras 12 a 72horas después de un trauma. Se presenta el caso de un paciente de 77años, con diagnóstico de glomerulonefritis membranosa primaria, quien durante la hospitalización muestra deterioro neurológico, con alteración del estado de consciencia, como manifestación pura de embolia grasa, lo que representó un reto diagnóstico dada la asociación causal de origen no traumático, considerada infrecuente.
Cerebral fat embolism (CFE) is an incomplete and rare form of fat embolism syndrome (FES), characterized by variable neurological compromise, including irritability, headache, seizures, stupor, and coma. It usually occurs in the first 12 to 72hours after trauma. The case of a 77-year-old patient with a diagnosis of primary membranous glomerulonephritis is presented, who during hospitalization presented neurological deterioration, with altered state of consciousness, as a pure manifestation of fat embolism; which represented a diagnostic challenge given the causal association of non-traumatic origin, considered infrequent.
El síndrome de embolia grasa (SEG) es una condición médica infrecuente, con una incidencia estimada alrededor del 0,9% al 2,2% de los pacientes con fracturas de huesos largos1,2; la embolización grasa genera un compromiso multisistémico, que se manifiesta con erupción petequial, compromiso neurológico de grado variable e insuficiencia respiratoria1,3,4. La fisiopatología no está bien dilucidada, y algunas aproximaciones explican que los émbolos grasos derivan de la lesión del tejido adiposo en la médula ósea, favoreciendo el paso de partículas grasas a la circulación sistémica3. La mayoría de las causas son asociadas a trauma; sin embargo, también se han documentado factores de riesgo de origen no traumático, como falla hepática, pancreatitis necrohemorrágica, transfusión sanguínea masiva, nutrición parenteral y algunos fármacos como los glucocorticoides, la ciclosporinaA y los anestésicos inhalados1,5,6. Por su parte, la embolia grasa cerebral (EGC) es una forma incompleta del SEG que se caracteriza únicamente por compromiso neurológico, que incluye irritabilidad, cefalea, estupor, convulsiones e incluso coma1.
Presentamos el caso inusual de un paciente de 77años con glomerulonefritis membranosa primaria con anticuerpos antifosfolipasaA2 (PLA2R) positivos, quien recibió manejo con esteroides sistémicos y durante la hospitalización presentó súbitamente alteración del estado de alertamiento con deterioro neurológico progresivo hasta llegar a coma profundo, y posteriormente fallece.
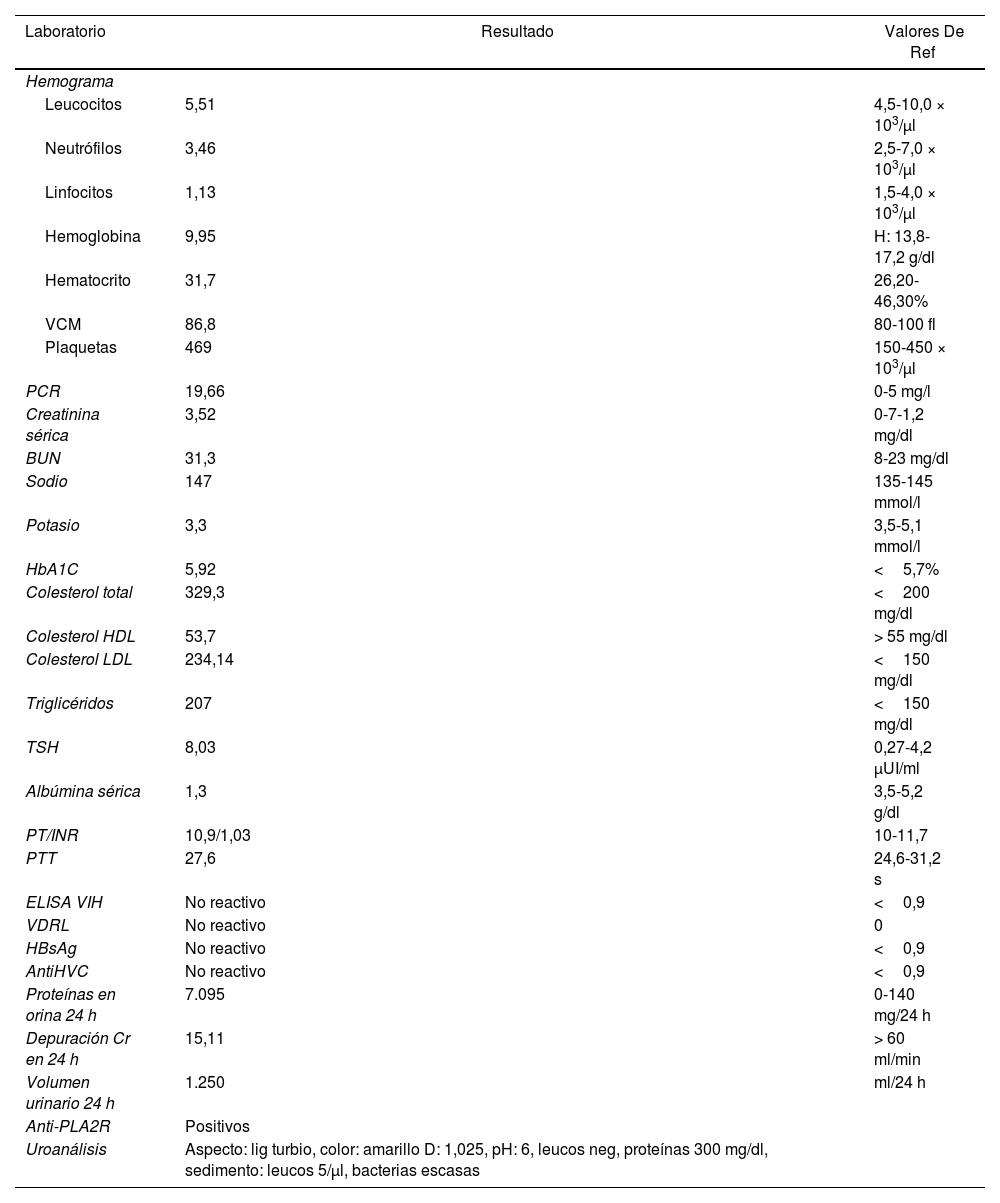
Caso clínicoHombre de 77 años con antecedentes de hipertensión arterial, hipotiroidismo, neoplasia mesenquimal gástrica fusiforme de bajo grado y tromboembolismo pulmonar diagnosticado dos meses atrás; en manejo con losartán, levotiroxina y rivaroxabán. Consulta por dos semanas de edema progresivo de miembros inferiores asociado a oliguria; ingresó con cifras tensionales elevadas (160/101mmHg) y presencia de ascitis; los laboratorios evidenciaron elevación de la creatinina, proteinuria en rango nefrótico, anemia microcítica, hipoalbuminemia e hipercolesterolemia (tabla 1); se descartaron causas secundarias infecciosas y metabólicas de síndrome nefrótico, y por presencia de PLA2R positivos se planteó la probabilidad de nefropatía membranosa de origen primario, que no pudo confirmarse por biopsia renal.
Estudios de laboratorio
| Laboratorio | Resultado | Valores De Ref |
|---|---|---|
| Hemograma | ||
| Leucocitos | 5,51 | 4,5-10,0 × 103/μl |
| Neutrófilos | 3,46 | 2,5-7,0 × 103/μl |
| Linfocitos | 1,13 | 1,5-4,0 × 103/μl |
| Hemoglobina | 9,95 | H: 13,8-17,2 g/dl |
| Hematocrito | 31,7 | 26,20-46,30% |
| VCM | 86,8 | 80-100 fl |
| Plaquetas | 469 | 150-450 × 103/μl |
| PCR | 19,66 | 0-5 mg/l |
| Creatinina sérica | 3,52 | 0-7-1,2 mg/dl |
| BUN | 31,3 | 8-23 mg/dl |
| Sodio | 147 | 135-145 mmol/l |
| Potasio | 3,3 | 3,5-5,1 mmol/l |
| HbA1C | 5,92 | <5,7% |
| Colesterol total | 329,3 | <200 mg/dl |
| Colesterol HDL | 53,7 | > 55 mg/dl |
| Colesterol LDL | 234,14 | <150 mg/dl |
| Triglicéridos | 207 | <150 mg/dl |
| TSH | 8,03 | 0,27-4,2 μUI/ml |
| Albúmina sérica | 1,3 | 3,5-5,2 g/dl |
| PT/INR | 10,9/1,03 | 10-11,7 |
| PTT | 27,6 | 24,6-31,2 s |
| ELISA VIH | No reactivo | <0,9 |
| VDRL | No reactivo | 0 |
| HBsAg | No reactivo | <0,9 |
| AntiHVC | No reactivo | <0,9 |
| Proteínas en orina 24 h | 7.095 | 0-140 mg/24 h |
| Depuración Cr en 24 h | 15,11 | > 60 ml/min |
| Volumen urinario 24 h | 1.250 | ml/24 h |
| Anti-PLA2R | Positivos | |
| Uroanálisis | Aspecto: lig turbio, color: amarillo D: 1,025, pH: 6, leucos neg, proteínas 300 mg/dl, sedimento: leucos 5/μl, bacterias escasas |
AntiHVC: anticuerpos totales del virus de la hepatitisC; BUN: nitrógeno ureico en sangre; HbA1C: hemoglobina glicosilada; HBsAg: antígeno de superficie de la hepatitisB; PCR: proteína C reactiva; PT: tiempo de protrombina; PTT: tiempo parcial de tromboplastina; TSH: hormona estimulante del tiroides; VCM: volumen corpuscular medio; VDRL: Venereal Disease Research Laboratory; VIH: virus de la inmunodeficiencia humana,
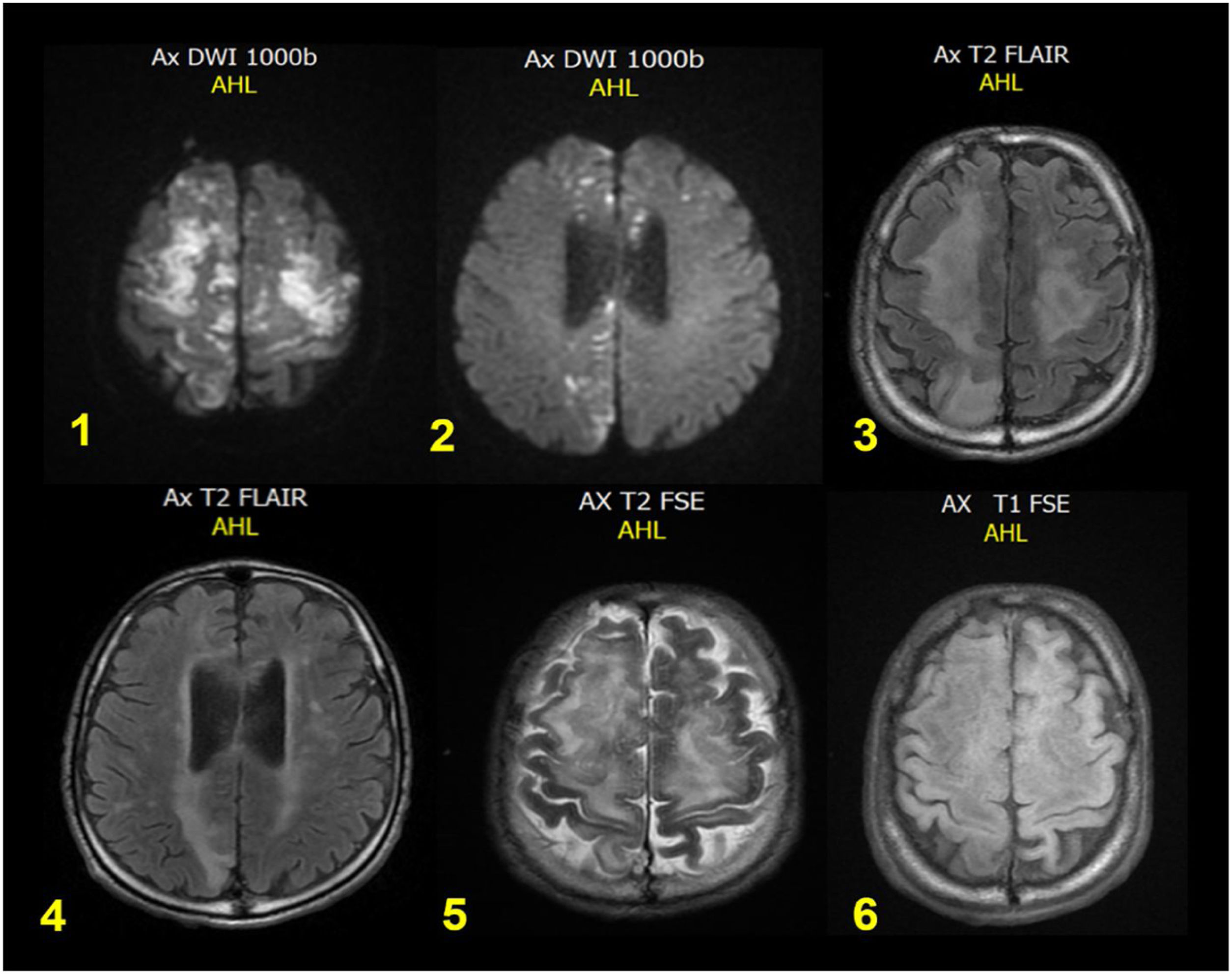
Recibió prednisolona a 1mg/kg sin respuesta clínica; tras dos semanas de manejo presentó deterioro progresivo de función renal, requiriendo terapia de reemplazo renal como soporte; de forma súbita durante hospitalización se torna estuporoso, con respuesta únicamente a estímulos dolorosos, presión arterial de 120/65mmHg, frecuencia cardíaca de 95lpm, frecuencia respiratoria de 21rpm, saturación de oxígeno del 93%, glucometría de 136mg/dl. Al examen neurológico, mutismo, con isocoria normorreactiva, bobbing ocular, cuadripléjico, arrefléxico global, con respuesta plantar neutra bilateral, por lo cual se trasladó a la unidad de cuidados intensivos. La tomografía de cráneo simple evidenció imágenes hipodensas serpingiformes corticales frontales anteriores bilaterales, altamente sugestivas de embolismo graso (fig. 1) e IRM cerebral simple con múltiples focos isquémicos subagudos, coalescentes, corticosubcorticales frontales altos, bilaterales y parietales mediales derechos, con aumento del tamaño del sistema ventricular supratentorial y ensanchamiento de los espacios subaracnoideos de las convexidades, compensatorios (fig. 2). Paciente con evolución tórpida, sin adecuada tolerancia a terapia dialítica, presentó un paro cardiorrespiratorio con ritmo de asistolia y finalmente falleció.
Resonancia magnética cerebral simple. Múltiples focos isquémicos subagudos coalescentes corticosubcorticales frontales altos bilaterales y parietales mediales derechos con aumento del tamaño del sistema ventricular supratentorial y ensanchamiento de los espacios subaracnoideos para las convexidades, compensatorios.
La EGC es una manifestación intracraneal del SEG, considerada una entidad poco frecuente y de difícil diagnóstico, dado que no hay signos típicos en la presentación clínica ni en las neuroimágenes, por lo que puede confundirse fácilmente con otras entidades neurológicas. No hay datos claros epidemiológicos, pero se estima que la mortalidad es de alrededor del 10%6, donde la mayoría de las muertes obedecen a insuficiencia respiratoria. La EGC por lo general es secundaria a fracturas cerradas de huesos largos, particularmente cuando hay fracturas múltiples (≥3sitios)7, pero también se describe causalidad asociada a eventos no traumáticos infrecuentes, como quemaduras, anemia de células falciformes, pancreatitis aguda necrohemorrágica, diabetes mellitus tipo2, hígado graso, en relación a procedimientos quirúrgicos estéticos, nutrición parenteral y terapia con corticosteroides1,5,6, como la recibida por nuestro paciente. La embolia grasa a menudo ocurre a nivel pulmonar, y es raro un compromiso cerebral aislado, lo que resalta el interés particular de este caso.
Respecto a la patogenia no es del todo clara, se han postulado dos teorías: una teoría «mecánica», donde se propone que hay presencia de microembolización, que atraviesa los capilares pulmonares y alcanza la circulación sistémica, más probable en presencia de foramen oval permeable (FOP), anomalía estructural no documentada en el paciente; y una teoría «bioquímica», que no es excluyente con la teoría mecánica y se relaciona con la presencia de mediadores plasmáticos, que generan daño por oclusión de los vasos y por la liberación de citoquinas proinflamatorias, que ocasionan lesión endotelial y agregación plaquetaria, aumentando el riesgo de sangrado. En estos pacientes típicamente se encuentran microinfartos, edema vasogénico y petequias a nivel cerebral1,7.
Las principales manifestaciones clínicas incluyen alteraciones del estado de consciencia, síntomas respiratorios8 y lesiones petequiales en regiones inusuales como las axilas, el cuello y el tórax anterior9,10. Los síntomas respiratorios están presentes aproximadamente en el 75% de los pacientes11, y la erupción petequial, en el 50-60%12. Nuestro paciente no presentó manifestaciones pulmonares ni cutáneas, únicamente signos y síntomas neurológicos aislados, lo cual representó un desafío diagnóstico al no cumplir con los criterios clásicos de Gurd y Wilson1 (tabla 2); igualmente es importante resaltar que solo entre el 1 al 29% de los pacientes cumplen la triada clásica de manifestaciones cerebrales, respiratorias y cutáneas10-12.
Criterios de Gurd y Wilson. El diagnostico de síndrome de embolia grasa requiere dos criterios mayores, o un criterio mayor y tres criterios menores
| Criterios mayores | Criterios menores |
|---|---|
| Insuficiencia respiratoria (PaO2 <60mmHg, FiO2 <0,4) | Taquicardia (FC>120lpm) |
| Fiebre (T>38°C) | |
| Anemia súbita inexplicable | |
| Afectación de SNC | Trombocitopenia |
| Aumento VSG | |
| Partículas grasas en fondo de ojo | |
| Petequias | Partículas grasas en orina |
| Partículas grasas en esputo |
FC: frecuencia cardíaca; PaO2: presión arterial de oxígeno; T: temperatura axilar (°C).
Fuente: tomado y adaptado de Porpodis, K. (2012). Fat embolism due to bilateral femoral fracture: A case report. Int J Gen Med. 5;59-63. Disponible en: https://doi.org/10.2147/IJGM.S28455
Respecto a las neuroimágenes, según Kuo et al.13 la resonancia magnética cerebral se considera el estándar de oro para el diagnóstico de EGC, siendo más sensibles las imágenes ponderadas por difusión (DWI) y por susceptibilidad (SWI)14; sin embargo, la EGC es un proceso dinámico con ventanas de tiempo específicas para patrones de imágenes. Los cambios pueden verse tan pronto como cuatro horas después del inicio de los síntomas, y en esta etapa predomina el patrón en campo de estrellas, que se caracteriza por lesiones múltiples, dispersas, hiperintensas sobre un fondo oscuro, en la sustancia blanca y gris profunda, que corresponden a edema citotóxico15,16. Sin embargo, estas lesiones pueden ser reversibles, no estando presentes en la etapa subaguda o tardía. En el caso del paciente la resonancia cerebral estuvo disponible 48horas posterior al inicio de la sintomatología, y ya en este punto son esperables otros hallazgos, como edema vasogénico o presencia de hemorragia petequial difusa17 con restricción a la difusión13, que tampoco fueron evidenciados en nuestro paciente.
Si bien es cierto que la tomografía computarizada cerebral se considera menos sensible y específica que la resonancia magnética y en muchos casos puede ser normal o mostrar signos inespecíficos de edema difuso18-20, constituye, dada su amplia disponibilidad, el primer estudio en todo paciente con compromiso neurológico agudo. En la EGC se pueden evidenciar lesiones redondas, hipodensas, dispersas con densidad específica de grasa, hallazgos que orientan con una adecuada correlación clínica al diagnóstico19,20; en particular en este paciente, este dato fue clave, dado que los hallazgos en la resonancia, como se mencionó, fueron inespecíficos, mientras que la medición de la densidad de las lesiones típicas por tomografía facilitó el diagnóstico. Otro rasgo característico sugestivo de EGC por tomografía es el «signo de la arteria hipodensa»13,21, que indica la presencia de un émbolo macroscópico con densidad de grasa y es consecuencia de oclusiones de vasos intracraneales, que dan lugar a grandes infartos territoriales; para el caso reportado, este dato no estuvo presente.
No existen pautas terapéuticas específicas para la EGC, y la mayoría de los estudios sugieren terapia sintomática y de apoyo como tratamiento principal22. El uso de los glucocorticoides es controvertido; algunos autores lo recomiendan, dados sus efectos antiinflamatorios y beneficiosos sobre la estabilización de las membranas y la reducción de la permeabilidad capilar23,24; sin embargo, no se ha demostrado que tengan un impacto en la tasa de mortalidad. Se recomiendan también medidas antiedema cerebral y el uso de fármacos sedantes para evitar el riesgo de hipertensión endocraneana. El curso clínico del paciente fue hacia el rápido deterioro neurológico y sistémico a pesar del manejo de soporte, presentando un desenlace fatal en un paciente con condiciones desfavorables como su edad avanzada y la pluripatología médica preexistente.
A partir de este caso, surge un interrogante, y es si la proteinuria masiva, el estado de hipoalbuminemia, con la consiguiente hiperlipidemia, podrían ser factores de riesgo de embolia grasa no traumática en condiciones de estrés; no hay estudios que correlacionen directamente esta asociación, lo que puede plantear la base para futuras investigaciones.
ConclusionesLa EGC es una entidad infrecuente, pero potencialmente mortal, que supone un importante reto diagnóstico, sobre todo cuando es secundaria a causas no traumáticas poco frecuentes, como es el caso de este paciente. Puede ser difícil diferenciar esta condición de otra enfermedad neurológica cuando se presenta de manera aislada y no asociada a manifestaciones pulmonares y cutáneas típicas del SEG, y esto se debe principalmente a que los signos y los síntomas neurológicos son muy diversos e inespecíficos y no cumplen la mayoría de veces los principales criterios diagnósticos propuestos en la literatura. Sin embargo, la neuroimagen, tanto la RM y en algunos casos —como el nuestro— la TC cerebral es determinante y puede orientar al diagnóstico.
FinanciaciónNo ha habido soporte financiero para la redacción y la publicación de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en relación con este artículo.