La encefalitis límbica es una enfermedad caracterizada por compromiso subagudo de la memoria, síntomas psiquiátricos y convulsiones. Se ha demostrado una vinculación entre anticuerpos contra antígenos de superficie y encefalitis límbica.
Caso clínicoPaciente de 58 años que comienza insidiosamente con cambios conductuales y convulsiones faciobraquiales distónicas. Se realizó diagnóstico de encefalitis límbica, confirmado por estudios de imágenes y determinación de anticuerpos anticanales de potasio; presentó mala respuesta al tratamiento inmunomodulador con una evolución atípica.
ComentarioEl rápido reconocimiento de las características clínico-radiológicas de la encefalitis límbica permite un inicio temprano del tratamiento y un mejor pronóstico.
Limbic encephalitis is a disease characterized by subacute involvement of memory associated with psychiatric symptoms and seizures. A relationship between antibodies directed against surface antigens and limbic encephalitis has been demonstrated.
Clinical case58 year old female who started insidiously with behavioral changes and refractory faciobrachial dystonic seizures. Limbic encephalitis was diagnosed and confirmed by imaging studies and the presence of voltage-gated potassium channel antibodies in serum. The patient had poor response to immunomodulatory treatment with an atypical outcome.
CommentaryThe early recognition of limbic encephalitis clinic-radiological features allows prompt treatment and better prognosis.
La encefalitis límbica es una enfermedad caracterizada por compromiso subagudo de la memoria anterógrada, cambios conductuales, síntomas psiquiátricos, convulsiones y alteración del ritmo del sueño.
Fue descrita por primera vez por Brierley et al. en 1960, quienes reportaron 3 pacientes con una encefalitis subaguda que afectaba principalmente la región límbica1.
Posteriormente, Corsellis et al., en 1968, le dieron el nombre de encefalitis límbica y plantearon la hipótesis de una etiopatogenia paraneoplásica, ya que las descripciones eran en pacientes con patología neoplásica asociada2-4.
La etiología autoinmune y su relación con anticuerpos dirigidos contra antígenos de superficie (complejo anticanal de potasio dependiente de voltaje [CPDV], receptor NMDA, GABA y AMPA) fue descrita en los últimos 10 años5,6.
Es importante destacar que existen características clínicas asociadas a cada tipo de anticuerpo. Por ejemplo, las encefalitis límbicas con convulsiones faciobraquiales distónicas e hiponatremia están relacionadas con anticuerpos CPDV, mientras que aquellas que presentan predominantemente síntomas psiquiátricos, distonía y catatonía se relacionan con anticuerpos anti-NMDA.
El rápido reconocimiento de las características clínicas permite abreviar los tiempos hasta llegar al diagnóstico. Esto es fundamental, ya que la encefalitis límbica de origen autoinmune habitualmente tiene buena respuesta al tratamiento inmunomodulador y el inicio temprano del mismo permite obtener mejores resultados6-8.
Se presenta el caso de una paciente con encefalitis límbica, hiponatremia y convulsiones focales resistentes al tratamiento, asociado a anticuerpos anti-CPDV, con evolución atípica.
Caso clínicoPaciente de sexo femenino, de 58 años de edad, diestra, sin antecedentes patológicos de importancia, que comenzó 4 meses previos a su internación, con síntomas psiquiátricos de instauración subaguda, consistentes en alucinaciones visuales y auditivas, y cambios conductuales. Posteriormente, agregó déficit de memoria reciente y convulsiones focales, lo cual motivó su internación.
En el momento de su ingreso presentaba en el examen neurológico una alta frecuencia de crisis focales discognitivas, faciobraquiales distónicas. Las mismas eran de breve duración, caracterizadas por mueca facial derecha, postura distónica en el miembro superior derecho, con elevación del hombro y flexión del brazo derecho. Durante el periodo postictal presentaba mínima confusión. La paciente tenía crisis espontáneas y/o desencadenadas por estímulo auditivo o estrés. La frecuencia era de 6 a 8 episodios en una hora. En ocasiones, tenía crisis bilaterales, aunque no de manera simultánea.
Durante la primera semana de su internación evolucionó con hiponatremia hipoosmolar secundaria a síndrome de secreción inadecuada de hormona antidiurética (SIHAD).
Ante el diagnóstico presuntivo de encefalitis límbica, se procedió con el plan de estudios correspondiente.
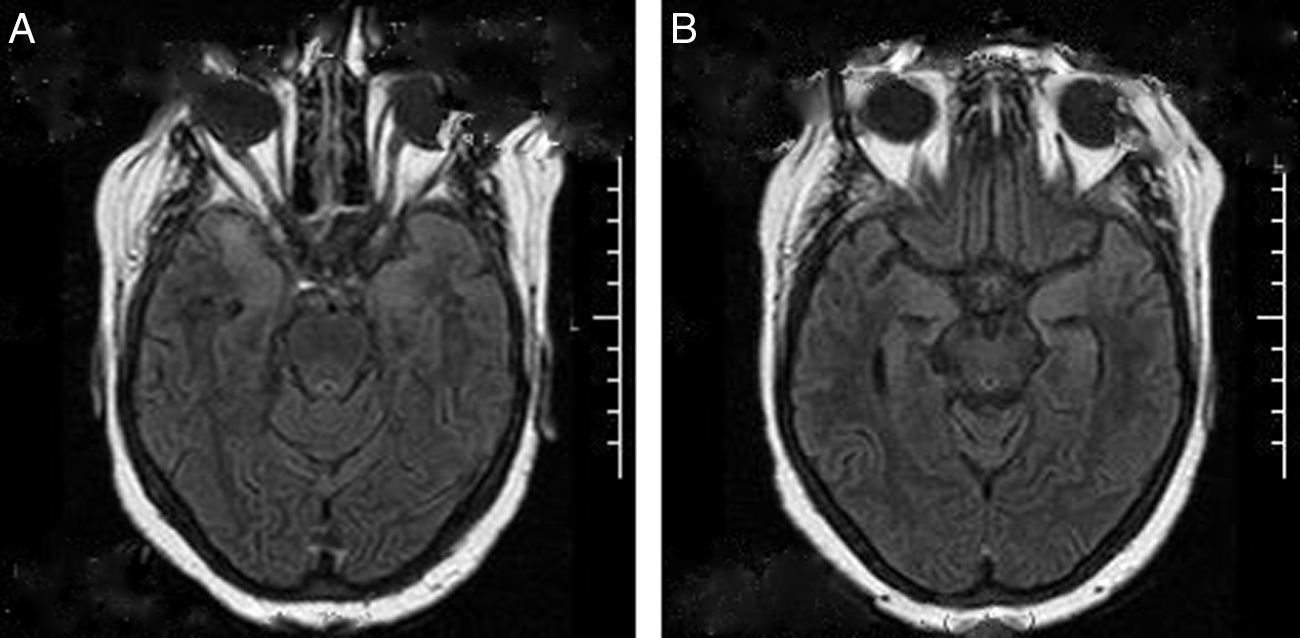
Dentro de los estudios diagnósticos realizados, el electroencefalograma (EEG) mostró actividad ictal caracterizada por un inicio de actividad rápida, en rango beta en la región centrotemporal izquierda de 3 s de duración, seguida de paroxismos de punta onda fronto-temporal izquierda, de 2-4Hz, con duración máxima de 2 s. Por otra parte, en las imágenes por resonancia magnética (IRM) de encéfalo se objetivó señal hiperintensa en T2 y FLAIR, sin restricción en la difusión en ambos hipocampos (figs. 1A y B).
Se efectuó una punción lumbar y el examen físico-químico del líquido cefalorraquídeo (LCR) fue normal, con análisis bacteriológico, micológico y virológico negativos. Se solicitó reacción en cadena de la polimerasa para virus herpes simple en el LCR, que fue negativa.
Se realizó química sanguínea, medición de hormonas tiroideas y colagenograma, los cuales se encontraron en parámetros normales, excepto por el sodio, de 124mEq/L.
De esta manera, se excluyeron causas metabólicas, infecciosas, tumorales y tóxicas, considerando, entonces, las etiologías paraneoplásica y autoinmune como las más probables.
Para descartar origen paraneoplásico, se realizó medición de anticuerpos onconeuronales séricos (anti-Hu, anti-Yo, anti-Ri), que fue negativo. Dentro de los estudios de imágenes, se efectuó una tomografía computarizada de tórax, abdomen y pelvis, que no mostró hallazgos patológicos. La mamografía y la ecografía transvaginal fueron normales.
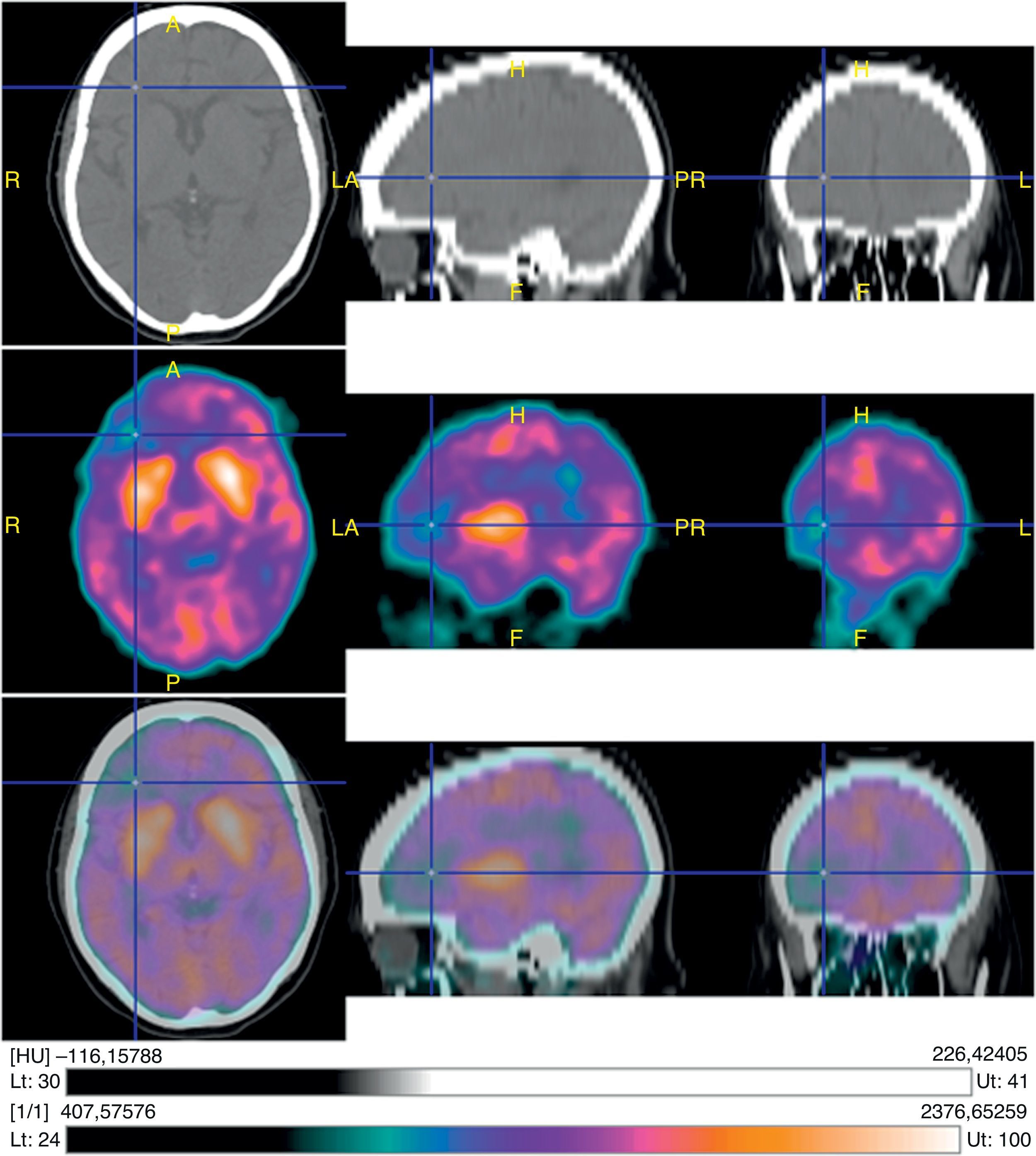
La tomografía por emisión de positrones (TEP) corporal total objetivó hipometabolismo frontal derecho, disminución del metabolismo temporohipocampal bilateral con predominio derecho y aumento marcado del metabolismo en los ganglios basales a predominio izquierdo (fig. 2).
Finalmente, se realizó medición de anticuerpos séricos anti-CPDV, que fueron positivos, con un valor de 699 pml/L (valor de referencia 0-75).
La paciente recibió tratamiento anticonvulsivo con oxcarbazepina y lorazepam, con escasa respuesta, por lo cual se agregó levetiracetam.
La oxcarbazepina debió rotarse a ácido valproico por SIHAD.
Posteriormente, se agregaron lacosamida, clobazam y topiramato, sin obtenerse mayores cambios en la frecuencia de crisis.
En cuanto al SIHAD, como ya se mencionó, inicialmente se atribuyó a un posible efecto adverso del tratamiento anticonvulsivo (oxcarbazepina). Por tal motivo, se cambió el esquema terapéutico, no resultando suficiente dicha medida para revertirlo. La paciente requirió tratamiento con restricción hídrica, que debió mantenerse durante toda su internación.
Ante el diagnóstico de encefalitis autoinmune, se inició tratamiento con pulsos de 1 g/día de metilprednisolona por vía intravenosa durante 3 días y posterior dosis de mantenimiento con escasa respuesta clínica.
Luego de 3 semanas, se realizó tratamiento con inmunoglobulina por vía intravenosa (0,4 g/kg/día, durante 5 días), con mejoría parcial solo de las crisis nocturnas. A la quinta semana de haber finalizado el tratamiento con inmunoglobulinas, se indicó plasmaféresis. La paciente evolucionó con discreta disminución de la frecuencia diaria de crisis y fue externada. Al cabo de 10 meses del inicio de los síntomas, falleció.
ComentariosLa encefalitis límbica es un cuadro clínico caracterizado por alteraciones neuropsiquiátricas y convulsiones que indican disfunción temporolímbica. Tanto la etiología paraneoplásica como la autoinmune expresan una respuesta inmunomediada contra autoantígenos. Cada una de ellas presenta características particulares en cuanto a cuadro clínico y respuesta a los tratamientos de primera línea9.
Las encefalitis de origen paraneoplásico se asocian con anticuerpos contra antígenos intracitoplasmáticos. Los mismos desencadenan una reacción inmunológica de tipo citotóxica, por lo cual suelen tener pobre respuesta al tratamiento inmunosupresor10-13.
Las de origen autoinmune, en cambio, se relacionan con anticuerpos contra antígenos de superficie. En este caso la respuesta inmunomediada es de tipo humoral predominantemente, por lo cual suelen tener buena evolución con el tratamiento inmunosupresor. La encefalitis límbica asociada a anticuerpos anti-CPDV afecta más a hombres que a mujeres (2:1) de edad superior a los 50 años. Las características clínicas que la distinguen son el inicio subagudo de déficit de memoria reciente, cambios conductuales, alta frecuencia de crisis faciobraquiales distónicas e hiponatremia7,14.
En un 25-30% de los pacientes con anticuerpos anti-CPDV se encuentra un tumor subyacente.
Los anticuerpos contra el complejo CPDV pueden estar dirigidos contra las subunidades del canal o contra alguna de sus proteínas asociadas15. Este es el caso de los anticuerpos dirigidos contra la proteína Leucine-rich glioma inactivated 1 (LGI1). Esta proteína está ampliamente expresada en el hipocampo y la neocorteza, y su detección se asocia fuertemente a la presencia de hiponatremia y de crisis focales faciobraquiales distónicas (FBD), de breve duración, resistentes al tratamiento con fármacos anticonvulsivos16.
Para el diagnóstico de encefalitis límbica autoinmune se sugiere realizar un plan de estudio que debe incluir el análisis del LCR, el EEG y las neuroimágenes (IRM de encéfalo y TEP).
Habitualmente, en estos pacientes, el LCR muestra cambios inflamatorios, aunque la ausencia de estos hallazgos no descarta el diagnóstico.
El EEG puede mostrar un predominio de ondas lentas difuso o focalizado; o bien, descargas epileptiformes focales.
Dentro de los estudios de imágenes, es de elección la IRM de encéfalo, en la que el hallazgo más habitual son lesiones hiperintensas en T2 y FLAIR, uni o bilaterales en lóbulos temporales. Sin embargo, en alrededor del 40% de los casos puede no hallarse imagen patológica17,18.
La TEP con fluorodeoxiglucosa es una importante herramienta diagnóstica que permite detectar cambios en el metabolismo cortical y en ganglios basales. El hipermetabolismo bilateral de ganglios basales asociado a hipometabolismo cortical difuso es una característica recientemente descrita y altamente indicativa de encefalitis límbica autoinmune. Este hallazgo en ganglios basales podría relacionarse con una sobreexpresión de proteínas LGI1 en dicha estructura anatómica7,17,19.
Existen factores de buen pronóstico, que son: la menor agresividad o severidad de la enfermedad, el inicio temprano del tratamiento y la remoción del tumor (en el caso de los paraneoplásicos).
Los tratamientos de primera línea son metilprednisolona (1g/día durante 3 a 5 días), inmunoglobulinas (0,4 g/kg/día, por vía intravenosa, divididos en 3 a 5 días) o plasmaféresis (en los casos de respuesta parcial al tratamiento con corticoides o inmunoglobulinas).
En un estudio retrospectivo reciente, se propone como protocolo terapéutico repetir pulsos de metilprednisolona o inmunoglobulinas en forma semanal durante 4 a 6 semanas. Los datos de este estudio muestran que el 62% de los pacientes tuvieron buena respuesta al primer esquema de tratamiento. Del grupo de pacientes no respondedores, la mitad mejoró con un segundo agente inmunosupresor20.
En los pacientes que responden a la inmunoterapia se debe considerar inmunosupresión en forma prolongada, dado que una pequeña proporción puede tener un curso con recaídas y remisiones8,21,22.
Cuando la respuesta al tratamiento de primera línea es escasa o nula, algunos autores indican la administración de fármacos de segunda línea, como rituximab, y/o ciclofosfamida8.
En el caso que se presenta, el cuadro clínico y radiológico era compatible con encefalitis límbica.
El resultado de la TEP, altamente indicativo de etiología autoinmune, fue fundamental para determinar el inicio del tratamiento inmunomodulador, aun sin confirmación serológica.
Si bien la paciente recibió 3 esquemas inmunomoduladores de primera línea (metilprednisona intravenosa, inmunoglobulina intravenosa y plasmaféresis), es probable que el tiempo de evolución y la gravedad de los síntomas en el momento de la internación fueran factores de mal pronóstico y determinantes en su respuesta al tratamiento.
Es por esto que es de vital importancia que, ante la presencia de un cuadro clínico compatible y con el apoyo de exámenes complementarios como la TEP, el inicio del tratamiento inmunomodulador no se demore a la espera de la confirmación serológica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.