El síndrome radiológico aislado (RIS) describe a sujetos que presentan de forma incidental lesiones en la sustancia blanca (SB) del sistema nervioso central por resonancia magnética (RM) indicativas de esclerosis múltiple (EM) y que cumplen con los criterios de Barkhof/Tintoré para diseminación en espacio, pero no presentan signos ni síntomas de la enfermedad.
DesarrolloEl uso cada vez más frecuente de la RM en la práctica clínica ha llevado a detectar lesiones inespecíficas en la SB. La causa más frecuente de la solicitud del estudio es la migraña. Incluso antes de la introducción del término RIS y sus criterios para el diagnóstico, estudios longitudinales por RM de sujetos sanos y autopsias encontraron lesiones en la SB indicativas de EM. Un problema al que nos enfrentamos para determinar si los pacientes son asintomáticos o no es el déficit cognitivo, dado que se encuentra con frecuencia en el RIS. Los esfuerzos para aumentar los datos disponibles ayudaron a conocer factores pronósticos de progresión que son detallados en esta revisión. Los escenarios posibles de progresión son: diseminación en tiempo por RM o primer brote clínico. Se estima que 2/3 progresa por RM y 1/3 por clínica en el seguimiento a 5 años. Respecto al manejo, existen recomendaciones bajo 3 conceptos esperar, seguir o tratar. La actitud más promovida es la de seguir a estos sujetos con RM y evaluación clínica periódica. En la actualidad, no existe suficiente evidencia para recomendar el tratamiento. Sin embargo, algunos autores indican su uso en aquellos pacientes con varios factores de riesgo de progresión. El objetivo de esta revisión es describir las novedades respecto al diagnóstico, el pronóstico y su posible conversión a EM, y hacer un resumen sobre los pasos a seguir ante estos pacientes.
ConclusionesSon necesarios estudios prospectivos futuros que nos permitan determinar si el RIS es una entidad clínica propia o una forma subclínica o asintomática de EM. Estos estudios deberán validar los criterios diagnósticos existentes, determinar la prevalencia, pronóstico, impacto en la calidad de vida y el inicio del tratamiento.
The radiological isolated syndrome (RIS) describes persons who incidentally present lesions in central nervous system white matter (WM) in magnetic resonance imaging (MRI) suggestive of multiple sclerosis (MS) with criteria of Barkhof/Tintoré for dissemination in space but they present no signs or symptoms of the disease.
DevelopmentThe increasingly frequent use of MRI in clinical practice has made it possible to detect nonspecific lesions in WM. The most common cause of a study requirement is migraine. Even before the term RIS was introduced, along with its criteria for diagnosis, longitudinal studies of MRI in health subjects and autopsies found WM lesions suggestive of MS. One problem we face in determining whether if the patients are asymptomatic or not is cognitive deficit, as this is often found in the RIS. The efforts made to increase the amount of available data helped find predictors of progression that are detailed in this review. Possible scenarios of progression are: dissemination in time for MRI or first clinical outbreak. It is estimated that two thirds of the affected progress through RM and a third part progresses by clinic within the time of five years. Regarding the management, recommendations are to wait, follow or treat. The most promoted attitude is to follow these patients with periodic MRI and clinical evaluation. At present there is insufficient evidence to recommend treatment. However, some authors suggest its use in patients with multiple risk factors of progression. The aim of this review is to describe developments regarding diagnosis, prognosis, possible conversion to MS and make a summary of the steps to follow regarding these patients.
ConclusionsProspective studies are needed to allow us to determine if the RIS is a clinical entity itself or a subclinical or asymptomatic form of MS. These studies should validate existing diagnostic criteria, to determine the prevalence, prognosis, impact on quality of life and the beginning of treatment.
El uso cada vez más frecuente de la resonancia magnética (RM) en la práctica clínica y el aumento de la disponibilidad en los centros de atención ha llevado a detectar lesiones en sustancia blanca (SB), tanto inespecíficas como relacionadas a patologías frecuentes, como migraña, síncope o traumatismo encefalocraneano (TEC)1. Estos hallazgos incidentales están estimados en un 2,7% para la población general y aumenta al 4,7% en aquellos estudios con RM de alto campo2,3. Muchas de estas imágenes son indicativas o típicas de enfermedad inflamatorio-desmielinizante del sistema nervioso central (SNC), como la esclerosis múltiple (EM), por sus características topográficas y morfológicas, aun sin síntomas o signos neurológicos compatibles con la enfermedad3. De estos hallazgos surge la pregunta sobre la existencia de EM preclínica o asintomática. Es conocido que ante un primer brote de EM, la RM inicial es la principal herramienta disponible a fin de estratificar el riesgo de conversión a EM clínicamente definida (EMCD)4. Sin embargo, el concepto de lesiones incidentales desmielinizantes en pacientes asintomáticos es relativamente nuevo, complejo y con elementos fundamentales que necesitan respuesta, con el fin de aclarar su relación específica con la EM. Asimismo, diversas series recientemente publicadas han demostrado que los pacientes con este tipo de lesiones tienen un riesgo elevado de desarrollar un síndrome clínico aislado (CIS, del inglés clinically isolated syndrome) o una EMCD definida por los nuevos criterios de McDonald (2010)1,4. El objetivo de esta revisión es describir las novedades respecto al diagnóstico, el pronóstico, su posible conversión a CIS o EMCD y el papel de tratar o no tratar a este tipo de pacientes.
Criterios diagnósticos y epidemiologíaDesde su descripción inicial, se utilizaron varias denominaciones para definir estas lesiones indicativas de EM en pacientes asintomáticos, con examen neurológico normal y sin una mejor explicación para dichas lesiones. Okuda et al.1, en 2009, introdujeron el término síndrome radiológico aislado (radiologically isolated syndrome o RIS) para este tipo de hallazgos (tabla 1). Asimismo, Siva et al.5, en el mismo año, comunicaron el término radiologically uncovered asymptomatic possible inflammatory-demyelinating disease (RAPPID) para definir a este tipo de pacientes. Si bien ambos términos son de uso universal, en este trabajo se utilizará RIS. Las lesiones en la SB indicativas de EM no son exclusivas de la era de RM, ya que diversos estudios anatomopatológicos post mortem en la era pre-RM con más 40.000 autopsias realizadas muestran una prevalencia de lesiones desmielinizantes del 0,08-0,3%6–9. Por el contrario, un metaanálisis3 realizado en 2009 que evaluó la frecuencia de RM anormal en 15.559 sujetos sanos encontró que el 0,06% tenía lesiones desmielinizantes. En otro estudio recientemente publicado en Suecia, región con alta prevalencia de EM, se evaluó la RM de 2.105 sujetos (mediana: 48 años) y solo un paciente (0,05%) cumplía criterios de Okuda para RIS10. Sin embargo, el estudio realizado por Wasay et al. en 864 adultos sanos encontró el porcentaje más elevado de lesiones desmielinizantes asintomáticas que cumplía criterios de Barkhof/Tintoré con un 0,7% (6/864)11–13. Gabelic et al., en un trabajo reciente, evaluaron a familiares sanos de pacientes con EM vs. sujetos asintomáticos (controles) a los cuales le realizó RM de 3 teslas y se aplicaron los criterios de Okuda modificados (incluyeron criterios de Swanton para diseminación en espacio [DIS]), observando que el 10,3 y el 3,7% de los sujetos cumplían criterios de RIS-Swanton, repectivamente14,15. Asimismo, se observó que los familiares de primer grado de pacientes con EM presentaron un mayor número de lesiones en la SB y un mayor tamaño comparado con sujetos normales14. En conclusión, más allá de los datos antes descritos, aún se desconoce la prevalencia real del RIS.
Criterios de Okuda et al. para síndrome radiológico aislado (2009)
| 1. Lesiones en la sustancia blanca del SNC incidentales que cumplan los siguientes criterios:A. Lesiones ovoideas, homogéneas bien delimitadas con o sin afección del cuerpo callosoB. Lesiones hiperintensas en T2, mayores de 3mm que cumplen 3 de 4 criterios de Barkhof/Tintoré para diseminación en el espacioC. Anormalidades en sustancia blanca del SNC no consistentes con patrón vascular |
| 2. Sin historia de síntomas ni signos neurológicos compatibles con disfunción neurológica |
| 3. Las anomalías radiológicas no son responsables aparentemente de alteraciones a nivel social, ocupacional u otras áreas en general |
| 4. Las anormalidades en la RM no son debidas al efecto fisiológico directo de sustancias (abuso de sustancias recreacionales, tóxicos o fármacos) o a condiciones médicas |
| 5. Exclusión de sujetos con RM indicativas de leucoaraiosis o patología extensa de la sustancia blanca del SNC con compromiso del cuerpo calloso |
| 6. Ausencia de una mejor explicación sobre los hallazgos |
Tomado de Okuda et al.1.
Una de las primeras preguntas que surge ante este cuadro es: ¿realmente los pacientes son asintomáticos?, ¿por qué se solicitó el estudio por RM? En principio, datos bibliográficos refieren que una recaída clínica es el reflejo de 8-10 lesiones encefálicas subclínicas nuevas16. Dicha pregunta fue evaluada por Granberg et al.17 (2013) en una revisión sistemática que incluyó 12 estudios, con un cohorte de 394 pacientes, donde el motivo más frecuente de indicación de RM en todas las series estudiadas fue la cefalea, seguida del TEC y los trastornos psiquiátricos y endocrinos. De manera interesante, un trabajo multicéntrico, retrospectivo, recientemente publicado por Okuda et al.18, con pacientes incluidos en la revisión sistemática antes descrita, observó que de 451 sujetos con RIS, el 42,10% se realizó una RM por cefalea, el 8,40% por traumatismo, el 5,50% por ansiedad/depresión, el 5,50% spells y el 4,40% por dolor (radicular/musculoesquelético) como causas más frecuentes. Estos datos marcan a las claras que la causa más frecuente de solicitud de RM es la cefalea. Por lo tanto, la siguiente pregunta sería: ¿la cefalea es un síntoma común en los pacientes con EM? D’Amico et al.19 demostraron que la cefalea es común en la EM y puede ser una manifestación poco frecuente de inicio de la enfermedad. En otro estudio (retrospectivo) se evaluaron RM de pacientes migrañosos con lesiones incidentales y se encontró que de un 2,4 a un 7,1% cumplían criterios de Barkhof y de un 24,4 a un 34,5% cumplía con los criterios de McDonald 2010 para DIS. Los autores concluyen que se debería contextualizar clínicamente los hallazgos por RM20,21. Por otro lado, el problema al que nos enfrentamos para determinar si el paciente es asintomático o no es el déficit cognitivo. Estudios recientes demuestran que los trastornos cognitivos se encuentran en este tipo de pacientes17–22, así como en el CIS y la EMCD (43-70%)23, lo cual nos plantea el dilema de considerar a los pacientes realmente asintomáticos o no. En 2 estudios realizados en 2010 y 2012 sobre función cognitiva, mediante variados test, y RIS (comparación EM brote remisión y RIS), se encontraron fallas en al menos un test neurocognitivo en el 62 y el 28%, respectivamente24,25. Estos datos indican la necesidad de que los pacientes con RIS tengan una evaluación neuropsicológica luego del diagnóstico con controles periódicos.
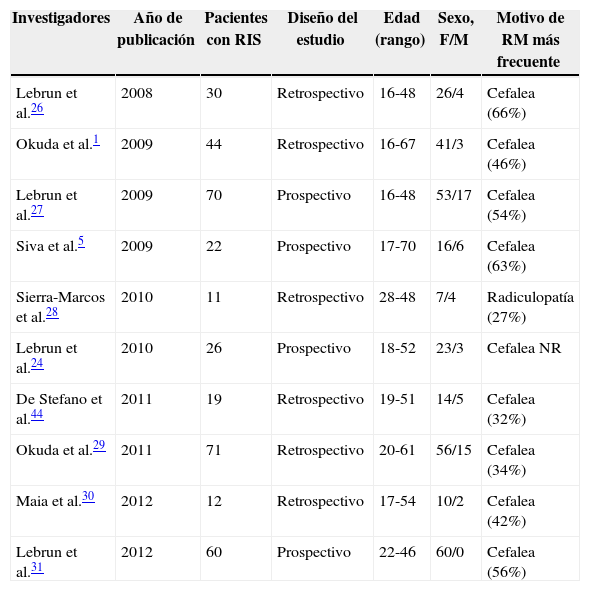
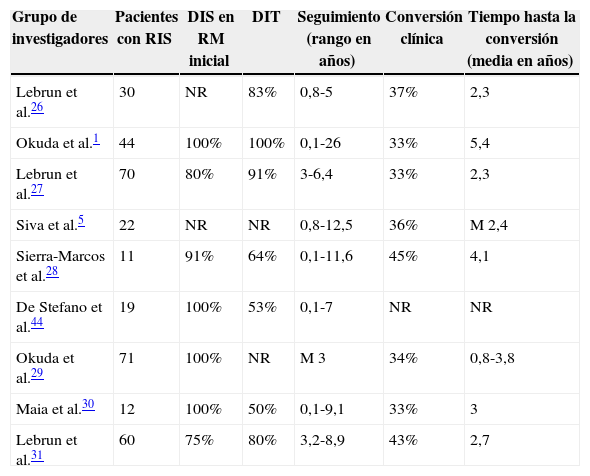
Factores de progresión a síndrome clínico aislado o esclerosis múltiples clínicamente definidaExisten 2 escenarios posibles de progresión ante un paciente que presenta RIS: el primero, que durante la evolución presente diseminación en tiempo (DIT) por RM (RIS+evidencia de DIT por RM), y el segundo, que presente el primer brote clínico (RIS+CIS o EMCD). Diversas series publicadas y revisadas (tablas 2 y 3) describen una lista de factores de riesgo para la conversión clínica y radiológica. En el primer estudio se evaluó a 30 pacientes, de los cuales 11 presentó un CIS, con una media de 2,3 años desde la primera RM, y un 77% (23/30) tenía DIT y DIS en su segunda RM (media: 6 meses)26. En un segundo estudio de 44 sujetos, el 59% presentó progresión por imágenes (nueva lesión de más de 3mm en T2, una nueva lesión gadolinio positiva [Gd+] o un aumento en el tamaño de una lesión previamente conocida), observando que las lesiones Gd+eran predictivas de DIT. Asimismo, 10 sujetos progresaron a CIS o EMCD1. Lebrun et al.27 encontraron que el 33% (23/70) presentó un brote clínico con un tiempo medio de 5,4 años desde la primera RM. Además, demostró que las lesiones Gd+y los potenciales evocados visuales (PEV) patológicos son factores pronósticos de conversión a EMCD. En otro estudio prospectivo5, 8 de 22 pacientes tuvieron conversión clínica con criterios temporo-espaciales suficientes para EMCD, con una media de 2,4 años. En una serie española28, el 45,5% de los pacientes presentó conversión a CIS (tiempo medio: 4,1 años), mientras que un 27,2% desarrolló EMCD, según los criterios de McDonald con un tiempo medio: 8,54 años. Otra investigación realizada por Okuda et al.29 en 71 pacientes demostró que la presencia de lesiones medulares e infratentoriales sería predictiva de conversión a EMCD. Además, concluyó que el 85% de estos pacientes desarrollaron CIS o EMCD en un promedio de 1,6 años. Es interesante destacar que de aquellos pacientes con lesiones cerebrales sin imágenes cervicales, solo el 7% progresó a EMCD. Un estudio más reciente30 muestra que el 33% de la serie presenta conversión clínica, con un rango de tiempo de 0,6-5,9 años, y el 42% cumplía criterios de CIS. Otro trabajo31 mostró que 26/60 sujetos presentaron conversión clínica, con un tiempo medio de 2,7 años. Un metaanálisis reciente17, que incluye varios de los trabajos citados anteriormente, con 388 pacientes, demostró que aproximadamente 2 tercios de los pacientes con RIS, al ser controlados, presentan progresión en el número de lesiones en la RM y un tercio presenta al menos un brote clínico cuando fueron seguidos por 5 años, ya sea con diagnóstico de CIS o EMCD. Asimismo, en este trabajo se resumen los factores predictivos de progresión clínica y radiológica17:
- –
Más de 9 lesiones hiperintensas en T2.
- –
Lesiones Gd+.
Comparación de las características generales de los cohortes con RIS
| Investigadores | Año de publicación | Pacientes con RIS | Diseño del estudio | Edad (rango) | Sexo, F/M | Motivo de RM más frecuente |
|---|---|---|---|---|---|---|
| Lebrun et al.26 | 2008 | 30 | Retrospectivo | 16-48 | 26/4 | Cefalea (66%) |
| Okuda et al.1 | 2009 | 44 | Retrospectivo | 16-67 | 41/3 | Cefalea (46%) |
| Lebrun et al.27 | 2009 | 70 | Prospectivo | 16-48 | 53/17 | Cefalea (54%) |
| Siva et al.5 | 2009 | 22 | Prospectivo | 17-70 | 16/6 | Cefalea (63%) |
| Sierra-Marcos et al.28 | 2010 | 11 | Retrospectivo | 28-48 | 7/4 | Radiculopatía (27%) |
| Lebrun et al.24 | 2010 | 26 | Prospectivo | 18-52 | 23/3 | Cefalea NR |
| De Stefano et al.44 | 2011 | 19 | Retrospectivo | 19-51 | 14/5 | Cefalea (32%) |
| Okuda et al.29 | 2011 | 71 | Retrospectivo | 20-61 | 56/15 | Cefalea (34%) |
| Maia et al.30 | 2012 | 12 | Retrospectivo | 17-54 | 10/2 | Cefalea (42%) |
| Lebrun et al.31 | 2012 | 60 | Prospectivo | 22-46 | 60/0 | Cefalea (56%) |
F: femenino; M: masculino; NR: no remitido; RIS: síndrome radiológico aislado; RM: resonancia magnética.
Modificado de Granberg et al.17.
Características generales sobre pronóstico de conversión de RIS
| Grupo de investigadores | Pacientes con RIS | DIS en RM inicial | DIT | Seguimiento (rango en años) | Conversión clínica | Tiempo hasta la conversión (media en años) |
|---|---|---|---|---|---|---|
| Lebrun et al.26 | 30 | NR | 83% | 0,8-5 | 37% | 2,3 |
| Okuda et al.1 | 44 | 100% | 100% | 0,1-26 | 33% | 5,4 |
| Lebrun et al.27 | 70 | 80% | 91% | 3-6,4 | 33% | 2,3 |
| Siva et al.5 | 22 | NR | NR | 0,8-12,5 | 36% | M 2,4 |
| Sierra-Marcos et al.28 | 11 | 91% | 64% | 0,1-11,6 | 45% | 4,1 |
| De Stefano et al.44 | 19 | 100% | 53% | 0,1-7 | NR | NR |
| Okuda et al.29 | 71 | 100% | NR | M 3 | 34% | 0,8-3,8 |
| Maia et al.30 | 12 | 100% | 50% | 0,1-9,1 | 33% | 3 |
| Lebrun et al.31 | 60 | 75% | 80% | 3,2-8,9 | 43% | 2,7 |
DIS: diseminación en espacio; DIT: diseminación en tiempo; M: mediana; NR: no remitido; RIS: síndrome radiológico aislado; RM: resonancia magnética.
Modificado de Granberg et al.17.
Por otro lado, se describe que existen predictores clínicos de progresión17 como:
- –
Lesiones en médula cervical.
- –
Lesiones infratentoriales.
- –
Alta carga lesional de inicio.
- –
PEV patológicos.
- –
Inicio en la juventud.
- –
Bandas oligoclonales (BOC) y/o índice de IgG en combinación con más de 9 lesiones en T2 en la RM inicial.
Sin embargo, en otro trabajo multicéntrico18 (22 países), publicado en 2014, con 451 pacientes, muchos ya descritos, se observó que la edad de inicio menor a 37 años se asocia a riesgo elevado de un brote (p=0,03), con una reducción del riesgo estimado por cada año del 2%. Otro predictor significativo es la lesión en la médula cervical y/o dorsal, es decir, que la asociación de ambos factores (edad y médula) conlleva un riesgo de conversión clínica a 5 años del 58%. Asimismo, el sexo masculino tiene más riesgo de conversión que el femenino (p=0,004). Es interesante destacar que el sexo masculino, la edad menor a 37 años y las lesiones en la médula se comportan como los factores pronósticos independientes más importantes en esta cohorte.
Manejo clínico y tratamientoNo existen dudas respecto del tratamiento temprano con fármacos modificadores de la enfermedad (DME) en el CIS y/o la EMCD. Estudios clínicos multicéntricos (CHAMPS para interferón β-1a por vía intramuscular, BENEFIT para interferón β-1b por vía subcutánea, REFLEX para interferón β-1a por vía subcutánea y PreCISe para acetato de glatinamer)32-35 demostraron que, ante un primer brote clínico con DIS por RM inicial, el tratamiento temprano se asocia a una disminución de la tasa de conversión a EMCD, de la carga lesional o lesiones Gd+y de la discapacidad. Por el contrario, el manejo del RIS aún es controversial17. Esto genera una gran incertidumbre tanto para el paciente como para el médico tratante, debido al pronóstico incierto y su posibilidad de progresión a CIS o EMCD. Sobre la base de los estudios (prospectivos, retrospectivos y metaanálisis) y en los nuevos conceptos, y dado que las guías de recomendaciones para el seguimiento y tratamiento con DME se centran en el CIS y la EMCD, estas guías no son aplicables para RIS4,36,37. Por lo tanto, existen recomendaciones de expertos basadas en la experiencia personal. Una revisión sistemática17 propone, en primer lugar, descartar otros diagnósticos diferenciales que permitan excluir causas que expliquen los hallazgos radiológicos, tal como se propone en la EM según la disponibilidad que tenga cada centro36. Asimismo, son de vital importancia el examen físico y una anamnesis minuciosa en manos de profesionales abocados y con experiencia en enfermedades desmielinizantes del SNC, así como tener en cuenta las «banderas rojas» o «red flags»36–39. Sellner et al.39 proponen 3 escenarios posibles: esperar («wait»), seguir («follow») o tratar («treat»). En el primer caso, «wait», el médico debe alertar e informar al paciente sobre los posibles síntomas indicativos de la EM sin la necesidad de un seguimiento clínico ni por RM y solo tomará una conducta activa si se convierte en CIS o EMCD. Esta decisión evita que el paciente y el médico se encuentren en estado de tensión ante una posible progresión radiológica. En el segundo caso, «follow», parece la actitud más sensata y consiste en hacer un seguimiento radiológico y clínico para detectar su progresión. En este punto, el autor recomienda una RM a los 6 meses de la inicial; si existe DIT tanto por clínica o por RM, continuar con punción lumbar (PL) y, si las BOC o el índice de IgG son patológicos, podría iniciarse un tratamiento con DME. Si por RM y por clínica no se cumplen los criterios de DIT (a los 6 meses), se reevaluará con RM a los 24 meses. En el estudio recientemente realizado por Okuda et al.18 se observó que la PL se realizó en el 67% (300/451) de todos los casos de RIS con un líquido cefalorraquídeo anormal en el 64,7% (194/300) de los pacientes. Por otro lado, en un estudio realizado en EE. UU.40, mediante encuestas, sobre casos clínicos de RIS a especialistas en EM, con el objetivo de profundizar en el conocimiento de las prácticas para diagnóstico y tratamiento actual, se observó que la mayoría de los encuestados (63%) no realizaría una PL, pero había consenso (88%) para llevar a cabo una RM espinal y el 89% indicó no iniciar tratamiento si los resultados de la RM eran normales. El 88% respondió a favor de realizar un control con RM y el 91% refirió que el estudio debería realizarse dentro de los 12 meses. El tercer y último punto es «treat», usar DME basados en la evidencia de los efectos beneficiosos del tratamiento en la EM en brote-remisión y CIS. En una revisión de estudios recientes18 (n = 451), el 10% de los casos reportados recibieron tratamiento con DME. Sin embargo, no existe suficiente evidencia para recomendar el tratamiento41, dado que, como publicaron de Stefano y Siva2, «nosotros tratamos a pacientes, no una RM», pero algunos autores indican su uso en aquellos pacientes con varios factores de riesgo de progresión42-45.
En resumen, luego de la revisión de la literatura internacional, se podría inferir que los pasos a seguir son:
- –
Anamnesis y examen clínico minucioso.
- –
Excluir diagnósticos diferenciales («red flags» clínicos, paraclínicos y por imágenes).
- –
Realización de RM cérvico-dorsal con Gd.
- –
PEV con flash y damero (¿neuritis óptica subclínica?).
- –
Test neurocognitivo (al menos Symbol Digit Modalities Test).
- –
PL solo si se demostró DIT por clínica o RM.
- –
Si los estudios iniciales fueron negativos, nueva RM a los 6 meses (o dentro del primer año) y, si no se demuestra DIT, repetir a los 24 meses.
- –
No se recomienda el inicio de tratamiento con DME hasta el inicio de sintomatología clínica.
En la actualidad, todavía continúa la duda de si el RIS se encuentra en pacientes asintomáticos o «subclínicos», fundamentalmente por los trastornos cognitivos, que se encuentran en un alto porcentaje de los sujetos con EM. Los estudios comentados anteriormente indican que aproximadamente un 66% presenta progresión por RM y un 33% por clínica (brote) en el seguimiento a 5 años. Sin embargo, son necesarios estudios prospectivos futuros que nos permitan determinar si el RIS es una entidad clínica propia o una forma subclínica o asintomática de EM. Estos estudios deberán contar con una muestra suficiente como para validar los criterios diagnósticos y determinar la prevalencia, el pronóstico, el impacto en la calidad de vida y el inicio del tratamiento con DME.