El Grupo de Trabajo de Neurología de la Conducta y Neurociencias Cognitivas de la Sociedad Neurológica Argentina publicó en 2006 la primera Guía de práctica clínica sobre la enfermedad de Alzheimer para su aplicación en nuestro medio y, eventualmente, en el resto de los países hispanoparlantes del Cono Sur.
La Guía que hoy publicamos, mediante la revisión y actualización del estado actual del conocimiento sobre la enfermedad de Alzheimer y su manejo clínico y neurológico, provee a los profesionales los estándares surgidos de la medicina basada en la evidencia para una adecuada implementación de las conductas diagnósticas y terapéuticas a su alcance en nuestro medio.
In 2006, the Argentine Neurological Society Research Group on Behavioral Neurology and Cognitive Neurosciences published the first Clinical Practice Guideline on Alzheimer's Disease to be consulted in Argentina and eventually in other countries in Latin America.
The present Guideline is a review of the state of the art concerning the 2010 knowledge on the management of this disease. It provides physicians with the usual standards provided by evidence based medicine in order to reach the most adequate diagnostic and therapeutic measures at hand in our countries.
Establecer un consenso para la detección, evaluación, diagnóstico y tratamiento de la enfermedad de Alzheimer (EA) en la práctica clínica. Estas recomendaciones están pensadas especialmente para su aplicación en el contexto de la atención primaria, para su empleo por los profesionales usualmente involucrados en la atención de pacientes con demencia (neurólogos, psiquiatras, geriatras, etc.), como así también para información de los distintos Sistemas de Salud.
Metodología empleadaUna guía de práctica clínica es un conjunto de recomendaciones con el objetivo de apoyar la toma de decisiones por parte de los profesionales de la salud o de los pacientes acerca de los cuidados que resultan apropiados para circunstancias clínicas específicas. Debe considerar la mejor evidencia científica disponible, identificada a partir de una revisión sistemática de la literatura.
Para la confección de la presente guía de práctica clínica se ha procedido al estudio comparativo de guías similares propuestas por sociedades, instituciones y grupos de reconocido prestigio internacional (referidos en el apartado de Bibliografía general) y una revisión sistemática de la literatura científica disponible, otorgando preferencia a los trabajos de revisión más recientes y a los trabajos de actualización de mayor relevancia clínica (citados en el texto y referidos en el apartado Bibliografía especial).
A cada artículo seleccionado que cumpliera los criterios de inclusión le fue asignado un nivel de evidencia correspondiente basado en definiciones a priori (ver más adelante). De los resultados obtenidos se determinó si los datos del estudio clínico van a ser luego traducidos en última instancia a grados de recomendación (ver más adelante).
Según la U.S. Agency for Health Research and Quality, los niveles de evidencia se categorizan numéricamente (I, II, III, IV) y se basan en la validez del diseño de los estudios evaluados (tabla 1), mientras que la fuerza (grado) de las recomendaciones (A, B, C, D) se basa en la ponderación de la cantidad y de la consistencia de la evidencia disponible (tabla 2).
Niveles de evidencia
| Ia | La evidencia proviene de metaanálisis de ensayos controlados, aleatorizados, bien diseñados |
| Ib | La evidencia proviene de, al menos, un ensayo controlado aleatorizado |
| IIa | La evidencia proviene de, al menos, un estudio controlado bien diseñado sin aleatorizar |
| IIb | La evidencia proviene de, al menos, un estudio no completamente experimental, bien diseñado, como los estudios de cohortes. Se refiere a la situación en la que la aplicación de una intervención está fuera del control de los investigadores, pero cuyo efecto puede evaluarse |
| III | La evidencia proviene de estudios descriptivos no experimentales bien diseñados, como los estudios comparativos, estudios de correlación o estudios de casos y controles |
| IV | La evidencia proviene de documentos u opiniones de comités de expertos o experiencias clínicas de autoridades de prestigio o los estudios de series de casos |
Se trata de una demencia con cambios citológicos, histológicos e inmunohistoquímicos característicos con una distribución topográfica que los diferencia de los patrones de envejecimiento normal1–3.
La certeza diagnóstica requiere confirmación anatomopatológica: ovillos neurofibrilares intraneuronales formados por proteína tau anormalmente fosforilada y placas neuríticas extracelulares con proteína amiloide anómala, pérdida sináptica, degeneración neuronal y depósitos de amiloide en los vasos sanguíneos4,5.
El diagnóstico de la EA es probabilístico (National Institutes of Neurologic and Communicative Disorders and Stroke-Alzheimer's Disease and Related Disorders Association [NIN-CDS-ADRDA]), ya que el fenotipo clínico (demencia progresiva con compromiso de la memoria episódica y otras funciones cognitivas) sólo puede ser confirmado patológicamente en estudios post mórtem que certifiquen los cambios característicos arriba mencionados.
En los últimos años, sin embargo, se ha generado un importante cuerpo de evidencia que certifica la existencia de presentaciones atípicas (no amnésicas) confirmadas neuropatológicamente6, entre las cuales destacan algunas formas de atrofia cortical posterior7, afasia progresiva primaria con lenguaje no fluido8–10 y afasia logopénica11–15.
Criterios diagnósticos de investigación para la enfermedad de AlzheimerEn 2007, el International Working Group for New Research Criteria for the Diagnosis of AD propuso nuevos criterios diagnósticos de investigación, basados a la vez en la evidencia clínica y biológica (confirmación patológica in vivo). Esto último, impensado hasta hace pocos años, se ha convertido en una posibilidad eventual con el empleo de biomarcadores específicos adecuadamente validados16–23.
Este mismo grupo ha ampliado la propuesta recientemente (2010), incluyendo una nueva nomenclatura que sirva como punto de referencia común para la investigación y, oportunamente, para la aplicación clínica. Por este último motivo, incorporamos estos criterios como complemento de la presente guía:
Criterios diagnósticos de investigación en la enfermedad de Alzheimer (International Group for New Research Criteria for the Diagnosis of AD-2010)
Estadios preclínicos de la enfermedad de AlzheimerIncluye los conceptos de estadio asintomático de paciente en riesgo y estadio presintomático. Se extiende entre el momento de aparición de los primeros eventos patogénicos o las primeras lesiones de la EA y la aparición de los primeros cambios cognitivos específicos.
- •
Estadio asintomático con riesgo de padecer EA (“at-risk state for AD”). Se puede sospechar por evidencia de amiloidosis cerebral (neuroimágenes con trazadores específicos de amiloide) o de cambios sugestivos en el líquido cefalorraquídeo (LCR) en las concentraciones de amiloide β42, tau y fosfotau. Es de notar aquí que no existe evidencia suficiente que permita conocer el valor predictivo de estos hallazgos.
- •
EA presintomática. Esta definición se aplica a los individuos que desarrollarán la enfermedad, lo cual sólo es predecible en familias afectadas por las formas monogénicas autosómicas dominantes (mutaciones conocidas).
Categoría diagnóstica aplicable a partir del momento de aparición de los primeros síntomas específicos de la enfermedad. Incluye las etapas de predemencia y de demencia. Requiere la evidencia de trastornos mnésicos específicos (presentación típica) o no (presentaciones atípicas), en ambos casos confirmada por marcadores biológicos (amiloide β42 en LCR, tau total y fosfo-tau en LCR, marcadores de amiloide en tomografía por emisión de protones (PET), atrofia temporal mesial en imágenes por resonancia magnética (MRI) y/o hipometabolismo temporoparietal en PET con fluorodesoxiglucosa.
Esta categoría puede ser subdividida en dos estadios: prodrómico y de demencia.
Enfermedad de Alzheimer prodrómica (EA “predemencia”)Etapa sintomática temprana caracterizada por la aparición de signos clínicos incluyendo el compromiso de memoria episódica con perfil hipocámpico (déficit en recuerdo libre que no mejora con facilitación) que no afectan las actividades instrumentales de la vida diaria y son insuficientes para el diagnóstico de demencia y en la cual se detecta la presencia de marcadores biológicos en LCR o neuroimágenes que apoyan la sospecha de cambios patológicos compatibles con EA.
Demencia de AlzheimerEtapa durante la cual los síntomas cognitivos (memoria episódica y por lo menos otro dominio cognitivo) son lo suficientemente severos como para interferir con el funcionamiento social y las actividades instrumentales de la vida diaria.
Se pueden reconocer aquí formas típicas y atípicas.
- •
EA típica. Fenotipo clínico más común de la EA, caracterizado por el déficit progresivo temprano de la memoria episódica que se mantiene dominando el cuadro hasta estadios tardíos de la enfermedad, seguido por o asociado con otros trastornos cognitivos (disfunción ejecutiva, trastornos del lenguaje, praxias y procesamiento visual complejo) y trastornos neuropsiquiátricos. El diagnóstico es reforzado por la presencia de uno o más marcadores biológicos de EA in vivo.
- •
EA atípica. Este término se reserva para las formas menos comunes y bien caracterizadas de presentación de la enfermedad, incluyendo la afasia progresiva primaria no fluente, la afasia logopénica, la variante frontal de la EA y la atrofia cortical posterior.
Cuando se diagnostica uno de estos cuadros, el diagnóstico de EA requiere de evidencia in vivo de amiloidosis cerebral o en LCR (ver antes).
- •
EA mixta. Este término se reserva para los pacientes que cumplen plenamente con los criterios diagnósticos de EA pero presentan evidencia clínica y/o biológica/neuroimagenológica adicional de trastornos comórbidos tales como enfermedad cerebrovascular o enfermedad con cuerpos de Lewy.
Aplicable a individuos que reúnen criterios clínicos mensurables para DCL en ausencia de compromiso evidente de las actividades instrumentales de la vida diaria. Este diagnóstico sólo es permitido en ausencia de toda otra patología a la cual pueda ser atribuido.
Debe ser considerado como término de exclusión en los individuos sospechosos de padecer EA pero que no reúnen los nuevos criterios diagnósticos propuestos para EA prodrómica por presentar síntomas mnésicos poco característicos o por negatividad en la búsqueda de biomarcadores.
Patología de enfermedad de AlzheimerEste término se refiere a los cambios neurobiológicos subyacentes responsables de la EA. Abarca desde los eventos patogénicos cerebrales más tempranos, incluyendo lesiones neuronales específicas (ovillos neurofibrilares y placas neuríticas), pérdida sináptica y depósitos vasculares de amiloide en la corteza cerebral. Su uso es independiente de la existencia de manifestaciones clínicas.
Criterios diagnósticos para enfermedad de Alzheimer en la práctica clínicaEn la práctica clínica usual, los criterios diagnósticos de la Asociación Psiquiátrica Americana establecidos en el Diagnostic and Statistical Manual of Mental Disorders (DSM-III-R/ DSM-IV/DSM-IV-TR) y los del National Institute of Neurologic and Communicative Disorders and Stroke en conjunto con la Alzheimer Disease and Related Disorders Association (NIN-CDS-ADRDA), comparten buena sensibilidad (promedio entre estudios: 81%) pero baja especificidad (promedio entre estudios: 70%) para EA probable basada en estudios clase I-II con confirmación post mórtem.
La definición de “demencia tipo Alzheimer” del DSM-IV y DSM-IV-TR es la única que se establece por exclusión en estos manuales, ya que estipula que “el diagnóstico puede ser realizado sólo cuando otras etiologías para la demencia han sido descartadas”. En cuanto al curso clínico, destaca la presencia de “déficit tempranos en memoria reciente … seguidos por el desarrollo de afasia, apraxia y agnosia luego de varios años”24.
La definición de “demencia en la enfermedad de Alzheimer” según el ICD-10 omite los rasgos clínicos y el curso de la enfermedad: “La enfermedad de Alzheimer es una enfermedad cerebral degenerativa primaria de etiología desconocida con rasgos neuropatológicos y neuroquímicos característicos. El trastorno es usualmente de comienzo insidioso y evoluciona lenta pero sostenidamente por un período de varios años”24.
Criterios diagnósticos DSM-IV de demencia tipo Alzheimer- A.
Desarrollo de múltiples déficit cognitivos que se manifiesta por ambos:
- 1.
Deterioro de la memoria (deterioro de la capacidad para aprender nueva información o recordar información aprendida previamente).
- 2.
Una (o más) de las siguientes alteraciones cognitivas:
- a.
Afasia (alteración del lenguaje).
- b.
Apraxia (deterioro de la capacidad para llevar a cabo actividades motoras, a pesar de que la función motora está intacta).
- c.
Agnosia (fallo en el reconocimiento o identificación de objetos, a pesar de que la función sensorial está intacta).
- d.
Alteración de la ejecución (p. ej., planificación, organización, secuenciación y abstracción).
- a.
- 1.
- B.
Los déficit cognoscitivos en cada uno de los criterios A1 y A2 provocan:
- 1.
Un deterioro significativo de la actividad laboral o social, y
- 2.
Representan una merma importante del nivel previo de actividad.
- 1.
- C.
El curso se caracteriza por un inicio gradual y un deterioro cognitivo continuo.
- D.
Los déficit cognitivos de los criterios A1 y A2 no se deben a ninguno de los siguientes factores:
- 1.
Otras enfermedades del sistema nervioso central que provocan déficit de memoria y cognitivos (p. ej., enfermedad cerebrovascular, enfermedad de Parkinson, corea de Huntington, hematoma subdural, hidrocefalia crónica del adulto, tumor cerebral).
- 2.
Enfermedades sistémicas que pueden provocar demencia (p. ej., hipotiroidismo, deficiencia de ácido fólico, vitamina B12 y niacina, hipercalcemia, neurosífilis, infección por VIH).
- 3.
Enfermedades inducidas por abuso de sustancias.
- 1.
- E.
Los déficit no aparecen exclusivamente en el transcurso de un delírium.
- F.
La alteración no se explica mejor por la presencia de otro trastorno del eje I (p. ej., trastorno depresivo mayor, esquizofrenia).
- I.
Criterios para el diagnóstico de enfermedad de Alzheimer probable:
- 1.
Demencia establecida por examen clínico y documentada por el Mini Mental State Examination (MMSE), la escala de demencia de Blessed o alguna prueba similar y confirmada por test neuropsicológicos.
- 2.
Déficit en dos o más áreas de la cognición.
- 3.
Empeoramiento progresivo de la memoria y de otras funciones cognitivas.
- 4.
Ausencia de alteraciones de la conciencia.
- 5.
Inicio entre los 40 y los 90 años, más frecuentemente después de los 65 años de edad.
- 6.
Ausencia de alteraciones sistémicas u otras enfermedades cerebrales que por ellas mismas pudieran dar cuenta de los trastornos progresivos en la memoria y la cognición.
- 1.
- II.
El diagnóstico de enfermedad de Alzheimer probable está apoyado por:
- 1.
Deterioro progresivo de funciones cognitivas específicas como el lenguaje (afasia), las habilidades motoras (apraxia) y la percepción (agnosia).
- 2.
Alteración de las actividades de la vida diaria y patrones de conducta alterados.
- 3.
Historia familiar de trastornos similares, particularmente cuando están confirmados neuropatológicamente.
- 4.
Exploraciones de laboratorio que muestran:
- a.
Punción lumbar normal evaluada mediante técnicas estándar.
- b.
Patrón normal o cambios inespecíficos en el EEG tales como incremento de actividad lenta.
- c.
Evidencia de atrofia cerebral en la tomografía computarizada (TC) y progresión documentada mediante observaciones seriadas.
- a.
- 1.
- III.
Otros rasgos clínicos consistentes con el diagnóstico de enfermedad de Alzheimer probable tras la exclusión de otras causas de demencia distintas de la enfermedad de Alzheimer:
- 1.
Mesetas en el curso de progresión de la enfermedad.
- 2.
Síntomas asociados de depresión, insomnio, incontinencia, delirios, ilusiones, alucinaciones, reacciones catastróficas verbales, emocionales o físicas, alteraciones sexuales y pérdida de peso.
- 3.
Otras alteraciones neurológicas en ciertos pacientes, especialmente en las fases más avanzadas de la enfermedad, incluyendo signos motores como incremento del tono muscular, mioclonías o trastornos de la marcha.
- 4.
Convulsiones en estadios avanzados de la enfermedad.
- 5.
TC normal para la edad.
- 1.
- IV.
Rasgos que hacen incierto el diagnóstico de enfermedad de Alzheimer probable:
- 1.
Inicio brusco, apoplético.
- 2.
Hallazgos neurológicos focales, como hemiparesia, trastornos sensoriales, defectos de campos visuales e incoordinación en fases tempranas del curso de la enfermedad.
- 3.
Crisis epilépticas o trastornos de la marcha en el inicio o muy al principio del curso de la enfermedad.
- 1.
- V.
Diagnóstico de enfermedad de Alzheimer posible:
- 1.
Se puede realizar sobre la base del síndrome de demencia, en ausencia de otras alteraciones neurológicas, psiquiátricas o sistémicas suficientes para causar demencia, y en la presencia de variaciones en el inicio, la presentación y el curso clínico.
- 2.
Se puede realizar en presencia de una segunda enfermedad sistémica o enfermedad cerebral suficiente para producir demencia, que no se considera ser la causa de la demencia.
- 3.
Debería usarse en estudios de investigación cuando se identifica un único trastorno cognitivo grave en ausencia de otra causa identificable.
- 1.
- •
Los criterios diagnósticos para enfermedad de Alzheimer de NINCDS-ADRDA tienen un grado de recomendación clase A (niveles de evidencia Ia) en individuos con deterioro cogni- tivo.
- •
El diagnóstico de demencia en enfermedad de Alzheimer aplicando los criterios del DSM-IV apoyados en una historia clínica que incluya un informante confiable y suplementados por una aproximación objetiva mediante tests cognitivos y evaluación neuropsicológica alcanzan un nivel de evidencia tipo II y un grado de recomendación clase B.
- •
Los trastornos cognitivos y las demencias incrementan su prevalencia como resultado del envejecimiento progresivo de la población.
- •
Este envejecimiento afecta a todas las regiones del planeta, con excepción del África subsahariana.
- •
Actualmente este proceso es más acelerado en los países en desarrollo.
- •
En las próximas décadas la región que más envejecerá será América del Sur25–28.
- •
En el año 2001 se estimaba que el número de personas con demencia a escala mundial alcanzaba la cifra de 24.300.00028.
- •
Las proyecciones son 42.300.000 en 2020 y 81.100.000 en 204028.
- •
Entre 2001 y 2040 el crecimiento del número de casos en países desarrollados se estima que será del 100%, mientras que en países subdesarrollados este valor alcanzaría el 300%28.
- •
En 2001 el 60% de los casos de demencia estaban en países en desarrollo; este valor aumentará al 64,5% en 2020 y al 71,2% en 204028.
- •
Prevalencia de demencia en personas mayores de 60 años:
- —
6,4% en América del Norte.
- —
5,4% en Europa occidental.
- —
4,6% en Latinoamérica.
- —
4% en China.
- —
3,85% en Europa oriental.
- —
1,6% en África28.
- —
- •
Prevalencia media de demencia en mayores de 65 años en la región, 5,3% (95% CI, 3,9-6,5):
- —
60% Enfermedad de Alzheimer.
- —
30% Demencia Vascular (DV)29.
- —
- •
Incidencia anual de demencia:
- —
América del Norte: 10,5 por mil.
- —
Europa Occidental: 8,8 por mil.
- —
Latinoamérica: 9,2 por mil.
- —
China: 8 por mil.
- —
Europa Oriental: 7,9 por mil.
- —
África: 3,5 por mil28.
- —
- •
A nivel global, el número de nuevas personas afectadas es de 4.600.000 nuevos casos de demencia/año, lo que representa un nuevo caso cada 7 segundos28.
- •
Datos nacionales disponibles:
- •
Países desarrollados:
- —
Costos anuales vinculados a la demencia: 242.800 millones de dólares.
- a.
Costos directos: 168.100 millones de dólares.
- b.
Costos indirectos: 74.700 millones de dólares29.
- a.
- —
- •
Países en desarrollo:
- —
Costos anuales vinculados a la demencia: 72.600 millones de dólares.
- a.
Costos directos: 42.300 millones de dólares.
- b.
Costos indirectos: 30.300 millones de dólares29.
- a.
- —
- •
Datos locales: costos anuales por paciente con EA:
- —
EA estadio leve: 3.420 dólares anuales.
- —
EA estadio severo: 9.657 dólares anuales.
- —
Paciente no institucionalizado: 3.189 dólares anuales.
- —
Paciente institucionalizado: 14.447 dólares anuales31, 32.
- —
En los próximos años se observará un aumento progresivo en el número de habitantes añosos a nivel mundial, teniendo esta situación una particular importancia en las regiones en desarrollo.
Dado que el principal factor de riesgo para los trastornos cognitivos y las demencias es la edad, podrá observarse un incremento en la cantidad de personas con estas patologías a nivel poblacional.
Los sistemas sanitarios de cada región deberán enfrentar este cambio demográfico en un lapso temporal relativamente corto y, para hacerlo de manera adecuada, será necesario realizar adaptaciones a sus sistemas sanitarios teniendo en cuenta que estas patologías tienen altos costos y muchas veces los presupuestos asignados en la actualidad no serán suficientes.
Por estas razones, será de fundamental importancia:
- •
Llevar adelante estudios epidemiológicos regionales.
- •
Ahondar en la investigación de factores de riesgo locales para poder contar con datos confiables.
- •
Poder planificar políticas de salud adaptadas a cada problemática particular.
- •
Mediante la educación médica y sociosanitaria, propender a la consulta temprana y al diagnóstico precoz y certero.
- •
Mejorar la oportunidad, la adecuación y la accesibilidad a los tratamientos disponibles en la actualidad y los que aparezcan en el futuro.
Se presenta con mayor prevalencia en adultos mayores de 65 años, pero en las formas hereditarias (mutaciones en los cromosomas 1, 14 y 21, correspondiendo a los genes de las presenilinas 2 y 1 y de la proteína precursora de amiloide, respectivamente) puede aparecer a los 40 años de edad o antes. El curso evolutivo se caracteriza por el empeoramiento progresivo, aunque pueda presentar ocasionales períodos de relativa estabilidad clínica.
Actualmente el diagnóstico de demencia en la EA es clínico (neurológico, psiquiátrico y neuropsicológico) (recomendación grado A, nivel de evidencia I) y se basa en criterios operativos estandarizados. Comprende 6 pasos:
- •
Entrevista al paciente.
- •
Entrevista a un informante confiable.
- •
Examen físico.
- •
Evaluación neurocognitiva.
- •
Exámenes complementarios de laboratorio.
- •
Estudios de neuroimágenes.
El compromiso funcional afectando las actividades de la vida diaria (AVD) forma parte esencial del diagnóstico en los criterios del DSM-IV y es considerado de apoyo en los criterios de NINCDS-ADRDA (ver antes). Esta contradicción es sólo aparente, ya que el DSM-IV establece criterios normativos para demencia tipo Alzheimer, mientras que los criterios de los NINCDS-ADRDA intentan una aproximación diagnóstica más general a la EA (definida, probable o posible según el grado de certeza), la cual, como se ha visto en la discusión preliminar, puede presentar un largo período preclínico (asintomático y en riesgo) seguido por una etapa clínica “predemencia” (prodrómica) de duración variable.
Apoyan el diagnóstico la presencia de síntomas conductuales característicos concomitantes, como depresión o ideación delirante, trastornos neurovegetativos (p. ej., alimentarios) y antecedentes familiares positivos.
La historia clínica es de fundamental importancia para guiar el examen general del paciente y los exámenes complementarios pertinentes. Se deben registrar los dominios cognitivos afectados, la forma de comienzo, el patrón de progresión y el impacto funcional. Asimismo es necesario conocer la historia educacional (nivel de instrucción alcanzado), laboral (habilidades, exposición a tóxicos), médica (enfermedades con posible impacto en la función cognitiva), comorbilidades, etc. El antecedente familiar de demencia puede ser asimismo relevante en las formas hereditarias o con compromiso genético sospechado.
Es importante que un informante confiable e independiente aporte información que corrobore los datos suministrados por el paciente.
El examen neurológico en las formas tempranas de EA no suele brindar información relevante, exceptuando el deterioro cognitivo; sin embargo, es fundamental para detectar comorbilidades y para el diagnóstico diferencial. En estadios tardíos pueden aparecer signos neurológicos, como extrapiramidalismo (usualmente leve), mioclonías, convulsiones o signos motores “arcaicos”, como los reflejos de prensión o de succión.
Todos los criterios exigen la presencia de síndrome demencial, que en la EA está determinado por la afección de dos o más funciones cognitivas con compromiso predominantemente temprano de la memoria (sin excluir formas de comienzo con compromiso de otro dominio cognitivo) y síndrome afaso-apracto-agnósico ulterior en ausencia de síndrome confusional o enfermedades sistémicas que pudieran ser causa del cambio del estado mental. El compromiso cognitivo se integra por déficits relativamente selectivos que siguen un curso evolutivo relativamente predecible. Con frecuencia se lo divide en estadios arbitrariamente definidos (leve, moderado, severo). La presencia de deterioro cognitivo debe ser documentada a través de una evaluación breve del estado mental confirmada mediante una evaluación abarcativa33:
- •
El síntoma inicial más frecuente es la queja de trastornos mnésicos, afectando particularmente la memoria episódica reciente con dificultad para retener nueva información. La memoria semántica también se compromete en forma relativamente temprana34.
- •
El compromiso del lenguaje se caracteriza por la presencia de dificultades en el hallazgo de vocablos, y más adelante en la denominación y la comprensión. Se debe tener presente que en algunas formas atípicas de la EA, las alteraciones del lenguaje pueden ser el síntoma inicial (p. ej., algunas variantes de demencia semántica, afasia logopénica y afasia progresiva primaria no fluente).
- •
Las alteraciones en la función ejecutiva están virtualmente presentes desde los estadios iniciales de la enfermedad34 pero no son manifiestas en las actividades de la vida diaria, por lo que su detección temprana depende de la oportunidad de realizar una evaluación neuropsicológica. En la variante frontal o disejecutiva de la EA, pueden ser el síntoma de presentación más precoz.
- •
Los trastornos atencionales suelen aparecer en forma relativamente temprana, particularmente la atención selectiva. Con la progresión se afectan también la atención dividida y la atención sostenida34.
- •
Las habilidades visuoespaciales y las agnosias (sobre todo visuales) tienden a presentarse tardíamente34. En la atrofia cortical posterior, sin embargo, pueden ser los síntomas iniciales.
Los síntomas conductuales de la EA, por su parte, han sido denominados en forma diversa por distintos autores: síntomas conductuales y psicológicos de la demencia (BPSD, behavioural and psychological symptoms of dementia), síntomas neuropsiquiátricos, síntomas no cognitivos, etc., los cuales contribuyen sustancialmente al compromiso funcional del paciente y a la sobrecarga del cuidador35.
La ansiedad, la apatía y/o la depresión pueden aparecer precozmente; la agitación suele aparecer en estadios más avanzados, en ocasiones con ideas delirantes y alucinaciones. Los trastornos de identificación e interpretación son frecuentes en el estadio medio de la enfermedad. El examen psiquiátrico puede evidenciar psicosis y/o depresión, ya sea como comorbilidad o como diagnóstico primario.
Los criterios diagnósticos para psicosis y para depresión en la EA aún se encuentran en elaboración provisoria36.
Dentro de los síntomas conductuales, se considera una media aproximada de cinco posibles manifestaciones tipo: apatía, agresión/irritabilidad, depresión, agitación, ansiedad, actividad motora aberrante, ideación delirante, alteraciones del sueño, desinhibición, trastornos alimentarios, euforia y alucinaciones37.
Las ideas delirantes pueden asociarse con agresividad en pacientes con demencia. Las cinco ideas delirantes más características de la enfermedad de Alzheimer son38:
- •
Idea delirante de hurto [la gente le está robando] (18-43%).
- •
Paramnesia reduplicativa [la casa no es su casa].
- •
Síndrome de Capgras [su cónyuge o cuidador es un impostor].
- •
Sentimiento de abandono (3-18%).
- •
Idea delirante de infidelidad (1-9%).
Las falsas percepciones y falsas identificaciones varían en frecuencia según los distintos estudios, dependiendo de la definición adoptada y de las poblaciones evaluadas, siendo las más prevalentes39–41:
- •
Presencia de extraños en la casa [“phantom boarder syndrome”] (17%).
- •
Dialogar con la propia imagen en el espejo como si se tratara de otra persona [“mirror sign”] (4%).
- •
Las personas no son quienes pretenden ser [síndrome de Capgras: un extraño pretende ser su familiar/cuidador; síndrome de Frégoli: su familiar/cuidador pretende ser otra persona] (12%).
- •
Considerar que los personajes vistos en la televisión se hallan presentes en la habitación (6%).
La resultante de los trastornos cognitivos y conductuales es el compromiso funcional del paciente, que afecta sus AVD, inicialmente las instrumentales y, con la evolución, las básicas.
Recomendaciones- •
La información aportada por un cuidador confiable está avalada por estudios con niveles de evidencia I (recomendación grado A).
- •
El examen neurológico para descartar comorbilidades y para el diagnóstico diferencial tiene un nivel de evidencia tipo III (recomendación grado C).
- •
La evaluación cognitiva es mandatoria para el diagnóstico y manejo de la demencia, debiendo ser administrada a todos los pacientes (recomendación grado A).
El manejo adecuado de los métodos diagnósticos para demencia es un tema de suma importancia. El uso empírico de algunos métodos (p. ej., test genéticos) es aún tema de controversia.
Los estudios que se refieren a la utilidad diagnóstica de los exámenes complementarios son escasos y generalmente se vinculan a series de casos. Por ello los niveles de recomendaciones en general son de grado B o C. Pese a lo anterior, se pueden resumir en las siguientes recomendaciones prácticas:
Recomendaciones de laboratorio- •
Se recomienda una rutina básica de laboratorio (hemograma completo, velocidad de sedimentación globular, glucemia, uremia, creatininemia y análisis completo de orina) con el agregado de dosajes séricos de TSH, T4 libre, ácido fólico y vitamina B12 (recomendación grado B).
- •
La determinación de serología para VIH y sífilis se reserva para los pacientes con situaciones especiales que lo ameriten (recomendación grado C).
- •
Otros análisis de laboratorio (inmunológicos, hepatograma, perfil fosfocálcico, etc.) sólo deben ser solicitados si existen datos clínicos o antecedentes que lo justifiquen (recomendación grado B).
- •
Las neuroimágenes estructurales deben realizarse en todo paciente en quien se sospeche un diagnóstico de demencia (recomendación grado A).
- —
El requerimiento mínimo en neuroimágenes es una to- mografía computarizada (TC) sin inyección de contraste intravenoso (recomendación grado A).
- —
Se recomienda realización de IRM para mejorar la especificidad diagnóstica en todos los casos en los que la etiología no pueda ser establecida por los métodos usuales y la TC de cerebro (recomendación grado A).
- —
Según las guías del National Institute for Health and Clinical Excellence (NICE, 2006) y la European Federation of Neurological Societies (EFNS, 2007), la tomografía por emisión de fotón simple (SPECT) podría emplearse para el diagnóstico diferencial entre la EA y la degeneración lobar frontotemporal (demencia frontotemporal y afasia progresiva primaria) si persistieran dudas diagnósticas luego de haber realizado las neuroimágenes estructurales (recomendación grado B).
- —
- •
El EEG debe ser empleado en los pacientes en los que se deba realizar el diagnóstico diferencial con enfermedad de Creutzfeldt-Jakob o amnesia transitoria epiléptica (recomendación grado B).
- •
No se recomienda el dosaje de biomarcadores en LCR (proteína tau y amiloide β1-42) en la rutina diagnóstica de EA (recomendación grado B). Si bien ambas determinaciones por separado o juntas presentan una aceptable sensibilidad y especificidad para el diagnóstico de esta enfermedad, ningún estudio ha demostrado que su empleo brinde mejores resultados que los obtenidos con el diagnóstico clínico, quedando por lo tanto las mismas reservadas para la investigación.
- •
El examen del LCR estará limitado al diagnóstico de enfermedad de Creutzfeldt-Jakob y otras formas de demencia rápidamente progresivas (recomendación grado C).
- •
Los test genéticos, incluyendo la detección del gen de la apolipoproteína E (ApoE), no son recomendados para el diagnóstico de EA en el paciente individual debido a que su valor predictivo positivo y negativo son bajos (recomendación grado D), reservándose su empleo para estudios poblacionales de investigación.
La evaluación del estado cognitivo y conductual constituye un eje clínico de fundamental importancia para el diagnóstico de demencia, y en la actualidad se dispone de un gran número de escalas que pueden ser administradas en las distintas fases del desarrollo de la demencia.
Las manifestaciones de inicio presentan alteraciones sutiles y requieren de una evaluación más profunda que permita optimizar el diagnóstico temprano.
Si bien los síntomas cognitivos definen el síndrome demencial y pueden facilitar la aproximación nosológica, la comorbilidad con síntomas neuroconductuales se observa con elevada frecuencia42. Los trastornos de conducta se presentan con baja frecuencia en los estadios iniciales de la enfermedad pero tienen elevada prevalencia y son determinantes de la institucionalización del paciente en los estadios medios y finales.
La entrevista inicial al paciente y a su cuidador es clave para realizar una correcta evaluación cognitiva. Un cuidadoso interrogatorio permitirá efectuar el relevamiento de la historia familiar y obtener datos que posibiliten inferir sobre el estado premórbido del sujeto. Las variables demográficas (edad, ocupación, nivel de instrucción, dominancia manual, etc.) y los antecedentes personales son fundamentales tanto para la elección de las técnicas de evaluación más apropiadas como para su ulterior interpretación.
En todos los casos, la escala elegida para la evaluación inicial del estado mental (cribado) debería reunir las siguientes características:
- •
Brevedad en su aplicación.
- •
Aceptable nivel de sensibilidad.
- •
Fácil administración (requerimiento de materiales y entrenamiento del evaluador).
- •
Adecuación según el nivel de instrucción alcanzado.
- •
Estandarización (cuantificable y reproducible).
Las guías consultadas sugieren una gran variedad de escalas y test que permiten evaluar en profundidad, en caso de ser necesario, los distintos dominios cognitivos y conductuales. Mencionamos a continuación las escalas de uso internacional más citadas. Sugerimos no obstante emplear las escalas y baterías que tengan una norma validada para nuestra población según sean aplicables en cada situación. Se subraya que no es indispensable administrar la totalidad de las pruebas enumeradas, y su mención tiene por fin constituir una guía informativa y amplia para el examinador.
Evaluación cognitivaEvaluación global de las funciones cognitivasProponemos una serie de test de detección (cribado) que permitirán una aproximación inicial:
Evaluación abarcativa de las funciones cognitivasSe emplean distintas escalas diseñadas para evaluar las diferentes funciones cognitivas en forma específica. Se sugiere evaluar la totalidad de ellas para mayor precisión diagnóstica cuando ello sea posible:
- •
Atención.
- •
Memoria.
- •
Lenguaje.
- •
Habilidades visuoespaciales.
- •
Funciones ejecutivas.
- •
Abstracción y razonamiento.
En todos los casos, el profesional actuante deberá determinar, en función del estadio clínico de la enfermedad y del compromiso cognitivo, conductual y funcional del paciente, cuáles serán los test más apropiados en cada situación individual.
A continuación se presenta, a modo de ejemplo, un listado de escalas putativas aplicables a las diferentes funciones cognitivas que no agota las posibilidades de elección. Las mismas son recomendadas para su aplicación cuando el examinador lo considere oportuno según el caso individual e intercambiables por similares debidamente validadas.
- •
Atención. Sugerimos los test que se muestran en la tabla 3 para la evaluación de las funciones atencionales.
Tabla 3.Evaluación de las funciones atencionales
Atención selectiva • Tests de cancelación (test de las campanas)47 • Test de ejecuciones continuas (Continuous Performance Test)48 Atención sostenida • Test de ejecuciones continuas (Continuous Performance Test)48 Velocidad de procesamiento de la información • Subtest de Dígito-Símbolo WAIS- III49 Amplitud atencional • Span visuoespacial del WMS-R50 • Trail-Making Test “A”51 - •
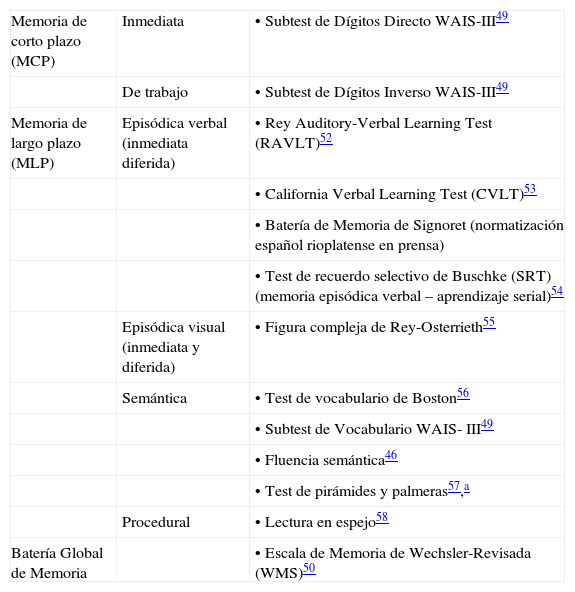
Memoria. Algunas de las escalas adaptadas en nuestro medio se ilustran en la tabla 4.
Tabla 4.Evaluación de la memoria
Memoria de corto plazo (MCP) Inmediata • Subtest de Dígitos Directo WAIS-III49 De trabajo • Subtest de Dígitos Inverso WAIS-III49 Memoria de largo plazo (MLP) Episódica verbal (inmediata diferida) • Rey Auditory-Verbal Learning Test (RAVLT)52 • California Verbal Learning Test (CVLT)53 • Batería de Memoria de Signoret (normatización español rioplatense en prensa) • Test de recuerdo selectivo de Buschke (SRT) (memoria episódica verbal – aprendizaje serial)54 Episódica visual (inmediata y diferida) • Figura compleja de Rey-Osterrieth55 Semántica • Test de vocabulario de Boston56 • Subtest de Vocabulario WAIS- III49 • Fluencia semántica46 • Test de pirámides y palmeras57,a Procedural • Lectura en espejo58 Batería Global de Memoria • Escala de Memoria de Wechsler-Revisada (WMS)50 - •
Lenguaje. Se recomienda la evaluación de funciones lingüísticas básicas que aparece en la tabla 5.
- •
Habilidades visuoespaciales. Se recomienda la evaluación de funciones visuoperceptivas (análisis visuoperceptivo, organización visual) y visuoconstructivas (tabla 6).
- •
Funciones ejecutivas. Se han seleccionado algunos de los instrumentos más conocidos que permitan evaluar un espectro aceptable de funciones ejecutivas (tabla 7).
Tabla 7.Evaluación de las funciones ejecutivas
Planificación y organización gráfica • Figura compleja de Rey- Osterrieth55 Planificación y secuenciación gráfica • Trail-Making Test “B”51 Resistencia a interferencia e inhibición de respuestas • Test de Stroop64 Tareas simples de acción e inhibición • “GO No-GO” Task65 Flexibilidad cognitiva - Ajuste de respuestas • Wisconsin Card Sorting Test66 Secuenciación motora, verbal y gráfica • Series de Luria65 - •
Pensamiento abstracto y razonamiento. Nuevamente, se ha priorizado seleccionar instrumentos de uso habitual que brinden información aceptablemente adecuada a las funciones en estudio (tabla 8).
- •
Escala de evaluación cognitiva global para EA. En toda evaluación neurocognitiva dirigida al diagnóstico de la EA es de uso corriente administrar un instrumento de tipo abarcativo (tabla 9).
Tabla 9.Escala cognitiva global para la enfermedad de Alzheimer
Enfermedad de Alzheimer • Alzheimer's Disease Assessment Scale (ADAS)67,68
- •
Si bien las baterías neurocognitivas breves permiten discriminar entre demencia y estado cognitivo normal, no hay evidencia que permita favorecer el empleo de cualquiera de ellas por encima de las demás (recomendación grado B) ni que el uso de las mismas permita determinar el subtipo clínico de demencia (recomendación grado B).
- •
La Sociedad Española de Neurología sugiere una evaluación cognitiva global (examen del estado mental), una evaluación funcional y pruebas breves específicas de dominio para una aproximación inicial. Eventualmente se administrarán pruebas extendidas (evaluación abarcativa) para una aproximación clínica intermedia (nivel II, grado B).
La evaluación de síntomas conductuales y psicológicos en las demencias es de fundamental importancia, ya que los mismos son una expresión propia de la enfermedad y pueden ser predictivos del éxito o del fracaso terapéutico. Se deberá prestar especial atención a:
- •
Validez de los agrupamientos de síntomas.
- •
Su posible valor localizador.
- •
Probabilidad de síntomas específicos.
- •
Monitorización para intervención temprana.
En todos los casos, el profesional actuante deberá determinar, en función del estadio clínico de la enfermedad y del compromiso cognitivo, conductual y funcional del paciente, cuáles serán los test más apropiados en cada situación individual.
A continuación se presenta, a modo de ejemplo, un listado de escalas putativas aplicables a las diferentes áreas de la conducta que no agota las posibilidades de elección. Las mismas son recomendadas para su aplicación cuando el examinador lo considere oportuno según el caso individual e intercambiables por similares debidamente validadas.
Esfera conductua!Esfera emocionalSegún la signosintomatología predominante, se sugieren:
- •
Depresión. Se han seleccionado escalas de uso universalmente aceptado, todas las cuales tienen versiones en español:
- •
Apatía/Irritabilidad-agresividad.
- —
Escala de evaluación de irritabilidad, agresión y apatía75.
- —
- •
Ansiedad.
- —
Escala de ansiedad de Hamilton (Ham-A)76.
- —
- •
Manía.
- —
Escala de manía de Young77.
- —
- •
Psicosis (ideación delirante, alucinaciones, agitación).
- —
Clinical Scale for Symptoms of Psychosis in Alzheimer's Disease (SPAD)78.
- —
- •
La evaluación de síntomas conductuales y psicológicos deberá realizarse en todos los pacientes (grado A).
- •
En todos los casos deberán descartarse comorbilidades como factores etiológicos de los síntomas conductuales y psicológicos (grado C).
La declinación en las habilidades funcionales cotidianas afecta seriamente la calidad de vida del paciente y el grado de cuidado requerido, afectando por ello también la calidad de vida del cuidador. Una correcta evaluación del estado funcional permite planificar las mejores opciones terapéuticas y anticipar la necesidad de cuidado permanente o institucionalización.
La evaluación del estado funcional:
- •
Permite establecer una descripción inicial o basal del desempeño.
- •
Establece medidas objetivas para monitorizar el curso clínico en el paciente individual.
- •
Permite diseñar planes de rehabilitación ad hoc.
Entre las escalas que se pueden encontrar en español, se sugieren:
- •
Actividades de la vida diaria (AVD): la escala de Katz et al79 toma en consideración elementos básicos del desempeño: capacidad de higienizarse, vestirse, concurrir al baño, caminar y comer.
- •
Actividades instrumentales de la vida diaria (AIVD): la escala de Lawton et al80 evalúa el rendimiento del paciente en actividades que requieren la utilización de utensilios o elementos intermediarios en niveles que le permitan una vida independiente. Evalúa el desempeño en el hogar, la capacidad en ir de compras, lavar la ropa, etc. Esta escala puede ser autoadministrada o administrada por el investigador en el contexto de una entrevista.
- •
La evaluación del estado funcional deberá realizarse en todos los pacientes (grado A).
- •
En todos los casos deberá establecerse que el compromiso funcional sólo se explica por el deterioro cognitivo-conductual (grado C).
La aprobación de fármacos para el tratamiento de la EA requiere, según normativas de la Administración de Alimentos y Drogas de Estados Unidos (Food and Drug Administration [FDA])81 y la Agencia Europea de Evaluación de Medicamentos (European Medicines Evaluation Agency [EMEA])82, de una mejoría de 4 puntos en la subescala cognitiva de la Escala de evaluación de la enfermedad de Alzheimer (Alzheimer's Disease Assessment Scale [ADAS-Cog]). El ADAS-Cog es una escala de 70 puntos en la cual las puntuaciones elevadas indican mayor grado de compromiso cognitivo, por lo que una disminución en la puntuación sería indicativa de mejoría.
El tratamiento farmacológico de la EA debe ser iniciado y supervisado por un médico experimentado en el diagnóstico y tratamiento de las demencias. El diagnóstico debe estar basado en criterios aceptados (p. ej., DSM-IV o NINCDS-ADRDA), y el tratamiento debe iniciarse solamente cuando se pueda contar con un cuidador que controle regularmente la toma del fármaco por parte del paciente.
Los principios básicos para el uso de fármacos antidemenciales exigen:
- •
Hacer un diagnóstico preciso del síndrome demencial.
- •
Caracterizar la severidad de la demencia (leve, moderada y severa).
- •
Informar al paciente y al cuidador de las expectativas razonables del tratamiento (mejorías sintomáticas modestas).
- •
Optimizar la dosis.
- •
Vigilar la aparición de efectos adversos.
- •
Disminuir la dosis si surgen efectos adversos (sin caer por debajo del rango terapéutico).
- •
Monitorizar múltiples dominios para evaluar la eficacia (p. ej., cognición, conducta y funcionalidad).
- •
Ofrecer la forma farmacéutica (comprimidos o parches) según la preferencia del paciente y su cuidador.
- •
Cambiar de un inhibidor de la acetilcolinesterasa a otro, si se presenta intolerancia o falta de respuesta con el tratamiento instituido.
- •
Enfatizar la importancia de tomar los medicamentos regularmente.
Existe una correlación directa entre el déficit colinérgico cerebral y el deterioro cognitivo83. Es por ello que para el tratamiento sintomático de la enfermedad de Alzheimer leve a moderada los medicamentos antidemenciales aprobados por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT)84 recomendados por la Sociedad Neurológica Argentina (SNA)85 incluyen a los inhibidores de la acetilcolinesterasa (donepecilo, rivastigmina y galantamina). El donepecilo tiene aprobación de la FDA para el tratamiento de la EA de grado severo desde el año 2006.
Estas drogas, al inhibir la acetilcolinesterasa, aumentan la disponibilidad de acetilcolina en el cerebro. La galantamina además funciona como agonista nicotínico presináptico y la rivastigmina inhibe a la butirilcolinesterasa.
La Academia Americana de Neurología (American Academy of Neurology [AAN]) recomienda el uso de drogas inhibidoras de la acetilcolinesterasa para el tratamiento de la EA, con un nivel de evidencia clase I86.
En la evaluación de la efectividad de estas drogas se consideran los cambios en la cognición, en las actividades de la vida diaria, en la conducta y en el humor. Con respecto a los síntomas conductuales, han demostrado eficacia en algunos de ellos (p. ej., agitación)87.
La mayoría de los estudios clínicos con inhibidores de la acetilcolinesterasa han probado eficacia en mejorar el estatus cognitivo y en la discapacidad en sujetos con EA de grado leve a moderado82,86,88–93. La eficacia de los tratamientos ha sido evaluada en múltiples guías nacionales e internacionales85,89,90,93–99. Se han publicado estudios de análisis costoeficacia que revelan un beneficio económico con estas drogas100.
La eficacia de las tres drogas anticolinesterásicas es similar a dosis terapéuticas, y su efecto terapéutico presenta una curva de respuesta dependiente de la dosis101. Se produce una meseta en la mejoría sintomática a los 6–12 meses de tratamiento99. Tras la interrupción del tratamiento se ha observado una reducción gradual de los efectos beneficiosos (tratamiento sintomático).
Indicaciones y posología- •
Donepecilo: 5 a 10 mg/día. Aprobado para EA leve a severa. Dosis inicial: 5 mg/día, titular a 10 mg luego de un mes. Los estudios de interacción demuestran que el ketoconazol y la quinidina, inhibidores de la CYP3A4 y de la 2D6, respectivamente, inhiben el metabolismo de donepecilo. Por lo tanto, éstos y otros inhibidores de la CYP3A4 —como el itraconazol y la eritromicina— y los inhibidores de la CYP2D6 —como la fluoxetina— podrían inhibir el metabolismo de donepecilo.
- •
Galantamina: 16 a 24 mg/día. Aprobado para EA leve a severa. Dosis inicial: 2 a 4 mg/día. En las presentaciones que no son de liberación prolongada: iniciar con 4 mg dos veces por día, titular a 8 mg dos veces por día luego de un mes y a 12 mg dos veces por día luego de otro mes, según tolerabilidad. Formas de liberación prolongada: iniciar con 8 mg/día en una toma, titular luego de un mes a 16 mg/día en una toma y el siguiente mes a 24 mg/día.
- •
Rivastigmina: 6 a 12 mg/día. Aprobado para EA leve a moderada y deterioro cognitivo en la enfermedad de Parkinson. La dosis inicial es de 1,5 mg dos veces al día. Si esta dosis es bien tolerada luego de un lapso no menor a dos semanas, puede incrementarse a 3 mg dos veces al día. Posteriores aumentos a 4,5 mg y a 6 mg dos veces al día deben estar basados en la buena tolerabilidad de la dosis previamente administrada y sólo deben ser contemplados tras un mínimo de 2 semanas de tratamiento con la dosis precedente. Actualmente se dispone de parches transdérmicos de 5 y 10 cm2 equivalentes a 9 y 18 mg del principio activo con una tasa de liberación in vivo de 4,6 y 9,5 mg/día, respectivamente (iniciar con 5 y aumentar a 10 cm2 tras un mes de tratamiento)102.
Los efectos adversos observados con las drogas anticolinesterásicas son: náuseas, vómitos, diarrea, dolor abdominal, pérdida del apetito, pérdida de peso, insomnio, síncope y bradicardia. Se recomienda precaución cuando se utilicen en pacientes con síndrome del nodo sinusal o trastornos de la conducción (bloqueo sinoauricular o bloqueo auriculoventricular). Se recomienda monitorizar la función cardíaca antes y durante la titulación. Debe tenerse precaución en el tratamiento de pacientes con úlceras gástrica o duodenal activas o en pacientes predispuestos a estas enfermedades. Los fármacos inhibidores de la colinesterasa deben ser prescritos con precaución a pacientes con antecedentes de asma o enfermedad pulmonar obstructiva crónica. Como sucede con otros colinomiméticos, pueden exacerbar o inducir síntomas extrapiramidales96.
Los criterios de discontinuación del tratamiento con estos fármacos son:
- •
La presencia de efectos adversos que no se corrigen con reducción de dosis con actividad terapéutica.
- •
La pérdida de eficacia.
Ambos criterios permiten optar por el cambio por otra droga anticolinesterásica y comprobar la eficacia y la tolerabilidad con esta nueva droga (evidencia clase II).
Cualquiera de las tres drogas puede utilizarse para el tratamiento de la EA en etapa leve a moderada. La selección de la misma depende de la comodidad de la posología y de la menor frecuencia e intensidad de sus efectos adversos y fenómenos de interacción medicamentosa92.
Moduladores de la transmisión glutamatérgica- •
Memantina: Antagonista del receptor N-metil,D-aspartato (NMDA), es un fármaco seguro en dosis de 20 mg/día. Como efecto adverso más frecuente se describe la agitación. La memantina está aprobada para la EA de grado moderado a severo.
Posología: dosis de inicio de 5 mg/día por una semana. Se ajustará la dosis titulando incrementos progresivos semanales de 5 mg, p. ej., 10 mg/día en dos tomas, 15 mg/día (10 + 5 mg) y 20 mg/día (10 mg dos veces al día). El intervalo mínimo recomendado entre los incrementos de la dosis es de una semana. Existen comprimidos de 20 mg para administrar en una sola toma diaria.
Hay estudios que avalan la eficacia de la memantina sola o combinada con un inhibidor de colinesterasa para el tratamiento de la demencia tipo Alzheimer grado moderado a severo86,88,97,103–105
Otros fármacos- •
Cerebrolisina: Es una preparación de péptidos con acción neurotrófica derivados de cerebros porcinos, que se administra por vía parenteral intravenosa. Aunque no se ha esclarecido su mecanismo de acción a nivel molecular, se postula un efecto en la reducción de la fosforilación de la proteína precursora del amiloide y de la producción del péptido β-amiloide a partir de la modulación de las cinasas GSK3β y CDK5 en el ratón transgénico. En América Latina este fármaco ha sido aprobado en Argentina (ANMAT) y en Chile, al igual que en países de Europa y Asia (p. ej., Portugal, Austria, Alemania, Rusia, Hong Kong y Tailandia)106. Existen estudios aleatorizados, doble ciego, controlados contra placebo que demuestran la eficacia de la cerebrolisina en la EA de grado leve a moderado107–109. Un metaanálisis publicado recientemente sugiere la necesidad de estudios multicéntricos de mayor escala110.
Posología: 10 ml diarios (hasta 30 ml para casos severos), 5 días a la semana repetidos durante 4 semanas (1 ciclo). Se recomienda repetir los ciclos de tratamiento 2–4 veces por año.
Forma de administración: hasta 10 ml se pueden aplicar directamente en forma intravenosa, sin dilución, inyectando lentamente (no menos de 3 min). Dosis mayores a 10 ml se administran por perfusión intravenosa como perfusión (entre 15 y 60 min) después de diluirlas en una solución de perfusión estándar.
RecomendacionesNivel de evidencia y grado de recomendación para los tratamientos de uso en la EA:
- •
Anticolinesterásicos: recomendación grado A.
- •
Memantina: recomendación grado A.
- •
Combinación anticolinesterásicos/memantina: recomendación grado B.
- •
Cerebrolisina: recomendación grado B.
- •
Otros fármacos (estatinas, drogas antiinflamatorias, vitamina E, gingko biloba, etc.) no pueden ser recomendados para su uso en la prevención ni en el tratamiento de la EA: Recomendación grado A116.
Los pacientes con demencia requieren psicofármacos en el 70-90% de los casos. Al prescribirlos debe considerarse el efecto deletéreo antimuscarínico de los fármacos antidepresivos y antipsicóticos. Estas drogas pueden producir sedación, caídas y trastornos mnésicos por su acción antihistamínica y antimuscarínica. No se recomienda el uso crónico de benzodiacepinas para la agitación y el insomnio. Los psicofármacos benzodiacepínicos pueden alterar la conducta en pacientes con demencia, producir amnesia anterógrada y efectos paradoxales, con alta prevalencia en pacientes añosos111,112.
La reciente publicación de trabajos científicos alertando sobre complicaciones cardio y cerebrovasculares y aumento de la mortalidad en pacientes con demencia por el uso prolongado de antipsicóticos atípicos y típicos113–115 hace que se desaconseje el uso regular de estos fármacos, por lo que deben reservarse para eventos de descompensación aguda. Si las características del paciente llevan a considerar la utilización de este tipo de drogas por períodos más prolongados, deben discutirse los potenciales riesgos y beneficios de su empleo con los familiares y pacientes.
Si bien la FDA desaconseja el uso de antipsicóticos en la demencia, cabe destacar que otras agencias internacionales de medicamentos (Canadá, España y Reino Unido) autorizan el uso de risperidona95,96,99 “para el tratamiento a corto plazo (hasta 6 semanas) de los cuadros de agresividad persistente que pueden aparecer en pacientes con demencia de tipo Alzheimer de moderada a grave que no responden a medidas no farmacológicas y cuando hay un riesgo de daño para ellos mismos o para los demás”.
RecomendacionesLa asociación de fármacos antipsicóticos con efectos adversos potencialmente severos no invalida su uso, debiendo ser empleados con precaución cuando el cuadro clínico lo amerite (recomendación grado A).
Tratamiento no farmacológicoSi bien no existen estudios aleatorizados que evidencien recomendación de tratamiento de estimulación en la enfermedad de Alzheimer, la utilización de recursos farmacológicos no excluye el empleo de otras estrategias terapéuticas dirigidas a los aspectos bio-psico-sociales del paciente con los mismos objetivos:
- •
Estimular las funciones cognitivas preservadas.
- •
Mejorar la sintomatología no cognitiva.
- •
Conservar las actividades de la vida diaria (AVD) para prolongar la autonomía funcional.
- •
Mantener la dignidad.
- •
Reforzar la autoestima.
- •
Mantener la comunicación.
- •
Mejorar la calidad de vida.
Las acciones sobre la función cognitiva se centran en:
- •
Estimulación y activación cognitiva.
- •
Manipulación ambiental.
- —
Medio seguro y familiar.
- a.
Alarmas interiores.
- b.
Seguros en las puertas.
- a.
- —
Simplificar el medio ambiente.
- —
Evitar la excesiva estimulación.
- —
Proveer buena iluminación.
- —
Proveer claves externas.
- a.
Etiquetar puertas de habitaciones.
- b.
Letras grandes, colores distintivos, dibujos.
- a.
- —
Las acciones sobre el trastorno conductual se basan en:
- •
Considerar la personalidad premórbida.
- •
Descartar trastornos neurosensoriales: aislamiento social.
- •
Evaluar el estado nutricional.
- •
Tratar enfermedades intercurrentes.
- •
Considerar los efectos secundarios del tratamiento.
Para prolongar la independencia funcional, hay que asegurar:
- •
Medio ambiente seguro y familiar.
- •
Rutinas predecibles.
- •
Evitar exigencias abrumadoras.
- •
Dieta bien balanceada.
- •
Actividad física regular.
- •
Consejo individual.
A pesar de la creciente evidencia acumulada sobre los beneficios potenciales que el diagnóstico temprano, la conducta terapéutica apropiada y las redes de apoyo social brindan al paciente con demencia y a su cuidador —incluyendo los aspectos biopsicosociales y económicos (costos directos e indirectos)—, ésta no se traduce en una mejor aplicación de las herramientas disponibles para optimizar el aprovechamiento de los recursos humanos y materiales.
El Grupo de Trabajo de Neurología de la Conducta y Neurociencias Cognitivas de la Sociedad Neurológica Argentina publicó en 2006 la primera Guía de práctica clínica sobre la enfermedad de Alzheimer para su aplicación en nuestro medio y, eventualmente, al resto de los países hispanoparlantes del Cono Sur.
Si bien las recomendaciones de este panel de expertos pueden no ser aplicables en todas las circunstancias dadas las características individuales de cada paciente, la realidad sociocultural del entorno familiar y la disponibilidad de recursos en los distintos escenarios geográficos, la Guía que hoy publicamos, mediante la revisión y actualización del estado actual del conocimiento sobre la EA y su manejo, provee a los profesionales los estándares surgidos de la medicina basada en la evidencia para una adecuada implementación de las conductas diagnósticas y terapéuticas a su alcance en nuestro medio.
Conflicto de interesesR.F. Allegri es conferencista para Novartis y Lundbeck; J. Kremer es investigador principal de Eli Lilly y Wyeth y conferencista para Novartis, Janssen Cilag, Phoenix, Raffo, Richmond y Neuropharma; D.R. Zuin es investigador principal de Novartis.
Anexo 1 - Miembros del Grupo de Trabajo de Neurología de la Conducta y Neurociencias Cognitivas de la SNAAbel C, Allegri RF, Arizaga R, Barreto MD, Bartoloni LC, Bavec CV, Brusco LI, Castro DM, Cedrolla M, Colli LP, Cristalli D, Demey I, Elorza P, Estévez N, Famulari A, Fernández MC, Figini H, Fracaro ME, Frontera SA, Garau ML, Genovese O, Giménez JJ, Golimstok A, Harris P, Juárez E, Kremer J, Labos E, Loñ L, López DH, Manes F, Mangone CA, Marche JA, Ollari JA, Paolini RR, Perret L, Quintana JJ, Reich EG, Rojas G, Russo MJ, Salmini O, Sarasola D, Schiefelbein R, Serrano C, Solana Silveira J, Somale MV, Stolfi M, Ure JA, Zuin D.
Esta Guía de práctica clínica ha sido aprobada en sesión extraordinaria del Grupo de Trabajo celebrada el 18 de noviembre de 2010, con la coordinación de Ollari JA (secretario) y Kremer J (secretario alterno) y la presencia de los siguientes miembros: Allegri RF, Arizaga R, Bavec CV, Castro DM, Colli LP, Demey I, Famulari A, Fernández MC, Garau ML, Giménez JJ, Labos E, López DH, Perret L, Quintana JJ, Reich EG, Rojas G, Salmini O, Somale MV y Zuin D.