La criptococosis meníngea es una de las infecciones oportunistas más frecuentes en pacientes con infección por VIH, con una elevada mortalidad temprana. Para el tratamiento se utiliza anfotericinaB, 5-flucitosina y fluconazol. Sin embargo, la toxicidad de la anfotericinaB y el aislamiento de un número creciente de cepas resistentes a fluconazol determinan la necesidad de investigar sobre tratamientos alternativos, como la utilización de la simvastatina. Este estudio evaluó las capacidades inhibitorias de la asociación de simvastatina y fluconazol en los cultivos de criptococos en LCR de pacientes con meningitis criptocócica que concurrieron al hospital Padilla durante los años 2015 y 2016. Se realizó un estudio in vitro prospectivo sobre la capacidad antifúngica de la asociaciones de simvastatina con fluconazol en los cultivos de criptococos extraídos de pacientes con criptococosis del SNC que concurrieron al hospital Padilla. Se evaluaron en las 9 muestras de criptococos los distintos tamaños de los halos de inhibición y se compararon los mismos. Hubo inhibición con las soluciones de fluconazol y en las dos asociaciones de simvastatina y fluconazol. En las comparaciones de los halos inhibitorios de las soluciones se observó un aumento significativo del tamaño de los halos en presencia de la simvastatina. La simvastatina tiene una seguridad comprobada, y por lo cual sería un fármaco que podría utilizarse en un estudio clínico que evalúe su eficacia en la meningitis por criptococo.
Meningeal cryptococcosis is one of the most frequent opportunistic infections in patients with HIV infection with an early mortality. The disease is treated with amphotericinB, 5-flucidosine and fluconazole. However, the toxicity of amphotericinB and the isolation of an increasing number of strains resistant to fluconazole determine the need to research into alternative treatments, such as simvastatin. This study assessed the inhibitory abilities of the combination of simvastatin and fluconazole in Cryptococcus cultures of CSF from patients with cryptococcal meningitis who were treated at the Padilla Hospital in 2015 and 2016. We conducted a prospective in vitro study on the antifungal effect of simvastatin combinations with fluconazole in cultures of cryptococci extracted from patients with CNS cryptococcosis who were treated at the Hospital Padilla. The different sizes of the inhibition halos were assessed in the 9 samples of cryptococci and compared. There was inhibition with fluconazole solutions and with the two combinations of simvastatin and fluconazole. In the comparisons of solution inhibitory halos a significant increase in the size of halos was observed in the presence of simvastatin. Simvastatin has proven safety and therefore would be a drug that could be used in a clinical study to evaluate its efficacy in cryptococcal meningitis.
El criptococo es un basidiomiceto que se encuentra en el ambiente y cuyas levaduras son microbios intracelulares facultativos que en determinadas condiciones pueden crecer de forma independiente e infectar al humano1. Existen dos variedades con cinco serotipos: Cryptococcus neoformans (A, D, AD) y Cryptococcus gattii (C, B). C.neoformans es el más frecuente como patógeno en los seres humanos, aunque C.gattii también puede producir enfermedad y la infección se adquiere por inhalación de las levaduras2. Este hongo tiene diversos factores de virulencia, entre los cuales el más estudiado es su cápsula de polisacáridos3, una estructura dinámica que ha demostrado inhibir la fagocitosis y otras respuestas inmunes del huésped4. Esta cápsula está muy anclada a la pared de la levadura y está compuesta por dos polisacáridos grandes, el glucoronoxylomanano y el glucoronoxylogalactomanano5. Existen otros factores de virulencia además de la cápsula, como la melanina, que provee protección ante el estrés del ambiente; el manitol, que le otorga resistencia osmótica, al calor y al estrés oxidativo, y la fosfolipasaB16-9. En la actualidad existen muchas investigaciones que están direccionadas a conocer las características de los factores de virulencia de estas levaduras, con el propósito de desarrollar nuevas estrategias terapéuticas10.
La infección comienza con la inhalación del hongo y con mayor frecuencia durante la infancia11. En los pulmones el hongo interactúa con el sistema inmunitario del huésped, más precisamente con los macrófagos alveolares y las células dendríticas, desarrollando diversos mecanismos de adaptación para poder sobrevivir y replicarse en el interior de los fagocitos12-14. A partir de esta interacción y dependiendo del estado inmunitario del paciente, la infección por esta levadura puede limitarse al pulmón sin producir síntomas y suele evolucionar a la curación o conformando granulomas en periodo de latencia y, de acuerdo a los factores del huésped y de la virulencia del hongo, puede diseminarse a sitios extrapulmonares. Este microorganismo tiene una especial predilección por el sistema nervioso central (SNC), al que llega por vía hematógena extracelular o en el interior de un macrófago, para luego atravesar la barrera hematoencefálica (BHE)15-18. De esta forma, las levaduras ingresan al SNC atravesando la BHE por mecanismos transcelulares y paracelulares, o a través de un macrófago análogo a un caballo de Troya que posteriormente liberará la levadura viva por un proceso denominado vomocitosis, causando meningoencefalitis19-23.
La criptococosis es una de las infecciones oportunistas más frecuentes en pacientes con infección por VIH y un gran contribuyente de la mortalidad temprana en países en desarrollo24. Aunque dicho microorganismo se conoce desde hace más de cien años, con el surgimiento del sida la criptococosis ha emergido como una causa muy importante de morbimortalidad como infección oportunista en estos pacientes, fenómeno que ha aumentado su incidencia en casi un millón de casos nuevos en el mundo, con una mayor prevalencia en el África subsahariana; en Latinoamérica se presenta con una letalidad superior al 50% de los casos a los 3meses del diagnóstico25. La meningitis por criptococo se caracteriza clínicamente por presentar insidiosamente un cuadro febril acompañado de cefalea, náuseas y vómitos, aunque también se ha observado en un cuarto de los pacientes la presencia de signos de inflamación meníngea, encefalitis, deterioro del sensorio, déficit focal y convulsiones26. La sospecha de la presencia del hongo en el líquido cefalorraquídeo (LCR) se realiza luego de una punción lumbar (PL), donde puede encontrarse aumentada la presión de apertura y evidenciar hipoglucorraquia, hiperproteinorraquia y pleocitosis de predominio mononuclear en el LCR. El diagnóstico se confirma con la antigenorraquia del criptococo con una sensibilidad del 95%, y con el cultivo micológico y el examen directo con tinta china con una sensibilidad del 85 y del 75%, respectivamente27,28.
El tratamiento actual de la meningitis por criptococo consiste en administrar anfotericinaB y 5-flucitosina como tratamiento de inducción y luego dosis altas de fluconazol29,30. Para los países en los que la 5-flucitosina no está disponible, el tratamiento de inducción se compone de anfotericinaB y de altas dosis de fluconazol (800-1.200mg/día)31,32. Sin embargo, la toxicidad de la anfotericinaB y el aislamiento de un número creciente de cepas resistentes a fluconazol determinan la necesidad de investigar tratamientos alternativos y estrategias novedosas33. Pero para poder acceder a estas posibilidades es necesario estudiar el comportamiento del hongo ante determinados agentes antifúngicos que actúan inhibiendo el crecimiento de los mismos.
La utilización de estatinas, como la atorvastatina y la simvastatina, ha demostrado tener un efecto antifúngico contra el criptococo; además, esta última ha demostrado tener este efecto en concentraciones inhibitorias mínimas (CIM) menores, por lo que puede utilizarse en menores cantidades que la atorvastatina. Estas drogas actúan inhibiendo a la enzima HMG-CoA reductasa e impidiendo la transformación de su sustrato en mevalonato en una etapa precoz de la síntesis de ergosterol en la pared fúngica34-36. En concordancia con estos estudios, se ha demostrado la capacidad antifúngica de la simvastatina en comparación con otras estatinas37-39. Continuando con estos aportes, este estudio evaluó las capacidades inhibitorias de la asociación de simvastatina y fluconazol en los cultivos de criptococos en LCR de pacientes con meningitis criptocócica que concurrieron al hospital Ángel C. Padilla durante los años 2015 y 2016.
Material y métodosSe realizó un estudio in vitro prospectivo sobre la capacidad antifúngica de la asociaciones de simvastatina con fluconazol en los medios de cultivo, comparándolas con la inhibición producida por el fluconazol en cultivos de criptococos extraídos de pacientes con criptococosis del SNC que concurrieron al hospital Padilla durante el periodo comprendido entre los años 2015 y 2016. Se solicitó autorización a los pacientes para el uso del material biológico mediante un consentimiento informado.
Las cepas de criptococo fueron cultivas en placas de Petri con medios de Miller Hinton, pero no fueron tipificadas. La concentración utilizada para la simvastatina fue de 2mg/ml. La solución de simvastatina se preparó utilizando el protocolo de Lorenz y Parks diluyendo la droga en una solución de NaOH etanólico (15% v/v de etanol y 0,25% de NaOH) a 60°C durante una hora, obteniendo una concentración de 40mg/ml para luego diluir en solución estéril de RPMI1640 hasta alcanzar una solución de 2mg/ml, con la que se trabajó finalmente.
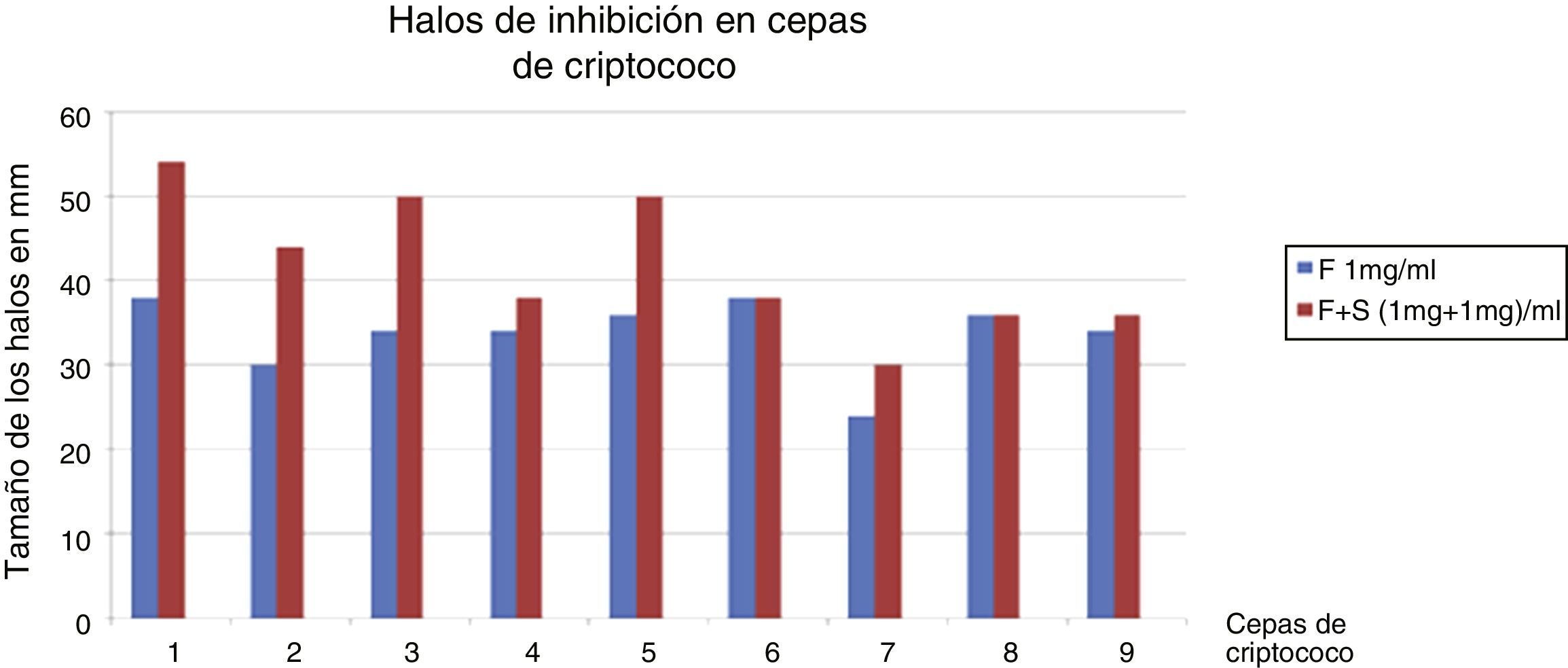
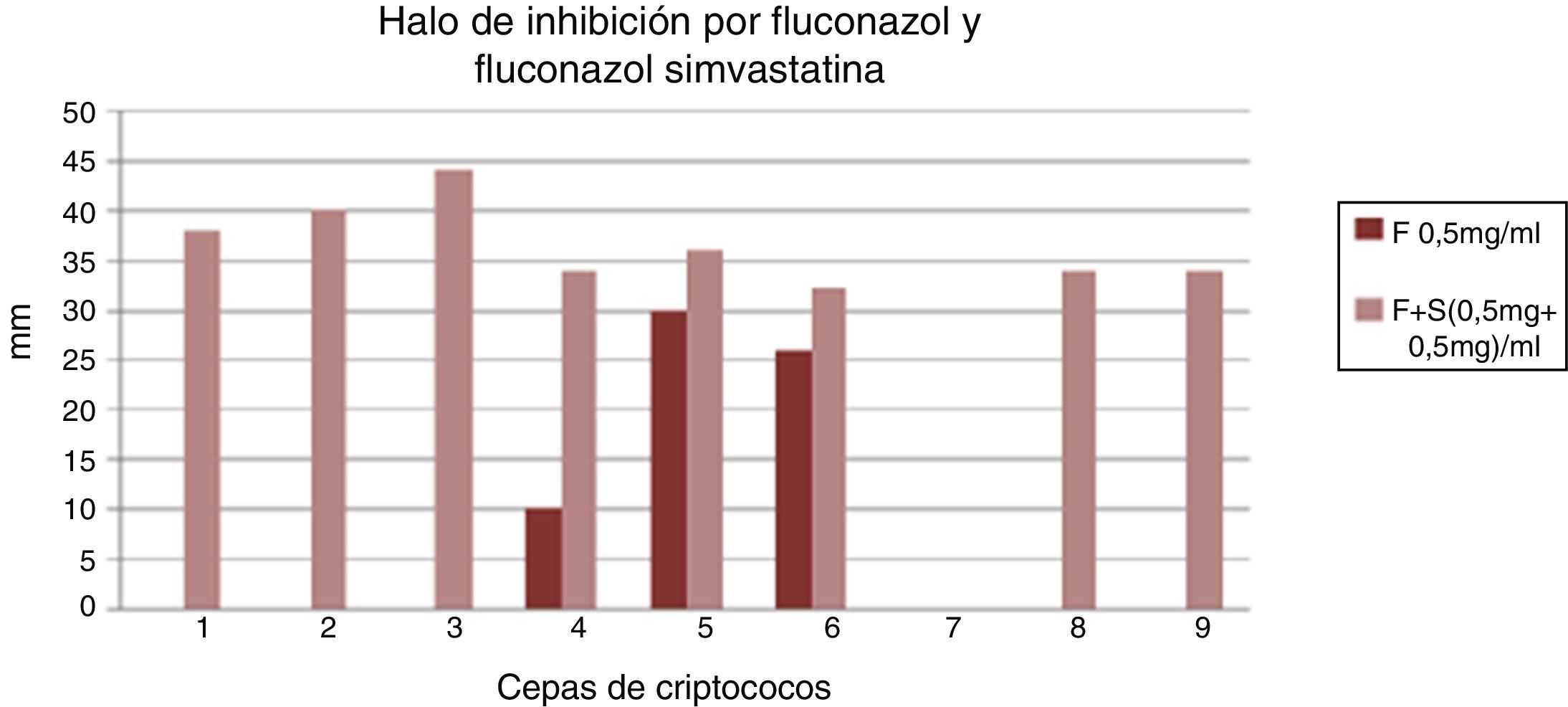
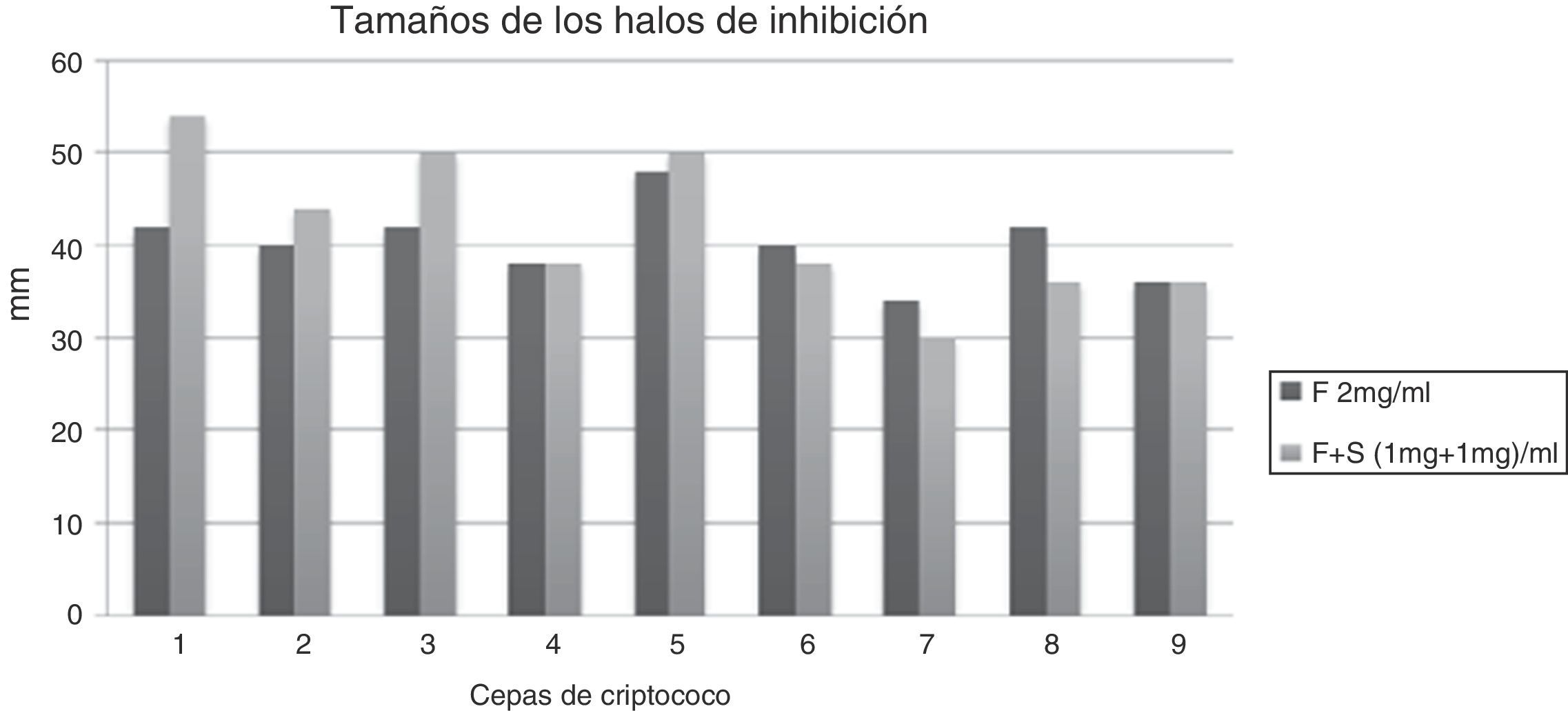
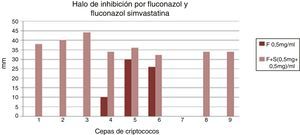
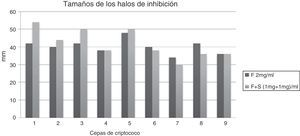
En los cultivos de la placa de Petri con medio de Miller Hinton se extrajeron por medio de un sacabocado estéril pocillos correspondientes a 50μl, donde luego se depositaron las soluciones de OHNa, simvastatina 2mg/ml, simvastatina 1mg/ml, simvastatina 0,5mg/ml, fluconazol 2mg/ml, fluconazol 1mg/ml y fluconazol 0,5mg/ml, así como las asociaciones de simvastatina 0,5mg más fluconazol 0,5mg (1mg/ml) y simvastatina 1mg más fluconazol 1mg (2mg/ml). Se incubaron por 72h a 37°C y se evaluó la presencia de halos de inhibición por medio de un calibre de precisión en los 9 pocillos. Se compararon los halos inhibitorios de las soluciones de fluconazol 1mg/ml con la asociación de fluconazol 1mg/ml más simvastatina 1mg/ml; fluconazol 2mg/ml con asociación de fluconazol 1mg/ml más simvastatina 1mg/ml, y fluconazol 0,5mg/ml con asociación de fluconazol 0,5mg/ml más simvastatina 0,5mg/ml. Se excluyeron los cultivos de LCR de pacientes expuestos a más de 3días de terapia antifúngica.
ResultadosSe evaluaron las 9 muestras de criptococos, se evaluaron los distintos tamaños de los halos de inhibición por medio de un calibre de precisión y se compararon los mismos. Los datos se analizaron con el test estadístico de Wilcoxon para evaluar las medianas. No hubo inhibición en las soluciones de OHNa ni alrededor de los tres pocillos con las diferentes concentraciones de simvastatina. Hubo inhibición en los pocillos con las tres soluciones de fluconazol y con las dos asociaciones de simvastatina y fluconazol.
En las comparaciones de los halos inhibitorios de las soluciones de fluconazol 1mg/ml con la asociación de fluconazol 1mg/ml más simvastatina 1mg/ml se observó un aumento significativo del tamaño de los halos en presencia de la simvastatina (fig. 1). Lo mismo se objetivó en las comparaciones de fluconazol 0,5mg/ml con asociación de fluconazol 0,5mg/ml más simvastatina 0,5mg/ml (fig. 2). Además, no se observó diferencia significativa del tamaño de los halos en la comparación de fluconazol 2mg/ml con asociación de fluconazol 1mg/ml más simvastatina 1mg/ml (fig. 3).
A pesar de la limitación del estudio por la escasa población de criptococos estudiados, se demostró que, en las 9 muestras, la asociación de simvastatina con fluconazol tiene una mayor inhibición fúngica que el fluconazol a dosis doble. Esto plantea la hipótesis de que la asociación de fluconazol con simvastatina no solo podría utilizarse en el tratamiento de la meningitis por criptococo, sino también disminuir la dosificación del fluconazol reduciendo los efectos adversos del azol a dosis elevadas administrado en estos pacientes. Este pequeño estudio in vitro contribuye a los estudios previos37-39 que sostienen la hipótesis de que la simvastatina podría actuar como un fármaco sinergista en la inhibición fúngica en las infecciones causadas por el criptococo. Sin embargo, se necesitan estudios clínicos para confirmarla.
Hay que tener en cuenta que existe contraindicación en el uso de simvastatina en pacientes con terapia antirretroviral (TARV) debido a que esta interacción eleva los niveles plasmáticos de la estatina, aumentando el riesgo de rabdomiólisis40,41. Sin embargo, en los pacientes que padecen meningitis por criptococo el uso de TARV debe retardarse hasta completar el tratamiento de la infección fúngica, ya que existe un elevado riesgo de desencadenarse un síndrome de reconstitución inmune42-44. Es por esto que en la actualidad se aconseja comenzar la TARV luego del tratamiento de la criptococosis meníngea45. Además, la simvastatina es la estatina con el perfil de seguridad mejor estudiado46,47, y por ello sería un fármaco que podría utilizarse en la realización de un estudio clínico que evalúe su eficacia en el tratamiento de la meningitis por criptococo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio se llevó a cabo con recursos propios de los investigadores.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Este artículo fue realizado conjuntamente por los servicios de Neurología y de Bacteriología en el Hospital Ángel C. Padilla de la provincia de Tucumán, Argentina.