En los últimos años se sucedieron cambios en la neurooncología que mejoraron la calidad de vida y sobrevida de pacientes con tumores primarios (TP) del SNC.
ObjetivosPresentar las características clínicas de una cohorte de pacientes con TP de SNC de la serie glial.
Material y métodosEntre los años 2002-2009 se realizó el seguimiento de 148 pacientes con TP de SNC. Se analizaron sólo los tumores de la serie glial intracraneanos. Éste es un estudio descriptivo.
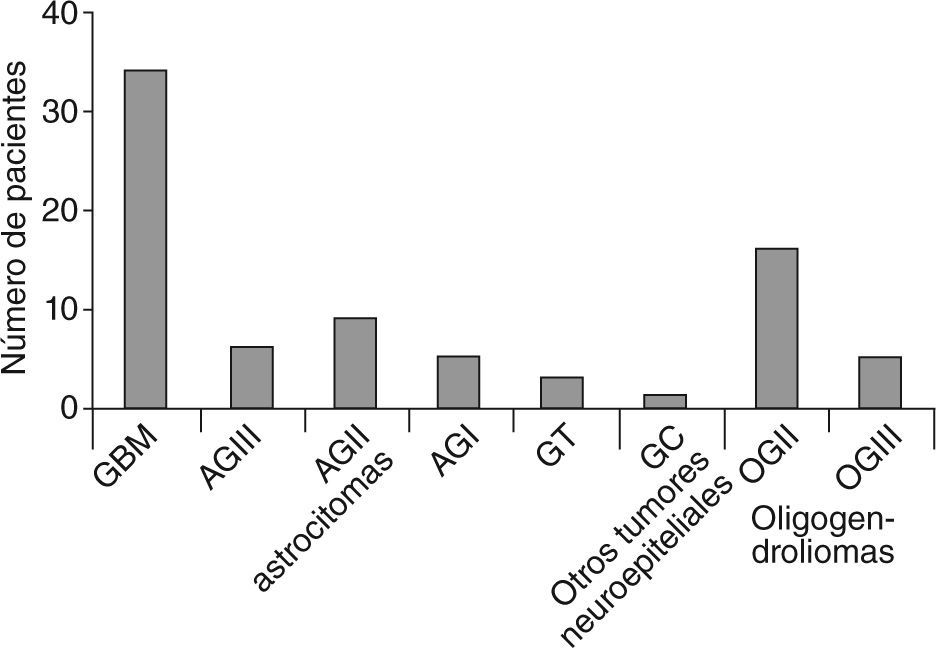
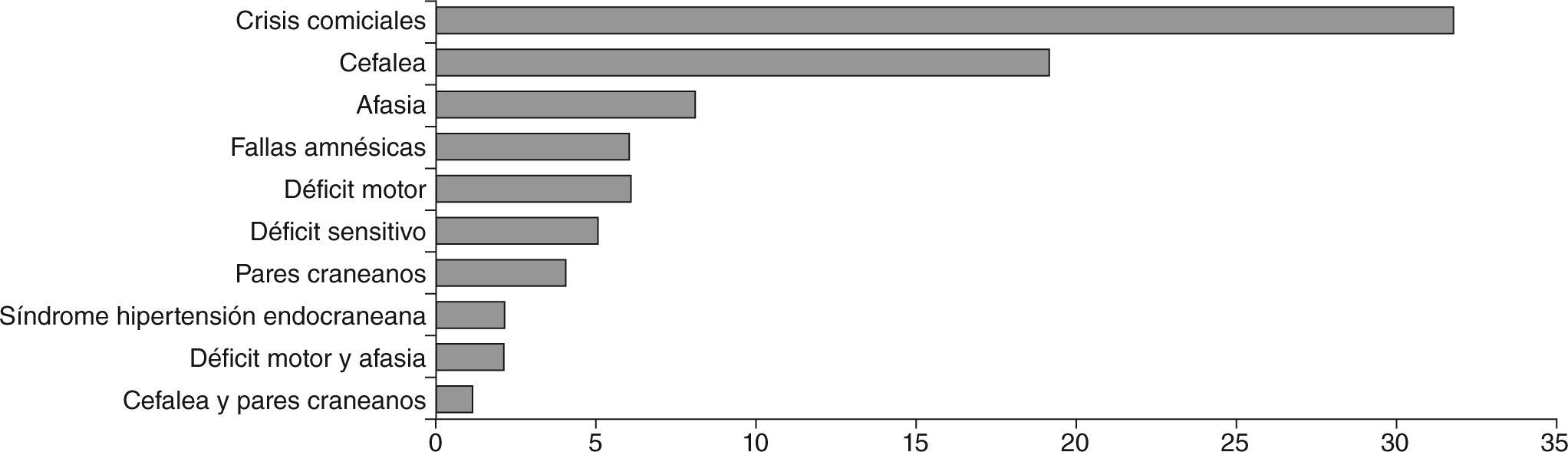
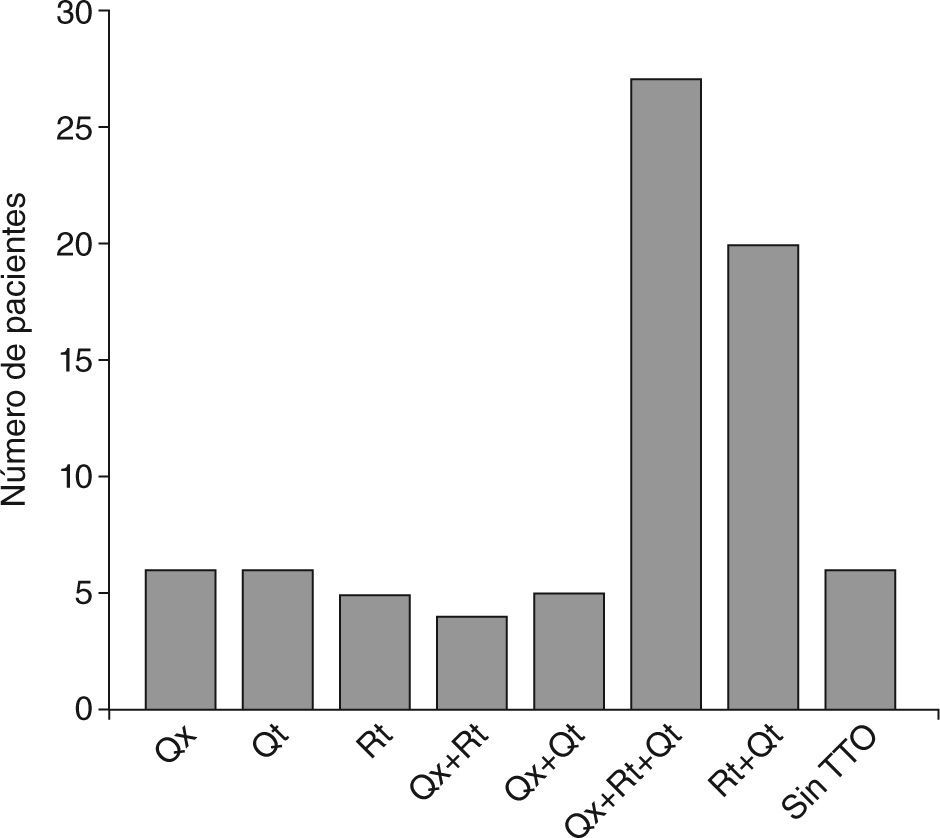
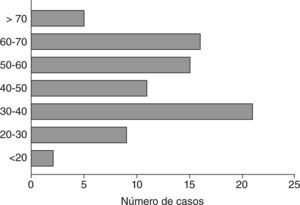
ResultadosSetenta y nueve pacientes (52 varones y 27 mujeres) presentaron tumores de la serie glial. El mayor número de casos se presentaron en la cuarta década. Según la histopatología: 34 glioblastomas multiformes (GBM), 6 astrocitomas GIII, 9 astrocitomas GII, 5 astrocitomas GI, 3 gliomas de tronco, 1 glioma cordoide, 16 oligodendrogliomas GII y 5 oligodendrogliomas GIII. La localización más frecuente fue en el lóbulo frontal. Los síntomas de inicio, en orden de frecuencia, fueron: crisis comiciales, cefalea, afasias, déficits cognitivos, motores o sensitivos, patología de pares y síndrome de hipertensión endocraneana. En 27 pacientes el tratamiento fue quirúrgico/radioterapia/quimioterapia (Qx/Rt/Qt), 20 Rt/Qt, 6 Qx, 6 Qt, 5 Rt, 5 Qx/Qt, 4 Qx/Rt, y 6 pacientes no realizaron tratamiento. El 51% de los pacientes tuvieron resección parcial o completa del tumor. Las crisis epilépticas (parciales [62%] y generalizadas [38%]) fueron controladas completamente en el 66% de los casos con monoterapia.
ConclusionesEl GBM fue el tumor más frecuente y el lóbulo frontal el más comprometido. El síntoma prevalente fueron las crisis epilépticas. Obtuvimos un porcentaje bajo de pacientes con resección parcial o completa del tumor.
In recent years there have been changes in neurooncology that have improved quality of life and survival for patients with primary CNS tumors (PCNST).
ObjectivesTo present the clinical features of a cohort of patients with primary CNS glial tumors.
Materials and methodsOne hundred and forty-eight patients with PCNST were followed up between 2002 and 2009. Only glial type PCNST was studied. This is a descriptive study.
ResultsSeventy-nine patients (52 males and 27 females) presented glial type PCNST. In most of the cases, tumors appeared in the fourth decade. Glioblastoma multiforme (GBM) 34, GIII astrocytoma 6, GII astrocytoma 9, GI astrocytoma 5, brainstem glioma 3, chordoid glioma 1, GII oligodendroglioma 16 and GIII oligodendroglioma 5 were diagnosed according to the WHO histological tumor classification. The frontal lobe was the most frequent location. Initial symptomatology in order of frequency was: seizures, headache, aphasia, cognitive impairment, motor weakness, sensorial deficits, cranial nerve involvement and intracranial hypertension syndrome. Surgery/radiotherapy/chemotherapy (Sx/Rt/Cht) was performed in 27 patients; Rt/Cht 20, Sx 6, Cht 6, Rt 5, Sx/Cht 5, Sx/Rt 4 and 6 patients were not treated. Partial or complete tumor resection occurred in 51% of patients. In 66% of the cases, the epileptic seizures (62% partials, 38% generalized) were succesfully controlled with monotherapy.
ConclusionsGBM was the most frequent tumor, and the frontal lobe was the most affected. Seizures were the prevalent symptom. We observed a suboptimal percentage of patients with partial or complete tumor resection.
La frecuencia de tumores primarios del sistema nervioso central (SNC) de la serie glial en Estados Unidos es de 20.500 nuevos casos. La incidencia es de 7,3 por 100.000 habitantes, y en los adultos se presentan entre la cuarta y la séptima décadas de la vida. Aproximadamente el 50-60% de éstos son glioblastomas multiformes (GBM)1–5. Los tumores encefálicos son responsables del 2,5% de las muertes asociadas a cáncer1.
En los últimos años sucedieron muchos cambios en la neurooncología, especialmente en el tratamiento de los gliomas, planteándose nuevos tratamientos específicos, los cuales mejoraron la calidad de vida y sobrevida en estos pacientes. Esto ha sido en gran parte debido a los avances en las técnicas de neuroimágenes que han permitido un diagnóstico precoz y seguimiento de los pacientes con esta enfermedad. Avances en las técnicas quirúrgicas y en la radioterapia también han influido en las mejoras en el tratamiento de estos pacientes. Y más recientemente, nuevas opciones de quimioterapia han comenzado a tener un impacto en el tratamiento de estos tumores6.
El objetivo de este estudio es presentar las características demográficas, clínicas, anatomopatológicas, los esquemas terapéuticos y la respuesta a los fármacos anticomiciales en una cohorte de pacientes con tumores primarios de la serie glial en nuestra institución.
Material y métodosEntre los años 2002 y 2009 se realizó el seguimiento de 148 pacientes con diagnóstico de tumores primarios de SNC según la clasificación WHO de tumores del SNC.
El presente es un estudio retrospectivo descriptivo de una cohorte de 79 pacientes portadores de tumores de la serie glial.
ResultadosDe los 79 pacientes con tumores de la serie glial, 52 eran varones y 27 mujeres, con el pico de mayor número de casos de la enfermedad en la cuarta década de la vida (fig. 1).
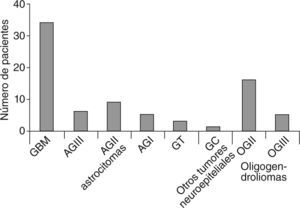
Los tipos histológicos (OMS 2007)7 fueron (fig. 2):
Tipos histológicos de tumores (OMS 2007)7. GBM: glioblastoma multiforme; AG: astrocitoma grado; GT: glioma de tronco; GC: glioma cordoide; OG: oligodendroglioma grado.
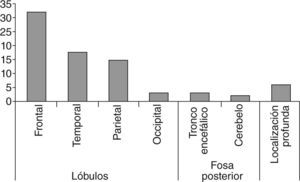
La localización más frecuente fue en los lóbulos, y de éstos: frontal en 32 pacientes, temporal en 18 pacientes, parietal en 15 pacientes y occipital en 3 pacientes; el tronco encefálico en 3 pacientes, el cerebelo en 2 pacientes, y los 6 restantes eran de localización profunda (fig. 3). No se observaron tumores multicéntricos de inicio.
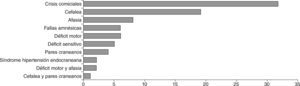
Los síntomas de inicio en orden a la frecuencia fueron: crisis comiciales en 32 pacientes, cefalea en 19 pacientes, afasia en 8 pacientes, fallas mnésicas en 6 pacientes, déficit motor en 6 pacientes, déficit sensitivo en 5 pacientes, 4 pacientes presentaron patología de pares craneanos y 2 pacientes presentaron síndrome de hipertensión endocraneana. Sólo 3 pacientes presentaron más de un síntoma de inicio, de los cuales 2 presentaron déficit motor y afasia, y el tercero cefalea y patología de pares craneanos (fig. 4).
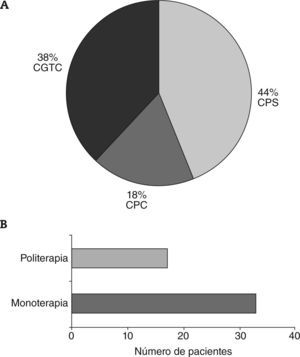
El 63% (50/79) de los pacientes presentaron crisis epilépticas en algún momento de la evolución de su enfermedad. El 62% de las crisis epilépticas fueron del tipo parcial, mientras que un 38% fueron crisis generalizadas (fig. 5A). Todos los pacientes excepto 3, eventualmente, tuvieron control completo de sus crisis epilépticas; en el 66% (33/50) utilizando un único fármaco (fig. 5B, tabla 1).
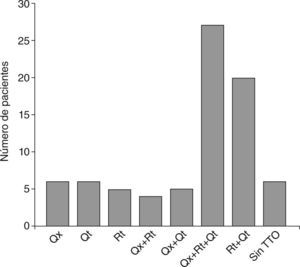
Veintisiete pacientes recibieron como tratamiento cirugía seguida por radioterapia y quimioterapia, 20 pacientes recibieron radioterapia y quimioterapia combinadas, 6 pacientes sólo fueron tratados quirúrgicamente, 6 pacientes recibieron exclusivamente quimioterapia, 5 pacientes fueron tratados únicamente con radioterapia, 5 pacientes realizaron tratamiento quirúrgico y quimioterapia, 4 pacientes tuvieron resección parcial del tumor y posterior radioterapia, y sólo 6 pacientes no realizaron tratamiento alguno (fig. 6).
Discusión y conclusionesEn esta cohorte de pacientes de nuestra institución con tumores primarios de SNC, observamos un predominio de sexo masculino (aproximadamente 2:1), con un pico de incidencia en la cuarta década de la vida. El GBM fue el tumor más frecuente, con un 43% de los casos. Estos hallazgos son similares a otras publicaciones sobre tumores primarios de SNC1–5.
En nuestra serie de pacientes, el 100% realizó al menos una resonancia magnética (RM) diagnóstica. Observamos que el lóbulo prevalente de asentamiento tumoral fue el frontal, seguido por el lóbulo temporal, similar a otras publicaciones3,5. Debido a su alta sensibilidad y detalle anatómico, las imágenes convencionales por RM se utilizan como método estándar en el diagnóstico y seguimiento de pacientes con tumores cerebrales. En la actualidad se están aplicando técnicas metabólicas (espectroscopia) y funcionales, como perfusión y difusión/ADC (coeficiente de difusión aparente) en la evaluación de los tumores cerebrales. Con estas técnicas podemos obtener una mayor sensibilidad y especificidad en el diagnóstico de los tumores cerebrales, una mejor “aproximación histológica”, así como también controlar la respuesta terapéutica y la progresión de la enfermedad. Incluso podemos utilizar estas técnicas como guía para el planeamiento prequirúrgico y biopsia8. Ampliaremos este punto cuando se discuta la “seudoprogresión”.
El síntoma más frecuente fueron las crisis epilépticas (tanto de inicio como durante la evolución de la enfermedad), seguidas de la cefalea, también similar a lo publicado por otros autores3,5,9,10. La gran mayoría de nuestros pacientes, excepto 3, fueron monosintomáticos de inicio. Como se observa en éste y en otros trabajos, las crisis epilépticas fueron muy prevalentes; entre el 20 y el 40% de los pacientes presentarán crisis epilépticas al momento del diagnóstico tumoral y un 20-45% más (dependiendo de factores como la histología del tumor, la localización, la edad y los tratamientos), eventualmente sufrirán crisis comiciales3,5,9,10. En nuestra serie de pacientes, sabemos que las crisis correspondían a una localización; sin embargo, el 38% fue descrito o asentado en la historia clínica como crisis generalizadas tónico-clónicas (CGT-C). En una revisión efectuada por Glantz et al encontraron que el 42% de las crisis fueron clasificadas como CGT-C10. Las cifras de CGT-T, que creemos elevadas, pudieron obedecer a interrogatorio insuficiente, falta de testigos, crisis parcial muy breve seguida de generalización secundaria, crisis parciales complejas malinterpretadas por los cambios de conducta/carácter en estos pacientes, crisis parciales secundariamente generalizadas durante el sueño, entre otras. Es probable que con tiempo y experiencia ganada, este 38% se reduzca en nuestro centro. La introducción de nuevos fármacos anticonvulsivantes permitió un mejor manejo de esta frecuente complicación en estos pacientes. El fármaco antiepiléptico de elección en pacientes con tumores primarios de SNC debe ser efectivo tanto para el control de crisis parciales como generalizadas, no debe interferir con fármacos quimioterápicos ni con otros medicamentos frecuentemente administrados, ni debe tener efectos deletéreos en la esfera neurocognitiva. En los últimos años el levetiracetam ha demostrado no presentar interacción con quimioterápicos, corticoides y otros fármacos antiepilépticos, y por estas características sería el fármaco de elección actual en estos pacientes9,10. Cabe recordar que en pacientes sin historia de crisis epilépticas no se deben indicar fármacos anticomiciales10. En el grupo de pacientes con crisis epilépticas tuvimos un porcentaje elevado clase I (Clasificación de ILAE) de control de las mismas con monoterapia, lo cual difiere, favorablemente, con otras publicaciones9,11. Como segundo fármaco, el levetiracetam fue de elección en la mayoría de los casos. Existe un trabajo que menciona que por el uso de fármacos anticomiciales inductores enzimáticos en pacientes con GBM y epilepsia, éstos tendrían un mejor pronóstico; sobre meras especulaciones de esta asociación, los efectos adversos y potenciales riesgos de los mismos los colocan como fármacos de segunda línea9,10,12.
En esta cohorte de pacientes, el 51% tuvieron resección parcial o completa del tumor, un porcentaje que se encuentra por debajo de las cifras mencionadas en otros estudios, y por ende en relación directa con un tratamiento insuficiente2,3,6. Podrá aducirse que en los estudios fase III los pacientes tuvieron más acceso a la neurocirugía para obtener un mejor rédito de los tratamientos adyuvantes (radioterapia [Rt] y/o quimioterapia [Qt])13. En nuestra experiencia podemos afirmar que un acceso rápido a una neurocirugía y con la mayor resección tumoral posible sin morbilidad agregada, ha demostrado ser beneficioso para estos pacientes.
El esquema actual estándar para el tratamiento de los gliomas malignos en adultos es el tratamiento combinado de Rt + Qt con temozolomida (TMZ) per os. Además, en el año 2006 la Administración Nacional de Medicamentos, Alimentos y Tecnología (ANMAT) autorizó para este mismo grupo de pacientes el esquema Rt + nimotuzumab intravenoso. El esquema de Rt recomendado o estándar para el tratamiento de los gliomas malignos en adultos es 60Gy en dosis diarias de 2Gy incluyendo el área de boost. Esquemas hipofraccionados de irradiación pueden ser usados en pacientes añosos, con mal pronóstico, bajo performance score (Karnofsky <50) y sobrevida limitada, sin comprometer la respuesta al tratamiento radiante14. El 77% de nuestros pacientes recibieron Rt estándar. En los pacientes con GBM y GIII (astrocitomas de alto grado o malignos), la incorporación al tratamiento radiante de un agente alquilante, la TMZ, resultó en una mayor sobrevida, estadísticamente significativa13,15. Los GBM presentan diferentes subtipos moleculares que condicionan la respuesta al tratamiento estándar16. El gen MGMT (metilguanina ADN metiltransferasa) se localiza en el cromosoma 10q26 y codifica la proteína reparadora del ADN dañado removiendo grupos alquilados de la posición O6 de la guanina, sitio importante de acción de los agentes alquilantes sobre el ADN. La reparación del ADN consume la proteína MGMT, que la célula debe reponer. En algunos tumores, el silencio epigenético del gen MGMT por un promotor de metilación está asociado con la pérdida de la expresión MGMT y la consiguiente merma en la actividad reparadora del ADN. Sin reparar el ADN, lesiones inducidas por la Qt, especialmente O6 metilguanina, desencadenan citotoxicidad y apoptosis. En resumen, la Rt y/o TMZ promueven la metilación, y cuando la enzima MGMT se encuentra metilada, es incapaz de reparar el ADN, y esto se ha asociado a una mayor sobrevida en pacientes con GBM tratados con Rt + TMZ17. Cincuenta y ocho de nuestros pacientes recibieron Qt en algún momento de su tratamiento, 58 recibieron TMZ, mientras que 5 recibieron nimotuzumab. Este anticuerpo monoclonal humanizado anti EGF-R (epidermal growth factor receptors) tiene propiedades antiangiogénica, antiproliferativa y pro-apoptótica18. Sólo un paciente con tumor de tronco y disfagia severa recibió el anticuerpo monoclonal de inicio. Hecha esta salvedad, el nimotuzumab se utilizó en 4 pacientes como segunda línea de tratamiento. Con los tratamientos quimioterápicos observamos una baja incidencia de complicaciones significativas, todas por la TMZ. Dos pacientes cursaron con neutropenia febril, de los cuales uno de ellos la presentó en 2 ocasiones. Se constataron 2 casos de mielodisplasia por TMZ, uno de ellos presentado en el 2008 durante el XLV Congreso Argentino de Neurología y las XXIV Jornadas de Oncología19. Una paciente falleció por cuadro de sepsis severa secundaria a celulitis por S. aureus. Las complicaciones severas por la Qt fue de 7,6%, valor muy por debajo del 15-18% publicado en otros estudios3,13,20.
En gliomas recidivados, los tratamientos quimioterápicos de segunda línea con bevacizumab e irinotecan han demostrado una prometedora respuesta con una toxicidad aceptable. En un estudio, los efectos adversos fueron mínimos en todos los pacientes excepto 2 que presentaron toxicidad grado II por bevacizumab (fatiga, epistaxis y elevación de las enzimas hepáticas) y no se observaron complicaciones trombóticas21. En otros se observaron complicaciones trombóticas, infecciones y sangrado en SNC, que en ocasiones determinaron la finalización del tratamiento22–25.
Vale la pena extenderse en el conocimiento de la “seudoprogresión”. Este término se refiere a un aparente aumento de tamaño de la masa tumoral y de la captación de contraste vinculado al tratamiento con Rt y Qt. La seudoprogresión se presenta habitualmente hasta en un 20% de los pacientes tratados con Rt y TMZ, y explica aproximadamente la mitad de los casos en los que se observa aumento del tamaño de la lesión al finalizar el tratamiento concomitante de Rt + TMZ. Estas lesiones, en el curso de meses, decrecen de tamaño y se estabilizan sin tratamientos adicionales, y permanecen clínicamente “silentes”. La fisiopatología de la seudoprogresión no es completamente conocida. Es probable que la combinación de Rt con la TMZ provoque un alto grado de muerte celular en el tumor y en el endotelio tumoral. Esto sería responsable del edema y el aumento de la permeabilidad capilar que se observan en las imágenes y que aparentan como progresión tumoral, pero de hecho corresponde a una seudoprogresión. En pacientes tratados con Rt concomitante con TMZ que presentan un aumento de la “masa tumoral”, sin nuevos síntomas o asintomático al final del tratamiento, se debería continuar con TMZ adyuvante. En pacientes con lesiones sintomáticas se debe considerar neurocirugía-biopsia o resectiva. Si la anatomía patológica evidencia un ≥ 50% de necrosis por la Rt y/o TMZ (este porcentaje es discutible), también se debería continuar con adyuvancia con TMZ26,27. Como nuestro estudio comenzó en el 2002, no se tenía un conocimiento claro de este proceso así como la conducta a seguir respecto al mismo, y por ello es que carecemos de información como para mostrar nuestra experiencia.
La RM con difusión/ADC y espectroscopia, y el CMET11 PET (metionina-C11, aminoácido trazador derivado de la metionina) pueden proporcionar valiosa información anatómica, bioquímica y molecular en forma no invasiva, y cumplen un rol importante en el seguimiento y la elección del tratamiento. Aplicando la técnica de difusión se observó que las áreas de recurrencia del GBM presentan valores de ADC más bajos que las correspondientes a efectos de la Rt. La RM con espectroscopia ha sido empleada como estudio para el diagnóstico diferencial entre recidiva tumoral y radionecrosis. Este último método mostró una sensibilidad del 94% y una especificidad del 100% con RM tridimensional multivoxel, aunque esto deberá ser confirmado en futuros estudios27–30. Coincidimos con otros autores en que todas las secuencias de RM ya mencionadas, y potencialmente el CMET11 PET, deberían incorporarse como estudios de rutina en el seguimiento de estos pacientes30. Es importante aclarar que el diagnóstico definitivo de seudoprogresión sólo puede realizarse por histología.
Respecto de los oligodendrogliomas y los gliomas de bajo grado (astrocitomas GII) que en su estudio molecular presentan la deleción 1p/19q, no sólo tienen mejor y más prolongada respuesta a la Qt y Rt, sino que también presentan un curso clínico más indolente3,5,20.
Nuevos avances en el reconocimiento del deterioro cognitivo y en la factibilidad de realizar pruebas neurocognitivas en pacientes con tumores de SNC han permitido brindar una mejor calidad de vida a los pacientes. Fármacos que retrasen la progresión del deterioro cognitivo por el tumor, así como por los tratamientos con Qt y Rt, serían de gran utilidad31. Drogas antagonistas del calcio como el nimodipino y aquellos que tienen su acción sobre los aminoácidos excitatorios centrales, como la memantina sobre el glutamato, podrían potencialmente tener un lugar.
Factores pronósticos novedosos, como la asociación de trombocitosis preoperatoria y la menor sobrevida en pacientes con GBM, nos permiten conocer más acerca de la evolución de estos pacientes32.
La falta de estadísticas sobre esta patología es notoria en toda Latinoamérica. Este estudio, creemos, aporta algún conocimiento sobre esta enfermedad en nuestro país, teniendo en cuenta que nuestra institución universitaria es un centro oncológico de referencia a nivel nacional.