la correlación interobservador del Alberta Stroke Protocol Programme Early CT Score (ASPECTS) es moderada. La determinación de la diferencia en unidades Hounsfield (UH) entre tejido isquémico y no isquémico a partir de la observación directa (umbral de detección visual o UDV) podría servir para desarrollar protocolos digitales que contribuyan a una estratificación más uniforme y consistente del pronóstico pre-trombólisis en pacientes con stroke isquémico agudo.
Objetivosdeterminar el UDV para la disminución de densidad tomográfica en el que la evaluación directa identifique áreas de hipodensidad en las regiones ASPECTS.
Métodosrealizamos una tomografía computarizada (TC) de cerebro a 10 pacientes en las primeras tres horas desde el inicio del stroke isquémico. Todas las TC fueron evaluadas por dos neurólogos. Analizamos la correlación interobservador mediante el coeficiente kappa. Utilizamos una matriz estandarizada de 20 regiones de interés de 36mm2 para medir la densidad tomográfica de las regiones del ASPECTS de ambos hemisferios en las 10 tomografías. Mediante curvas ROC (receiver operating characteristic) obtuvimos el UDV. Utilizando este UDV analizamos la correlación entre la evaluación visual y la digital para la estratificación en grupos ASPECTS <7 o ≥7 y para clasificar a cada una de las regiones en hipodensas o no hipodensas.
Resultadosidentificamos un UDV de 1,9 UH. Utilizando este valor la correlación para la estratificación en ASPECTS <7 o ≥7 y para clasificar las regiones en hipodensas o no hipodensas fue excelente (kappa 1,00) y moderada (kappa 0,49) respectivamente.
Conclusionesel UDV de 1,9 UH se asoció a una excelente correlación interobservador entre la evaluación visual y la digital. Este UDV puede ser utilizado para el desarrollo de protocolos digitales que contribuyan a mejorar la reproducibilidad de la escala.
Some studies have yielded a moderate to poor agreement between observers when using the Alberta Stroke Protocol Programme Early CT Score (ASPECTS). Identifying a threshold for tomographic density decline at which visual assessment identifies areas of hypoattenuation on ASPECTS regions could be used to develop digital protocols for achieving a more homogeneous stratification of ASPECTS scores in the hyperacute ischemic stroke setting.
ObjectiveTo identify the threshold for tomographic density decline at which visual assessment identifies areas of hypoattenuation on ASPECTS regions.
MethodsA non contrast computed tomography (CT) scan of the brain was performed in 10 patients within 3hours of acute ischemic stroke onset. All CT scans were evaluated by 2 neurologists trained in using ASPECTS. The only clinical information given to them was symptoms’ side. Results of ASPECTS scores were dichotomized into <7 or ≥7. Interrater variability was tested using the kappa coefficient. We measured the tomographic density of the 10 ASPECTS regions on the ischemic and nonischemic hemispheres. A standardized matrix consisting of 10 regions of interest of 36mm2 placed at the core of the ASPECTS regions was used for this purpose. The neuroradiologist was blinded to patient symptoms. We used ROC (receiving operating characteristic) curves for establishing the threshold for achieving the best correlation between the digitally measured and visually assessed ASPECTS scores. We assessed Interrater variability between the direct visual observation and the digital evaluations for defining areas of hypoattenuation and for classifying patients into groups of ASPECTS <7 or ≥7.
ResultsWe identified a threshold of 1.9 Hounsfield units (HU) which best correlated to the visual observations. When this threshold was used, the correlation between visual and digital assessments was moderate (Kappa 0.49) for defining the presence or absence of hypoattenuation, and excellent (Kappa 1.00) for classifying patients into groups of ASPECTS <7 or ≥7.
ConclusionsWe found a threshold of 1.9 HU for identifying ischemic ASPECTS regions. This difference in attenuation could be used for developing a digital grading protocol aimed at reducing interobserver variability when assessing CT scans in the hyperacute ischemic stroke setting.
El Alberta Stroke Protocol Programme Early CT Score (ASPECTS) es un test tomográfico semicuantitativo, desarrollado para optimizar la identificación de los cambios isquémicos cerebrales en la ventana de tres horas de la trombólisis intravenosa con activador tisular plasminógeno recombinante (rtPA). Predice el pronóstico funcional y el riesgo de hemorragia cerebral sintomática después de la infusión de rtPA en pacientes con infartos en el territorio de la arteria cerebral media1.
La disminución de la densidad tomográfica parenquimatosa es muy sutil en la fase inicial de la isquemia cerebral y puede ser difícil de identificar2. Por otra parte, esta dificultad se traduce en una pobre a moderada correlación cuando la hipoatenuación es evaluada por distintos observadores (kappa 0,30-0,53)3.
La definición del pronóstico del stroke isquémico agudo basada en los hallazgos tomográficos antes de la trombólisis intravenosa debe ser rápida y segura. Idealmente debe evitarse que se vea amenazada por potenciales discrepancias entre los observadores. En línea con esta idea, la determinación digital y automática de la puntuación total del ASPECTS en el paciente en ventana para trombólisis sería una ayuda para disminuir la variabilidad interobservador. Los neurólogos y no neurólogos podrían consultar esta medición automática en casos de dudas o discrepancias. Para ello sería necesario, en primera instancia, definir la diferencia en unidades Hounsfield (UH) a partir de la cual el ojo humano es capaz de distinguir una hipodensidad tomográfica (tejido isquémico) entre dos regiones correspondientes de ambos hemisferios.
Materiales y métodosAnalizamos 10 tomografías computarizadas (TC) de pacientes con stroke isquémico agudo realizadas dentro de las primeras tres horas desde el comienzo de los síntomas. Los pacientes fueron incluidos consecutivamente entre el 26 de agosto de 2007 y el 26 de julio de 2008.
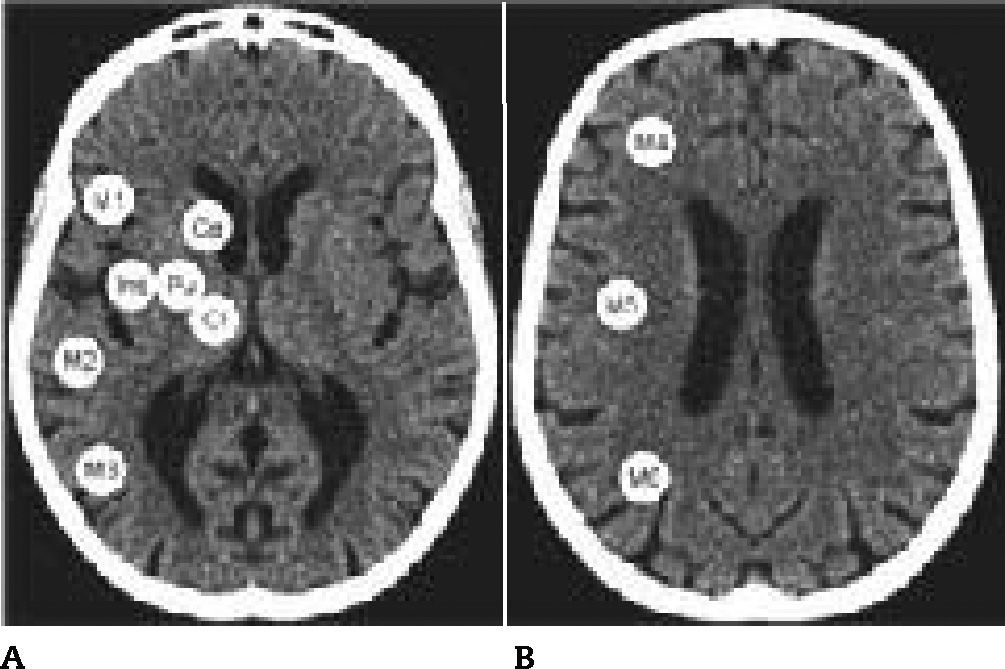
Utilizamos un tomógrafo helicoidal de 64 pistas Toshiba Alquilon 64 (cortes continuos de 5mm, 120 Kv, corriente de tubo de 225 mAs). Los valores de la ventana fueron optimizados para la distinción entre sustancia gris y sustancia blanca (80 UH). Evaluamos los dos cortes estándar del ASPECTS en las 10 TC: el primero al nivel del tálamo/ ganglios basales y el segundo adyacente al límite superior de las estructuras ganglionares. El primer corte incluye 7 regiones ASPECTS y el segundo contiene tres (fig. 1). Las 10 regiones se encuentran en el territorio de la arteria cerebral media. El ASPECTS se calcula partiendo de una puntuación inicial de 10 puntos, a la que se le va restando un punto por cada región con evidencia de hipoatenuación o edema. Dado que el edema representaría penumbra isquémica y no infarto cerebral, decidimos basar la puntuación solamente en la presencia o ausencia de hipodensidad4,5. La mejor puntuación ASPECTS es 10 (normal) y la peor es 0. La dicotomización en <7 o ≥7 define los grupos de mal y buen pronóstico, respectivamente1.
– Guía para la construcción de la matriz digital y para la evaluación visual. La figura muestra las 10 regiones de cada hemisferio. En el primer corte (A): M1, M2, M3, ínsula (Ins), putamen (Pu), cápsula interna (CI) y caudado (Ca). En el segundo corte (B): M4, M5 y M6. La guía fue construida mediante el montaje de un hemisferio copiado en espejo y simulando el contralateral para facilitar la observación mediante imágenes perfectamente simétricas.
En nuestra institución el 99% de los pacientes es evaluado mediante TC y el 11% mediante resonancia magnética nuclear (RMN). Por lo tanto, los dos neurólogos que participaron en la evaluación de las TC tienen una amplia experiencia en la observación de este tipo de neuroimágenes y en el uso del ASPECTS. Ambos neurólogos evaluaron las TC de los 10 pacientes de forma independiente. La única información que recibieron fue la lateralidad de los síntomas. Analizamos la correlación interobservador para el total de las 100 regiones (10 regiones en 10 pacientes) y para la clasificación en ASPECTS <7 o ≥7 mediante el coeficiente kappa (Medcalc® para Windows, v 9.6.4.0). La correlación fue considerada de la siguiente manera: pobre (kappa 0,0-0,19), regular (kappa 0,20-0,39), moderada (kappa 0,40-0,59), sustancial (kappa 0,60-0,79) y excelente (kappa ≥ 0,80)6. Del total de 100 regiones evaluadas identificamos aquellas en las que los dos observadores no coincidieron, con el fin de reevaluarlas en presencia de un tercer observador para llegar a un consenso final. De esta forma se obtuvo un cómputo definitivo para cada paciente basado en la puntuación de cada una de las 100 regiones, que fue denominado “consenso visual”.
Un neurorradiólogo, sin datos clínicos acerca de los pacientes, utilizó una matriz predefinida con 10 regiones de interés (ROI) de 6mm por 6mm para cada región ASPECTS de ambos hemisferios, con el fin de comparar la densidad tomográfica. De esta manera se registró la densidad de 200 regiones (10 por cada hemisferio de cada una de las 10 TC). Definimos el umbral de detección visual (UDV) como la diferencia mínima de densidades que debe existir para que una región sea considerada como hipodensa con respecto a la región correspondiente en el hemisferio contralateral por el ojo humano mediante la observación directa. A modo de ejemplo, si en la ínsula derecha la medición es de 34,5 UH y en la izquierda es de 33,1, sólo podrá clasificarse como hipodensidad insular izquierda cuando el UDV sea ≥ 1,4 UH. Durante las primeras tres horas desde el comienzo de los síntomas del stroke isquémico agudo se produce una disminución gradual de 0,4 UH por hora, según estudios que evaluaron la correlación entre los cambios observados en el coeficiente aparente de difusión en la RMN y aquellos observados en la TC7. A partir de estos datos, estimando una disminución media de 1,2 UH en las primeras tres horas, decidimos evaluar 21 UDV (desde 0,2 UH hasta 2,2 UH).
Mediante la construcción de un macro en Excel (Microsoft Office 2007®) obtuvimos la puntuación del ASPECTS para la evaluación digital utilizando diversos UDV. De esta forma, la evaluación digital generó un resultado por cada UDV seleccionado tanto para el ASPECTS final de cada paciente como para el pool de 100 regiones. Utilizamos curvas ROC (receiving operating characteristic) para determinar la diferencia de densidades asociada a la mejor correlación entre la evaluación digital y el consenso visual. Con este fin consideramos como patrón oro el consenso visual, dado que es el parámetro a partir del cual fue diseñada y validada la escala originalmente. La correlación fue evaluada tanto para la puntuación final como para el conjunto de las 100 regiones ASPECTS.
Evaluamos el tiempo transcurrido entre el comienzo de los síntomas y la realización de la TC para todos los pacientes, así como también su perfil de factores de riesgo, gravedad del stroke (escala de Stroke del NIH) y estatus funcional a los tres meses (índice de Barthel y escala Rankin modificada a los 90 días). Analizamos la relación entre la puntuación del ASPECTS resultante de la evaluación digital y el consenso visual con la gravedad del stroke y el estatus funcional.
ResultadosEvaluamos las TC de cerebro sin contraste de 10 pacientes que consultaron dentro de las primeras tres horas desde el comienzo del stroke isquémico agudo. El tiempo transcurrido entre el comienzo de los síntomas del stroke isquémico agudo y la adquisición de las imágenes fue de 97 ± 62 minutos (rango: 31 a 172 minutos).
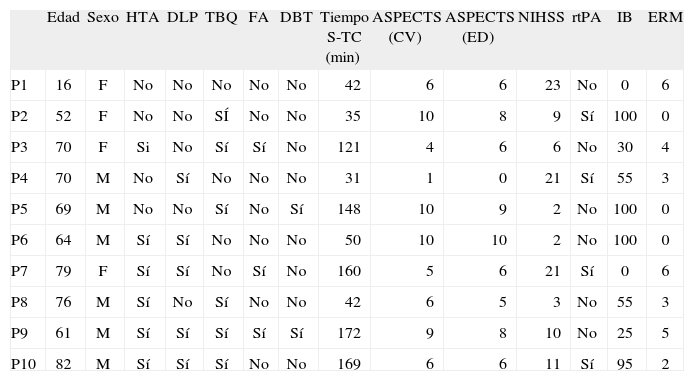
Las características de cada paciente con su ASPECTS determinado por consenso visual y por evaluación digital se resumen en la tabla 1. Todos los pacientes presentaron cuadros neurológicos con síntomas corticales compatibles con compromiso de la arteria cerebral media. En el 50% de los casos correspondían al hemisferio izquierdo.
– Características de los pacientes
| Edad | Sexo | HTA | DLP | TBQ | FA | DBT | Tiempo S-TC (min) | ASPECTS (CV) | ASPECTS (ED) | NIHSS | rtPA | IB | ERM | |
| P1 | 16 | F | No | No | No | No | No | 42 | 6 | 6 | 23 | No | 0 | 6 |
| P2 | 52 | F | No | No | SÍ | No | No | 35 | 10 | 8 | 9 | Sí | 100 | 0 |
| P3 | 70 | F | Si | No | Sí | Sí | No | 121 | 4 | 6 | 6 | No | 30 | 4 |
| P4 | 70 | M | No | Sí | No | No | No | 31 | 1 | 0 | 21 | Sí | 55 | 3 |
| P5 | 69 | M | No | No | Sí | No | Sí | 148 | 10 | 9 | 2 | No | 100 | 0 |
| P6 | 64 | M | Sí | Sí | No | No | No | 50 | 10 | 10 | 2 | No | 100 | 0 |
| P7 | 79 | F | Sí | Sí | No | Sí | No | 160 | 5 | 6 | 21 | Sí | 0 | 6 |
| P8 | 76 | M | Sí | No | Sí | No | No | 42 | 6 | 5 | 3 | No | 55 | 3 |
| P9 | 61 | M | Sí | Sí | Sí | Sí | Sí | 172 | 9 | 8 | 10 | No | 25 | 5 |
| P10 | 82 | M | Sí | Sí | Sí | No | No | 169 | 6 | 6 | 11 | Sí | 95 | 2 |
DBT: diabetes; DLP: dislipemia; FA: fibrilación auricular; HTA: hipertensión arterial; rtPA: plasminógeno recombinante; TBQ: tabaquismo.
La correlación interobservador entre los dos neurólogos fue excelente cuando clasificaron las TC en ASPECTS <7 o ≥7 (kappa 0,81; IC 95%: 0,39-0,96; p = 0,004). Coincidieron en 9 casos. En el paciente en el que no hubo acuerdo, la diferencia en el cómputo final fue de 3 puntos (9 frente a 6). Al clasificar cada una de las 100 regiones en “presencia de hipodensidad” frente a “ausencia de hipodensidad” sólo coincidieron en el 70% de las observaciones, alcanzando una regular correlación (kappa 0,34; IC 95%: 0,15-0,50; p <0,001). Las 30 regiones en las que hubo discordancia fueron reevaluadas por un tercer neurólogo y se llegó a una puntuación final por consenso en la que 6 pacientes fueron clasificados con ASPECTS < 7 y 4 con ASPECTS ≥ 7.
Mediante la matriz digital medimos la densidad de las 200 regiones ASPECTS. La densidad en los 10 hemisferios con compromiso del territorio de la arteria cerebral media fue de 30,9 ± 3,6 UH, mientras que en los 10 hemisferios no isquémicos (contralaterales) fue de 32,7 ± 3,5. La diferencia entre tejido isquémico y no isquémico fue de 1,8 ± 0,5 UH (IC 95%: 0,81-2,79; p <0,001).
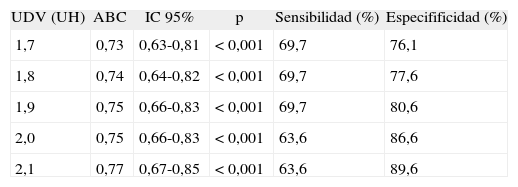
La comparación de las curvas ROC analizando sensibilidad, especificidad y área bajo la curva (ABC) de la evaluación digital con respecto al consenso visual para clasificar las 100 regiones ASPECTS, según cada UDV, se muestra en la tabla 2. Si bien evaluamos los UDV entre 1,0 y 2,5 UH sólo mostramos los resultados para el intervalo 1,7-2,1 UH, por ser los más significativos. El UDV que se asoció a una mejor correlación entre la evaluación digital y el consenso visual fue 1,9 UH. Utilizando este valor la correlación entre la evaluación digital y el consenso visual para clasificar pacientes en ASPECTS < 7 o ≥ 7 fue perfecta (kappa 1,00). Sin embargo, al evaluar la correlación para determinar la presencia o ausencia de hipodensidad en cada una de las 100 regiones ASPECTS la correlación fue sólo moderada (kappa 0,49, IC 95%: 0,33-0,63; p = <0,001), con coincidencia en 78 de 100 regiones evaluadas.
– Comparación de curvas ROC para distintos puntos de corte al evaluar las 100 regiones ASPECTS
| UDV (UH) | ABC | IC 95% | p | Sensibilidad (%) | Especifificidad (%) |
| 1,7 | 0,73 | 0,63-0,81 | <0,001 | 69,7 | 76,1 |
| 1,8 | 0,74 | 0,64-0,82 | <0,001 | 69,7 | 77,6 |
| 1,9 | 0,75 | 0,66-0,83 | <0,001 | 69,7 | 80,6 |
| 2,0 | 0,75 | 0,66-0,83 | <0,001 | 63,6 | 86,6 |
| 2,1 | 0,77 | 0,67-0,85 | <0,001 | 63,6 | 89,6 |
IC 95%: intervalo de confianza para el 95%; UDV: puntos de corte; UH: unidades Hounsfield.
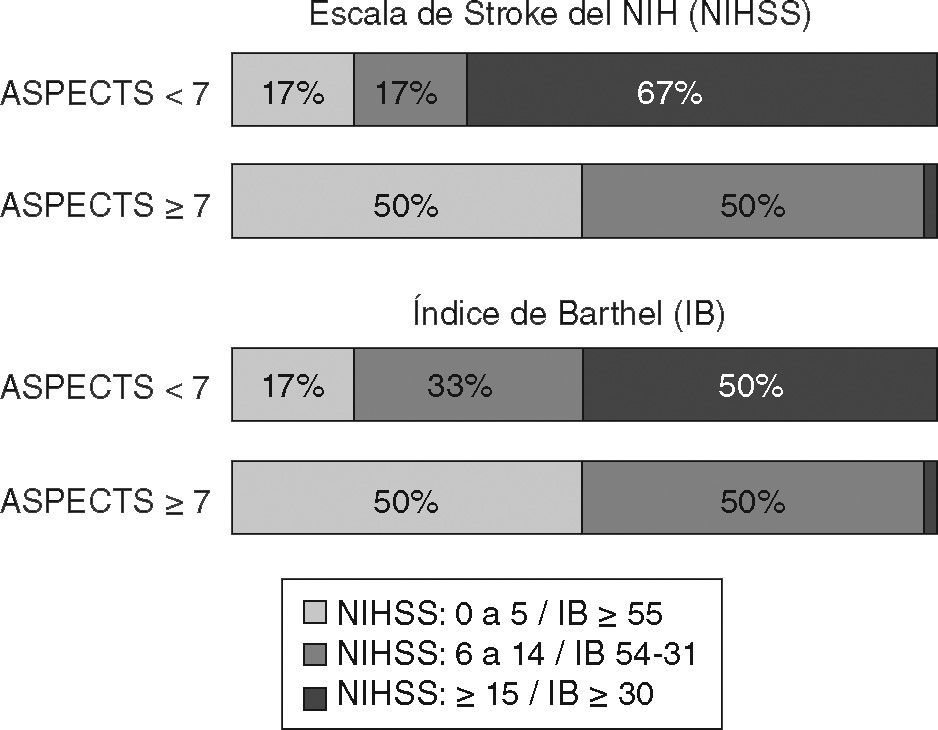
Tal como se muestra en la figura 2 encontramos una buena relación entre el ASPECTS obtenido por consenso visual y la gravedad/ pronóstico del stroke.
DiscusiónLa correlación entre neurólogos para la clasificación en ASPECTS < 7 o ≥ 7 fue excelente. Sin embargo, el acuerdo para identificar las regiones hipodensas fue sólo moderado. Identificamos un UDV de 1,9 UH que permitió correlacionar satisfactoriamente la medición digital con la observación directa.
La detección mediante observación directa de áreas de hipodensidad se asocia con peor pronóstico postrombólisis1. Esta observación puede explicarse porque dichas áreas representan la porción de parénquima encefálico más gravemente afectado por las condiciones de isquemia tisular: hipoperfusión crítica con infarto consolidado8. Es probable que la disminución de 1,8 ± 0,5 UH que encontramos en las regiones ASPECTS afectadas refleje áreas de isquemia irreversible. En este sentido, nuestros resultados son similares a los reportados por Kucinski et al, quienes evidenciaron una disminución de 1,3 ± 0,7 UH entre las horas 1,3 y 4,5 después del comienzo de los síntomas de stroke isquémico agudo7. En este trabajo la disminución lineal y continua de la densidad tomográfica se correlacionó con una reducción proporcional del coeficiente aparente de difusión.
La fiabilidad del ASPECTS para estratificar el pronóstico de pacientes sometidos a trombólisis intravenosa con rtPA ha sido puesta en duda por varios motivos. Tal vez el aspecto más cuestionable es que su reproducibilidad puede ser baja. Si bien algunos estudios han demostrado una moderada a excelente correlación interobservador8,9, la metodología aplicada en ellos puede ser discutida al menos en un aspecto: al analizar la correlación interobservador sólo evalúan si los observadores clasifican las TC en ASPECTS < 7 o ≥ 7. De esta forma, los resultados parecen ser fiables. Sin embargo, no consideran que dos puntuaciones finales exactamente iguales generadas por observadores independientes, al evaluar un mismo paciente, pueden estar determinadas por evaluaciones parciales muy distintas; es decir, un observador pudo haber otorgado una puntuación de 7 a un paciente por haber observado una hipodensidad en el nivel de la ínsula, el putamen y el núcleo caudado, mientras que otro pudo haber llegado al mismo resultado pero por haber observado una hipodensidad en las regiones ASPECTS M4, M5 y M6. Si bien este es un ejemplo extremo, puede ser perfectamente posible. De hecho, los dos observadores de nuestro estudio coincidieron en la puntuación final en 9 de 10 pacientes, a pesar de la no coincidencia en 30 de las 100 regiones evaluadas. Dado que la escala predice el pronóstico basándose en la dicotomización en < 7 o ≥ 7, podría argüirse que no importan los caminos por los cuales se llegue al resultado final mientras se pueda demostrar que diversos observadores pueden alcanzar la misma puntuación con un índice kappa aceptable. Sin embargo, también se ha argumentado que la dicotomización en < 7 o ≥ 7 puede no ser útil para establecer el pronóstico individual de cada paciente10. Por otra parte, aun si aceptáramos que sólo es relevante la puntuación final < 7 o ≥ 7, otros autores han encontrado una baja reproducibilidad11. Nuestros resultados coinciden con estas observaciones. Los autores del ASPECTS proponen que los observadores deben estar entrenados y familiarizados con la escala para que su aplicación sea fiable12. En nuestro estudio los neurólogos tenían una amplia experiencia en la evaluación tomográfica de pacientes con stroke isquémico agudo. Esta afirmación se ve confirmada por la correlación entre el resultado del ASPECTS obtenido por consenso visual y la gravedad del stroke, como se muestra en la figura 2.
El UDV de 1,9 UH mostró la mejor combinación de sensibilidad y especificidad, a pesar de un ABC levemente inferior que la de UDV mayores. Tomando este UDV la correlación entre el valor total del ASPECTS evaluado digitalmente y el obtenido por observación directa fue perfecta. Cuando se evaluó el conjunto de 100 regiones la correlación fue del 78%. Estos datos hacen suponer que el ASPECTS evaluado digitalmente puede ser más fiable que la observación directa.
Nuestro estudio tiene varias limitaciones. En primer lugar, la evaluación de nuestros observadores puede no representar a la gran cantidad de neurólogos y no neurólogos involucrados en el tratamiento del stroke isquémico agudo. En cuanto a las mediciones de densidades tomográficas la superposición de lesiones secuelares y agudas en una misma región encefálica podría causar una sobreestimación de la hipodensidad. Por el contrario, la superposición con imágenes hiperdensas, como la transformación hemorrágica o el contraste iodado (por ejemplo strokes post-angioplastia o angiografía diagnóstica) podría ocasionar una subestimación de la hipodensidad real. Otro aspecto técnico a tener en cuenta es que las regiones que rodean el core del infarto pueden mostrar un aumento en el volumen sanguíneo cerebral por reclutamiento de flujo colateral. Este fenómeno podría producir una falsa imagen de isodensidad tisular, por la suma del exceso de agua intracelular (hipodensidad) y aumento del volumen sanguíneo cerebral (hiperdensidad)13.
En conclusión, identificamos un UDV de 1,9 UH para determinar la presencia o ausencia de hipodensidad en la TC de cerebro realizada a pacientes con stroke isquémico agudo en la ventana terapéutica de tres horas. Este UDV, de ser validado en futuras investigaciones e idealmente confrontado con la información complementaria ofrecida por la RMN, podría ser utilizado para crear un sistema digital que contribuya a la observación directa en la clasificación de pacientes con elevado o bajo riesgo de complicaciones postrombólisis intravenosa con rtPA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.