Los antidepresivos tricíclicos (ATC) han sido considerados durante muchos años fármacos de primera línea para el tratamiento del dolor neuropático periférico de origen diabético (DNPD). Sin embargo, sus efectos secundarios e interacciones medicamentosas limitan el uso, especialmente en pacientes con comorbilidades. Los inhibidores de la recaptación de serotonina y noradrenalina (ISRSN) producen alivio del dolor en la neuropatía diabética mediante la inhibición dual de dichos neurotransmisores, de manera similar que los ATC, indicando su utilidad como alternativa de tratamiento para el DNPD.
ObjetivosSe ha realizado una revisión sistemática de publicaciones científicas con la finalidad de resumir datos actuales relacionados con los mecanismos de acción y eficacia de los antidepresivos, en especial los ISRSN, en el manejo del DNPD.
DesarrolloVarios antidepresivos han sido estudiados para el tratamiento del dolor neuropático. Aunque el mecanismo de acción exacto es aún desconocido, se considera que el principal mecanismo mediante el cual los ATC y los ISRSN producen alivio del dolor es la inhibición de la recaptación de serotonina y noradrenalina en el sistema nervioso central. Los nuevos antidepresivos del grupo de los ISRSN han demostrado ser efectivos en el tratamiento del DNPD y se ha observado que producen menos efectos secundarios que los ATC.
ConclusionesLos ISRSN tales como la duloxetina y la venlafaxina demuestran ser efectivos para el manejo del DNPD, con un mecanismo de acción similar al de los ATC, aunque con un mejor perfil de tolerabilidad debido a su acción farmacológica selectiva.
Tricyclic antidepressants (TCAs) have been considered for many years as first-line agents for the symptomatic treatment of diabetic peripheral neuropathic pain (DPNP). However, adverse effects and drug interactions of TCAs limit their use in clinical practice, particularly in patients with comorbidities. Serotonin noradrenaline reuptake inhibitors (SNRIs) produce pain relief of DPNP through dual inhibition of serotonin and noradrenaline reuptake, which is similar to that of the TCAs. It suggests they are likely to be beneficial as an alternative treatment of DPNP.
ObjectiveA systematic review of the scientific literature on the treatment of DPNP was conducted in order to summarize current data about the mechanisms and efficacy of antidepressant drugs, particularly SNRIs, in the management of DPNP.
DevelopmentMany antidepressants have been investigated in the management of neuropathic pain. Although the precise mechanism of action is still unknown, there have been many significant advances in this area. The main mechanism through which the TCAs and the SNRIs are thought to produce pain relief is inhibition of noradrenaline and serotonin reuptake in the central nervous system. Newer SNRIs antidepressants have demonstrated to be effective in the treatment of DPNP and it has been shown that produce fewer adverse effects than the TCAs.
ConclusionsSNRIs such as duloxetine and venlafaxine were shown to be effective for the management of DPNP, with a mechanism of action similar to that of TCAs, although they appeared to have a better tolerability profile due to a selective pharmacological mechanism.
La Asociación Internacional para el Estudio del Dolor (IASP) ha definido el dolor neuropático como “dolor iniciado o causado por una lesión o disfunción primaria del sistema nervioso”1. El dolor neuropático ocurre en aproximadamente el 1% de la población, aunque no se dispone de suficientes datos epidemiológicos para evaluar su verdadera prevalencia, debido a que abarca diversas entidades complejas con múltiples signos y síntomas que varían con el tiempo2–5.
Los síndromes de dolor neuropático más comunes incluyen neuralgia postherpética, el síndrome de dolor central posterior a accidente cerebrovascular, el síndrome de dolor regional complejo y el dolor neuropático periférico de origen diabético (DNPD). Según la definición de consenso de los términos de la IASP, el “dolor neuropático periférico” ocurre cuando la lesión o disfunción afecta al sistema nervioso periférico, mientras que el término “dolor central” puede usarse cuando la lesión o disfunción afecta al sistema nervioso central (SNC)1,5.
Típicamente, el dolor neuropático no responde bien a los analgésicos habituales ni a los enfoques farmacológicos convencionales, lo que lo convierte en un gran desafío para los clínicos2–4. Por consiguiente, existe una necesidad persistente de tratamientos más eficaces, seguros y con buena tolerancia para estos pacientes. Este análisis sistemático presenta evidencia experimental y clínica sobre el uso de fármacos antidepresivos para el alivio del dolor neuropático, concentrándose en los inhibidores de la recaptación de serotonina y noradrenalina (ISRSN).
MétodosEl presente es principalmente un análisis descriptivo. La búsqueda se limitó a artículos escritos en inglés desde 1960 hasta julio de 2009. El método de búsqueda principal se implementó usando las bases de datos de PubMed y MEDLINE. También se consultaron libros de texto estándar de neurología, farmacología y diabetes.
En primer lugar se identificaron los estudios clínicos aleatorizados y controlados con placebo. Se prestó atención al diseño, métodos de informe, resultados y efectos adversos. También se incluyeron otros estudios como, por ejemplo, estudios abiertos, series de casos, revisiones clínicas, estudios retrospectivos y comunicaciones de resúmenes que han abordado la eficacia, seguridad y tolerabilidad de los tratamientos disponibles en la actualidad para el DNPD. También se indagó acerca de los mecanismos de acción de los fármacos antidepresivos a partir del análisis de las publicaciones científicas. Las conclusiones principales se basaron fundamentalmente en los resultados de estudios controlados, pero también se tuvo en cuenta la información clínicamente relevante de estudios no aleatorizados.
Los términos de búsqueda utilizados para este análisis fueron “dolor neuropático”, “neuropatía diabética”, “analgésico”, “antidepresivos”, “monoaminas”, sensibilización central”, “ISRSN”, “duloxetina”, “venlafaxina”, “tratamiento”, “eficacia”, “seguridad”, “tolerabilidad”, “costo efectividad” y “costo utilidad”.
Dolor neuropático periférico de origen diabéticoLa diabetes es un trastorno serio para el individuo y la sociedad, y su prevalencia global en rápido aumento es una causa importante de preocupación. Se ha calculado que la prevalencia actual de la diabetes es del 2,8% para todos los grupos etarios a nivel mundial, y se prevé que la cifra aumente al 4,4% para el año 2030 (más de 360 millones de personas en el mundo)6. Los pacientes con diabetes insulinodependiente (diabetes tipo 1) y diabetes no insulinodependiente (diabetes tipo 2) tienen mayor riesgo de complicaciones clínicas a largo plazo, incluyendo enfermedad de las arterias coronarias, nefropatía, retinopatía y neuropatía6–8.
Una de las complicaciones más comunes de la diabetes es la neuropatía diabética, que se caracteriza por una pérdida progresiva de las fibras nerviosas. Se calcula que del 30 al 60% de los pacientes con diabetes pueden experimentar signos y síntomas de neuropatía periférica diabética, y hasta un 10-20% de ellos pueden experimentar dolor. Aunque algunos pacientes con neuropatía periférica diabética pueden estar asintomáticos, otros manifiestan síntomas de carácter e intensidad variables. Los síntomas de la neuropatía periférica diabética pueden clasificarse como positivos (p. ej., dolor, hormigueo, ardor, parestesias) y/o negativos (p. ej., hipoestesia)2–5.
Muchos estudios han evaluado la prevalencia del DNPD dentro de las poblaciones diabéticas. Un estudio de aproximadamente 1.000 pacientes diabéticos comunicó una prevalencia de dolor en las extremidades inferiores del 11,6% en pacientes con diabetes tipo 1 y del 32,1% en aquellos con diabetes tipo 2. En un estudio reciente, la prevalencia de neuropatía periférica dolorosa entre 350 pacientes con diabetes demostró ser del 16,2%, mientras que otros estudios hallaron DNPD en el 20-50% de los pacientes diabéticos7–9.
Casi todos los pacientes con DNPD experimentan síntomas dolorosos con regularidad y a diario, y la gravedad del dolor con frecuencia aumenta por la noche. El DNPD tiene un impacto negativo considerable en muchos aspectos de las actividades cotidianas, incluyendo el sueño, la movilidad, el trabajo, la función social y la calidad de vida en general2–5. Dado el grado de morbilidad y discapacidad asociado con el DNPD, se han evaluado numerosas estrategias de manejo terapéutico. Los enfoques farmacológicos más comunes para el manejo del DNPD incluyen antidepresivos, especialmente antidepresivos tricíclicos (ATC), e ISRSN, anticonvulsivos, opiáceos y otros analgésicos2–7.
Mecanismos de modulación del dolorSe sabe bien que el dolor es una sensación compleja con dimensiones sensoriales, cognitivas y emocionales. Muchas áreas específicas distribuidas a lo largo del eje cerebroespinal realizan una modulación descendente de la sensación de dolor de acuerdo con la naturaleza del estímulo doloroso y el estado emocional del individuo, tanto en condiciones normales como patológicas. Esta modulación es mediada esencialmente por las vías monoaminérgicas descendentes que inhiben o facilitan la transmisión de información nociceptiva a nivel del asta dorsal2,3,5,10–14.
Las monoaminas activan diferentes receptores y vías10–14. Estos sistemas monoaminérgicos desempeñan un rol importante en los mecanismos del dolor neuropático y son un blanco para el manejo farmacológico de los trastornos dolorosos. Los factores neurotróficos, particularmente el factor neurotrófico derivado del cerebro (BDNF, por sus siglas en inglés), también desempeñan un rol significativo en el intrincado sistema de modulación del dolor13.
La red de modulación del dolor abarca los aferentes nociceptivos de las neuronas del ganglio de la raíz dorsal, las neuronas de asociación del asta dorsal que se proyectan a través de las vías espinotalámica y espinobulbar, las neuronas del circuito local del asta dorsal, y una red supraespinal diseminada que modula la transmisión y el procesamiento de estímulos nociceptivos en el asta dorsal.
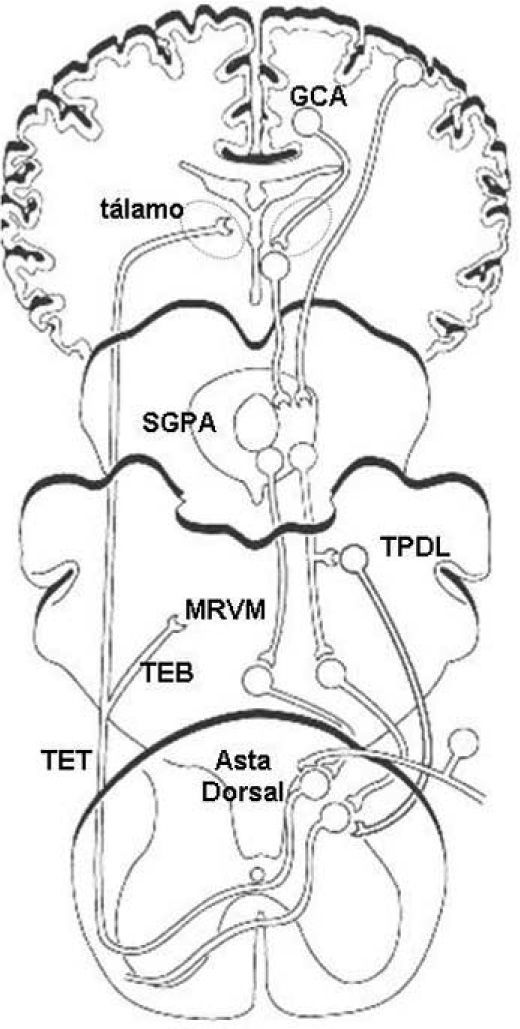
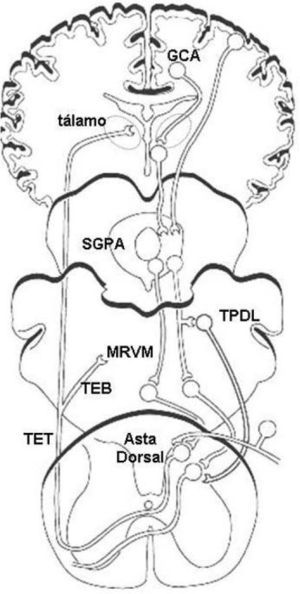
Los aferentes nociceptivos proporcionan estímulos glutamatérgicos excitatorios a varias láminas del asta dorsal de la médula espinal. La lámina I y la lámina V se proyectan a través del tracto espinotalámico al tálamo y a través de las vías espinobulbares a las estructuras subcorticales, la sustancia gris periacueductal (SGPA), la médula rostral ventromedial (MRVM), el hipotálamo y la amígdala.
Muchas áreas del SNC son activadas por estímulos nociceptivos y participan en la modulación central del dolor (fig. 1). Estas áreas producen efectos antinociceptivos o pronociceptivos a través de las vías descendentes que utilizan monoaminas. Estas vías ejercen influencias bidireccionales sobre la sensación de dolor, ya que pueden inhibir o bien facilitar la transmisión de estímulos nociceptivos a nivel del asta dorsal10–13.
– Principales zonas del SNC que participan en la modulación central del dolor. Los estímulos nociceptivos se proyectan desde el asta dorsal de la médula espinal a diversas áreas corticales y subcorticales a través de las vías espinotalámicas (TET) y espinobulbares (TEB). Dichas áreas incluyen la corteza prefrontal, el giro cingulado anterior (GCA), la corteza insular, el tálamo, el hipotálamo, la amígdala, la sustancia gris periacueductal (SGPA), el tegmento pontino dorsolateral (TPDL) y la médula rostral ventromedial (MRVM). Estas estructuras forman parte del circuito modulador central del dolor, el cual a través de vías descendentes monoaminérgicas ejerce su efecto antinociceptivo o pronociceptivo sobre el asta dorsal de la médula espinal. (Adaptado de Benarroch10 y Robinson et al11.)
Clásicamente, la vía serotoninérgica SGPA-MRVM ha sido considerada el sistema primario de modulación endógena del dolor10–14. La MRVM recibe una fuerte proyección desde la SGPA. Los estímulos serotoninérgicos al asta dorsal originan neuronas de la MRVM y estas neuronas se proyectan al asta dorsal. La serotonina (5-hidroxitriptamina, 5-HT), actuando a través de distintos subtipos de receptores, ejerce efectos modulatorios complejos sobre la transmisión nociceptiva en el asta dorsal. La activación de los receptores 5-HT1 produce un efecto antinociceptivo. Los receptores 5-HT1-A postsinápticos inhiben la excitabilidad de las neuronas espinotalámicas y las interneuronas excitatorias, mientras que los receptores 5-HT1-B/D presinápticos inhiben la liberación de neurotransmisores desde los aferentes primarios10–12.
Los terminales axónicos noradrenérgicos inervan los cuerpos celulares de las neuronas de proyección y las interneuronas. Diversos grupos de células en el tegmento pontino dorsolateral (TPDL), incluyendo el locus coeruleus, originan la inervación noradrenérgica del asta dorsal. La noradrenalina inhibe la transmisión nociceptiva en el asta dorsal a través de los receptores alfa-2 presinápticos, particularmente los receptores alfa-2A, en los terminales nociceptivos primarios. Se ha postulado que estos receptores noradrenérgicos también pueden mediar la inhibición postsináptica de las neuronas espinotalámicas10–12.
El rol de los factores neurotróficosEl factor neurotrófico derivado del cerebro (BDNF), un miembro de la familia de factores neurotróficos, desempeña un rol clave en regular la supervivencia, el desarrollo y el mantenimiento de las neuronas en los sistemas nerviosos central y periférico. El BDNF también puede modular la plasticidad sináptica y la liberación de neurotransmisores en diversos sistemas. Estudios recientes llevados a cabo en animales y seres humanos han demostrado que los antidepresivos pueden aumentar tanto los niveles centrales como los plasmáticos de BDNF. Por lo tanto, se ha propuesto que el BDNF podría estar implicado en los mecanismos antinociceptivos del dolor neuropático.
En el sistema sensorial, el BDNF es producido por un subconjunto de neuronas sensoriales primarias localizadas en el ganglio de la raíz dorsal. Una vez sintetizado en los cuerpos celulares de estas neuronas sensoriales, el BDNF es almacenado en grandes vesículas y transportado a los terminales de dichas neuronas en el asta dorsal. Tras su liberación, el BDNF estimula al receptor tirosina cinasa B (TrkB), que se disemina por toda la médula espinal. Por ende, el BDNF puede deprimir indirectamente la transmisión de neuronas sensoriales en el asta dorsal. Algunos otros factores neurotróficos potenciales que posiblemente puedan actuar como intermediarios en la fisiopatología del dolor neuropático son el factor de crecimiento nervioso (NGF), la neurocinina-1 (NK-1) y la neurotrofina-3 (NT-3)10,11,13.
Sensibilización central como un mecanismo del dolorLa presencia de diversos circuitos inhibitorios y facilitadores del dolor en el SNC se encuentra bien documentada. Tanto la serotonina como la noradrenalina se han visto implicadas en la modulación de los mecanismos analgésicos endógenos a través de las vías inhibitorias descendentes del dolor en el cerebro y la médula espinal. Razonablemente, un desequilibrio en estos mecanismos inhibitorios puede contribuir a la “sensibilización central” y la “hiperexcitabilidad” de las vías de transmisión del dolor espinal y supraespinal, dando lugar a dolor persistente10,14.
Se ha sugerido que el dolor neuropático de origen diabético podría ser el resultado de cambios metabólicos crónicos en las neuronas que dan lugar a una señalización anormal desde el nociceptor periférico que es percibida en el cerebro como dolor. La teoría de la plasticidad neuronal en los sistemas nerviosos postula que la estimulación nociva repetida podría dar lugar a habituación (disminución de la respuesta) o sensibilización (aumento de la respuesta). La activación prolongada o potente de las neuronas del asta dorsal causada por estimulación nociva sostenida podría posteriormente dar lugar a un mayor grado de reacción neuronal (hiperexcitabilidad), sensibilización central, o ambas10,11,14.
En la actividad neuronal fisiológica, las vías inhibitorias descendentes del dolor en el tronco cerebral limitan la intensidad de la señalización nociceptiva entrante desde la periferia. En el DNPD, la actividad de estas vías inhibitorias descendentes del dolor puede verse disminuida, magnificando de este modo la percepción de dolor. Aunque los mecanismos fisiopatológicos exactos del DNPD no se entienden con claridad, se reconoce que la desinhibición y el desequilibrio de la serotonina y la noradrenalina en las vías inhibitorias descendentes del dolor podrían contribuir a sensaciones de dolor persistente14.
Efecto analgésico de los antidepresivosEl dolor neuropático con frecuencia responde mal a los tratamientos habituales para el dolor. Se han investigado numerosos antidepresivos en el manejo del dolor neuropático, y los estudios en animales y clínicos han demostrado efectos beneficiosos. Se han producido muchos avances significativos en esta área, aunque aún se desconocen los mecanismos precisos subyacentes al efecto antinociceptivo de los antidepresivos en el dolor neuropático. El tratamiento del dolor neuropático incluye fármacos antidepresivos que bloquean la recaptación de monoaminas, ligandos de la subunidad alfa-2/delta de los canales de calcio dependientes del voltaje, y opioides2–5,15–20.
Clásicamente, el efecto analgésico de los antidepresivos se ha atribuido mayormente a la inhibición de la recaptación de noradrenalina más que de serotonina, dado que la eficacia de los inhibidores selectivos de la recaptación de serotonina (ISRS) es sustancialmente inferior a la de los ISRSN2,3,15–19. No obstante, estudios llevados a cabo en modelos de ratones knockout indican que la participación de la serotonina en el mecanismo de acción de los fármacos antidepresivos varía con el tipo de dolor10,17,18.
El efecto analgésico de los ISRSN durante una prueba térmica de dolor agudo se redujo mucho o estuvo ausente en estos ratones knockout sin neuronas serotoninérgicas en el tronco cerebral, lo que sugiere que el bloqueo de la recaptación de serotonina es el mecanismo primario de los efectos analgésicos agudos de los antidepresivos17. En otro estudio, el efecto analgésico de duloxetina en modelos de dolor persistente en roedores no se vio afectado por la pérdida de neuronas serotoninérgicas, lo que indica un rol esencial de la noradrenalina en la analgesia inducida por antidepresivos en condiciones dolorosas crónicas18.
Tratamiento del DNPD con fármacos antidepresivosDurante más de 3 décadas, los ATC se han utilizado como agentes de primera línea para el tratamiento del dolor neuropático, incluyendo el DNPD2,3,5,15,19–28. El mecanismo principal a través del cual se piensa que los ATC producen alivio del dolor es la inhibición de la recaptación de noradrenalina y serotonina en el SNC, que activa las vías analgésicas descendentes. No obstante, muchos factores limitan el uso de los ATC en la práctica clínica, incluyendo interacciones medicamentosas frecuentes y efectos adversos tales como sedación, aturdimiento, visión borrosa y boca seca. Estos efectos secundarios probablemente se deban a la afinidad de los ATC por los receptores colinérgicos y adrenérgicos y posiblemente debido a las acciones bloqueadoras de los canales de sodio2–5,10,11,19–23
Se requiere precaución con la administración concurrente de ATC con otros fármacos psicoactivos tales como la fenitoína, ya que esta interacción aumenta las concentraciones plasmáticas de fenitoína y puede causar toxicidad. La administración de ATC a pacientes con trastornos cardíacos debe considerarse cuidadosamente porque la mayoría de los ATC pueden elevar el riesgo de alteraciones del ritmo, insuficiencia cardíaca congestiva y cardiopatía isquémica. Se justifica especial precaución al recetar ATC a pacientes de edad avanzada, ya que las caídas debidas a hipotensión ortostática en los pacientes mayores a menudo puede dar lugar a fracturas de cadera y otras lesiones traumáticas. Hay muchos otros trastornos en los cuales los ATC deben evitarse o usarse con precaución, como por ejemplo la retención urinaria y el glaucoma. Además, se recomienda no recetar ATC de rutina a pacientes con alto riesgo de suicidio o muerte accidental por sobredosis2,3,15,22.
Otra clase de fármacos antidepresivos, los ISRSN, producen alivio del dolor en el DNPD a través de la inhibición selectiva de la recaptación de serotonina y noradrenalina. Este mecanismo es similar al de los ATC pero causa menos efectos adversos debido a un mecanismo farmacológico selectivo2–5,10,19–30.
ISRSN en el manejo del DNPDLos ISRSN tales como la venlafaxina y la duloxetina se utilizan comúnmente en el manejo del DNPD. Estos agentes duales producen el alivio del dolor neuropático a través de la inhibición de la recaptación de serotonina y noradrenalina como los ATC; no obstante, su débil o insignificante afinidad por otros receptores (p. ej., acetilcolina, histamina) dan lugar a un mejor perfil de tolerabilidad2,3,5,15,19–21.
VenlafaxinaLa eficacia y la seguridad de la venlafaxina para el manejo del dolor neuropático fue evaluada en muchos estudios2,3,5,15,20,21,29,30. La venlafaxina es un ISRSN que inhibe la recaptación de serotonina a dosis más bajas y la recaptación de serotonina y noradrenalina a dosis más altas15. Se presenta en dos formulaciones: de liberación inmediata y de liberación prolongada (LP)2,3,5,31.
Un estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo llevado a cabo por Rowbotham et al31 incluyó a 244 pacientes ambulatorios adultos con diabetes tipo 1 o tipo 2 y DNPD. Dicho estudio se llevó a cabo para evaluar la eficacia y seguridad de 6 semanas de tratamiento con venlafaxina LP (75mg y 150–225mg). Las variables de eficacia primarias fueron las puntuaciones diarias en la escala visual analógica de 100mm para intensidad del dolor (VAS-PI) y la escala visual analógica de alivio del dolor (VAS-PR). Las variables de eficacia secundarias incluyeron otras escalas clínicas y de dolor y el porcentaje de pacientes que lograron una reducción ≥ 50% en la intensidad del dolor. La reducción porcentual respecto del valor basal en la escala VAS-PI fue de 32% (75mg) y 50% (150–225mg), pero solamente la dosis más alta de venlafaxina LP (150–225mg) fue significativamente mejor que el placebo (27%) en la semana 6 (p < 0,001). Las puntuaciones de la escala VAS-PR en el grupo tratado con la dosis más alta también fueron significativamente superiores a las del placebo al final del estudio (p < 0,001). Los eventos adversos más comunes fueron náuseas y somnolencia, y en 7 pacientes bajo tratamiento con venlafaxina se observaron cambios electrocardiográficos (ECG) clínicamente importantes durante el tratamiento. Los cambios electrocardiográficos son un efecto adverso potencialmente serio que podría limitar el uso de este antidepresivo en pacientes diabéticos con factores de riesgo cardiovascular.
En este estudio aleatorizado, controlado, los autores llegaron a la conclusión de que la venlafaxina LP en dosis de ≥ 150mg/día es efectiva y segura para el alivio del dolor en pacientes con DNPD.
Cuando se comparó la venlafaxina con un ATC (imipramina), la eficacia de la venlafaxina para producir el alivio del dolor fue superior a la de imipramina3,5,15,32.
Sindrup et al32 llevaron a cabo un estudio aleatorizado, controlado, para evaluar la eficacia de la venlafaxina en el alivio de la polineuropatía dolorosa y la compararon con la imipramina. El estudio tuvo un diseño aleatorizado, doble ciego, controlado con placebo, y cruzado con tres secuencias de tratamiento. Cuarenta pacientes fueron asignados a una de las secuencias de tratamiento en la visita basal, y 29 pacientes completaron los tres periodos del estudio (12 semanas). Las dosis diarias fueron 225mg de venlafaxina y 150mg de imipramina. Durante los periodos de tratamiento, los pacientes evaluaron los paroxismos de dolor, el dolor persistente y el dolor evocado por tacto o presión. La suma de las puntuaciones de dolor, en comparación con las puntuaciones basales, fue más baja en los pacientes bajo tratamiento con venlafaxina (80%) e imipramina (77%) que para los que recibieron placebo (100%), pero no mostró una diferencia estadística entre la venlafaxina y la imipramina (p = 0,44) al final del estudio. El número necesario para tratar (NNT) para obtener un paciente con alivio moderado o mejor del dolor fue de 5,2 para la venlafaxina y de 2,7 para la imipramina. La tasa de respondedores para la venlafaxina fue baja (26%) comparada con la de la imipramina (48%). No obstante, se ha sugerido que la baja eficacia de la venlafaxina en este estudio podría ser atribuible a la falta de homogeneidad en la naturaleza de la polineuropatía experimentada por los pacientes3. Los efectos adversos más comunes de la venlafaxina reportados en el estudio de Sindrup et al32 incluyeron náuseas, dispepsia, sudoración, somnolencia e insomnio3.
DuloxetinaLa duloxetina es un ISRSN potente que fue el primer agente antidepresivo en recibir la aprobación regulatoria para el tratamiento de la neuropatía diabética dolorosa tanto de la Food and Drug Administration (FDA) estadounidense como del Comité de Productos Medicinales para Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMEA)3,5,15,22,23,30.
La duloxetina es un inhibidor selectivo de la recaptación de 5-HT y noradrenalina con actividad relativamente equilibrada y sin efectos significativos en otros sitios. La duloxetina exhibe una afinidad débil por el transportador de dopamina y una afinidad insignificante por los receptores muscarínicos, histamínicos, opioides, glutamatérgicos y gabaérgicos, al igual que por los sitios de los canales de sodio, potasio y calcio20,21.
La eficacia clínica de la duloxetina para el DNPD se ha demostrado en tres estudios aleatorizados, doble ciego, controlados con placebo24–26. Estos estudios con dosis fijas de 12 semanas enrolaron a un total de 1.139 pacientes con diabetes tipo 1 o tipo 2 que habían estado padeciendo neuropatía diabética dolorosa durante más de 6 meses27. Los tres estudios asignaron aleatoriamente a los participantes a las ramas de duloxetina 60mg una vez al día (QD), duloxetina 60mg dos veces al día (BID) o placebo; uno de los estudios también incluyó una rama de tratamiento de 20mg QD como parte de la evaluación de la respuesta a la dosis24. La variable de eficacia primaria de cada estudio fue la media de la puntuación de gravedad de dolor promedio en 24h usando la escala de dolor de 11 puntos tipo Likert desde la visita basal hasta el final del periodo de dosificación. Las variables secundarias incluyeron otros resultados del diario de dolor, las impresiones globales clínicas y del paciente, mediciones de calidad de vida (QOL) y otras escalas24–26.
Los tres estudios demostraron índices de respuesta significativamente mayores en los puntos finales entre los pacientes que recibieron duloxetina (60mg QD o 60mg BID) que entre los que recibieron placebo, independientemente de los criterios de respuesta elegidos (una reducción de al menos el 30 o el 50%, o 2 puntos en la intensidad del dolor promedio en 24h en el punto final)28. Los índices de respuesta sostenida al tratamiento por visita en los pacientes tratados con duloxetina fueron de aproximadamente el 50 al 70% en la última visita de la fase aguda. Se observó un efecto significativo del tratamiento con duloxetina en la mayoría de las variables secundarias del dolor. Se observó una respuesta temprana al tratamiento en los grupos tratados con duloxetina, y la proporción de pacientes que lograron el alivio del dolor en los grupos tratados con duloxetina fue significativamente mayor que en el grupo tratado con placebo en la semana 1 y en todas las visitas subsiguientes del estudio hasta el final de los estudios. Usando los datos de los diarios de paciente de los tres estudios, la evaluación de la intensidad del dolor promedio en 24h demostró una separación significativa entre duloxetina 60mg QD y el placebo en los índices de respuesta temprana en los primeros días del periodo de tratamiento24–28.
Los eventos adversos emergentes del tratamiento comunicados con mayor frecuencia (> 5%) en los pacientes tratados con duloxetina (duloxetina 60mg QD y duloxetina 60mg BID) usando los datos combinados de los tres estudios incluyeron náuseas, somnolencia, mareos, diarrea, fatiga, estreñimiento, hiperhidrosis, boca seca, vómitos, disminución del apetito, astenia y anorexia24–26. No se registraron diferencias estadísticamente significativas en la incidencia de eventos adversos entre la duloxetina 20mg QD y el placebo24.
Tanto la dosis de duloxetina 60mg QD como la de 60mg BID fueron consistentemente eficaces en comparación con el placebo en los tres estudios. No es claro a partir de los datos si la dosis de 60mg de duloxetina BID brinda un beneficio adicional respecto de la dosis de 60mg QD. No obstante, es posible que algunos no respondedores a la dosis de 60mg QD puedan beneficiarse a partir de una dosis más alta24–28.
Ziegler et al33 llevaron a cabo un estudio interesante en el cual se evaluó el impacto de las variables basales de la enfermedad relacionadas con la diabetes y la gravedad de la neuropatía diabética respecto de la eficacia y seguridad de duloxetina. La influencia de los trastornos basales se evaluó usando datos combinados de estudios controlados con placebo de duloxetina (dosis de 60mg QD y 60mg BID) frente al placebo. No hubo interacciones significativas del tratamiento por edad, tipo de diabetes (tipo 1 o tipo 2), duración de la diabetes, duración de la neuropatía diabética, gravedad inicial de la neuropatía diabética, nivel basal de hemoglobina A1c glucosilada, o uso basal de insulina. Se observaron interacciones significativas para las variables de dolor únicamente en los subgrupos iniciales de gravedad del dolor, y la duloxetina fue más efectiva en el subgrupo con dolor basal más intenso. No se observaron asociaciones significativas entre los otros subgrupos. Por lo tanto, la gravedad del dolor, pero no las variables relacionadas con la diabetes o la neuropatía, puede pronosticar los efectos de la duloxetina en el DNPD33.
Comparación de los antidepresivos ISRSN frente a los anticonvulsivos en el tratamiento del DNPDLos antidepresivos y los anticonvulsivos constituyen los enfoques farmacológicos más comunes para el manejo del DNPD. Los fármacos actualmente aprobados para esta enfermedad incluyen la duloxetina y los análogos del ácido gamma-aminobutírico (GABA): gabapentina y pregabalina.
Los antidepresivos como grupo tienen un NNT (número necesario de pacientes para tratar) (IC del 95%) para neuropatía dolorosa de 3,3 (2,7-4,1), con un NNH (número necesario de pacientes a perjudicar) de 16 (10,2-25). Sin embargo, el NNT basado en una reducción de al menos el 50% con respecto al valor basal en la puntuación de intensidad de dolor promedio para los pacientes tratados con amitriptilina fue de 5. Los NNT (IC del 95%) de la duloxetina 60mg QD y 60mg BID basados en una reducción del dolor del 50% fueron 5,2 (3,8-8,3) y 4,9 (3,6-7,6), respectivamente, y el NNH basado en la discontinuación debido a eventos adversos fue de 17,5 (12,2-58,8) en el grupo tratado con duloxetina 60mg QD y de 8,8 (6,3-14,7) en el grupo tratado con duloxetina 60mg BID a lo largo del período de tratamiento de 12 semanas en ambos grupos comparados con el placebo. Con respecto a la venlafaxina, se reportó un NNT de 6,9 (3,7-58,6) para las dosis que oscilan de 75 a 225mg/día y de 4,6 (2,9-10,6) para las dosis de 150 a 225mg/día27,34.
Los anticonvulsivos como la gabapentina, la pregabalina y la lamotrigina poseen un NNT comparable al de los ISRSN36,37.
Un metaanálisis indirecto fue realizado por Quilici et al34 para comparar la eficacia y la tolerabilidad de la duloxetina con las de la pregabalina y la gabapentina en el DNPD, usando placebo como comparador común.
En los análisis de eficacia de la duloxetina, la pregabalina y la gabapentina, todos los agentes fueron superiores al placebo con respecto a todos los parámetros de eficacia. Los índices de discontinuación fueron comparables en todos los grupos combinados y los eventos de tolerabilidad coincidieron con los datos previos de las clases farmacológicas correspondientes. Basándose en la combinación de los desenlaces comunes medidos en estudios aleatorizados, controlados en esta comparación indirecta, la duloxetina exhibe una tolerabilidad comparable a la de la gabapentina y la pregabalina para el alivio de la neuropatía diabética dolorosa32. Asimismo, en una comparación reciente de coste-utilidad de cuatro medicamentos de primera línea para el tratamiento del DNPD (desipramina, duloxetina, gabapentina y pregabalina) se valoraron los cambios relativos en la calidad de vida (QOL), los costes y la efectividad en relación al coste de cuatro medicamentos: desipramina 100mg/día, duloxetina 60mg/día, gabapentina 2.400mg/día y pregabalina 300mg/día en pacientes ambulatorios con dolor moderado a grave asociado con DNPD y sin contraindicaciones al tratamiento con antidepresivos tricíclicos.
De acuerdo con los resultados, la desipramina 100mg/día y la duloxetina 60mg/día parecieron ser más eficaces y efectivas en relación al coste que la gabapentina o la pregabalina para el tratamiento del DNPD35. No obstante, el uso de ATC tales como la desipramina en la práctica clínica está disminuyendo debido a sus efectos adversos significativos y frecuentes.
Este estudio posee algunas limitaciones que deben tenerse en cuenta. Es posible que se omitan algunos estudios relevantes cuando se usa la búsqueda y recuperación electrónica de datos, aunque intenté describir los estudios más recientes y más representativos disponibles. Estoy relativamente seguro de haber encontrado los estudios más relevantes con los métodos usados en este análisis. Además, la selección de los estudios puede haber afectado este análisis. No obstante, los estudios fueron seleccionados sobre la base de información específica sobre dolor neuropático y su relevancia para este análisis.
ConclusionesMúltiples mecanismos patogénicos se encuentran vinculados con el DNPD. Algunos de ellos implican cambios en las neuronas periféricas, mientras que otros mecanismos involucran al SNC tales como la sensibilización central.
La serotonina (5-HT) y la noradrenalina (NA) participan en la modulación de los mecanismos endógenos inhibitorios del dolor; un desequilibrio de estas monoaminas contribuye a la sensibilización central y a la hiperexcitabilidad del SNC, causando dolor persistente. Por lo tanto, la mejoría de los niveles de 5-HT y NA podría modificar el equilibrio a favor de una mayor inhibición de las señales dolorosas.
Los antidepresivos se encuentran entre los fármacos más útiles para el alivio del dolor neuropático y los ATC han sido considerados durante muchos años opciones de primera línea para el tratamiento sintomático del dolor neuropático.
El mecanismo principal de la acción analgésica de los ATC es la inhibición de la recaptación de 5-HT y NA. Dado que los ATC no son selectivos sino que en lugar de ello poseen actividad antihistamínica y anticolinérgica, tienen muchos efectos secundarios y diversas interacciones medicamentosas que reducen la tolerabilidad.
Los nuevos antidepresivos ISRSN tales como la duloxetina y la venlafaxina han demostrado clara eficacia en lo que respecta a la reducción del dolor en el DNPD, al menos equivalente a la de los compuestos tricíclicos, pero sin las preocupaciones relacionadas con la seguridad y la tolerabilidad.
La duloxetina y la venlafaxina poseen un mecanismo de acción comparable al de los ATC pero causan menos efectos adversos, particularmente en pacientes con comorbilidades, como resultado de una acción farmacológica más selectiva. Entre los tratamientos farmacológicos disponibles para el alivio sintomático de los síntomas de dolor neuropático, la duloxetina es el primer antidepresivo aprobado para el tratamiento de pacientes con DNPD.
Por lo tanto, los datos disponibles en la actualidad sobre eficacia y tolerancia demuestran que los antidepresivos ISRSN más nuevos constituyen una opción de tratamiento importante y valiosa para el manejo del DNPD.
Conflicto de interesesEl Dr. Luis A. Pliego es empleado de Eli Lilly Interamerica.
El autor da las gracias a Jorge J. Mosquera M.D. (www.FaseIII.com.ar) por su colaboración en la redacción inicial de este manuscrito.