La coexistencia de linfoma sistémico y VIH asociados a otras entidades que también pueden comprometer al sistema nervioso hace que el reconocimiento de la neoplasia en estos pacientes sea complejo. Por ello, resulta útil identificar las manifestaciones neurológicas frecuentes que permiten sospechar la presencia de linfoma sistémico en pacientes seropositivos y seleccionar opciones diagnósticas y terapéuticas adecuadas.
Objetivos Describir los signos neurológicos presentes en pacientes con linfoma sistémico y VIH, evaluar sus recuentos de CD4+ y calcular el tiempo entre la aparición del signo neurológico y el diagnóstico definitivo de linfoma sistémico.
Pacientes y métodoSe recolectaron datos de pacientes con VIH, linfoma sistémico y compromiso neurológico desde enero de 2005 a junio de 2018. Variables de estudio: signos neurológicos, recuentos de CD4+ y demora diagnóstica.
ResultadosDiecinueve pacientes. Edad media (±DE) 38,4 (7,9) años. 73,6% masculinos. Los signos neurológicos frecuentemente identificados fueron: neuropatía del VIIpar en 10/19 pacientes, déficits motores en 9/19 y signo de Roger en 6/19 individuos. El recuento de CD4+ al momento de la consulta neurológica fue de 233/mm3 (P25-75 99-521). El tiempo medio de demora entre la consulta con síntomas neurológicos y el diagnóstico de linfoma fue de 35,3 (34,5) días.
ConclusiónLa neuropatía del VIIpar, los déficits focales motores o el signo de Roger constituyen importantes manifestaciones clínicas cuya presencia en pacientes seropositivos debería incrementar el índice de sospecha de linfoma sistémico, aun cuando el individuo presente recuentos de CD4+ >200/mm3.
The coexistence of systemic lymphoma in HIV patients associated with other entities that can also compromise the nervous system turns this entity into a diagnosis and therapeutic challenge. Therefore, it is useful to identify the frequent neurological manifestations that could increase the index of suspicion of lymphoma to achieve an opportune diagnosis and to select the most appropriate therapeutic options.
ObjectivesTo describe the neurological signs related to systemic lymphoma in HIV patients, to evaluate CD4+ lymphocytes levels and to estimate the time between the appearance of neurological signs and the definitive diagnosis of systemic lymphoma.
Patients and methodData collected from patients from January 1st, 2005 to June 31st, 2018. The following variables were studied: neurological signs, CD4+ lymphocyte count and diagnostic delay.
Results19 patients with a mean age (standard deviation [SD]) of 38.4 (7.9) years. 73.6% were men. Neurological signs most frequently identified were neuropathy of seventh cranial nerve in 10/19 patients, motor deficits in 9/19 and Roger's sign in 6/19 individuals. The CD4+ count at the time of the neurological consultation was 233/mm3 (P25-75 99-541). The mean delay between the first consultation with neurological symptoms and the diagnosis was 35.3 (34.5) days.
ConclusionThe seventh cranial nerve neuropathy, focal motor deficits and Roger's sign are important clinical manifestations whose presence in seropositive patients should increase the index of suspicion of lymphoma, even when the individual does not have CD4+ counts below 200/mm3.
La infección por el virus de la inmunodeficiencia humana (VIH) es una patología crónica y tratable1 que ha afectado a casi todos los países y grupos de población a nivel mundial. Se estima que existen 36,9 millones de personas que viven con VIH en el mundo, de las cuales 34,5 millones son adultos. Desde el pico alcanzado en 2005, los casos de muertes relacionadas con el sida se han reducido en un 48%2. Si bien la introducción de la terapia antirretroviral de gran actividad (TARGA) condujo a un cambio radical en la historia natural de la infección por el VIH, la mortalidad por complicaciones a nivel sistema nervioso, neoplasias e infecciones asociadas sigue siendo elevada en personas infectadas no tratadas o en pacientes que desconocen su condición3. La inflamación, la activación inmune crónica, la inmunodeficiencia y la coinfección por agentes biológicos oncogénicos juegan un rol clave en el progreso de la infección y contribuyen al desarrollo de comorbilidades que incrementan la mortalidad4.
La afectación neurológica es un hecho frecuente entre los pacientes con VIH, dado que es un virus neurotropo que puede comprometer al sistema nervioso en cualquier etapa de la infección. Secundariamente, el sistema nervioso puede afectarse por la terapia antirretroviral (TARV), infecciones oportunistas vinculadas al grado de inmunodepresión y neoplasias.
El conjunto de las neoplasias que presentan los pacientes VIH se divide en dos grupos: las asociadas al virus y las no asociadas. Las primeras incluyen el sarcoma de Kaposi, los linfomas no Hodgkin (LNH) y el carcinoma de cérvix. Entre las segundas destacan el linfoma de Hodgkin (LH), el carcinoma del canal anal y el hepatocarcinoma5. Las causas responsables del incremento de estas últimas son múltiples: mayor expectativa de vida, mejor control del VIH, consumo de sustancias tóxicas, coinfección con otros virus, interacciones de antirretrovirales y reconstitución inmune incompleta6,7; por el contrario, la inmunosupresión severa relacionada con el recuento de CD4+ se vincula al desarrollo de neoplasias asociadas a VIH8.
Es un hecho conocido que la infección por VIH aumenta entre 100 a 200 veces el riesgo de desarrollar una neoplasia linfoide9 y que la morbimortalidad debida a esta complicación es significativa10.
Los LNH son la segunda neoplasia en frecuencia en pacientes con VIH, luego del sarcoma de Kaposi. La prevalencia de LNH en esta población es del 3 al 5%, y el 50% de los pacientes tienen diagnóstico de VIH previo al linfoma5. El riesgo de compromiso del sistema nervioso central (SNC) (recurrencia) se ubica entre el 5 y el 25% para el linfoma de Burkitt (LB), el linfoma linfoblástico agudo y el linfoma difuso agresivo de célulasB grandes (LDCGB). Desde el punto de vista clínico-semiológico el compromiso de las leptomeninges es la complicación más común de este tipo de neoplasias en el SNC. Los síntomas y signos con los que se presentan estos pacientes incluyen alteración del estado de conciencia, cefalea, dificultad para marchar, dolor radicular, debilidad muscular focal y convulsiones. Son frecuentes las neuropatías craneales únicas o múltiples. En este contexto, el síndrome de mentón dormido, o signo de Roger, puede constituir el primer síntoma de malignidad subyacente o el primer signo de recurrencia en estos pacientes11,12. La mayoría de las manifestaciones se producen por compresión o infiltración directa de los nervios periféricos, plexos y raíces nerviosas13.
El LH, a diferencia del anterior, rara vez afecta al SNC, y el compromiso ocurre en el 0,2% al 0,5% de los casos14. En el estudio «US HIV/AIDS Cancer Match» se observó que los pacientes con VIH tenían casi 8veces más riesgo de LH en comparación con la población general15. Esta neoplasia se asocia con complicaciones neurológicas que ocurren como consecuencia directa de la enfermedad, tales como metástasis, compresión de la médula espinal, meningitis y carcinomatosis meníngea; e indirectamente, debido al tratamiento con quimioterapia o radioterapia o por trastornos paraneoplásicos16.
La concomitancia de linfoma sistémico y VIH asociados a otras entidades que también pueden comprometer al sistema nervioso hace que los patrones de observación en las características de la enfermedad, el diagnóstico, la información sobre el pronóstico y la toma de decisiones terapéuticas sean difíciles. En este contexto, y con el objeto de disminuir la demora en el diagnóstico de linfoma, resulta útil identificar precozmente las manifestaciones neurológicas que aparecen en pacientes con VIH para sospechar la presencia de la neoplasia, seleccionar las opciones terapéuticas más adecuadas y establecer un pronóstico certero. Si bien el reconocimiento de los signos neurológicos en pacientes con VIH presupone desafíos adicionales para los médicos y los investigadores en el área, es valioso identificarlos precozmente y darlos a conocer para favorecer la atención integral de los pacientes con VIH/sida.
ObjetivosObjetivo general- -
Describir los signos neurológicos que aparecen en pacientes con linfoma sistémico y VIH.
- -
Evaluar recuentos de CD4 que tienen los pacientes con VIH al momento del diagnóstico de linfoma sistémico y compromiso del sistema nervioso.
- -
Calcular el tiempo entre la aparición del signo neurológico y el diagnóstico definitivo de linfoma sistémico (demora diagnóstica).
- -
Describir la cantidad de pacientes con VIH que presentaron TARV al momento del diagnóstico de linfoma sistémico y compromiso neurológico.
Se realizó un estudio retrospectivo, observacional, descriptivo, con recolección de datos de pacientes atendidos en los Servicios de Neurología del Hospital Rawson de Córdoba y en la Clínica Universitaria Reina Fabiola, durante el período comprendido entre el 1 de enero de 2005 al 31 de junio de 2018.
Población en estudioPacientes con VIH/sida y linfoma sistémico, con compromiso neurológico al momento de diagnóstico de linfoma sistémico, que fueron atendidos en la Clínica Universitaria Reina Fabiola y en el Hospital Rawson, en la ciudad de Córdoba, en el período comprendido entre el 1 de enero de 2005 al 31 de junio de 2018.
Criterios de inclusiónAmbos sexos, mayores de 18 años, diagnóstico de VIH-sida, diagnóstico de linfoma sistémico, compromiso neurológico al momento del diagnóstico de linfoma sistémico, historia clínica completa.
Criterios de exclusiónPacientes menores de 18 años, pacientes con diagnóstico de linfoma primario del SNC e individuos con antecedentes de neurotoxoplasmosis, tuberculosis con compromiso en el sistema nervioso, criptococosis cerebral, neurosífilis y CMV con afección en el sistema nervioso13-17.
Variables del estudioSignos neurológicos en la primera consulta: manifestaciones de compromiso neurológico que aparecen en el paciente, y que son objetivables en el examen físico de la primera consulta. Consisten en:
- -
Convulsiones: alteración súbita en la actividad eléctrica cortical, que se manifiesta clínicamente por alteración de la conciencia o por aparición de sintomatología motora, sensitiva, sensorial o conductual18.
- -
Alteración de la conciencia: afectación del estado de conocimiento de uno mismo y de lo que lo rodea19. Sopor, estupor y coma.
- -
Alteraciones del lenguaje: pérdida de habilidades lingüísticas adquiridas y previamente indemnes provocada por una lesión localizada en SNC20.
- -
Déficit focal motor con o sin signos piramidales: cambios en el movimiento, que incluyen pérdida de fuerza muscular con o sin aumento del tono muscular, alteración de reflejos miotáticos y reflejo plantar extensor21.
- -
Signos cerebelosos: hipotonía muscular, ataxia cerebelosa, dismetría, asinergia y adiadococinesia, temblor de actitud y cinético, desviaciones.
- -
Neuropatía del III, IV y VI par: compromiso de dichos pares craneales.
- -
Neuropatía completa del V par: compromiso del nervio trigémino.
- -
Signo de Roger (numb chin syndrome): zona de anestesia/hipoestesia cutánea referida al territorio inervado por el nervio mentoniano, rama terminal del nervio dentario inferior, procedente a su vez de la tercera rama del trigémino22.
- -
Neuropatía de VII: afectación del nervio facial (parálisis o paresia facial).
- -
Signos vestibulares: nistagmo, pruebas de Barany+, Romberg laberíntico y marcha zigzagueante.
- -
Neuropatías de pares bajos, compromiso de pares craneales IX, X, XI y XII.
Edad, sexo (características biológicas y fisiológicas que definen a hombres y mujeres)23.
Variables de laboratorio- -
Nivel de CD4+ al momento de la consulta con signos neurológicos (por citometría de flujo), resultados del análisis anatomopatológico del líquido cefalorraquídeo (LCR) extraído por punción lumbar (malignidad o no malignidad).
- -
TARV.
- -
Demora diagnóstica: tiempo (en días) trascurrido entre la aparición del signo neurológico y la realización del diagnóstico definitivo de linfoma.
Los datos categóricos se analizaron descriptivamente a partir de sus frecuencias y porcentajes. Los resultados de las variables mensurables se expresan como media ±desvío estándar y medianas con percentiles 25 y 75. Para el análisis de los datos se utilizó el paquete de software InfoStat®.
Aspectos éticosEl presente estudio se llevó a cabo respetando la normativa vigente en materia de investigación, incluyendo, pero no limitado a declaración de Helsinki 2013, las guías de buenas prácticas clínicas de ANMAT, la ley provincial 9694 de la provincia de Córdoba, las resoluciones de COEIS y la ley 25326 de protección de datos personales. Respecto a la confidencialidad, el registro de participantes fue archivado y solo pudo acceder al mismo el personal involucrado en el estudio. Se utilizó un código para cada paciente, únicamente conocido por las investigadoras. El trabajo de investigación fue aprobado por las secretarías de investigación y docencia de la Clínica Universitaria Reina Fabiola y del Hospital Rawson.
ResultadosEl estudio se basó en una muestra de 19 pacientes (n=19) con diagnóstico de VIH y linfoma sistémico. La edad media (DE) de los mismos fue de 38,4 (7,9) años. El 73,68% de los pacientes fueron hombres; 14pacientes tenían TARV al momento de la consulta y de los que no presentaban esta terapia, a uno se le diagnosticó LH y a 4 LNH. Los subtipos histológicos más frecuentes fueron el linfoma difuso de célulasB grandes en 8 (42, 1%) pacientes y linfoma de Burkitt en 4 (21,05%) pacientes.
Los signos neurológicos identificados con mayor frecuencia fueron: en 10 (53%) pacientes la neuropatía del VIIpar craneal, en 9 (47%) pacientes los déficits motores con o sin signos piramidales y en 6 (32%) individuos el signo de Roger. Con menor frecuencia, en 3 (16%) casos se presentaron las neuropatías del III, IV y VIpar, del Vpar completo, el compromiso de pares bajos y las convulsiones. Solo 2 (11%) pacientes consultaron por alteraciones del lenguaje. Un único paciente (5%) consultó por signos vestibulares y uno (5%) ingresó por alteración de la conciencia. Ningún paciente manifestó signos cerebelosos. Estos datos se muestran en la tabla 1.
Signos neurológicos en pacientes con HIV/sida y linfoma sistémico al primer examen clínico
| Signos neurológicos | n | % |
|---|---|---|
| Déficit focal motor o signos piramidales | 9 | 47 |
| Convulsiones | 3 | 16 |
| Neuropatía del III - IV - VI par craneal | 3 | 16 |
| Alteraciones del lenguaje | 2 | 11 |
| Alteración de la conciencia | 1 | 5 |
| Signos cerebelosos | 0 | 0 |
| Neuropatía del VII par | 10 | 53 |
| Signo de Roger | 6 | 32 |
| Rama V1 - V2 - V3 completas | 3 | 16 |
| Compromiso de pares bajos | 3 | 16 |
| Neuropatía craneal múltiple | 2 | 11 |
| Signos vestibulares | 1 | 5 |
La mediana del recuento de linfocitos T de CD4+ al momento de la consulta neurológica fue de 233células/mm3 y los cuartiles primero y tercero (Q1 y Q3) tomaron valores de 99 y 521 CD4+, respectivamente. La mediana de los niveles de CD4+ de los pacientes con neuropatía del VIIpar fue de 295, el Q1 presentó un valor de 110, mientras que el Q3 de 534 CD4+. Para los individuos con déficits motores, la mediana fue de 322 CD4+, con Q1 de 182 y Q3 de 521; y quienes debutaron con el signo de Roger presentaron una mediana de 87,5 CD4+/mm3 y los cuartiles primero y tercero tomaron valores de 58 y 521, respectivamente (tabla 2).
Medianas (P25-75) de recuentos de linfocitos T CD4+ en pacientes con HIV/sida y linfoma sistémico según signos neurológicos
| Variable | No tiene | Sí tiene | ||||||
|---|---|---|---|---|---|---|---|---|
| n | Mediana | Q1 | Q3 | n | Mediana | Q1 | Q3 | |
| Alteraciones de la conciencia | 18 | 210 | 99 | 326 | 1 | 688 | − | − |
| Convulsiones | 16 | 161 | 76 | 521 | 3 | 295 | 295 | 322 |
| Alteraciones del lenguaje | 17 | 295 | 99 | 521 | 2 | 81,5 | 53 | 110 |
| Déficit focal motor o signos piramidales | 10 | 122 | 76 | 295 | 9 | 322 | 182 | 521 |
| Neuropatía del III - IV - VI par craneal | 16 | 264 | 99 | 326 | 3 | 76 | 30 | 688 |
| Neuropatía del VII par | 9 | 188 | 76 | 322 | 10 | 295 | 110 | 534 |
| Signo de Roger | 13 | 295 | 134 | 326 | 6 | 87.5 | 58 | 521 |
| Signos vestibulares | 18 | 210,5 | 99 | 326 | 1 | 688 | − | − |
| Rama V1 - V2 - V3 completas | 16 | 161 | 76 | 326 | 3 | 295 | 295 | 561 |
| Compromiso de pares bajos | 16 | 161 | 76 | 322 | 3 | 561 | 233 | 688 |
| Neuropatía craneal múltiple | 17 | 188 | 99 | 322 | 2 | 624 | 561 | 688 |
El tiempo medio de demora entre la primera consulta con síntomas neurológicos y el diagnóstico de linfoma fue de 35,3días, con un rango de 5 a 154días (máximo de 3meses).
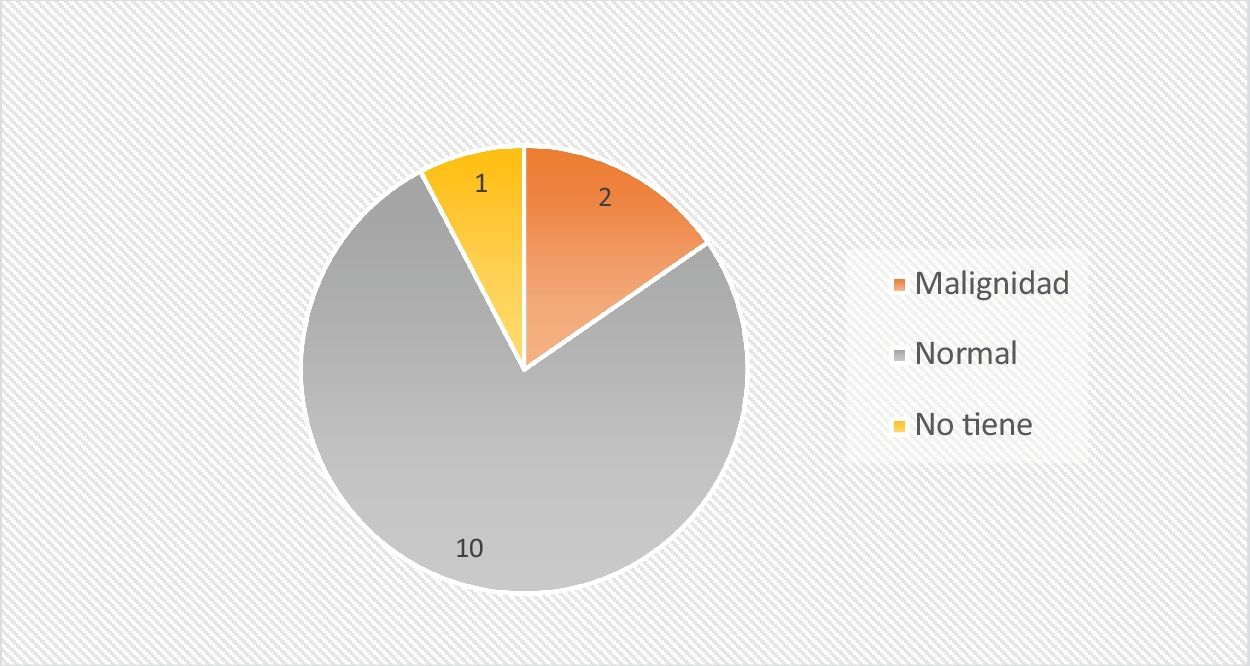
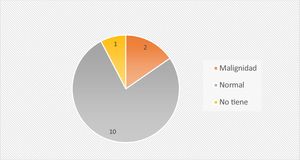
De los 19 pacientes, a 13 se les realizó punción lumbar diagnóstica y en el 77% de los mismos se obtuvo un LCR sin células malignas en el análisis anatomopatológico (fig. 1).
DiscusiónDe acuerdo con la literatura, los linfomas asociados a la infección por VIH se presentan con mayor frecuencia en varones con una edad media de 42años9-24. La comparación con nuestra casuística revela una distribución similar, dado que la gran mayoría de los pacientes (73,68%) fueron masculinos y el promedio etario de los mismos fue de 38,4años.
Las manifestaciones neurológicas presentes en pacientes con linfoma sistémico dependen de la localización de las lesiones; entre las más frecuentes se describen las neuropatías craneales (55%), la debilidad o déficit motor focal (33%), el papiledema (19%), los trastornos mnésicos (17%), las convulsiones (14%), las alteraciones de la marcha (5%) y otras (3%). A pesar de la diferencia epidemiológica, los individuos con diagnóstico de linfoma sistémico sin VIH presentan manifestaciones neurológicas similares a las de los pacientes de nuestra serie de casos13. Sin embargo, los signos neurológicos más frecuentes en nuestros pacientes difieren de los que se presentan en personas con linfomas primarios del sistema nervioso central (LPSNC). Estas neoplasias marcadoras de sida son tumores de célulasB de tipo inmunoblástico o centroblástico y se caracterizan por su alto grado de malignidad. Según el estudio publicado por Corti et al.25,26, las manifestaciones clínicas más frecuentemente presentadas por sus pacientes al momento del diagnóstico de LPSNC son los déficits focales y las convulsiones. Las diferencias clínicas entre ambos grupos podrían deberse a que la infiltración de las meninges es poco frecuente en individuos con LPSNC, en contraste con lo que ocurre con los LNH sistémicos, que además, en raras ocasiones, forman masas cerebrales.
Por otro lado, en nuestro estudio especificamos las neuropatías craneales y hallamos que la mayoría de los pacientes con VIH al momento del diagnóstico de linfoma sistémico consultaron por neuropatía del VIIpar craneal (53% de los casos) y presentaron una mediana de 295 CD4+. Resultados similares obtuvieron Woodcock y Nelson27, quienes publicaron una serie de casos de pacientes con VIH que presentaron parálisis facial periférica como signo de debut de linfoma Burkitt y concluyeron que el nervio facial es el que comúnmente se afecta en estos pacientes cuando se presentan neuropatías craneales aisladas. En contraposición a nuestras observaciones, los recuentos de CD4+ de los sujetos de dicho estudio fueron <200/mm3.
Según la publicación de Riancho et al.28 la parálisis facial periférica en pacientes infectados por VIH se puede dividir en dos grupos. En las etapas iniciales de la infección la respuesta inmune se encuentra relativamente conservada y las causas de la parálisis facial son similares a las de la población general. En los severamente inmunodeprimidos (CD4+ <250células/mm3) se debe considerar una variedad de etiologías y se justifica un extenso estudio de diagnóstico en el que deben descartarse los linfomas.
Un número importante de pacientes de nuestro estudio presentaron precozmente el signo de Roger. La sintomatología que provoca es escasa y poco molesta para el paciente, lo que hace que el mismo le reste importancia y no lo refiera, excepto si se efectúa una anamnesis específicamente dirigida29. Existen reportes y series de casos que indican que el compromiso de la rama mentoniana del Vpar craneal es un importante signo clínico para el diagnóstico de linfoma y que debe mantenerse un alto índice de sospecha de malignidad subyacente cuando un paciente con VIH/sida consulte por adormecimiento del mentón30,31. Un estudio de 16 pacientes demostró que el signo de Roger se asocia a malignidad, y en ausencia de una causa benigna siempre es indicativo de progresión del cáncer o de la existencia de una neoplasia oculta a pesar de los resultados normales de radiografías mandibulares y gammagrafía ósea12. El signo del mentón dormido relacionado con neoplasias es resultado de compresión local, de infiltración de los nervios alveolares, de carcinomatosis leptomeníngea y de lesiones infiltrativas de la base del cráneo, por lo que el pronóstico es malo ya que se produce en el contexto de una neoplasia en estado avanzado o recurrente32. De este modo es posible suponer que el signo aparece con niveles significativos de inmunosupresión; sin embargo, no se encuentran datos específicos que permitan establecer la relación entre el nivel de linfocitosT CD4+ y la presencia del numb chin. En el caso reportado por Vora et al.30 se describe un paciente masculino seropositivo con signo de Roger y un recuento de 580CD4/μl a quien se le realiza diagnóstico de linfoma de Burkitt. En nuestra serie de casos se observó que los pacientes que consultaron por adormecimiento del mentón tenían recuentos de CD4 <200, mientras que los que presentaron neuropatía del VIIpar tuvieron recuentos superiores.
Los linfomas en personas seropositivas clásicamente se relacionaron con una profunda inmunodeficiencia, ocurriendo generalmente en individuos con recuentos de linfocitosT CD4+ <200células/μl9-29. Sin embargo, no está completamente claro qué papel desempeña el recuento de CD4+, la carga viral y la TARGA. En consecuencia, un equipo de Francia determinó la frecuencia de los siete cánceres más habituales en pacientes con VIH y su relación con las variables antes mencionadas. En el análisis se detectó LNH en 511 pacientes (incidencia: 2,09) y LH en 149 (incidencia: 0,61). Los pacientes con LNH presentaron recuentos bajos de linfocitosT CD4+ (<200células/mm3). Dos tercios de los sujetos diagnosticados de cánceres no definitorios de sida estaban con TARV y mostraron una mediana de 244 CD4+/mm333. En nuestro estudio se obtuvo una cifra similar, ya que la mediana de recuento de linfocitos T CD4+ fue de 233/mm3. Este resultado es comparable al alcanzado por Gopal et al.34, quienes establecen la aparición de linfoma asociado a VIH con menos inmunosupresión (cifras de CD4+ >200) y además objetivan que pacientes con LH tuvieron niveles de linfocitosT CD4+ más altos que los pacientes con LNH. El linfoma difuso de células grandes de tipoB se asoció con mayor inmunosupresión y el linfoma Burkitt con menor, al momento del diagnóstico.
Con la introducción del TARV se redujo la incidencia de linfomas35,36. Estudios llevados a cabo en diferentes cohortes, como la International Collaborationon HIV and Cancer y la cohorte EuroSIDA, también documentaron una disminución en la incidencia de LNH sistémicos tras la introducción del TARGA37. En nuestra casuística la mayor parte de los individuos recibían TARV.
El diagnóstico de linfoma y la identificación del subtipo específico requieren un estudio histológico con inmunohistoquímica y en ocasiones estudio citogenético y molecular29; la demostración del compromiso neurológico en estos pacientes se basa en síntomas y signos, lesiones en el SNC objetivadas por TAC y/o RMN y el hallazgo de células malignas en el LCR. En muchos casos no se detecta malignidad en el LCR26, como ocurrió en la mayoría de los sujetos de nuestra investigación.
De particular importancia es la demora diagnóstica. Cualquier retraso en el inicio del tratamiento después del diagnóstico puede ser potencialmente peligroso para pacientes con neoplasias hematológicas. En nuestro estudio observamos que el tiempo medio desde el inicio de los síntomas hasta el diagnóstico definitivo de linfoma fue de 35,3días (5semanas). La información respecto al tiempo que transcurre hasta llegar al diagnóstico de linfoma y otros tumores es variable. En Canadá, un grupo de investigadores desarrolló un estudio de cohorte retrospectivo de 689 pacientes con LDCGB y observaron que el intervalo de tiempo entre el diagnóstico definitivo y el inicio de la quimioterapia puede influir en la progresión de la enfermedad y en el pronóstico de los pacientes, especialmente cuando su inicio se retrasa más de 8semanas después del diagnóstico38. Creemos que en nuestro grupo de pacientes el retraso en el diagnóstico de linfoma es un fenómeno complejo y multicausal en el influyen la demora en la búsqueda de atención, el contexto sociocultural del individuo, las dificultades en el reconocimiento precoz y en diferenciación de los síntomas por parte de los miembros del equipo de salud, y la aplicación de tratamientos inadecuados basados en un diagnóstico erróneo (p.ej., esteroides o fármacos antituberculosos). Cinco semanas es un período significativo cuando se trata de pacientes con VIH cuya mortalidad se encuentra aumentada, no solo por la presencia de linfoma sino por el compromiso del sistema nervioso, lo cual es indicativo de un estadio avanzado de la neoplasia.
La principal limitación de este estudio es su naturaleza retrospectiva, ya que la calidad de los exámenes neurológicos descriptos en las historias clínicas y a partir de los cuales recolectamos los datos no está asegurada. Cabe destacar que el número de pacientes fue inferior al que en un principio se estimó. El principal motivo fue la presencia de historias clínicas incompletas. A pesar de estas limitaciones, la metodología permitió alcanzar el objetivo principal, posibilitando la descripción detallada de los signos neurológicos hallados con mayor frecuencia en el grupo de pacientes en estudio.
ConclusiónUna de las neoplasias malignas que se relaciona usualmente con VIH es el linfoma sistémico, cuya presentación extranodal a nivel del sistema nervioso es habitual. En este estudio se describieron las manifestaciones neurológicas que aparecen en pacientes con ambas patologías. La neuropatía del VIIpar, los déficits focales motores o el signo de Roger constituyen importantes manifestaciones clínicas, cuya presencia en pacientes seropositivos debería incrementar el índice de sospecha de linfoma, aun cuando el individuo presente recuentos de linfocitosT CD4+ >200/mm3. Una anamnesis y una exploración física específicamente dirigidas a la identificación precoz de estos signos neurológicos permitirían lograr un reconocimiento temprano de la neoplasia, seleccionar las opciones terapéuticas más adecuadas y establecer un pronóstico certero.
En este contexto resulta fundamental reforzar la educación y la vigilancia de los equipos de salud para evitar las demoras en el diagnóstico y el tratamiento, teniendo en cuenta que la mayoría de los pacientes con linfoma e infección por VIH logran un control de la enfermedad con sobrevida global a 5años mayor del 60% si el mismo se detecta y trata a tiempo.
Conflicto de interesesNinguno.
A la Dra. Ana Bertoli, a la Sra. Liz López Patanés, al Dr. Piedrabuena y a la Prof. Eugenia Luján.