La melanosis neurocutánea es un trastorno congénito del desarrollo de las células melanóciticas que involucra el sistema nervioso central. La resonancia magnética de neuroeje contrastada es obligatoria en todo recién nacido con un nevo melanocítico congénito de alto riesgo para descartar compromiso neurológico, de modo que se pueda ofrecer un seguimiento adecuado por parte de un neurólogo pediatra. Nuestro objetivo es reportar dos casos de niños con nevo melanocítico congénito gigante con distribución en tronco, uno de ellos asociado a mielomeningocele. La RNM mostró múltiples lesiones hiperintensas del parénquima cerebral y leptomeninges confirmando el diagnóstico.
Neurocutaneous melanosis is a congenital disorder of the development of melanocytic cells that involves the central nervous system. The neuraxis MRI is mandatory in every newborn with a high-risk congenital melanocytic nevus to rule out neurological involvement so that adequate follow-up by a pediatric neurologist can be offered. Our objective is to report two cases of children with giant congenital melanocytic nevus with trunk distribution, one of them associated with myelomeningocele. MRI showed multiple hyperintense lesions of the brain parenchyma and leptomeninges confirming the diagnosis.
Los nevos melanocíticos congénitos gigantes (NMCG) son proliferaciones de melanocitos benignos que surgen durante la embriogénesis y ocurren en aproximadamente 1/20.000 a 1/50.000 nacidos vivos1, mientras que la melanosis neurocutánea (MNC) es una complicación de estos nevos congénitos y consiste en la proliferación de melanocitos en el sistema nervioso central (SNC) y leptomeninges, así como en la piel; se desconoce la incidencia exacta de esta patología pero es poco frecuente2, ocurre en el 2,5-45% de los pacientes con NMCG, los factores de riesgo incluyen un gran nevo melanocítico congénito, múltiples nevos satélites y más de dos nevos melanocíticos congénitos de tamaño mediano. Esta entidad puede ser asintomática o sintomática neurológica3. Nuestro objetivo es reportar dos casos sobre MNC, uno de ellos asociado a mielomeningocele lumbosacro y Chiari tipo II, lo cual es extremadamente raro. Fueron clasificados como investigación con riesgo mínimo; se obtuvo previo consentimiento informado de los tutores.
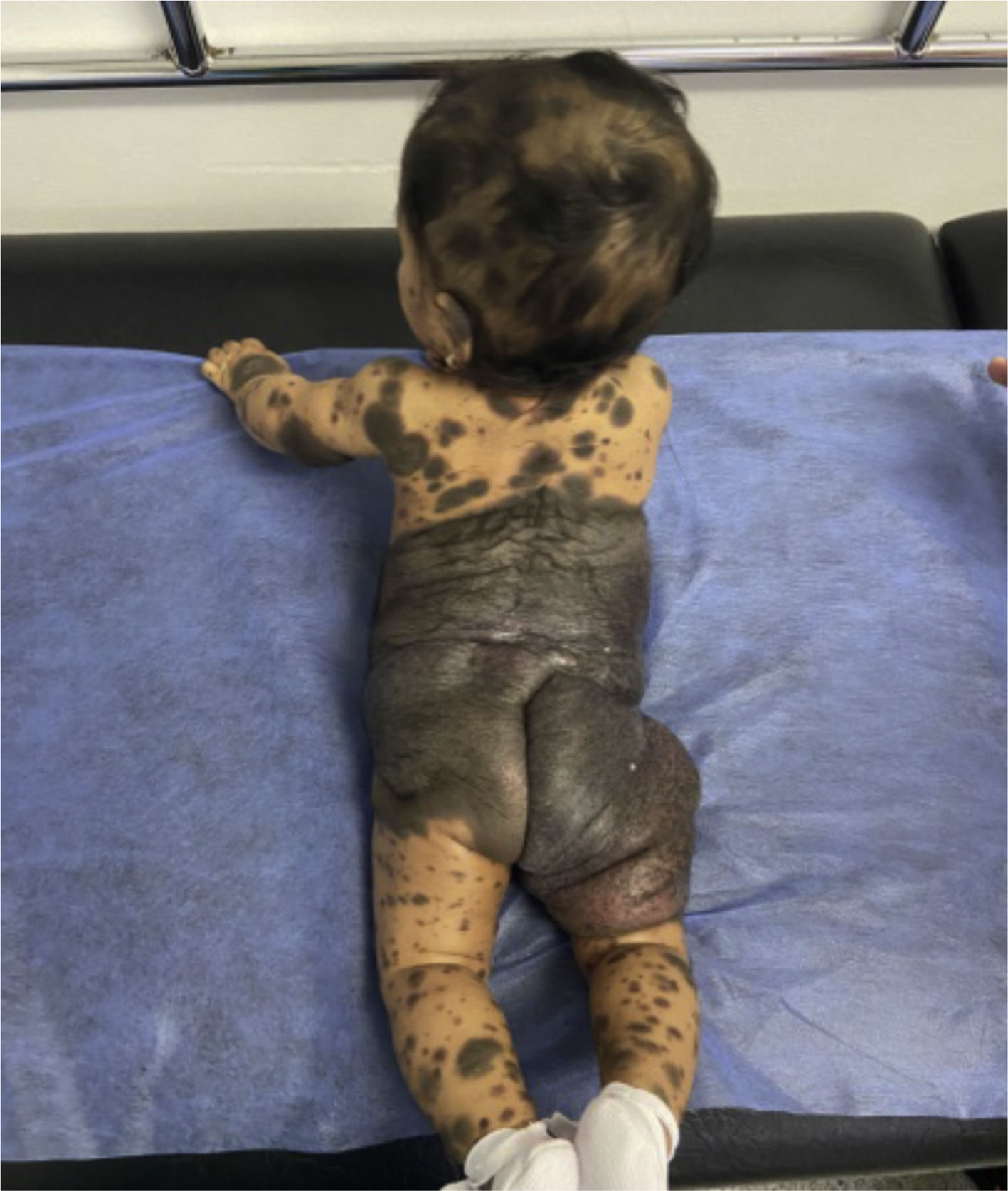
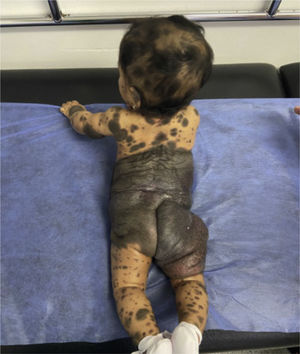
Caso clínico 1Paciente mujer de 6 meses de edad, producto de segundo embarazo, padres no consanguíneos. Nace pretérmino de 33 semanas debido a preeclampsia, parto por cesárea por posición podálica, requiriendo hospitalización en unidad de cuidados intensivos neonatal durante 14 días. Al nacimiento se evidenciaron múltiples nevos melanocíticos localizados en todas las áreas corporales, el mayor de ellos de 40 x 25 cm que abarca abdomen inferior y pelvis, con lesiones satélites en cabeza, cara y extremidades, facies no sindrómica (fig. 1). Se realizó RNM cerebral que confirma diagnóstico de MNC. Su desarrollo psicomotor ha sido límite en el dominio motor. Los primeros 3 meses de vida con episodios de jitterines de predominio en hemicuerpo derecho, actualmente sin posturas ni movimientos anormales. Se le realizó resección parcial de la lesión en región lumbar por ulceración.
Estudios- •
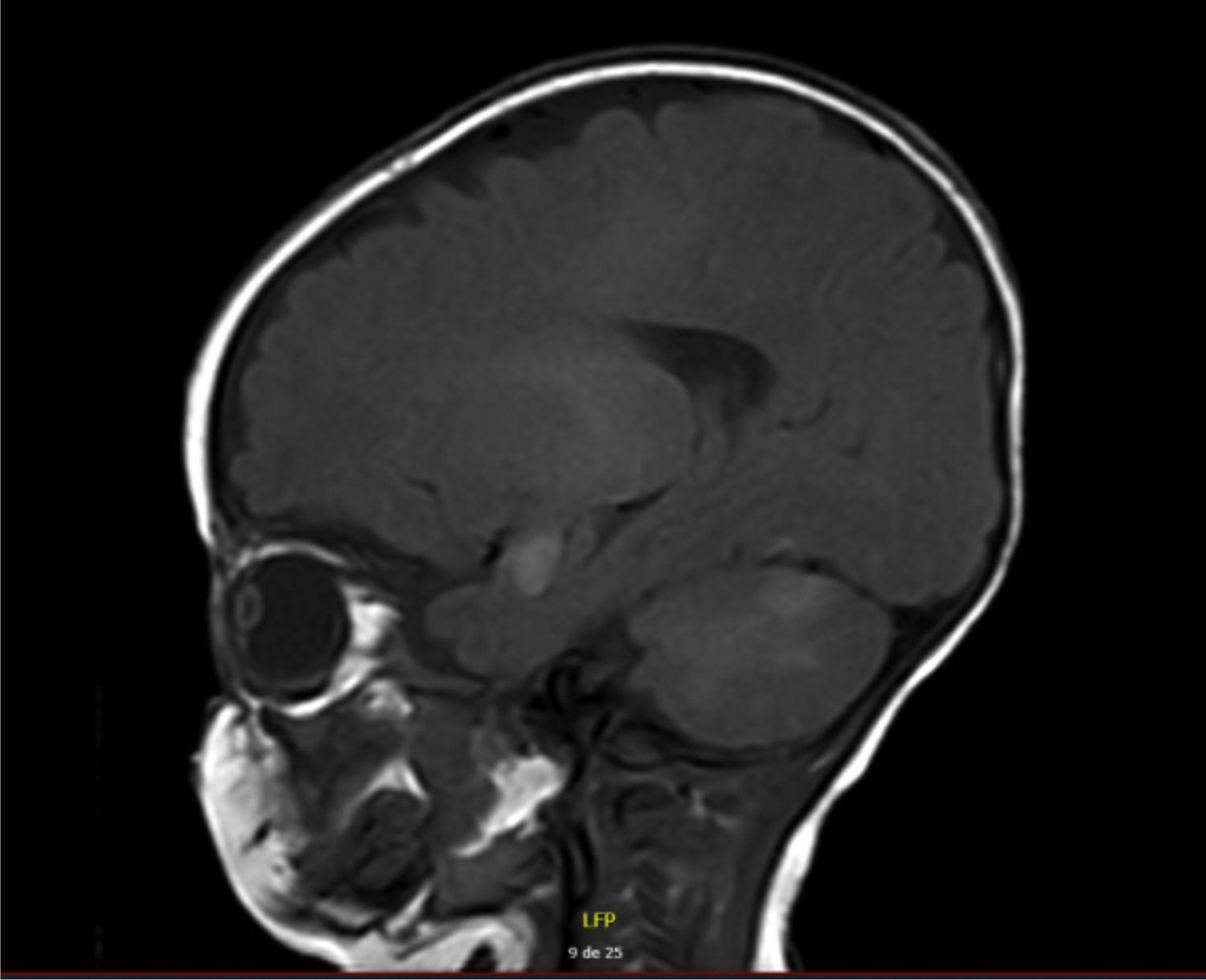
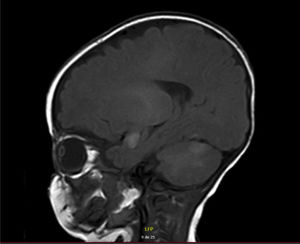
RNM de cerebro y columna total simple y contrastada: múltiples hiperintensidades cortico-subcorticales con compromiso temporal medial bilateral (epicentro en amígdalas y uncus), cortical parietal izquierda, tálamo derecho tanto posterior como anterior medial, algunos focos en la protuberancia y corteza cerebelosa bilateral (fig. 2). Lesiones en el tejido celular subcutáneo parietal derecho. Patrón de mielinización normal para la edad. Las imágenes de columna fueron normales.
- •
Electroencefalograma: ritmo de fondo normal y sin actividad epileptiforme.
- •
Biopsia de nevos de cuero cabelludo y región lumbosacra: lesión dérmica de células névicas con pigmento en la porción superficial, maduración intralesional y distribución perianexial y extensión al tejido celular subcutáneo formando bandas de células névicas de distribución septal con zonas de neurotización.
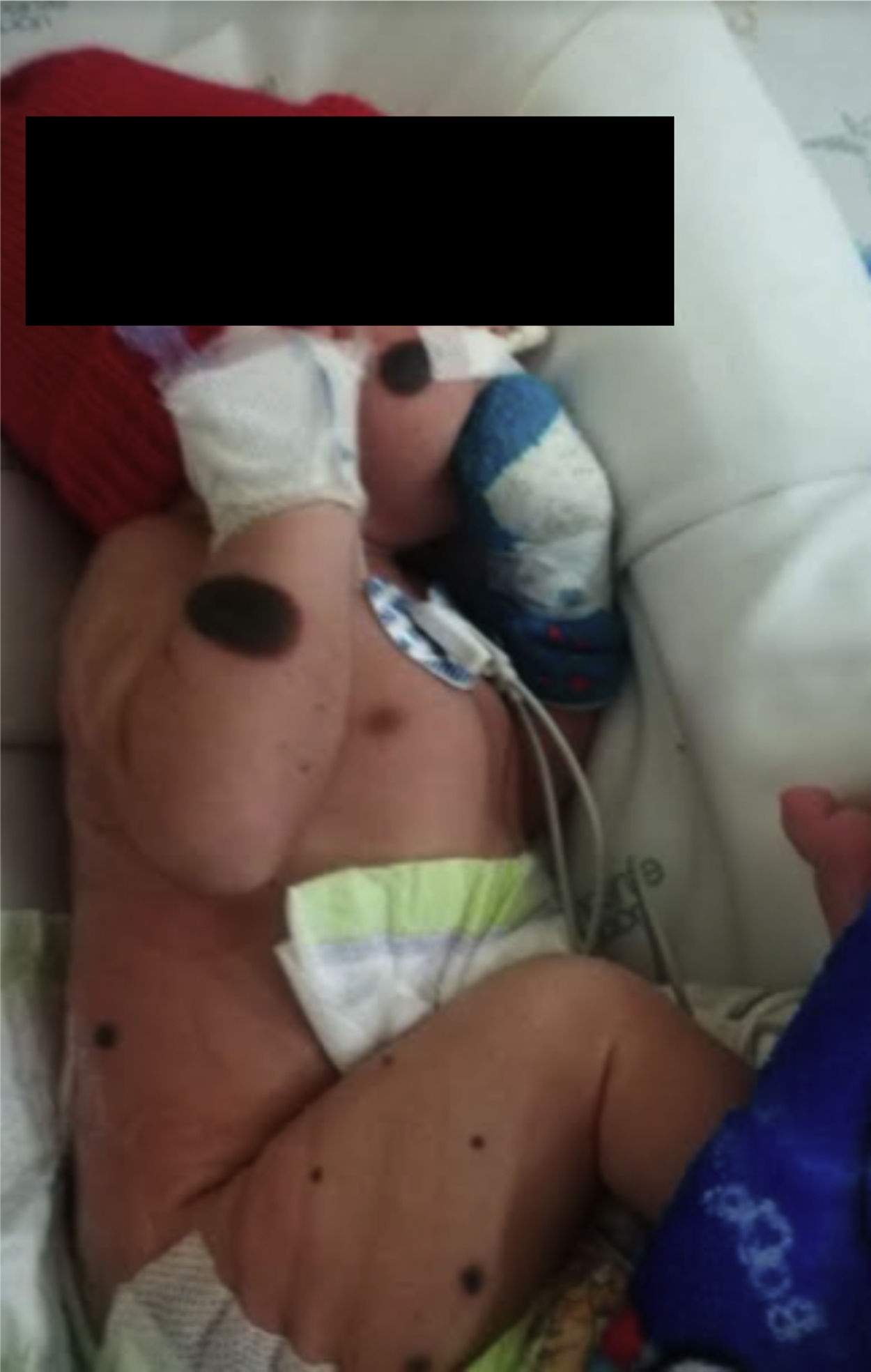
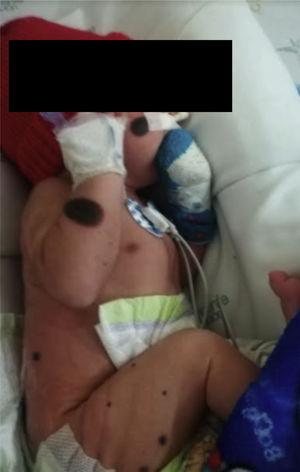
Recién nacido de sexo masculino, 1.er día de vida, producto de primer embarazo, madre adolescente, padres no consanguíneos (figs. 1-4) pobre control prenatal, con hallazgo prenatal ecográfico de ventriculomegalia bilateral asociado a dilatación del III ventrículo, estudios de virus de la inmunodeficiencia humana, hepatitis B, rubeola, sífilis y toxoplasma negativos. Nace por parto vaginal a las 33 semanas de edad gestacional, APGAR: 6 y 9 al primer y quinto minuto, requiriendo ventilación con presión positiva con CPAP logrando rápidamente metas de saturación, peso y talla adecuados para la edad gestacional, al examen físico se encontró activo, perímetro cefálico de 31cm (p50-90), sin dismorfia facial, buen tono en extremidades superiores, contractura en flexión con limitación de la abducción de las caderas y dorsiflexión de ambos pies (pie talo), hiporreflexia, esfínter anal hipotónico, defecto del canal medular abierto a nivel de L5-S1 compatible con mielomeningocele roto; adicional nevos gigante en región lumbosacra y presencia de nevus satélites en tronco, cabeza, frente, nariz, tórax y extremidades (fig. 3).
Piel con múltiples máculas y placas hiperpigmentadas café oscuras bien definidas de forma discoide y ovaladas, algunas con superficie verrucosa y pelos, la lesión de mayor tamaño compromete región abdominal y lumbar circunferencial, se extiende hasta los tercios medios de los muslos cubriendo la zona glútea y genital en forma completa. Además, múltiples lesiones satélites en todo el cuerpo.
RNM cerebral simple y contrastada. En la secuencia de T1 se evidencia hiperintensidad en la amígdala, además foco hiperintenso yuxtacortical cerebeloso derecho. Ventriculomegalia supratentorial con ascenso y disminución del volumen del cuerpo calloso y medialización de las formaciones hipocampales.
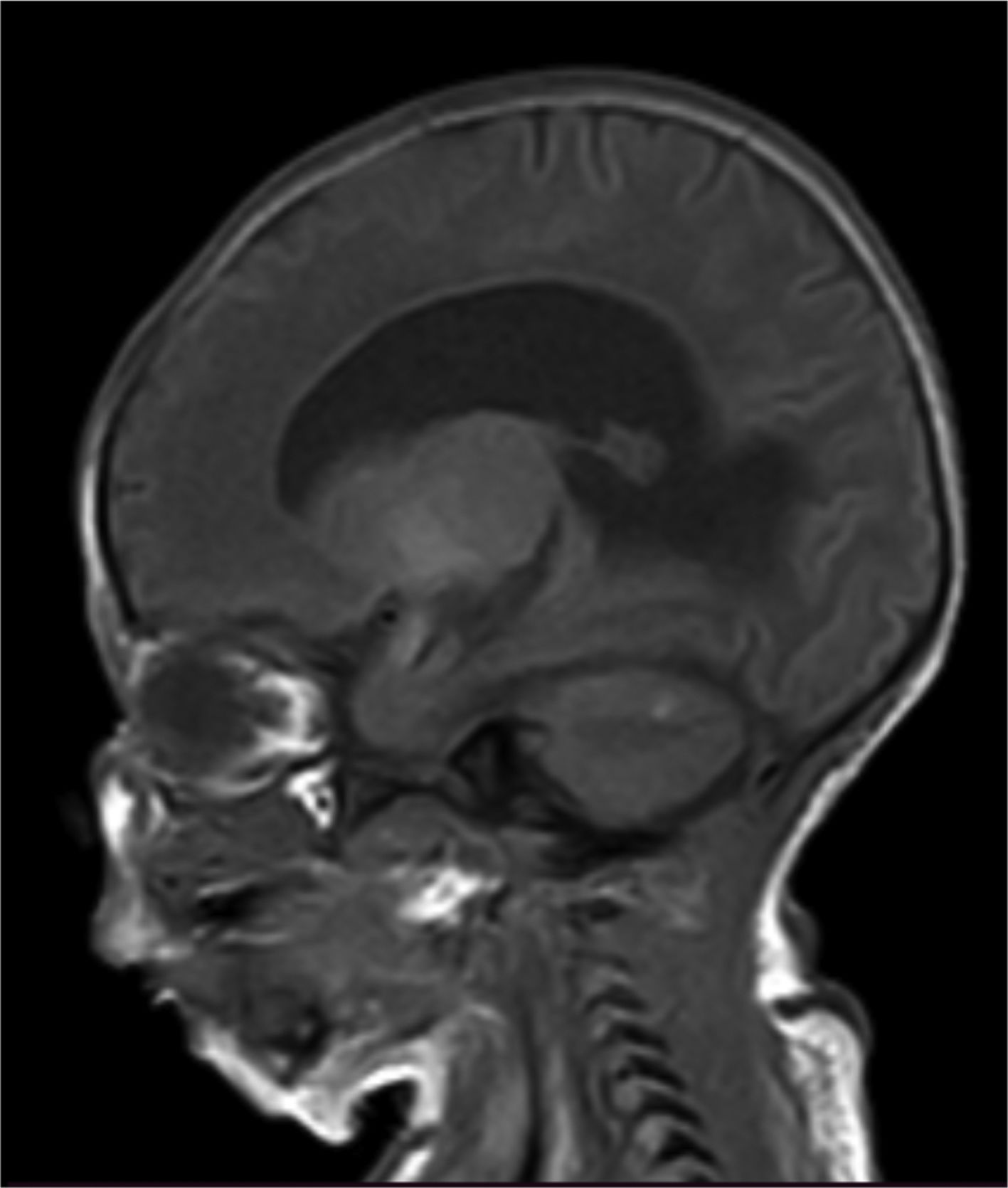
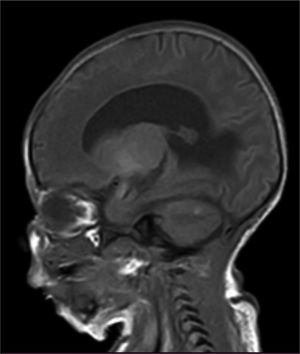
Fue llevado a cirugía al primer día de nacido para corrección de mielomeningocele sin complicaciones. La RNM cerebral y columna vertebral total a los 7 días de vida evidenció en la secuencia de T1 hiperintensidades en el cerebelo, uncus y amígdala bilateral como signos de melanosis, además signos de malformación de Arnold- Chiari tipo II (descenso de las amígdalas cerebelosas a través de la línea de Mc rae de 7,5mm), fosa posterior pequeña asociado a tectum mesencefálico en «pico» y ventriculomegalia supratentorial sin migración transependimaria del líquido cefalorraquídeo (fig. 4).
DiscusiónLa melanosis neurocutánea es una displasia neuroectodérmica embrionaria, no familiar, rara, sin predilección de género caracterizada por áreas cutáneas anormalmente pigmentadas e incluye principalmente nevos melanocíticos congénitos grandes presentes al nacer y que están asociados a melanosis en el sistema nervioso central, principalmente leptomeníngea4. Las teorías indican que podría ser resultado de una alteración en la migración de los melanocitos hacia la piel, o una alteración en el origen desde la cresta neural (semana 11 a 17 del desarrollo embrionario) con la resultante proliferación de melanocitos en el neuroeje. Desde el punto de vista patogénico, las mutaciones poscigóticas en mosaico en el protooncogén NRAS (neuroblastoma RAS viral oncogene homolog, localizado en el cromosoma 1p13.2) explican el compromiso del SNC; ya que interrumpen las vías de señalización de las células RAS (específicamente, la vía RAS/MEK/ERK y la vía mediada por fosfatidilinositol 3-quinasa/PI3K-Akt) e impulsa proliferaciones benignas melanocíticas en el útero5.
Las lesiones características son nevos peludos de color oscuro presentes al nacer, por lo general, hay múltiples nevos pequeños alrededor de un nevo gigante, aparece con mayor frecuencia en la parte inferior del tronco y el área perineal (distribución en «traje de baño»). Aproximadamente un tercio de los pacientes tienen un gran nevo en la parte superior de la espalda (en capa)2. La MNC ocurre en el 2,5-45% de los pacientes con nevos melanocíticos congénitos; Lovett et al., en una serie de 26 pacientes hallaron que la presencia de múltiples lesiones satélites, el gran tamaño y la ubicación en la línea media de las lesiones son factores predictivos de compromiso neurológico6. Nuestros pacientes tienen los 3 factores asociados para afectación del SNC.
La melanosis neurocutánea puede ser sintomática en el 3-10% de los casos, la presentación clínica depende de la ubicación y el grado de compromiso a nivel leptomeníngeo; los síntomas generalmente se presentan en los primeros 2 años de vida como retraso en el desarrollo psicomotor, convulsiones, alteraciones del comportamiento, síndrome de hipertensión endocraneana, en menor medida déficits motores (hemiparesia, compromiso de nervios craneales) y/o signos de mielopatía o radiculopatía. La hidrocefalia se encuentra con frecuencia debido a la obstrucción de la circulación del líquido cefalorraquídeo principalmente en las cisternas basilares y las vellosidades aracnoideas2,7. Se han descrito casos de MNC asociada a anomalías estructurales del SNC como malformación de Dandy-Walker, hemimegalencefalia, displasia cortical, quistes aracnoideos, malformaciones de Arnold Chiari tipo I y II, siringomielia, meningoceles, disrafismo espinal oculto, lipomatosis del SNC y schwannoma1,5,8. En nuestro segundo caso fue la coexistencia con mielomemingocele lumbosacro y malformación de Arnold- Chiari tipo II, en la revisión solo encontramos reportado un paciente con esta asociación.
Los hallazgos en el examen del líquido cefalorraquídeo pueden ser normales o mostrar una marcada hiperproteinorraquia, concentración de glucosa disminuida y leve leucocitosis sin aislamiento microbiológico; en el citológico se pueden observar células anormales que contienen melanina, sin embargo, este estudio no se realiza de forma rutinaria. El diagnóstico imagenológico está dado principalmente por la RNM, donde las lesiones pueden verse hiperintensas en T1 debido a las propiedades paramagnéticas de la melanina e hipointensas en T2 con realce homogéneo leptomeníngeo después de la administración de gadolinio, las lesiones predominan en cerebelo, lóbulos temporales (especialmente en la amígdala como en nuestros dos casos), piamadre, tálamo, protuberancia y la médula espinal3,9. Se requiere realizar diagnóstico diferencial con procesos inflamatorios o infecciosos leptomeníngeos, como tuberculosis, sarcoidosis o granulomatosis de Wegener por el predominio del compromiso en la región posterior. Recomendamos realizar resonancia de cribado en todo recién nacido con nevo melanocítico congénito de alto riesgo para descartar compromiso de SNC, ya que, aproximadamente la mitad de los niños neurológicamente asintomáticos con MNC tienen resultados anormales en los estudios de neuroimagen10.
Es importante tener en cuenta que zonas de necrosis, edema perilesional, realce del contraste y sangrado son hallazgos a favor de melanoma y no de melanosis intracraneal benigna3. El diagnóstico se basa en la clínica y las neuroimágenes, confirmándose con el estudio histopatológico de las lesiones. En 1991, Kadonaga y Frieden definieron los siguientes criterios11:
- 1.
Nevo melanocítico congénito gigante (mayor a 20cm en adultos; en niños mayor a 6cm en el cuerpo o 9cm en la cabeza) o múltiples (> 3 lesiones) en asociación con melanosis meníngea.
- 2.
Ausencia de melanoma cutáneo, excepto pacientes con lesión meníngea benigna probada por histología.
- 3.
Ausencia de melanoma meníngeo, excepto en pacientes con lesión cutánea benigna probada por histología.
Algunos autores discuten los anteriores criterios pues utilizan los términos grande y gigante indistintamente. Ruiz-Maldonado en 2004 planteó una clasificación que define medidas más precisas: nevos grandes miden entre 11 y 20cm, y los nevos gigantes son de 21 a más de 40cm12. Algunos autores sostienen que un diagnóstico definitivo de MNC requiere la confirmación histológica de las lesiones del SNC. Sin embargo, en el contexto de los nevos cutáneos melanocíticos típicos y los hallazgos característicos de las neuroimágenes, la biopsia leptomeníngea o cerebral es innecesaria. La biopsia de un nevo congénito revela la extensión de las células hacia la dermis profunda o el tejido celular subcutáneo entre los haces de colágeno y alrededor de los nervios, los folículos pilosos y los vasos sanguíneos. Las láminas de nevos melanocitos en la dermis pueden mostrar mitosis y células atípicas grandes13,14.
Las estrategias de tratamiento estándar incluyen terapia con láser, peeling químico y dermoabrasión, otros requerirán cirugía (escisión total o parcial) e injerto de piel; algunos pacientes colocación de derivación neuroquirúrgica, resección y quimioterapia para lesiones malignas del SNC. Se han propuesto terapias experimentales biológicas dirigidas a la vía MEK en un modelo murino, vía doble PI3K/mTOR en células clonadas derivadas de MNC transformadas oncogénicamente y la vía RAS-ERK, lo anterior dado la patogenia de la enfermedad5; aunque faltan estudios que demuestren la eficacia y seguridad en humanos.
El pronóstico de los pacientes asintomáticos es incierto, pero generalmente es malo, por lo cual deben ser controlados con exámenes neurológicos periódicos y, aunque la realización de neuroimagen de rutina es controvertida, se recomienda realizar en el seguimiento cuando aparecen síntomas neurológicos con el objetivo de descartar hidrocefalia o transformación maligna. Se han realizado muchos estudios sobre el riesgo de melanoma asociado con NMCG, las estimaciones tienen variaciones notables entre 0-50%, siendo habitualmente más alta en los primeros 5 a 10 años de vida, en pacientes con lesiones de gran tamaño y las que tienen ubicación axial, lo anterior conlleva una mortalidad significativa15,16.
En conclusión, nosotros reportamos dos casos de melanoma neurocutáneo con lesiones típicas en la RMM, uno de ellos asociado con mielomeningocele y malformación de Chiari tipo II. En niños de alto riesgo de compromiso del SNC es necesario realizar RNM de cerebro y columna total; los casos sintomáticos principalmente con manifestaciones clínicas de aumento de la presión intracraneal se asocian a un mal pronóstico. Es importante recordar que esta entidad puede coexistir con otras patologías del SNC. No encontramos un protocolo ni consenso para el manejo y seguimiento (intervalo de las visitas y neuroimágenes) en este grupo de pacientes, ya que es poco clara la historia natural de los focos parenquimatosos; sin embargo, se les debe ofrecer un control adecuado por parte de un neurólogo pediatra y la toma de decisiones se basará en las características de cada paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.